Імунологічні маркери ефективності дендритноклітинної вакцинотерапії у хворих з гліобластомою
Скачкова О.В.1, Главацький О.Я.2, Земскова О.В.2, Горбач О.І.1, Храновська Н.М.1, Хмельницький Г.В.2, Шуба І.М.2
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Державна установа «Інститут нейрохірургії ім. академіка А.П. Ромоданова Національної академії медичних наук України», Київ, Україна
Резюме. Актуальність. Гліобластома є найбільш поширеною первинною злоякісною пухлиною головного мозку у дорослих. Прогноз виживаності при гліобластомі залишається вкрай песимістичним, тож сьогодні активно розробляються варіанти імунотерапевтичного впливу на гліальні пухлини, зокрема із застосуванням аутологічної дендритноклітинної вакцини (ДКВ). Мета. Дослідити зміни популяційного і субпопуляційного складу лімфоцитів периферичної крові хворих з гліобластомою під час застосування ДКВ та встановити наявність кореляцій між ними та рівнем виживаності хворих. Об’єкт і методи. 24 хворим з вперше діагностованою гліобластомою після хірургічної резекції пухлини та завершення курсу променевої терапії (ПТ) до стандартного ад’ювантного лікування додано ДКВ. Дендритні клітини (ДК) генерували з моноцитів периферичної крові та навантажували лізатом аутологічних пухлинних клітин. Аналіз популяційного і субпопуляційного складу лімфоцитів периферичної крові проводився методом проточної цитофлуориметрії. Результати. Загальна 2-річна виживаність 24 хворих на гліобластому при застосуванні ДКВ у складі ад’ювантної терапії становила 52%. Найбільш виражені зміни у хворих фіксували для Т- та В-лімфоцитів та субпопуляцій Т-хелперів (CD3+4+), активованих лімфоцитів (CD3+HLA+) та супресорних клітин мієлоїдного походження (Myeloid-derived suppressor cells — MDSC) (HLA-DR-11b+33+). ДКВ сприяє зменшенню відносної кількості MDSC у периферичній крові хворих. Встановлено, що достатню чутливість та специфічність має тільки 1 показник, а саме кількість натуральних кілерних Т-клітин (НКТК) (CD3+16+56+-лімфоцитів) у периферичній крові. Обчислені порогові значення НКТК: до імунотерапії (ІТ) — ≤9%, після — ≤13%, які дають змогу прогнозувати ефективність проведеної ІТ з чутливістю від 77 до 86%. Висновки. Одержані результати дозволяють рекомендувати визначення кількісних змін у субпопуляції НКТК у хворих на гліобластому під час проведення ДКВ в якості імунологічних критеріїв її ефективності.
Одержано 08.03.2024
Прийнято до друку 18.03.2024
DOI: 10.32471/clinicaloncology.2663-466X.53-1.32005
Гліобластома є найбільш поширеною первинною пухлиною головного мозку у дорослих, що становить 45,2% усіх злоякісних первинних пухлин центральної нервової системи (ЦНС). Прогноз при гліобластомі залишається вкрай несприятливим з медіаною виживаності 15 міс та 5-річною виживаністю на рівні 5,5% [1]. Останнім часом зусилля багатьох дослідників спрямовані на пошук більш ефективних стратегій лікування пацієнтів з гліобластомою, поміж яких до найбільш обнадійливих належать ті, що ґрунтуються на імуноопосередкованому впливі [2, 3]. При цьому на сьогодні остаточно скасовано концепцію щодо імунного привілею ЦНС та чітко встановлено, що злоякісні гліоми можуть мати відповідь на імуноопосередкований вплив [4, 5].
Сучасна ІТ об’єднує широкий спектр різноспрямованих підходів, серед яких одним з найбільш перспективних є ІТ за допомогою дендритних клітин (ДК), враховуючи ключову регуляторну роль ДК у формуванні імунологічної протипухлинної відповіді та потенціальну прецизійність їх ефекту [6, 7].
ІТ як засіб лікування онкологічних захворювань базується на передумові, що активація власної імунної системи пацієнта певним чином дасть змогу побороти вже наявне захворювання. Моніторинг імунної відповіді є дуже важливим етапом для раціонального розвитку ІТ раку. Однією з основних цілей імуномоніторингу є документування формування пухлиноспецифічної імунної відповіді та на основі цих досліджень встановлення наявності зв’язку індукованої ІТ імунної відповіді із клінічними результатами. Незважаючи на прогрес у розробці методів аналізу імунного моніторингу, досить складно встановити суттєві, статистично значущі кореляції між викликаною терапією імунною реакцією та клінічними результатами. Ця відсутність кореляції може відображати як методологічні обмеження імунологічних аналізів, так і/або посттерапевтичну відсутність протипухлинної відповіді. Наразі дуже важливим напрямком імуномоніторингу є пошук сурогатних маркерів, які можуть бути предикторами клінічної відповіді, що сприятиме розвитку ІТ у майбутньому [8, 9].
Мета. Дослідити зміни популяційного і субпопуляційного складу лімфоцитів периферичної крові хворих з гліобластомою під час застосування ДКВ та встановити наявність кореляцій між ними та рівнем виживаності хворих.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Проспективне нерандомізоване одноцентрове дослідження охоплювало 24 пацієнти з вперше діагностованою гліобластомою, які отримували ад’ювантне мультимодальне лікування в Державній установі «Інститут нейрохірургії ім. академіка А.П. Ромоданова Національної Академії медичних наук (НАМН) України», відділі ад’ювантних методів лікування при пухлинах центральної нервової системи, відділенні радіонейрохірургії в період з 2018 до 2022 р. Збір даних був припинений 1.03.2023 р. (таблиця).
| Показник | Усього пацієнтів | N=24 | 100% |
| Вік |
≤60 років ≥60 років |
52,3 (31–70) років
17 7 |
70,8 29,2 |
| Стать | Чоловіча
Жіноча |
14
10 |
58,3
41,7 |
| Об’єм операції | Радикальне видалення
Нерадикальне видалення |
16
8 |
66,7
33,3 |
| Статус гена MGMT | Метильований
Неметильований |
12
12 |
50,0
50,0 |
| Функціональний стан | За шкалою Карновського:
70 балів 80 балів 90 балів |
8 11 5 |
33,3 45,8 20,9 |
Для специфічної активної ІТ у пацієнтів з гліобластомою використовували ІТ на основі ДК, схема якої була розроблена в науково-дослідній лабораторії експериментальної онкології Національного інституту раку [10].
Застосування ДКВ схвалено Комісією з питань етики Державної установи «Інститут нейрохірургії ім. академіка А.П. Ромоданова НАМН України» (протокол № 2 від 15.04.2019 р.). Усі пацієнти дали інформовану згоду на участь у дослідженні, яке проводилося з дотриманням усіх етичних норм, ухвалених українським законодавством.
ІТ на основі аутологічних ДК додавали до ад’ювантного мультимодального лікування пацієнтів з гліобластомою, яким проведено хірургічну резекцію, ад’ювантну гіпофракційну ПТ на тлі конкомітантної хіміотерапії темозоломідом з наступною підтримувальною алкілувальною хіміотерапією.
Перше введення ДКВ виконували після закінчення курсу ПТ за умови клінічної стабілізації, адекватних показників загального та біохімічного аналізів крові, припинення стероїдної терапії (враховуючи потенційну імуносупресивну дію стероїдних препаратів).
Кількість ДК, «навантажених» лізатом пухлинних клітин на одне введення, становила (2,0–5,0)•106 клітин. ДКВ вводили внутрішньошкірно паравертебрально в ділянку лопатки в об’ємі 1000 мкл. Усім пацієнтам застосовували 6 ін’єкцій протягом одного етапу з періодичністю 1 раз на місяць з наступним контролем імунологічних показників.
Дослідження популяційного складу лімфоцитів периферичної крові
Зразки периферичної крові для проведення імунологічних досліджень забирали одночасно із забором крові для виготовлення вакцини. Забір крові проводили натщесерце із ліктьової вени.
Дослідження популяційного і субпопуляційного складу лімфоцитів периферичної крові проводили на основі визначення фенотипових характеристик лімфоцитів, що включало визначення експресії маркерів клітинної приналежності, диференціювання та активації лімфоцитів.
Аналіз проводили за допомогою методу прямої імунофлюоресценції з використанням моноклональних антитіл (Becton Dickinson, Becton Coulter, США) з використанням 2 або 3 флюорохромів:
- CD3+ FITC, CD19+ APC, CD4+ PE, CD8+ APC, CD3+CD16+ PE (для дослідження Т-, В-лімфоцитів, натуральних кілерних клітин (НКК);
- HLA-DR+PE, CD38+ PE (активовані лімфоцити);
- HLA-DR PE, CD11b FITC, CD33 PC5 (супресорні клітини мієлоїдного походження);
- CD4 PE, CD25 FITC, CD127 APC (супресорні клітини лімфоїдного походження).
Усі цитометричні дослідження виконували на проточному цитофлуориметрі FACSCalibur (Becton Dickinson, США), що оснащений 2 лазерами (довжина хвилі 488 та 625 нм), з використанням програми CellQuest-PRO (США) для отримання та аналізу даних.
Аналіз результатів проводили на 3 етапах ІТ: до терапії, на її початку (1–2 введення ДКВ) та завершенні (4–5 введення ДКВ). Також у дослідженні використані показники 15 практично здорових людей (ПЗЛ).
Після хірургічного лікування всі пацієнти отримували ад’ювантну хіміопроменеву терапію. ПТ проводилася в гіпофракційному режимі (разової вогнищевої дози (РВД) — 3,0 Гр, сумарної вогнищевої дози (СВД) — 52,5 Гр, 15 фракцій опромінення), на лінійному прискорювачі Trilogy (США) (6 MeV), за допомогою опромінення з модулюванням інтенсивності (Intensity-modulated radiation therapy — IMRT). Протягом курсу ПТ пацієнти перорально отримували темозоломід, з першого до останнього дня променевого лікування, 7 днів на тиждень, 75 мг/м2 натще за 1 год до початку сеансу опромінення (конкомітантний режим хіміотерапії). Після завершення хіміопроменевого лікування пероральний прийом темозоломіду тривав в ад’ювантному підтримувальному режимі (не менше 6 циклів; 5 днів у добовій дозі 150–200 мг/м2 одноразово; загальна тривалість циклу — 28 днів).
Статистичний аналіз
Статистичний аналіз виконували за допомогою спеціалізованого програмного забезпечення Statistica 64 ver.10.0.1011.0 StatSoft Inc. та MedCalc. ver. 20 (2021) MedCalc. Software Ltd.
Дані представленні у вигляді Mean±SE для нормального розподілу та у вигляді медіани (25 та 75% квартиля) для даних, що не відповідають нормальному розподілу. Для порівняння параметричних даних у 2 групах використовували t-критерій Стьюдента. При аналізі непараметричних показників 2 залежних груп використовували критерій Уілкоксона та незалежних груп — U-критерій Манна — Уїтні.
Для оцінки прогностичної значимості біомаркерів проведено аналіз імунологічних показників за допомогою ROC-кривих (Receiver Operating Characteristic curves). Вибір найбільш цінного показника здійснювався відповідно до площі під ROC-кривою (AUC).
Ухвалення рішень щодо статистичної значущості результатів здійснювалося порівнянням визначених у роботі показників р-value зі встановленим критичним рівнем прийняття/відхилення статистичних гіпотез α=5%.
Виживаність пацієнтів (загальна виживаність (ЗВ) та виживаність після початку ДКВ) проаналізовані методом Каплана — Мейєра. Показник ЗВ розраховувався від дати проведення хірургічного втручання з видалення первинної гліобластоми (у випадку виживаності після ДКВ — від дати першого введення ДКВ) до дати настання події (смерті) або дати останнього контакту з пацієнтом, якщо подія не наставала, чи смерті пацієнта з причин, не пов’язаних з гліобластомою (цензуровані дослідження).
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ
На момент припинення збору даних з 24 (100%) пацієнтів, залучених у дослідження, померли 18 (75,0%) осіб. Медіана ЗВ (від дати хірургічного втручання) становить 24,8 міс (95% довірчий інтервал (ДІ) 18,7–26,4) при медіані спостереження 31,3 міс (95% ДІ 22,7–36,5). Медіана виживаності після початку ДКВ становить 19,7 міс (95% ДІ, 15,8–21,9). Через 18 міс після хірургічного втручання з видалення первинної гліобластоми частка пацієнтів, що залишалися живими, становила 78%; через 24 міс — 52%.
Деталізація отриманих онкологічних результатів, що свідчать про доцільність використання ДКВ у складі ад’ювантної мультимодальної терапії хворих на гліобластому, представлена нами в іншій публікації [11].
Аналіз результатів імунологічних досліджень
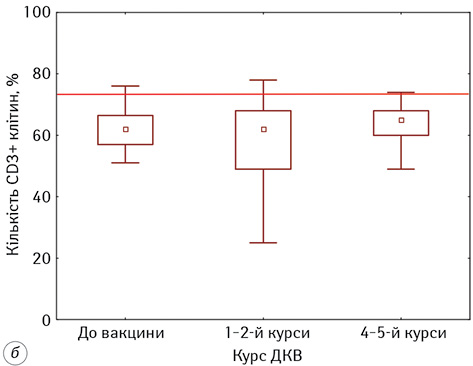
У наших дослідженнях встановлено, що у пацієнтів з гліобластомою проведення ДКВ мало нормалізувальний вплив на показники Т- та В-лімфоцитів (рис. 1). Слід зазначити, що рівень CD3+-лімфоцитів до початку проведення ІТ був знижений відносно показників ПЗЛ, тоді як кількість CD20+-лімфоцитів була у 1,5 раза більше нормативних значень. На тлі проведення ІТ у хворих фіксували нормалізацію кількості Т- та В-лімфоцитів.
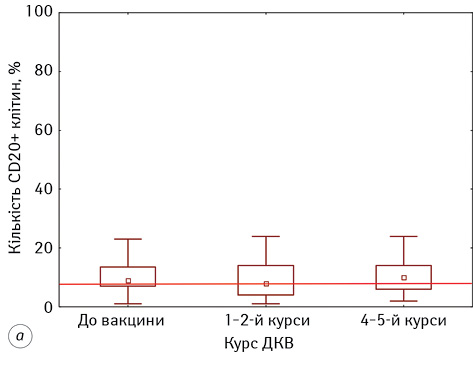
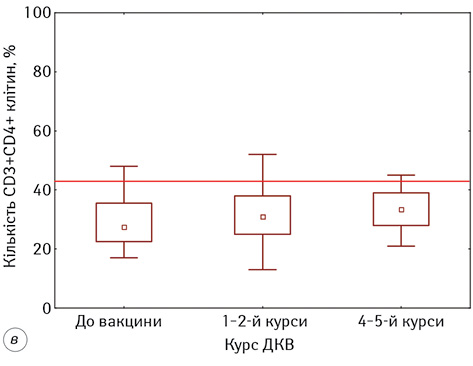
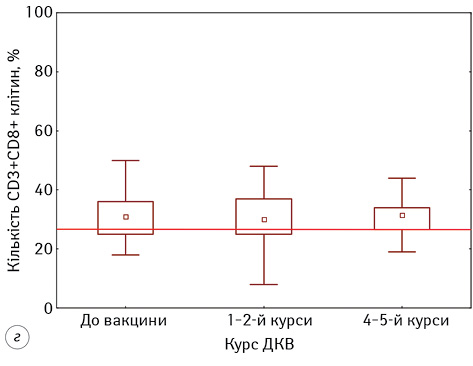
У дослідженні кількісних змін у субпопуляції CD4+-лімфоцитів у пацієнтів з гліобластомою встановлено, що на початку проведення ДКВ їх кількість була статистично значуще нижче показників ПЗЛ та становила 28,57±1,58% проти 43,40±1,60%, р<0,05 (див. рис. 1). На кожному наступному етапі проведення ДКВ відмічали підвищення показників, і на 4–5 курсі ІТ вони становили 34,00±1,50%, статистично значуще підвищившись відносно початкових показників (р=0,04). Нами встановлено, що проведення ДКВ значно не вплинуло на відносну кількість CD8+-лімфоцитів у периферичній крові пацієнтів (див. рис. 1). Вона майже не змінювалася на всіх етапах проведення ІТ та становила 31,53±1,74% до початку ДКВ і 32,47±1,72% на фінальних етапах, однак слід зауважити, що кількість CD8+-лімфоцитів була більшою за нормативні значення на всіх етапах проведення ДКВ.
Результати досліджень змін у стані природної ланки імунітету, а саме в субпопуляціях натуральних кілерних клітин (НКК) із фенотипом CD3-16+56+ та натуральних кілерних Т-клітин (НКTК) із фенотипом CD3+16+56+, які відіграють провідну роль у протипухлинному імунітеті, представлені на рис. 2.
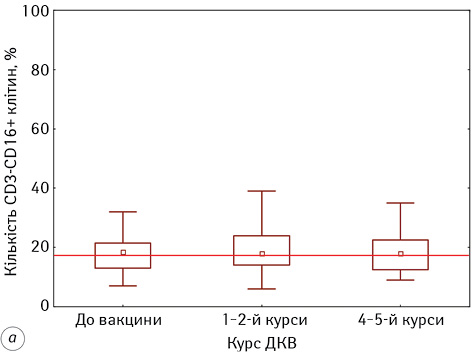
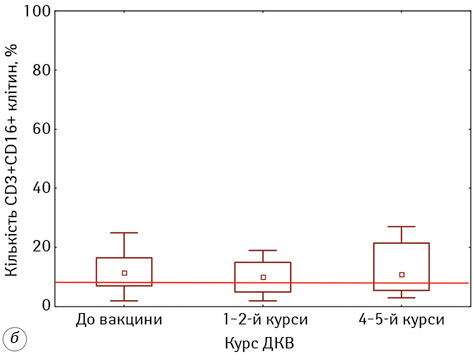
Нами встановлено, що проведення ДКВ значно не вплинуло на кількісні зміни в субпопуляціях цих лімфоцитів. Проведення ДКВ сприяло деякому підвищенню кількості НKTК до 12,63±1,97% на кінцевому етапі проведення ІТ, проте ці зміни не виявили статистичної значущості (р >0,05).
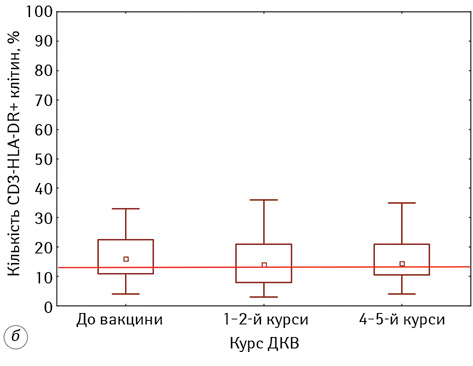
Наступним етапом нашої роботи була оцінка кількісних змін серед субпопуляцій активованих лімфоцитів, результати якої представлені на рис. 3.
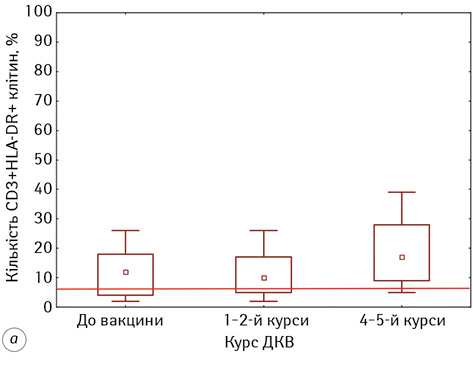
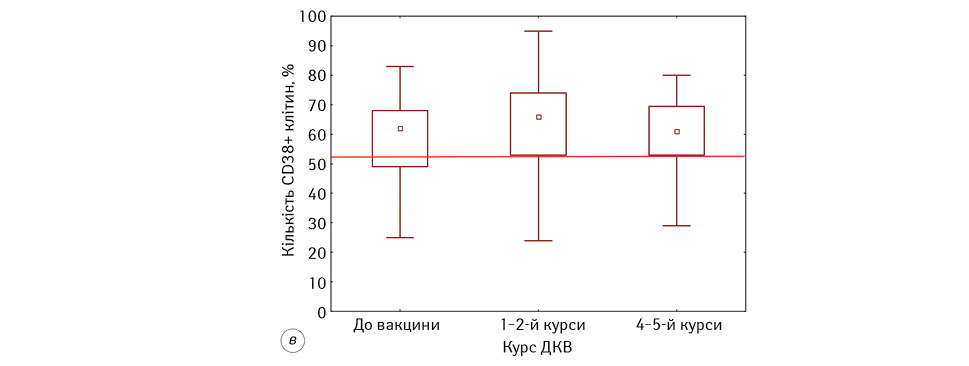
Відомо, що субпопуляція лімфоцитів з фенотипом CD3+HLA-DR+ належить до активованих Т-лімфоцитів, тоді як клітини із фенотипом CD3-HLA-DR+– до В- та активованих НКК-лімфоцитів. У результатах наших досліджень зафіксовано, що кількість активованих Т-лімфоцитів у пацієнтів на всіх етапах проведення ІТ була статистично значуще вище показників ПЗЛ (р <0,05). Так, до початку проведення ДКВ кількість клітин із фенотипом CD3+HLA-DR+ була у 2,24 раза вище, ніж у ПЗЛ, та становила 11,66±1,42% проти 5,20±1,20% відповідно. Під час проведення ДКВ ми відмічали подальше збільшення кількості цих клітин до 19,06±2,38% на фінальних етапах ІТ, і вони були статистично значуще вище показників до початку проведення ІТ (р=0,03).
В аналізі змін у субпопуляції активованих клітин із фенотипом CD3-HLA-DR+ встановлено, що до початку ДКВ їх значення були значно вищими за показники ПЗЛ 17,60±1,74% проти 12,0±1,93% (р <0,05). На тлі проведення ДКВ зафіксована нормалізація відносної кількості CD3-HLA-DR+-лімфоцитів до рівня 15,40±1,81%.
До активованих лімфоцитів також належать лімфоцити, що експресують маркер CD38. Проведення ІТ сприяло незначному збільшенню кількості CD38+-лімфоцитів після 1–2 введень ДКВ та їх нормалізації на фінальному етапі ДКВ.
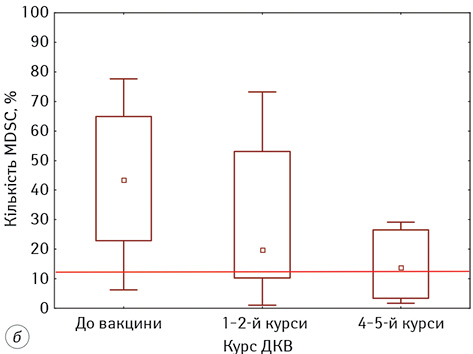
Наразі багато дослідників вказують на ключову роль MDSC з фенотипом HLA-DR-11b+33+ у розвитку пухлин. У наших результатах встановлено, що до початку ДКВ кількість MDSC в периферичній крові пацієнтів була у 3,6 раза більше показників ПЗЛ та становила 41,55±5,81% проти 11,0±1,50% відповідно (рис. 4). Проведення ДКВ сприяло статистично значущому зниженню кількості MDSC на кожному наступному етапі ІТ (р=0,004). Так, після 4–5 введень ДКВ відносна кількість MDSC у периферичній крові пацієнтів становила 14,94±3,75%.
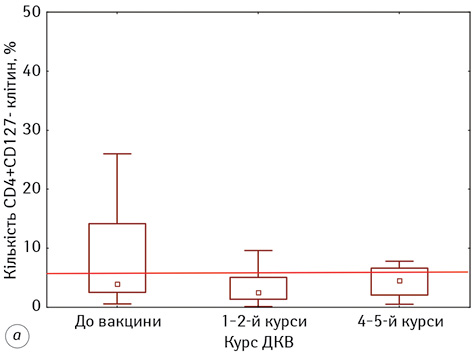
Нами не виявлено значного впливу ІТ на відносну кількість Т-рег-клітин у пацієнтів з гліобластомою на тлі проведення ДКВ. Так, до початку проведення ІТ їх кількість становила 7,72±1,60%, а на фінальному етапі (4–5-му введенні) — 6,51±1,82%. Також слід зазначити, що ці показники відповідали таким у ПЗЛ.
Наступним етапом нашої роботи було виявлення асоціацій між кількісними показниками вище наведених імунологічних показників та рівня виживаності хворих на гліобластому на етапах проведення ДКВ. Нами встановлено, що тільки 2 показники мають статистично значущу кореляцію із рівнем виживаності, а саме кількість НКTК (CD3+16+56+-лімфоцитів) та Т-рег-клітин (CD4+ CD127+-лімфоцитів). Результати аналізу представлені на рис. 5.
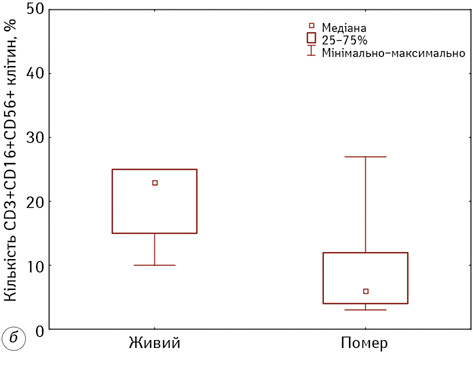
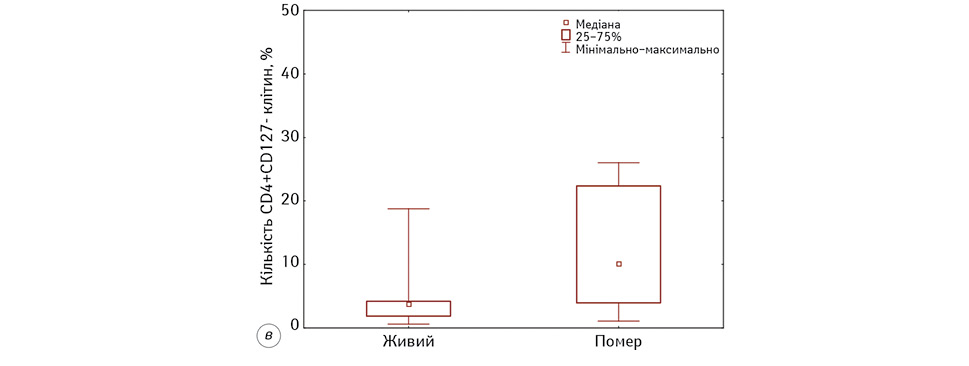
Після цього нами був проведений ROC-аналіз для цих показників. За результатами отриманих даних встановлено, що достатню чутливість (<75%) та специфічність (<65%) має тільки 1 показник, а саме кількість НКТК (CD3+16+56+-лімфоцитів). Слід зазначити, що він мав достатню чутливість та специфічність як до початку ІТ ДКВ (Se=77%, Sp=86%, р=0,0006, AUC=0,81), так і після (Se=77%, Sp=86%, р=0,001, AUC=0,87), порогові значення становили до ІТ ≤9%, після — ≤13%. Тож, визначення кількісних змін у субпопуляції НКТК у хворих на гліобластому під час проведення ДКВ дає змогу прогнозувати ефективність проведеної ІТ з чутливістю від 77 до 86%. Результати виживаності хворих після проведення ІТ ДКВ залежно від порогових значень НКТК у периферичній крові представлені на рис. 6.
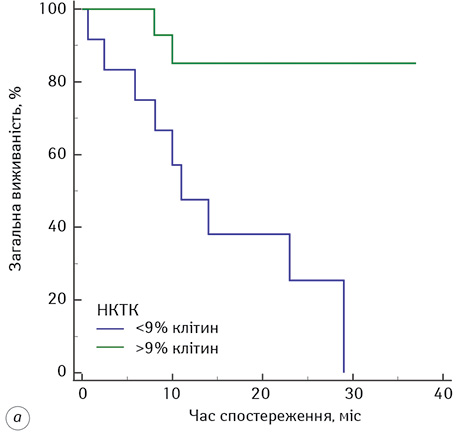
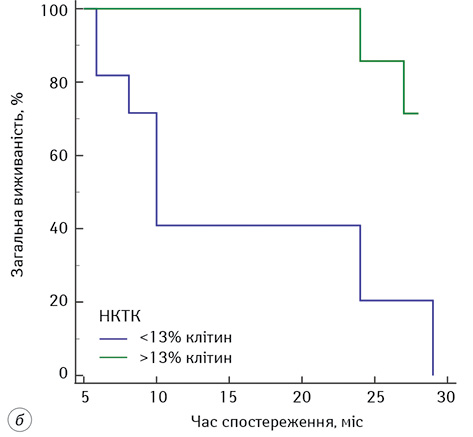
Встановлено, що пацієнти із кількістю НКТК <9% у периферичній крові в подальшому менш ефективно відповідають на ДКВ порівняно з пацієнтами, у яких кількість НКТК >9% (Logrank test = 9,08; p=0,003). Медіана ЗВ у пацієнтів становила 11 міс (95% ДІ 2,46–29,00) у пацієнтів, які на початку курсу ДКВ мали <9% НКТК у периферичній крові. У пацієнтів із кількістю НКТК >9% у периферичній крові на початку курсу ДКВ медіани виживаності не досягнуто.
Схожі дані отримали при аналізі кількості НКТК у периферичній крові у пацієнтів на останніх етапах курсу ДКВ. Виявлено, що пацієнти, які мали >13% НКТК у периферичній крові на 4–5-му етапах ДКВ, мали кращу відповідь на ДКВ, ніж пацієнти зі зниженим рівнем НКТК у периферичній крові (Logrank test = 6,79; p=0,009). Медіана ЗВ становила 10 міс (95% ДІ 5,87–24,00) у пацієнтів, що отримували ДКВ, у них виявлено кількість НКТК >13% на 4–5-му етапах ІТ. У пацієнтів, які мали >13% НКТК у периферичній крові на 4–5 курсах ІТ, медіани ЗВ не досягнуто. Відповідно до отриманих даних відносна кількість НКТК у периферичній крові пацієнтів із гліобластомою може бути прогностичним маркером ефективності ДКВ, що потребує подальших досліджень.
ОБГОВОРЕННЯ
Наше дослідження присвячене проблемі розробки підходів, спрямованих на підвищення ефективності результатів лікування пацієнтів із гліобластомою. Саме сьогодні світова нейроонкологічна спільнота долає скепсис щодо ІТ у пацієнтів зі злоякісними гліомами та стверджувально відповідає на питання щодо того, чи є ДКВ новим підходом у терапії пацієнтів з гліобластомою [12].
У 2023 р. L.M. Liau та співавторами опубліковані результати ІІІ фази мультицентрового рандомізованого клінічного дослідження. Це було проспективне зовнішньо-контрольоване когортне дослідження, що охоплювало інтернаціональні дані 94 дослідницьких центрів 4 країн за період з 2007 до 2015 р. [13]. У них встановлено позитивний вплив ДКВ, який полягає у підвищенні рівня виживаності (як безрецидивної, так і загальної) у пацієнтів з гліобластомою. Медіана ЗВ пацієнтів, що отримували вакцину DCVax-L, становила 19,3 міс (95% ДІ 17,5–21,3), тоді як для 1366 осіб з контрольної групи вона становила 16,5 міс (95% ДІ 16,0–17,5) (log-rank HR (коефіцієнт ризику) 0,80; 95% ДІ 0,00–0,94; р=0,002). При цьому відсоток 4-річної виживаності підвищувався майже у 2 рази, а саме повідомлялося, що ЗВ хворих через 48 міс після рандомізації становила 15,5 проти 9,9% в основній і контрольній групах відповідно. Автори висловлюють думку, що провідні імуноонкологічні центри повинні якомога швидше масштабувати ці здобутки на широку практичну площину.
Досягнуті показники виживаності в дослідженій нами когорті 24 пацієнтів із вперше діагностованою гліобластомою свідчать про доцільність застосування ДКВ у складі ад’ювантної мультимодальної терапії та співпадають з результатами, отриманими під час ІІІ фази клінічних досліджень. Слід наголосити, що не менше 2/3 пацієнтів дослідженої вибірки прожили 1,5 року після резекції первинної гліобластоми. При цьому у більше половини пацієнтів досягнуто 2-річної виживаності.
Водночас основним фокусом цієї роботи є аналіз імунологічних показників у пацієнтів досліджуваної вибірки, який дозволяє виявити відмінності в імунологічному статусі хворих із гліобластомою порівняно з ПЗЛ перед проведенням ДКВ, а також визначати зміни субпопуляційного складу лімфоцитів під впливом ІТ. Таких досліджень усе ще вкрай бракує на сьогодні, проте саме імунологічні критерії слід розглядати як одні з найбільш інформативних діагностичних ознак ефективності ДКВ, що дозволяють оцінити перебіг процесів, що відбуваються в організмі пацієнта з гліобластомою під впливом ІТ.
Незважаючи на численні відомості про зміни у стані імунної системи під впливом ІТ, до теперішнього часу остаточно не визначені її найбільш важливі імунологічні критерії. Одним з можливих пояснень цього є багатофункціональність імунної системи та плейотропність її ефектів, що ускладнює можливість прогнозування на підставі окремо взятих показників [14, 15].
Нами встановлено, що ІТ на основі ДКВ значно не впливає на кількість основних популяцій лімфоцитів периферичної крові (Т- та В-лімфоцитів) у динаміці проведення ІТ, однак слід зазначити, що кількість CD3+ Т-лімфоцитів та CD4+ Т-клітин хелперів до початку проведення ІТ була статистично значуще нижче показників ПЗЛ (р <0,05), а кількість CD20+ В-лімфоцитів та CD8+-лімфоцитів була статистично значуще вищою за референтні значення (р <0,05). Проведення ДКВ сприяло нормалізації цих показників, а для CD4+-лімфоцитів ми відмічали статистично значуще збільшення їх кількості. Отримані результати можуть свідчити про наявність певної імунологічної супресії на початку проведення ІТ, при якій відбувається пригнічення імунної відповіді на пухлинні антигени, але проведення ДКВ усуває негативний вплив та сприяє збільшенню кількості клітин клону Т-хелперів-1 (CD4+-лімфоцити), які активують головні ефекторні клітини протипухлинної імунної відповіді — цитотоксичні Т-лімфоцити (ЦТЛ) та NKT-клітини. Слід зазначити, що є публікації, присвячені дослідженню взаємодії клітин імунної системи та мікроглії, в яких доводиться, що саме Т-хелпери 1 (завдяки збільшенню секреції IFN-g) безпосередньо впливають і на мікроглію [16, 17].
Водночас у контексті питання, що обговорюється, не можна оминути увагою суттєву роль MDSC у розвитку новоутворень внаслідок безперечного ефекту імунної супресії, що призводить до спотворення імунного нагляду і порушення протипухлинної цитотоксичності [18]. Результати наших досліджень збігаються з даними інших авторів, які вказують на значне збільшення кількості циркулювальних MDSC у пацієнтів з гліобластомою [19]. Також вони припускають, що кількісні зміни в субпопуляції MDSC можуть слугувати імунологічним критерієм ефективності проведеної терапії. Однак ми не отримали підтвердження цих припущень у нашому дослідженні.
Зареєстрована асоціація між кількісними даними імунологічних показників та рівнем виживаності хворих на гліобластому після проведення ДКВ дає змогу встановити найбільш вірогідні біомаркери її клінічної ефективності. Тож нами був проведений ROC-аналіз незалежних імунологічних показників у досліджуваній вибірці для хворих на гліобластому. ROC-аналіз використовують як найбільш точний статистичний метод для оцінки діагностичної та прогностичної значущості маркера. За результатами отриманих даних встановлено, що достатню чутливість (>75%) та специфічність (>65%) має один біомаркер — НКТК із фенотипом CD3+16+56+, виявлені його порогові значення, які дають змогу прогнозувати ефективність проведеної ІТ з чутливістю від 77 до 88%. У результатах досліджень А.Е. Willemsen та співавт. зафіксовано, що зміни в абсолютній та відносній кількості популяцій та субпопуляцій лейкоцитів периферичної крові хворих на рак грудної залози можуть слугувати предикторами як протипухлинної відповіді, так і розвитку токсичності на лікування еверолімусом у комбінації із екземестаном [20]. Так, вони встановили, що кількість CD4+лімфоцитів до початку лікування асоціюється із протипухлинною відповіддю, а кількість NKT-клітин дає змогу передбачити легеневу токсичність, однак слід зазначити, що наша думка збігається із думкою вищезазначених авторів, що рекомендувати отримані біомаркери для застосування в якості імунологічних критеріїв ефективності ІТ лікарям-онкологам можливо тільки після залучення більшої когорти пацієнтів у дослідження.
Отже, продовження наукового пошуку, присвяченого вдосконаленню ІТ-підходів, перш за все ДКВ у складі мультимодальної терапії пацієнтів із гліобластомою, при збільшенні вибірки та терміну спостереження, є одним з пріоритетних напрямків сучасних нейроонкологічних досліджень.
ВИСНОВКИ
1. Встановлено, що у пацієнтів із гліобластомою до початку проведення ДКВ зафіксовано статистично значущі відхилення у кількості Т- та В-лімфоцитів периферичної крові відносно значень ПЗЛ, а саме зареєстровано зниження відносної кількості CD3+– та CD4+-лімфоцитів та збільшення показників CD20+– та CD8+-лімфоцитів (р <0,05).
2. Доведено, що проведення ДКВ сприяє достовірному збільшенню основних ефекторів імунної відповіді, а саме Т-хелперів (CD4+-лімфоцитів) на усіх етапах проведення ДКВ (р=0,04).
3. Виявлено статистично значуще збільшення активованих Т-лімфоцитів із фенотипом CD3+HLA+ на етапах проведення ДКВ (р=0,03).
4. До початку ДКВ кількість MDSC із фенотипом HLA-DR-11b+33+ у периферичній крові пацієнтів з гліобластомою була у 3,6 раза більшою порівняно з показниками ПЗЛ. Проведення ДКВ сприяло статистично значущому зниженню кількості MDSC на кожному наступному етапі ІТ (р=0,004).
5. Зафіксовано, що достатню чутливість та специфічність має тільки 1 показник, а саме кількість НКТК (CD3+16+56+-лімфоцитів) у периферичній крові. Обчислені порогові значення НКТК: до ІТ — ≤9%, після — ≤13%, тож визначення кількісних змін у субпопуляції НКТК у хворих на гліобластому під час проведення ДКВ дає змогу прогнозувати ефективність проведеної ІТ з чутливістю від 77 до 86%.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Kanderi, T., & Gupta, V. (2022). Glioblastoma Multiforme. Retrieved from pubmed.ncbi.nlm.nih.gov/32644380.
2. Wang, X., Zhao, H. Y., Zhang, F. C., Sun, Y., Xiong, Z. Y., & Jiang, X. B. (2014). Dendritic cell-based vaccine for the treatment of malignant glioma: a systematic review. Cancer investigation, 32(9), 451–457. doi.org/10.3109/07357907.2014.958234.
3. Van Gool, S. W., Makalowski, J., Kampers, L. F. C., Van de Vliet, P., Sprenger, T., Schirrmacher, V., & Stücker, W. (2023). Dendritic cell vaccination for glioblastoma multiforme patients: has a new milestone been reached? Translational cancer research, 12(8), 2224–2228. doi.org/10.21037/tcr-23-603.
4. Kipnis, J. (2016). Multifaceted interactions between adaptive immunity and the central nervous system. Science (New York), 353(6301), 766–771. doi.org/10.1126/science.aag2638.
5. Rustenhoven, J., Drieu, A., Mamuladze, T., de Lima, K. A., Dykstra, T., Wall, M., … Kipnis, J. (2021). Functional characterization of the dural sinuses as a neuroimmune interface. Cell, 184(4), 1000–1016. doi.org/10.1016/j.cell.2020.12.040.
6. Matsuo, K., Yoshie, O., Kitahata, K., Kamei, M., Hara, Y., & Nakayama, T. (2021). Recent Progress in Dendritic Cell-Based Cancer Immunotherapy. Cancers, 13(10), 2495. doi.org/10.3390/cancers13102495.
7. Najafi, M., Jahanbakhshi, A., Finocchi Ghersi, S., Giaccherini, L., Botti, A., Cavallieri, F., … Cozzi, S. (2023). Clinical Effects of Immuno-Oncology Therapy on Glioblastoma Patients: A Systematic Review. Brain sciences, 13(2), 159. doi.org/10.3390/brainsci13020159.
8. Lamano, J. B., Ampie, L., Choy, W., Kesavabhotla, K., DiDomenico, J. D., Oyon, D. E., … Bloch, O. (2016). Immunomonitoring in glioma immunotherapy: current status and future perspectives. Journal of neuro-oncology, 127(1), 1–13. doi.org/10.1007/s11060-015-2018-4.
9. Roulleaux Dugage, M., Albarrán-Artahona, V., Laguna, J. C., Chaput, N., Vignot, S., Besse, B., … Auclin, E. (2023). Biomarkers of response to immunotherapy in early stage non-small cell lung cancer. European journal of cancer, 184, 179–196. doi.org/10.1016/j.ejca.2023.01.029.
10. Храновская, Н., Крячок, И., Ганул, В., Воробьева, Л., Гриневич, Ю., Орел, В., … Горба А. (2014). Разработка, обоснование и оценка эффективности противоопухолевой вакцинотерапии на основе дендритных клеток у больных со злокачественными новообразованиями. Клиническая онкология, 2(14), 62–69.
11. Glavatskyi, O., Khranovska, N., Skachkova, O., Gorbach, O., Khmelnytskyi, H., Shuba, I., … Zemskova, O. (2023). Dendritic cells in glioblastoma treatment: a modern view of the problem and own experience. Experimental Oncology, 45(3), 282–296. doi.org/10.15407/exp-oncology.2023.03.282.
12. Datsi, A., & Sorg, R. V. (2021). Dendritic Cell Vaccination of Glioblastoma: Road to Success or Dead End. Frontiers in immunology, 12, 770390. doi.org/10.3389/fimmu.2021.770390.
13. Liau, L. M., Ashkan, K., Brem, S., Campian, J. L., Trusheim, J. E., Iwamoto, F. M., … Bosch, M. L. (2023). Association of Autologous Tumor Lysate-Loaded Dendritic Cell Vaccination With Extension of Survival Among Patients With Newly Diagnosed and Recurrent Glioblastoma: A Phase 3 Prospective Externally Controlled Cohort Trial. JAMA oncology, 9(1), 112–121. doi.org/10.1001/jamaoncol.2022.5370.
14. Hu-Lieskovan, S., Bhaumik, S., Dhodapkar, K., Grivel, J. J. B., Gupta, S., Hanks, B. A., …, Maecker, H. T. (2020). SITC cancer immunotherapy resource document: a compass in the land of biomarker discovery. Journal for immunotherapy of cancer, 8(2), e000705. doi.org/10.1136/jitc-2020-000705.
15. Mohme, M., Schliffke, S., Maire, C. L., Rünger, A., Glau, L., Mende, K. C., … Lamszus, K. (2018). Immunophenotyping of Newly Diagnosed and Recurrent Glioblastoma Defines Distinct Immune Exhaustion Profiles in Peripheral and Tumor-infiltrating Lymphocytes. Clinical cancer research, 24(17), 4187–4200. doi.org/10.1158/1078-0432.CCR-17-2617.
16. Adhikaree, J., Moreno-Vicente, J., Kaur, A. P., Jackson, A. M., & Patel, P. M. (2020). Resistance Mechanisms and Barriers to Successful Immunotherapy for Treating Glioblastoma. Cells, 9(2), 263. doi.org/10.3390/cells9020263.
17. Krishnarajah, S., & Becher, B. (2022). TH Cells and Cytokines in Encephalitogenic Disorders. Frontiers in immunology, 13, 822919. doi.org/10.3389/fimmu.2022.822919.
18. Diaz-Montero, C. M., Finke, J., & Montero, A. J. (2014). Myeloid-derived suppressor cells in cancer: therapeutic, predictive, and prognostic implications. Seminars in oncology, 41(2), 174–184. doi.org/10.1053/j.seminoncol.2014.02.003.
19. Mi, Y., Guo, N., Luan, J., Cheng, J., Hu, Z., Jiang, P., … Gao, X. (2020). The Emerging Role of Myeloid-Derived Suppressor Cells in the Glioma Immune Suppressive Microenvironment. Frontiers in immunology, 11, 737. doi.org/10.3389/fimmu.2020.00737.
20. Willemsen, A. E. C. A. B., He, X., van Cranenbroek, B., de Jong, P. C., de Boer, M., Joosten, I., … Gerritsen, W. R. (2021). Baseline effector cells predict response and NKT cells predict pulmonary toxicity in advanced breast cancer patients treated with everolimus and exemestane. International immunopharmacology, 93, 107404. doi.org/10.1016/j.intimp.2021.107404.
Адреса для листування:
Скачкова Оксана Володимирівна
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: oksanaskachkova@ukr.net
Correspondence:
Oksana Skachkova
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: oksanaskachkova@ukr.net














Leave a comment