ЛІКУВАННЯ ХВОРИХ НА ГЕРМІНОГЕННІ ПУХЛИНИ ЯЄЧКА: СУЧАСНІ СТРАТЕГІЇ ТА ОЦІНКА РЕЗУЛЬТАТІВ ТЕРАПІЇ
Сивак Л.А., Лялькін С.А., Стаховський О.Е., Войленко О.А., Касап Н.В., Кліманов М.Ю., Майданевич Н.М., Аскольський А.В.
Резюме. За останні десятиріччя захворюваність на герміногенні пухлини яєчка підвищилася більше ніж у 2 рази, у чоловіків віком 20–35 років це одна з найбільш поширених злоякісних пухлин. Проведено аналіз лікування 113 пацієнтів, хворих на герміногенні пухлини яєчка. Отримані результати продемонстрували успіхи хіміотерапії в лікуванні цієї нозології. Навіть за наявності дисемінованого процесу у більше ніж 80% хворих реально досягти повного одужання. При цьому необхідно зазначити, що такого прогресу вдалося досягти завдяки створенню раціональних схем хіміотерапії, підібраних на основі індивідуального прогнозу пацієнта, а також у результаті чіткого виконання алгоритмів лікування, представлених у даній статті.

Герміногенні пухлини яєчка (ГПЯ) є відносно рідкісними новоутвореннями: їх питома вага в структурі онкологічної захворюваності у чоловіків лише незначно перевищує 1%. Проте у чоловіків молодого віку (20–40 років) саме цей різновид неоплазми є не лише одним з найчастіших онкологічних захворювань, але й головною причиною онкологічної смертності [3, 5, 9, 13, 22]. За останні 40 років захворюваність тестикулярними пухлинами майже подвоїлася. Найменша частота ГПЯ спостерігається у Африці й Азії (менше 1 випадку на 100 000 чоловіків в рік) [3, 9, 13, 22]. У країнах Європи та Північної Америки цей показник становить 5–7 випадків, а в Скандинавії щорічна частота новоутворень яєчка досягає 8–10 первинних діагнозів на 100 000 чоловіків [3, 9].
В Україні захворюваність на ГПЯ у 2010 р. становила 2,5 випадки на 100 000 населення, але у структурі онкологічної захворюваності чоловіків віком від 18 до 29 років дана нозологія знаходиться на 2-му місці за частотою [1].
Захворюваність на ГПЯ не збільшується з віком, але досягає максимуму у віковій групі від 25 до 35 років, пік захворюваності при семіномі припадає на 35–40 років, при несеміномних пухлинах — на 20–25 років. Більше 50% випадків захворювання ГПЯ виявляють у чоловіків у віковій групі до 35 років [3, 8, 9, 13, 22]. Збереження працездатності у цієї групи пацієнтів має соціально-економічне значення.
Клінічно і морфологічно ГПЯ поділяють на семіноми і несеміномні пухлини, що обумовлено їх відмінностями у біології, тактиці лікування і прогнозі. Семіноми становлять близько 40% ГПЯ, несеміномні і змішані пухлини — близько 60%, в 2–3% випадків виявляють білатеральні пухлини [3, 5, 8, 9]. До несеміномних герміногенних пухлин відносять групу різнорідних гістологічних підтипів від таких низькодиференційованих і агресивних форм, як хоріонкарцинома, ембріональний рак, пухлина жовчного мішка, до тератоми в різних варіантах її диференціювання. Підвищення рівня захворюваності ГПЯ на 10–30%, характерне як для семіном, так і для несеміномних пухлин, відмічали кожні 5 років впродовж останніх 3 десятиліть [3, 8, 13, 22]. ГПЯ відрізняються швидким перебігом, високою агресивністю і раннім метастазуванням. У більшості пацієнтів до моменту встановлення діагнозу вже є метастази в лімфатичні вузли заочеревинного простору, лімфатичні вузли середостіння, або вісцеральні метастази, найчастіше в легені.
Актуальність проведення адекватного лікування ГПЯ на ранніх стадіях, що дозволяє досягти одужання пацієнта з мінімальною токсичністю (із застосуванням меншого арсеналу лікувальних методів), є очевидним фактом.
Матеріали і методи
У Національному інституті раку за період з 1995 по 2011 рр. проведено лікування 113 хворих на ГПЯ у віці від 18 до 72 років. З них у 63 (55,7%) хворих діагностована несеміномна пухлина, у 44 (39%) — семінома, решта 6 (5,3%) мали змішану пухлину. Розподіл хворих за віком представлено у табл. 1.
Таблиця 1. Розподіл хворих на герміногенні пухлини яєчка за віком
| Вік | Групи хворих | |||||
|---|---|---|---|---|---|---|
| Семінома | Несемінома | Змішані | ||||
| Абс. кількість |
% | Абс. кількість |
% | Абс. кількість |
% | |
| Менше 20 років | 1 | 2,3 | 9 | 14,3 | 0 | 0 |
| 21–30 років | 12 | 27,3 | 36 | 57,1 | 3 | 50 |
| 31–40 років | 19 | 43,2 | 11 | 17,5 | 2 | 33,3 |
| 41–50 років | 8 | 18,2 | 5 | 7,9 | 1 | 16,7 |
| Старші 50 років | 4 | 9,0 | 2 | 3,2 | 0 | 0 |
Як видно з табл. 1, серед хворих з несеміномними пухлинами переважали пацієнти молодого віку (близько 70% у віці 18–30 років). Серед хворих з семіномами найбільш численною була вікова група від 31 до 40 років.
Стадіювання ГПЯ проводили згідно з TNM-класифікацією AJCC (American Joint Committee on Cancer TNM staging system for Testis Cancer, 7 edition, 2010). Розподіл хворих згідно зі стадіями та TNM представлено у табл. 2.
Таблиця 2. Розподіл хворих на герміногенні пухлини яєчка за клінічними стадіями та TNM
| Стадія | pTNM | Групи хворих | |||||
|---|---|---|---|---|---|---|---|
| Семінома | Несемінома | Змішані | |||||
| Абс. кількість |
% | Абс. кількість | % | Абс. кількість | % | ||
| ІA | pТ1N0M0 | 8 | 18,2 | 5 | 7,9 | 1 | 16,7 |
| ІB | pT2N0M0 | 5 | 11,4 | 6 | 9,5 | 2 | 33,3 |
| pT3N0M0 | 4 | 9,0 | 5 | 7,9 | – | – | |
| Всього | 9 | 20,5 | 11 | 17,5 | 2 | 33,3 | |
| ІS | pT1–3N0M0S1–2 | 5 | 11,4 | 7 | 11,2 | – | – |
| IIA | pT1–3N1M0 | 6 | 13,6 | 8 | 12,7 | 1 | 16,7 |
| IIB | pT1–3N2M0 | 5 | 11,4 | 9 | 14,3 | – | – |
| IIC | pT1–3N3M0 | 6 | 13,6 | 9 | 14,3 | – | – |
| IIIA–B | pT1–3N1–3M1aS0–2 | 3 | 6,8 | 9 | 14,3 | – | – |
| ШС | pT1–3N1–3M1б | 2 | 4,5 | 5 | 7,9 | – | – |
| Всього | 44 | 100 | 63 | 100 | 6 | 100 | |
Обстеження пацієнтів на ГПЯ переслідує наступні основні цілі: коректне стадіювання, уточнення локалізації метастазів для планування циторедуктивних втручань після індукційної хіміотерапії та визначення супутньої клінічно значимої патології.
Окрім загальноприйнятих клінічних та лабораторних методів обстеження, використовували ультразвукове дослідження яєчок, рентгенографію органів грудної порожнини, ультразвукове дослідження органів черевної порожнини, заочеревинного простору і малої миски або комп’ютерну томографію (КТ) зазначених областей. Також обов’язково досліджували рівень сироваткових маркерів — альфа-фетопротеїну (АФП), бета-субодиниці хоріонічного гонадотропіну людини (b-ХГЛ) і лактатдегідрогенази (ЛДГ), що робить виключно важливий внесок в діагностику і стадіювання ГПЯ.
Схеми хіміотерапії, які використовували для лікування ГПЯ:
Карбоплатин AUC = 7.
ЕР: етопозид 100 мг/м 1–5-й день, цисплатин 20 мг/м 1–5-й день.
ВЕР: етопозид 100 мг/м 1–5-й день, цисплатин 20 мг/м 1–5-й день, блеоміцин 30 мг 1; 8; 15-й день.
VIP: етопозид 75 мг/м 1–5-й день, месна 120 мг/м — повільно вводити перед іфосфамідом у 1-й день, потім месну 1200 мг/м безперервною інфузією 1–5-й день, іфосфамід 1200 мг/м 1–5-й день, цисплатин 20 мг/м 1–5-й день.
VeIP: вінбластин 0,11 мг/кг 1-й і 2-й дні, месна 400 мг/м кожні 8 год 1–5-й день, іфосфамід 1200 мг/м 1–5-й день, цисплатин 20 мг/м 1–5-й день.
GEMOX: гемцитабін 1000 мг/м 1-й і 8-й дні, оксаліплатин 130 мг/м 1-й день.
ТІР: паклітаксел 250 мг/м 1-й день, іфосфамід 1500 мг/м 2–5-й день, месна 500 мг/м до іфосфаміду, потім через 4 і 8 годин після іфосфаміду 2–5-й день, цисплатин 25 мг/м 2–5-й день.
Результати та їх обговорення
Орхофунікулектомія
Найважливішим етапом діагностики і першим кроком у лікуванні є видалення ураженого яєчка з ретельним гістологічним дослідженням операційного матеріалу. Оперативне втручання виконується лише з пахвинного доступу, який дозволяє провести пересічення сім’яного канатика на рівні внутрішнього отвору пахового каналу. Проте досить часто в клінічній практиці зустрічаються пацієнти, яким орхектомію проведено з розрізу на калитці. Як правило, такий підхід може призвести до місцевого рецидиву пухлини в куксі сім’яного канатика із залученням нетипових шляхів лімфовідтоку, сприяючи ранньому ураженню пахових і тазових лімфатичних вузлів [2, 5, 25, 26]. У нашій клініці фунікулектомію виконано 7 хворим після орхектомії, проведеної в інших лікувальних установах неонкологічного профілю. В усіх випадках у видаленому сім’яному канатику морфологічно визначалася резидуальна пухлина.
Згідно з рекомендаціями Європейської Асоціації Урологів (2011 р.), у виняткових випадках, за наявності дисемінованого пухлинного процесу і загрозливих життю метастазів, допустимо розпочинати лікування з хіміотерапії, відклавши виконання орхофунікулектомії до моменту стабілізації стану хворого [5].
Органозберігаюче лікування (резекція яєчка) може виконуватися у виняткових ситуаціях та лише у спеціалізованих установах з великим досвідом роботи. Показаннями до резекції яєчка є: синхронні білатеральні пухлини яєчка, метахронна контрлатеральна пухлина яєчка, пухлина єдиного яєчка (за умови його достатньої гормональної активності), атрофії контрлатерального яєчка [5, 25, 26]. Слід пам’ятати, що після резекції яєчка в його тканині, що залишилася, завжди є внутрішньопротокова карцинома, що вимагає проведення променевої терапії. Якщо хворий планує батьківство, проведення оперативного втручання може бути відстрочено, але на мінімально короткий термін. На сьогоднішній день більш виправданим є кріопрезервація сперми пацієнта, що в подальшому дозволяє проводити екстракорпоральне запліднення.
У нашій клініці проведено 102 оперативних втручання, з них 100 — орхофунікулектомії та 2 резекції яєчка.
Лікування ранніх стадій ГПЯ
Семінома ІА–ІВ стадії. Нами проведено лікування 9 таких пацієнтів. До цієї стадії належать хворі з будь-якою поширеністю первинної пухлини, які не мають метастазів в регіонарні/заочеревинні лімфатичні вузли та віддалених метастазів, рівень пухлинних маркерів яких після орхофунікулектомії в межах норми. Після виконання орхофунікулектомії і за відсутності подальших лікувальних заходів приблизно у 20% пацієнтів відзначають прогресування захворювання за рахунок появи метастазів в заочеревинні лімфатичні вузли або лімфатичні вузли середостіння [2, 5, 14, 29]. Це твердження спонукає до вживання адекватних профілактичних заходів. У великому рандомізованому дослідженні MRC TE19/EORTC 30982, в якому взяло участь 1447 пацієнтів із семіномою I стадії, було здійснено порівняння профілактичної променевої терапії і одного курсу ад’ювантної хіміотерапії карбоплатином у дозі AUC=7 [20]. Обидва підходи показали однакову ефективність — було досягнуто високої 3-річної безрецидивної виживаності (95–96%) при 100% загальної виживаності [20].
У нашій клініці хворі з ІА–В стадією семіноми у більшості випадків отримували 1–2 курси ад’ювантної хіміотерапії карбоплатином. Такий підхід ми вважаємо більш виправданим у зв’язку з відносною простотою та мінімальною токсичністю.
Семінома 1S стадії. При підвищенні рівня АФП пацієнтів повинні лікувати за протоколами, затвердженими для несеміномних пухлин, тобто проводити ад’ювантну поліхіміотерапію (ПХТ): 3 курси за схемою ВЕР або 4 курси за схемою ЕР. Усі 14 пацієнтів із І стадією семіноми, які лікувалися у нашому інституті, на даний момент живі та знаходяться під спостереженням.
Семінома IІА–ІІВ стадії. Нами проліковано 11 хворих з цією стадією. Пацієнти отримували ад’ювантну ПХТ: 3 курси за схемою ВЕР або 4 курси за схемою ЕР (у випадках ризику легеневої токсичності внаслідок дії блеоміцину). Курси хіміотерапії проводилися з інтервалом в 21 день. Об’єктивна відповідь становила 91%. Пацієнтам з повною регресією заочеревиних метастазів показано тільки динамічне спостереження. За даними літератури, у 40–60% пацієнтів відзначають залишкові заочеревинні утворення [14, 27, 29]. Заочеревинні лімфаденектомії, виконувані раніше, можливі в радикальному варіанті лише у половини хворих; виявлено, що в 90% випадків резидуальна пухлина є некротичною масою [18, 27, 29]. Променева терапія на заочеревинні лімфатичні вузли також не покращує результатів лікування. Тому нині загальноприйнятою тактикою є динамічне спостереження за хворими з семіномою з резидуальною пухлиною після хіміотерапії. При неможливості виконання або наявності протипоказань до ПХТ альтернативним варіантом є проведення променевої терапії на парааортальні та клубові лімфовузли.
Несеміномні пухлини ІА–В стадії. До цієї стадії належать хворі з будь-якою поширеністю первинної пухлини, що не мають метастазів в регіонарні/заочеревинні лімфатичні вузли та віддалених метастазів, рівень пухлинних маркерів яких після орхофунікулектомії в межах норми. Пухлинні маркери (АФП, ХГ і ЛДГ) необхідно досліджувати перед орхофунікулектомією і через 7–8 днів після неї. У нормі період напівжиття в крові АФП не перевищує 7 днів, а ХГ — 2,5 дня. Їх нормалізація після орхофунікулектомії підтверджує I стадію захворювання. Припинення зниження рівня маркерів або його підвищенння свідчить про наявність клінічно невиявлених метастазів. У даному випадку виникає потреба у проведенні паліативної хіміотерапії. Якщо після орхофунікулектомії при несеміномних пухлинах I стадії ад’ювантні заходи обмежити лише динамічним спостереженням, то прогресування захворювання буде мати місце у 27–30%, при цьому близько 95% рецидивів виникають впродовж перших 2 років спостереження [2, 14, 15, 21]. Судинна інвазія в первинній пухлині є одним з найбільш важливих прогностичних критеріїв. Відповідно, вибір тактики лікування після виконання орхофунікулектомії у пацієнтів з I стадією захворювання визначається відсутністю або наявністю пухлинної інвазії в судини. За відсутності пухлинної інвазії в судини рекомендується динамічне спостереження, оскільки при проведенні лише однієї орхофунікулектомії одужують 75–85% хворих з I стадією [5, 21, 25]. При неможливості регулярного динамічного спостереження доцільне проведення 2 курсів хіміотерапії за схемою ВЕР.
За наявності пухлинної інвазії в судини рекомендують проведення 2 курсів хіміотерапії за схемою ВЕР, що дозволяє досягти 5-річної безрецидивної і загальної виживаності 97 і 99% відповідно [2, 5, 21].
Нами проведено лікування 11 пацієнтів з І стадією несеміномних пухлин: 10 з них отримали 2 курси ПХТ за схемою ВЕР, одному ПХТ не призначали. 8 хворих на сьогодні знаходяться під спостереженням без ознак прогресування процесу, 2 пацієнти отримували ПХТ 2-ї лінії з приводу рецидиву. 3-річна виживаність становить 91%.
Несеміномні пухлини ІІА–В стадії. Стандартним лікуванням пацієнтів зі сприятливим прогнозом за IGCCCG є індукційна ПХТ: 3 курси за схемою ВЕР або 4 курси за схемою ЕР (при протипоказаннях до блеоміцину). Для пацієнтів «проміжної» або «несприятливої» прогностичної групи стандартним лікуванням є 4 курси ВЕР. Нами проведено лікування 17 таких хворих, об’єктивна відповідь становила 82,3%.
Лікування метастатичних пухлин
Для хворих з наявністю метастазів обов’язково визначається прогноз захворювання відповідно до классификації IGCCCG, в якій виділяють 2 прогностичні групи для семіном і 3 прогностичні групи для несеміномних ГПЯ (табл. 3, 4) [16].
Таблиця 3. Прогностична класифікація IGCCCG (International Germ Cell Consensus Classification) для хворих з несеміномною метастатичною пухлиною
|
Сприятливий прогноз: за наявності всього нижчеподаного:
|
|
Проміжний прогноз: за наявності всього нижчеподаного:
|
Несприятливий прогноз: за наявності будь-чого з нижчеподаного:
|
Таблиця 4. Прогностична класифікація IGCCCG (для хворих з метастатичною семіномою)
|
Сприятливий прогноз:
|
|
Проміжний прогноз:
|
При лікуванні хворих з ГПЯ вкрай важливим є дотримання режиму введення і підтримка запланованої інтенсивності лікування. Будь-які відстрочення в проведенні хіміотерапії і/або редукція доз цитостатиків призводять до значного погіршення виживаності хворих. З іншого боку, підтримка запланованої дозової інтенсивності хіміотерапії пов’язана з підвищеним ризиком виникнення важких побічних ускладнень (найчастіше обумовлених мієлотоксичністю), що вимагає наявності досвіду супровідного лікування таких пацієнтів. Ретроспективний аналіз показав, що в центрах, які включили менше 5 пацієнтів з несприятливим прогнозом в одне з досліджень EORTC, виживаність хворих була достовірно гіршою [7]. У зв’язку з цим украй важливо, щоб терапія хворих (особливо з несприятливим прогнозом) здійснювалася в центрах, які мають достатній досвід її проведення.
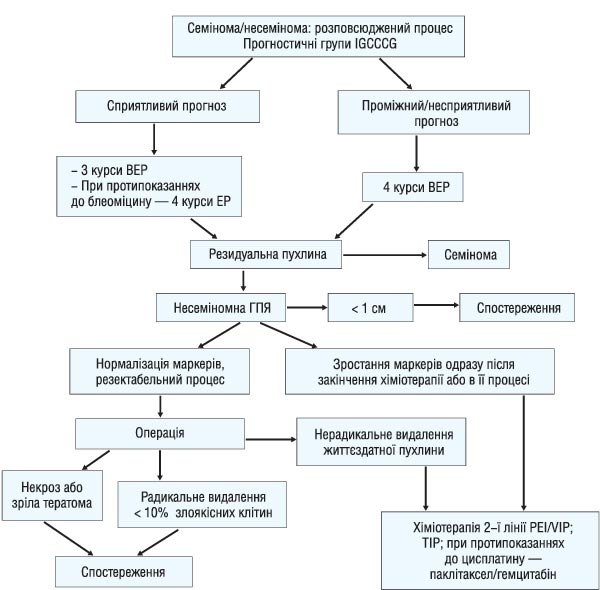
Тактику лікування хворих на метастатичні ГПЯ представлено на рисунку. У цілому пацієнтам зі сприятливим прогнозом за шкалою IGCCCG призначають 3 курси індукційної ПХТ за схемою ВЕР. Для пацієнтів «проміжної» або «несприятливої» прогностичної групи стандартним лікуванням є 4 курси ВЕР. У подальшому для семіном та несеміном з розміром резидуальної пухлини1 см показано оперативне видалення останньої. Підвищення рівня пухлинних маркерів під час або після завершення хіміотерапії свідчить про прогресування хвороби та є показанням для проведення ПХТ 2-ї лінії.
Нами проведено аналіз ефективності лікування 32 хворих з розповсюдженими ГПЯ, 12 семіном та 20 несеміномних пухлин. Серед хворих на семіному у 9 (75%) був сприятливий прогноз. Серед несеміномних пухлин: 12 (60%) хворих мали сприятливий прогноз , 5 (25%) хворих — проміжний, решта 3 (15%) — несприятливий. Всім хворим проводилася індукційна ПХТ за схемою ВЕР. Об’єктивна відповідь (повна + часткова регресія) зареєстрована у 91,6% хворих на семіному та у 85% пацієнтів з несеміномними пухлинами. 7 хворим на семіному з розмірами резидуальної пухлини >1 см проведено заочеревинну лімфаденектомію. При оцінці віддалених результатів встановлено, що 3-річна виживаність становить: для семіном — 91,6%, для несеміномних пухлин — 85%. Усі пацієнти, що не пережили 3-річний термін, належали до прогностично несприятливої або проміжної груп.
Слід зазначити, що максимального успіху у виліковуванні хворого вдається досягти лише при чіткому дотриманні рекомендацій з лікування таких пацієнтів і умінні коригувати побічні ефекти хіміотерапії. Нині у хворих зі сприятливим прогнозом, більшість з яких можуть одужати після проведення адекватної хіміотерапії, перспективною є розробка методів зменшення токсичності лікування.
Лікування рецидивів герміногенних пухлин
Найважливішим елементом лікувальної тактики при ГПЯ є постійне спостереження, яке включає визначення маркерів АФП і b-ХГ, ЛДГ, проведення рентгенографії грудної клітки і ультразвукової діагностики або КТ заочеревинного простору кожні 4–6 тиж впродовж 1-го року, кожні 2 міс впродовж 2-го року, щоквартально — на 3-му році і далі кожні півроку до 5 років. Інтенсивний моніторинг, особливо в 1-й рік, пояснюється тим, що близько 80% рецидивів захворювання реалізується саме в цей період [5, 14, 15]. Такий підхід дозволяє виявити прогресування захворювання на ранніх стадіях, що покращує результати подальшого лікування. Незважаючи на високу чутливість ГПЯ до платиновмісних режимів, рецидив захворювання, за даними різних авторів, спостерігається у 5–20% хворих після 1-ї лінії хіміотерапії (індукційної хіміотерапії) [4–6, 10, 12]. Рідше спостерігаються рецидиви при «сприятливому» прогнозі — в 5–10% випадків, частіше — при «проміжному» і «несприятливому» прогнозі захворювання — в 10–20% [4–6]. При поширеній формі ГПЯ прогресування можливе у 20–30% хворих. У таких випадках показано проведення 2-ї лінії лікування (в іноземній літературі використовується термін «salvage therapy»), ефективність якої може бути досить високою: у 50% хворих можливе досягнення повного регресу пухлини і повне одужання у 20–25% пацієнтів [4, 5, 23, 24, 28].
Вибір лікувальної тактики при рецидиві захворювання визначається з урахуванням прогностичних чинників, що включають: локалізацію первинної пухлини (гонадна або позагонадна), ефективність раніше проведеної індукційної хіміотерапії, тривалість безрецидивного періоду, ступінь поширення пухлинного процесу на момент прогресування захворювання, рівень маркерів АФП та b-ХГ.
Найбільш поширеною локалізацією рецидиву ГПЯ є ретроперитонеальні, медіастинальні лімфатичні вузли, легені. При лікуванні рецидивів ГПЯ стандартно застосовують режими хіміотерапії з іфосфамідом: VeIP (у хворих, які отримували етопозид у складі 1-ї лінії хіміотерапії) або VIP (хворим, які не отримували етопозид). Незважаючи на досить високу частоту об’єктивних відповідей при використанні режимів хіміотерапії VeIP або VIP, приблизно у 70–75% хворих тривалість лікувального ефекту коротка [5, 28]. Тому очевидна необхідність пошуку ефективніших режимів з використанням нових цитостатиків: паклітакселу, гемцитабіну, оксаліплатину, іринотекану.
Ефективність паклітакселу в монорежимі при цисплатин-резистентних формах ГПЯ становить 11–35% [5, 10, 11, 17, 18]. Застосування паклітакселу в комбінації з іфосфамідом, цисплатином (TIP) підвищує ефективність лікування до 75–80% [17, 18]. Комбінація оксаліплатину та гемцитабіну (GemOx) дозволяє досягти об’єктивної відповіді у 35–46% хворих, що були резистентними до цисплатину [5, 11, 18, 19].
Нами досліджено результати лікування 10 хворих з рецидивами ГПЯ, з них 2 з семіномами, решта 8 мали несеміномні пухлини. Схемами ПХТ 2-ї лінії були VeIP, 3-ї — GemOx або TIP. Об’єктивну відповідь отримано у обох хворих на семіному та у 6 пацієнтів (75%) з несеміномною ГПЯ. Віддалені результати не оцінювалися, враховуючи невеликий термін спостереження.
Висновки
ГПЯ є потенційно курабельними солідними пухлинами. У пацієнтів з ранніми стадіями ГПЯ 3-річна виживаність для семіном становить 100%, для несеміномних пухлин — 91%, що приблизно відповідає літературним даним. У хворих з розповсюдженою семіномою показник 3-річної виживаності становить 91,6%, несеміномними пухлинами зі «сприятливим» прогнозом — 85 %. Ці досягнення значною мірою обумовлені успіхами хіміотерапії, а також збільшеними діагностичними можливостями, раціональною тактикою лікування хворих залежно від прогностичних чинників.
Орхофунікулектомія є обов’язковим лікувально-діагностичним етапом, з якого повинно починатися лікування хворих на ГПЯ (крім окремих спеціально зазначених випадків). Орхофунікулектомія повинна проводитися з пахвинного доступу. Виконання простої орхектомії без видалення сім’яного канатика є абсолютно неприпустимим та повинно вважатися хибною методикою.
Таким чином, можливість виліковування практично усіх хворих зі сприятливим прогнозом виводить на перший план проблему токсичності хіміотерапії, що потребує проведення подальших досліджень з цього приводу. Результати терапії пацієнтів з несприятливим прогнозом залишаються незадовільними. Їх поліпшення можливе в результаті розробки нових препаратів, інтенсифікації терапії, а також виявлення сучасних молекулярно-біологічних факторів, що дозволять індивідуалізувати лікування хворих на ГПЯ.
ЛІТЕРАТУРА
1. Бюлетень Національного канцер-реєстру № 12. (2011) «Рак в Україні, 2009–2010», Київ.
2. Буланов А.А., Трякин А.А., Тюляндин С.А. (2006) Лечение герминогенных опухолей ранних стадий. Практическая онкология, 1(7): 24–29.
3. Имянитов Е.Н. (2006) Эпидемиология и биология герминогенных опухолей. Практическая онкология, 1(7): 1– 5.
4. Проценко С.А. (2006) Лечение рецидивов герминогенных опухолей. Практическая онкология, 1(7): 44–50.
5. Albers P., Albrecht W., Algaba F. et al. (2011) EAU Guidelines on Testicular Cancer, 304–319.
6. Albers P., Weinknecht S., Krege S. et al. (2002) Prediction of necrosis after chemotherapy of advanced germ cell tumors — results of a prospective multicenter trial of the GTCSG. J. Urol., 167(Suppl.): 172, abstr. 690.
7. Collette L., Sylvester R.J., Stenning S.P. et al. (1999) Impact of the treating institution on survival of patients with «poor-prognosis» metastatic nonseminoma. European Organization for Research and Treatment of Cancer Genito-Urinary Tract Cancer Collaborative Group and the Medical Research Council Testicular Cancer Working Party. J Natl Cancer Inst., 91: 839–846.
8. De Vita V., Hellman S., Rosenberg S. Cancer of the Testis //Principles and Practice of Oncology — 2005. — р. 125.
9. Dieckmann K.P., Pichlmeier U. (2004) Clinical epidemiology of testicular germ cell tumors. World J. Urol., 22: 2–14.
10. Farmakis D., Pestasides M., Pestasides D. (2005) Recent Advances in Conventional Dose Salvage Chemotherapy in patients with Cisplatin-Resistant or Refractory Testicular Germ Cell Tumors. J. Europ. Urology., 48: 400–407.
11. Feldman D.R., Patil S., Trinos M.J. et al. (2011) Progression-free and overall survival in patients with relapsed/refractory germ cell tumors treated with single-agent chemotherapy: Endpoints for clinical trial design. Cancer., 10: 1002.
12. Flechon A., Culine S., Theodore C., Droz J. (2005) Pattern of Relapse after First Line treatment of Advanced Stage Germ-Cell Tumors. J. Europ. Urology., 48: 957–964.
13. Garner M.J., Turner M.C., Ghadirian P., Krewski D. (2005) Epidemiology of testicular cancer: an overview. Int. J. Cancer., 116: 331–339.
14. Groll R., Warde P., Jewett M. (2007) A comprehensive systematic review of testicular germ tumor surveillance. Crit. Rev. Oncol. Hematol., 64: 182–197.
15. Hartmann M., Krege S., Souchon R. et al. (2011) Follow-up of testicular germ cell cancer patients: interdisciplinary evidence-based recommendations. Urologe A., 50: 830–835.
16. International Germ Cell Cancer Collaborative Group (1997) International Germ Cell Consensus Classification: A prognostic Factor-Based Staging System for Metastatic Germ Cell Cancers. J. Clin. Oncol., 15: 594–603.
17. Koychev D., Oechsle K., Bokemeyer C., Honecker F. (2011) Treatment of patients with relapsed and/or cisplatin-refractory metastatic germ cell tumours: an update. Int. J. Androl., 34: 266–273.
18. Krege S., Beyer J., Souchon R. et al. (2008) European consensus conference on diagnosis and treatment of germ cell cancer: a report of the second meeting of the European Germ Cell Cancer Consensus group (EGCCCG): part I. Eur. Urol., 53: 478–496.
19. Oechsle K., Kollmannsberger C., Honecker F., et al. (2011) German Testicular Cancer Study Group. Long-term survival after treatment with gemcitabine and oxaliplatin with and without paclitaxel plus secondary surgery in patients with cisplatin-refractory and/or multiply relapsed germ cell tumors. Eur. Urol., 60(4): 850–855.
20. Oliver R., Mason M., Mead G. et al. (2005) Radiotherapy versus single-dose carboplatin in adjuvant treatment of stage I seminoma: a randomized trial. Lancet, 366: 293–300.
21. Pont J., Albrecht W., Postner G. et al. (1996) Adjuvant chemotherapy for high-risk clinical stage I nonseminomatous testicular germ cell cancer: long term results of a prospective trial. J. Clin. Oncol., 14: 441–448.
22. Reuter V.E. (2005) Origins and molecular biology of testicular germ cell tumors. Mod. Pathol., Vol.18 (Suppl. 2): 51–60.
23. Sanchís Bonet A, Golmayo Muñoz-Delgado E. (2011) Analysis of clinical-pathologic variables, staging and prognostic groups, and therapeutic results of 106 germ-cell testicular tumors. Arch. Esp. Urol., 64: 972–980.
24. Schmoll H.J., Osanto S., Kawai K., Einhorn L., Fizazi K. (2011) Advanced seminoma and nonseminoma: SIU/ICUD Consensus Meeting on Germ Cell Tumors (GCT), Shanghai 2009. Urology, 78(4 Suppl): 456–68.
25. Schrader A.J., Ohlmann C.H., Rossmanith S. et al. (2006) Impact of evidence-based interdisciplinary guidelines on testis cancer management. Cancer, 106(2): 313–319.
26. Simmonds P.D., Mead G.M., Lee A.H.S. et al. (1995) Orchiectomy after chemotherapy in patients with metastatic testicular cancer. Cancer, 75: 1018–1024.
27. Sternberg C.N. (1998) The management of stage I testis cancer. Urol. Clin.North Am., 25: 435–449.
28. Voss M.H., Feldman D.R., Bosl G.J., Motzer R.J. (2011) A review of second-line chemotherapy and prognostic models for disseminated germ cell tumors. Hematol. Oncol. Clin. North Am., 25(3): 557–576.
29. Warde P., Specht L., Horwich A. et al. (2002) Prognostic factors for relapse in stage I seminoma managed by surveillance: a pooled analysis. J. Clin. Oncol., 20: 4448–4452.
Лечение больных герминогенными опухолями яичка: современные стратегии и оценка результатов терапии
Национальный институт рака, Киев
Резюме. За последние десятилетия заболеваемость герминогенными опухолями яичка увеличилась более чем в 2 раза, у мужчин в возрасте 20–35 лет это одна из самых часто встречающихся злокачественных опухолей. Проведен анализ лечения 113 пациентов с герминогенными опухолями яичка. Полученные результаты продемонстрировали успехи химиотерапии в лечении этой нозологии. Даже при наличии диссеминированного процесса более чем у 80% больных реально достичь полного излечения. При этом необходимо отметить, что такого прогресса удалось добиться благодаря созданию рациональных схем химиотерапии, подобранных на основании индивидуального прогноза пациента, а также в результате строгого выполнения алгоритмов лечения, представленных в данной статье.
герминогенные опухоли яичка, семинома, несеминомная опухоль, химиотерапия, орхофуникулэктомия.














Leave a comment