Функціональні результати органозберігаючого лікування місцево-поширеного та метастатичного нирково-клітинного раку
Стаховський Е.1, Вітрук Ю.1, Войленко О.1, Стаховський О.1, Кононенко О.1, Пікуль М.1, Семко С.1, Гречко Б.1, Кошель Д.1, Тимошенко А.1, Буйвол О.1, Гарбар Р.2, Яценюк Н.2
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Центр сучасної урології, Київ, Україна
Резюме. У статті представлено порівняльний аналіз функціональних результатів лікування 92 хворих на місцево-поширений та метастатичний нирково-клітинний рак (НКР). Аналіз результатів базувався на оцінці роздільної функції нирок за даними динамічної нефросцинтиграфії до резекції нирки або нефректомії та через 12 міс після їх виконання. Виявлено статистично значуще зниження показника сумарної швидкості клубочкової фільтрації (сШКФ) як після резекції нирки, так і нефректомії, проте сШКФ після нефректомії була значно нижча, ніж після резекції (р <0,0001). Функція ураженої пухлиною нирки після її резекції достовірно погіршувалася (максимальне зниження швидкості клубочкової фільтрації (ШКФ) на 74%) (р <0,006), що пов’язано з об’ємом резекції, впливом хірургічної травми на нирку та проведенням центральної ішемії, однак функцію нирки збережено. У частини хворих ШКФ зросла (максимальне підвищення на 42%), що вказувало на позитивний вплив видалення пухлини завдяки зменшенню внутрішньониркового тиску та відновлення функції нефронів. Після нефректомії ШКФ здорової нирки зростала за допомогою компенсаторних механізмів (максимальне підвищення на 65%), проте були пацієнти, у яких функція нирки достовірно не змінювалася або навіть погіршувалася (максимальне зниження на 5%), що вказувало на вплив інших чинників на функцію єдиної нирки. Цим чинником була наявність супутньої патології, яка значно погіршувала компенсаторні механізми поліпшення ниркової функції. Так, у випадку місцево-поширеного та метастатичного НКР необхідно виконувати органозберігаюче лікування, особливо у хворих із супутньою патологією, оскільки у цього контингенту хворих немає компенсаторних можливостей щодо покращення функції нирок, що призведе до розвитку хронічної хвороби нирок (ХХН) та її наслідків, а також знизить ефективність подальшої системної терапії.
Одержано 11.12.2023
Прийнято до друку 20.12.2023
DOI: 10.32471/clinicaloncology.2663-466X.52-4.31458
ВСТУП
За оцінками Національного та міжнародних канцер-реєстрів, НКР входить до 10 найпоширеніших видів онкопатології, а рівень захворюваності з кожним роком неухильно зростає в усіх регіонах світу, зокрема й в Україні [1–3]. Протягом останніх років спостерігається збільшення кількості встановлених діагнозів раку нирки в осіб працездатного віку, що призводить до зростання актуальності цієї проблеми [4].
Згідно із існуючими стандартами основним методом лікування раку нирки є хірургічний, який найчастіше використовується при І–ІІ стадіях захворювання [5, 6]. Однак 40% хворих звертаються за медичною допомогою вже із запущеними формами, наявністю місцево-розповсюдженого процесу, метастатичної хвороби [7]. Також 17% пацієнтів при первинному виявленні мають неоперабельну форму раку у зв’язку з множинними метастазами або відсутністю технічної можливості провести успішно операцію через великий розмір чи локалізацію пухлини [8, 9]. У такому разі, як правило, хворі отримують паліативне лікування, що призводить до високих показників смертності від раку нирки та його ускладнень.
З іншої сторони, низькі показники виживаності за умови поширеного раку нирки вочевидь пов’язані з тим, що стандартом лікування таких хворих є виконання нефректомії, яка асоціюється з підвищеним ризиком розвитку ниркової недостатності і, як наслідок, підвищенням рівня серцево-судинних ускладнень та ризику смерті [10–12]. Це серйозна проблема у світлі сучасних можливостей лікування.
Слід зазначити, що значення циторедукційної хірургії в онкології залишається дискусійним. Місце циторедукції широко обговорюється при поширеному колоректальному раку, раку яєчників, нирок тощо [13–15]. Роль циторедуктивної нефректомії детально досліджено у 2010-х роках, коли її комбінація з інтерфероном була найефективнішою при метастатичному НКР [16, 17]. Проте завдяки появі таргетної та імунотерапії, розпочався новий «раунд» наукових досліджень, присвячених доцільності видалення первинної пухлини нирки у пацієнтів із поширеним захворюванням, хоча перевагами такого підходу було усунення загрозливих для життя симптомів (кровотечі, болі, інтоксикація та ін.), видалення первинної пухлини та зменшення пухлинного навантаження на організм з метою покращення ефективності системної терапії, а також усунення джерела поширення потенційно нових метастазів [18, 19].
Втілення нових таргетних препаратів та checkpoint-інгібіторів поставили під сумнів необхідність такої складної операції [20, 21]. З іншого боку, впровадження нових імунних агентів поставило важливе запитання: якщо ремісія може тривати роками, можливо, нам слід зберегти уражену нирку шляхом виконання циторедуктивної резекції? Така нефрон-зберігаюча тактика покращить функціональну здатність нирок та зменшить кількість побічних явищ і загострень супутньої патології, покращить здатність пацієнтів добре переносити системну терапію [22, 23].
МЕТА ДОСЛІДЖЕННЯ
Оцінити функціональні результати органозберігаючого лікування місцево-поширеного та метастатичного НКР.
МАТЕРІАЛИ ТА МЕТОДИ
Починаючи з квітня 2008 р., у Державному некомерційному підприємстві «Національний інститут раку» триває проспективне нерандомізоване дослідження оцінки ефективності резекції нирки при місцево-поширеному та метастатичному НКР. У випадку виконання резекції нирки хворого залучали до групи резекції, якщо виконана нефректомія — до групи нефректомії. Проміжний аналіз проведено в грудні 2021 р.
Критерії включення: хворі віком від 18 до 80 років; клінічно та гістологічно виявлений світлоклітинний НКР (Т3–4, будь-яке N, будь-яке М); відсутність тромбозу нижньої порожнистої вени, об’єм функціонуючої паренхіми нирки з боку ураження >50% [24]. Пацієнтів із двобічними пухлинами нирки, вираженою ХХН (сШКФ <30 мл/хв), супутньою онкопатологією чи будь-якими іншими системними захворюваннями не залучали до цього аналізу.
Особливості клінічних проявів місцево-поширеного та метастатичного НКР потребували спеціального комплексного обстеження, які включали вивчення анамнестичних даних, оцінку загального стану хворого за Карновським [25] та ECOG-статусу (Eastern Cooperative Oncology Group — Східна кооперативна онкологічна група) [26], клініко-лабораторних, променевих та функціональних методів дослідження.
Вираженість супутньої патології визначали на основі Charlson scoring system [27]. Найважливішими лабораторними параметрами, окрім загальноприйнятих, які обов’язково встановлювали у хворих на місцево-поширений та метастатичний НКР, були:
- гемоглобін, кількість нейтрофілів та тромбоцитів, рівень скоригованого сироваткового кальцію, лактатдегідрогенази (ЛДГ) — з метою визначення приналежності хворого до групи ризику згідно з прогностичними класифікаціями Меморіального онкологічного центру ім. Слоуна — Кеттерінга (Memorial Sloan Kettering Cancer Center — MSKCC) та Міжнародного консорціуму баз даних метастатичного раку нирки (International Metastatic Renal Cancer Database Consortium — IMDC) [28, 29];
- креатинін сироватки крові, який дозволяє оцінити функціональний стан нирок;
- лужна фосфатаза сироватки крові, підвищення рівня якої може свідчити про наявність метастазів у печінку та кістки скелета.
Спіральна комп’ютерна томографія (СКТ) або магнітно-резонансна томографія (МРТ) були основними методами променевої діагностики НКР, які використовували для визначення основних характеристик пухлини та поширеності процесу з метою чіткого стадіювання захворювання згідно із сучасною TNM-класифікацією [30] та визначення показань до резекції нирки або нефректомії згідно з NCIU-нефрометрією [31].
У всіх випадках резекцію нирки чи нефректомію виконували відкритим методом через передньо-латеральний чи підреберний доступ, який забезпечував:
- фізіологічне положення хворого на операційному столі;
- швидку обробку ниркових судин без зайвих маніпуляцій із самою пухлиною;
- можливість проведення лімфаденектомії;
- проведення симультанних оперативних втручань на органах черевної порожнини та заочеревинного простору;
- чітку візуалізацію магістральних судин.
Центральну теплову ішемію використовували тільки при абсолютних показаннях: RENAL score 11–12 балів, розміщення пухлини у воротах нирки. В інших випадках використовували різні види локальної ішемії: стиснення прилеглої до пухлини ділянки паренхіми нирки за допомогою «руки асистента», 2 гемостатичних зйомних лігатур [32], перетиснення чи перев’язування сегментарних артерій 2-го та 3-го порядку.
Радикальну нефректомію виконували із дотриманням усіх стандартів та методик, розроблених Robson C.J. et al. [33].
Основним методом оцінки функціонального стану здорової та ураженої пухлиною нирки як у передопераційний, так і в різні терміни цього періоду, була динамічна реносцинтиграфія, яка дозволяла визначати їх роздільну функцію [34]. Це дозволило встановити не лише загальний рівень клубочкової фільтрації загалом, але і функцію кожної нирки окремо, особливо у хворих після резекції нирки.
Статистична обробка результатів виконана в пакеті Statistical software EZR v. 1.54 (graphical user interface for R statistical software version 4.0.3, R Foundation for Statistical Computing, Vienna, Austria) [35]. Закон розподілу кількісних показників відрізнявся від нормального, тому для їх представлення розраховано медіанне значення (Ме) та міжквартильний інтервал (QI–QIII). Показники для 2 груп порівнювали за критерієм Манна — Уїтні. Для порівняння якісних ознак використано точний критерій Фішера (у випадку альтернативного закону розподілу) або критерій c2 (для 3 і більше градацій).
РЕЗУЛЬТАТИ
Загалом оцінка функціонального стану нирок до операції та через 12 міс після її виконання проведена у 92 пацієнтів: у 53 (57,6%) випадках — після резекції нирки та у 39 (42,4%) — після нефректомії. Аналіз проводився для хворих на місцево-поширений та метастатичний рак разом, оскільки поширеність пухлинного процесу згідно з нашим дослідженням статистично не впливала на функціональний стан нирок (р=0,4). Порівняльний аналіз рівня сШКФ представлений у табл. 1.
| сШКФ | Оперативне втручання | Рівень значущості відмінності, р | |
| Резекція нирки,
n=53 |
Нефректомія,
n=39 |
||
| До операції, мл/хв/1,73 м2 | 96,7±20,1 | 93±17,4 | 0,26 |
| Після операції, мл/хв/1,73 м2 | 83,2±15,2 | 62,7±15,1 | <0,0001 |
| Рівень значущості відмінності, р | <0,002 | <0,00001 | |
Аналізуючи дані з табл. 1, необхідно відмітити статистично значуще зниження показника сШКФ як після резекції нирки (р <0,002), так і нефректомії (р <0,00001), проте сШКФ у пацієнтів після нефректомії була значно нижча, ніж після резекції (р <0,0001), що підтверджувало негативний вплив виконання нефректомії на загальну очисну функцію організму в післяопераційному періоді.
Однак представлені дані сШКФ не можуть повною мірою відображати функціональні зміни в нирках, адже можуть бути зумовлені, зокрема, і вікарною гіпертрофією та підвищенням функціонального навантаження на контралатеральну нирку, тому більш інформативним було вивчення роздільної функції нирок. Порівняльний аналіз рівня ШКФ ураженої пухлиною та здорової нирки в динаміці представлений у табл. 2 та 3.
| Показник ШКФ здорової нирки | Оперативне втручання | Рівень значущості відмінності, р | |
| Резекція нирки,
n=53 |
Нефректомія,
n=39 |
||
| До операції, мл/хв/1,73 м2 | 53,4±14,6 | 52,1±10,6 | 0,47 |
| Після операції, мл/хв/1,73 м2 | 55,3±9,5 | 62,7±15,1 | <0,0001 |
| Рівень значущості відмінності, р | 0,28 | <0,013 | |
| Показник ШКФ ураженої пухлиною нирки | Оперативне втручання | Рівень значущості відмінності, р | |
| Резекція нирки,
n=53 |
Нефректомія,
n=39 |
||
| До операції, мл/хв/1,73 м2 | 44,7±10,2 | 39,4±15 | <0,009 |
| Після операції, мл/хв/1,73 м2 | 37,9±9,8 | – | – |
| Рівень значущості відмінності, р | <0,005 | – | |
Наявні в табл. 2 дані засвідчують відсутність різниці вихідних даних рівня ШКФ здорової нирки в обох групах, тоді як через 12 міс після операції вони були статистично вищими у хворих після нефректомії, що вказувало на включення компенсаторних механізмів організму та підвищення навантаження на єдину нирку (р <0,0001).
Щодо функції ураженої пухлиною нирки до операції, як наведено в табл. 3, вона була достовірно нижчою у хворих, яким у кінцевому підсумку виконана нефректомія (р <0,009), що можна пояснити меншим об’ємом функціонуючої паренхіми нирки внаслідок пухлинного ураження більшого об’єму. Після резекції нирки ШКФ нирки з боку ураження також знижувалася (р <0,006), що пов’язано з об’ємом резекції, впливом самої хірургічної травми на нирку та проведенням центральної ішемії, однак функцію нирки збережено.
Аналізуючи дані ШКФ ураженої нирки, виявлено негативний вплив резекції з чи без центральної ішемії на її функцію (максимальне зниження на 74% — із 42 мл/хв/1,73 м2 до рівня 11 мл/хв/1,73 м2), однак у частини хворих її рівень зріс (максимальне підвищення на 42% — з 31 мл/хв/1,73 м2 до рівня 44 мл/хв/1,73 м2), що вказувало на позитивний вплив видалення пухлини завдяки зниженню внутрішньониркового тиску та відновлення функції нефронів (рис. 1).
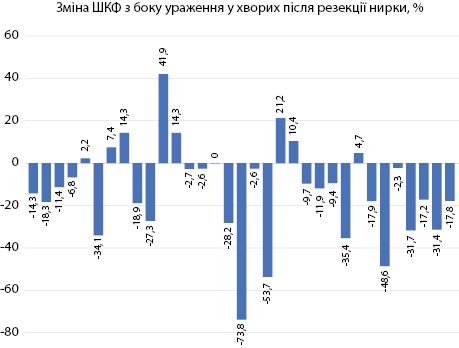
У пацієнтів, яким виконано нефректомію, ШКФ здорової нирки зростала за допомогою компенсаторних механізмів (максимальне підвищення на 65% — із 46 мл/хв/1,73 м2 до рівня 89 мл/хв/1,73 м2). Проте були хворі, у яких функція нирки достовірно не змінювалася або навіть погіршувалася (максимальне зниження на 5% — із 43 мл/хв/1,73 м2 до рівня 41 мл/хв/1,73 м2) (рис. 2), що вказувало на вплив інших чинників на функцію єдиної нирки.
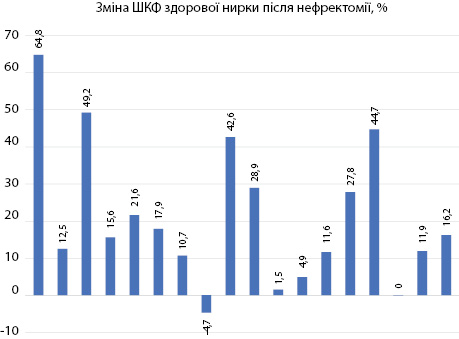
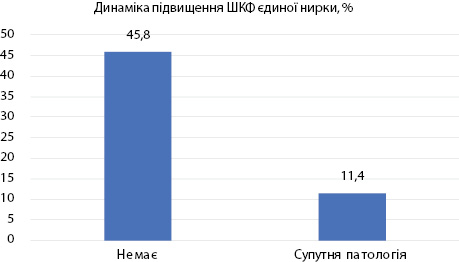
Аналізуючи дані 3 рис. 2, незрозуміло, чому не підвищується функція єдиної нирки після нефректомії. Відповідь отримано при аналізі супутньої патології у пацієнтів (рис. 3), при тому що за віком та статтю пацієнти статистично не відрізнялися (р=0,96).
Враховуючи вищенаведене, проведено аналіз випадків розвитку ХХН у хворих після резекції нирки та нефректомії, дані якого представлені в табл. 4.
| Кількість хворих із ХХН
(сШКФ <60 мл/хв/1,73 м2) |
Оперативне втручання | Рівень значущості відмінності, р | |
| Резекція нирки,
n=53 |
Нефректомія,
n=39 |
||
| До операції, n (%) | 4 (7,6) | 4 (10,3) | 0,23 |
| Після операції, n (%) | 6 (11,3) | 11 (28,2) | |
У даних з табл. 4 відмічено прогресування ХНН у 18,5% пацієнтів до ІІІ ступеня після операції. Кількість хворих з ХХН після нефректомії була значно вищою, ніж після резекції нирки (28,2 та 11,3% відповідно), однак статистично ці дані не відрізнялися (р=0,23). Вочевидь це пов’язано з незначущою кількістю проаналізованих даних хворих. Їх кількість могла бути значно більшою, однак частина пацієнтів померла протягом 1-го року спостереження від прогресування захворювання і, як наслідок, вони не увійшли в цей аналіз, а більшості з них виконали нефректомію.
ОБГОВОРЕННЯ
Після 50 років життя функція нирок погіршується. Цей «фізіологічний» процес поглиблює низка факторів, які викликають ХХН, а саме системні захворювання — артеріальна гіпертензія, діабет, запальні захворювання, медикаментозне пошкодження нирок та аномалії розвитку. Окрім того, в Україні щорічно виконують більше 5 тис. нефректомій, що збільшує кількість хворих з єдиною ниркою. Вищезгадане зумовлює збільшення кількості хворих онкологічного профілю з нирковою недостатністю.
ХХН є поліетіологічною патологією, що значно впливає на тривалість та якість життя пацієнтів. Використання сучасної класифікації ХХН в середній популяції зафіксувало, що майже 1 з 6 дорослих можна класифікувати до осіб з ознаками ХХН [36], причому таке співвідношення стає нагальнішим у пацієнтів похилого віку. Ця жахлива статистика спонукає замислитися щодо необхідності розвитку засобів лікування та профілактики не тільки самої ХХН, але й якомога більш ретельного збереження паренхіми нирки у хворих на НКР, адже, розвиваючись, пухлина поступово заміщує паренхіму, зменшуючи об’єм функціонуючої паренхіми нирки, що також значно підвищує ризик розвитку ХХН.
Проведення нефректомії як стандарту хірургічного лікування місцево-поширеного та метастатичного НКР може ще більшою мірою знизити очисну функцію організму, тому максимальне збереження паренхіми нирки завдяки широкому впровадженню органозберігаючих методик хірургічного лікування залишається актуальним. Ера нових таргетних препаратів та checkpoint-інгібіторів кардинально змінила тактику лікування таких хворих, однак перевагою резекції є збереження функції нирок і відповідно зниження ризику розвитку ХХН та серцево-судинних захворювань.
Тривала виживаність пацієнтів з НКР сприяє більш точній оцінці неонкологічних показників здоров’я та їх впливу на загальне лікування. Функція нирок може відігравати вагому роль у показнику загальної виживаності, якщо очікувана ремісія триватиме роками. Збережена клубочкова фільтрація може потенційно вплинути не тільки на загальні параметри здоров’я, але і стати «рятувальним парашутом» у разі контралатерального ураження нирки [15].
У нашій роботі представлено порівняльний аналіз функціональних результатів лікування 92 хворих на місцево-поширений та метастатичний НКР. Аналіз результатів базувався на оцінці роздільної функції нирок за даними динамічної нефросцинтиграфії до резекції нирки або нефректомії та через 12 міс після їх виконання. Зафіксовано статистично значуще зниження показника сШКФ як після резекції нирки, так і нефректомії, проте сШКФ у хворих після нефректомії була значно нижча, ніж після резекції (р <0,0001). Це зрозуміло, оскільки втрата однієї нирки так чи інакше призведе до розвитку ХХН, незважаючи на включення компенсаторних механізмів гіпертрофії.
Щодо функції ураженої пухлиною нирки, після резекції вона також знижувалася (р <0,006), що було пов’язано з об’ємом резекції, впливом самої хірургічної травми на нирку та проведенням центральної ішемії, однак функцію нирки вдалося зберегти. Виявлено негативний вплив резекції на її функцію (максимальне зниження на 74%), однак у частини хворих її рівень зріс (максимальне підвищення на 42%), що вказувало на позитивний вплив видалення пухлини за допомогою зниження внутрішньониркового тиску та відновлення функції нефронів.
У хворих, яким виконано нефректомію, ШКФ здорової нирки зростала завдяки компенсаторним механізмам (максимальне підвищення на 65%). Проте виявлено пацієнтів, у яких функція нирки достовірно не змінювалася або навіть знижувалася (максимально на 5%), що вказувало на вплив інших чинників на функцію єдиної нирки. Цим чинником була наявність супутньої патології, яка значно погіршувала компенсаторні механізми покращення ниркової функції.
ВИСНОВКИ
У хворих на місцево-поширений та метастатичний НКР, окрім оцінки пухлинного ураження нирки та поширеності процесу, потрібно визначати загальну та роздільну ШКФ нирок, значення яких буде вагомо впливати на вибір тактики терапії цього контингенту хворих.
У випадку місцево-поширеного та метастатичного НКР необхідно виконувати органозберігаюче лікування, особливо у пацієнтів із супутньою патологією, оскільки в цього контингенту хворих немає компенсаторних можливостей щодо покращення функції нирок, що призведе до розвитку ХХН та її наслідків, а також знизить ефективність подальшої системної терапії.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2023). Рак в Україні, 2021–2022. Захворюваність, смертність, показники діяльності онкологічної служби. О. В. Єфіменко (Ред.), Бюлетень Національного канцер-реєстру України, 24, 148. http://www.ncru.inf.ua/publications/BULL_24/index.htm.
2. ECIS — European Cancer Information System; Accessed SEP. 2023. Retrieved from: ecis.jrc.ec.europa.eu.
3. Lindblad, P. (2004). Epidemiology of renal cell carcinoma. Scandinavian Journal of Surgery, 93, 88–96. journals. sagepub. com/ doi/ pdf/ 10.1177/ 145749690409300202.
4. GLOBOCAN 2020; Accessed SEP. 2023. Retrieved from: globocan.iarc.fr.
5. EAU Guidelines on Renal Cell Carcinoma 2023. Retrieved from: uroweb.org/guidelines/renal-cell-carcinoma.
6. NCCN Guidelines on Kidney Cancer, Version 3.2023. Retrieved from: http://www.nccn.org/guidelines/guidelines-detail?category=1&id=1440.
7. Siegel, R., Miller, K. D., & Jemal, A. (2020). Cancer Statistics, 2020. Cancer Journal for Clinicians, 70, 7–30. doi: 10.3322/caac.21590.
8. Janssen, M. W. W., Linxweiler, J. Terwey, S., Rugge, S., Ohlmann, C. H., Becker, F., … Roos, F. C. (2018). Survival Outcomes in Patients With Large (≥7cm) Clear Cell Renal Cell Carcinomas Treated With Nephron-Sparing Surgery Versus Radical Nephrectomy: Results of a Multicenter Cohort With Long-Term Follow-Up. PloS One, 13(5), e0196427. doi: 10.1371/journal.pone.0196427.
9. McIntosh, A. G., Umbreit, E. C., Holland, L. C., Gu, C., Tannir, N. M., Matin, S. F., … Wood, C. G. (2020). Optimizing patient selection for cytoreductive nephrectomy based on outcomes in the contemporary era of systemic therapy. Cancer, 126, 3950–3960. doi: 10.1002/cncr.32991.
10. Huang, W., Levey, A. S., Serio, A. M., Snyder, M., Vickers, A. J., Raj, G. V., … Russo, P. (2006). Chronic kidney disease after nephrectomy in patients with renal cortical tumours: a retrospective cohort study. Lancet Oncology, 7(9), 735–740. doi: 10.1016/S1470-2045(06)70803-8.
11. Jankowski, J., Floege, J., Fliser, D., Böhm, M., & Marx, N. (2021). Cardiovascular Disease in Chronic Kidney Disease. Circulation, 143, 1157–1172. doi: 10.1161/CIRCULATIONAHA.120.050686.
12. Herzog, C. A., Asinger, R. W., Berger, A. K., Charytan, D. M., Díez, J., Hart, R. G., … Ritz, E. (2011). Cardiovascular disease in chronic kidney disease. A clinical update from kidney disease: improving global outcomes (KDIGO). Kidney International, 80, 572–586. doi: 10.1038/ki.2011.223.
13. Rovers, K. P., Bakkers, C., Simkens, G. A. A. M., Burger, J. W. A., Nienhuijs, S. W., Creemers, G. M., … de Hingh, I. H. J. T. (2019). Perioperative systemic therapy and cytoreductive surgery with HIPEC versus upfront cytoreductive surgery with HIPEC alone for isolated resectable colorectal peritoneal metastases: protocol of a multicentre, open-label, parralel-group, phase II–III, randomised, superiority study (CAIRO6). BMC Cancer, 19, 390. doi: 10.1186/s12885-019-5545-0.
14. Brand, A. H., DiSilvestro, P. A., Sehouli, J., & Berek, J. S. (2017). Cytoreductive surgery for ovarian cancer: quality assessment. Annals of Oncology, 28(8), v25–v29. doi: 10.1093/annonc/mdx448.
15. Mazzone, E., Nazzani, S., Preisser, F., Tian, Z., Marchioni, M., Bandini, M., … Karakiewicz, P. (2018) Partial nephrectomy seems to confer a survival benefit relative to radical nephrectomy in metastatic renal cell carcinoma. Cancer Epidemiology, 56, 118–125. doi: 10.1016/j.canep.2018.08.006.
16. Flanigan, R. C., Mickisch, G., Sylvester, R., Tangen, C., Van Poppel, H., Crawford, E. D. (2004). Cytoreductive nephrectomy in patients with metastatic renal cancer: a combined analysis. Journal of Urology, 171(3), 1071–1076. doi: 10.1097/01.ju.0000110610.61545.ae.
17. Barbastefano, J., Garcia, J. A., Elson, P., Wood, L. S., Lane, B. R., Dreicer, R., … Rini, B. I. (2010). Association of percentage of tumour burden removed with debulking nephrectomy and progression-free survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted therapy. BJU International, 106(9), 1266–1269. doi: 10.1111/j.1464-410X.2010.09323.x.
18. Feuer, Z., Taylor, J., & Huang, W. C. (2021). The contemporary role of metastasectomy in the management of metastatic RCC. Journal of Cancer Metastasis and Treatment, 7, 68. doi: 10.20517/2394-4722.2021.164.
19. Maisel, F., Smolle, M. A., Mollnar, S., Riedl, J. M., Barth, D. A., Seles, M., … Posch, F. (2022). Benefit of Metastasectomy in Renal Cell Carcinoma: A Propensity Score Analysis. Clinical Genitourinary Cancer, 20(4), 344–353. doi: 10.1016/j.clgc.2022.03.010.
20. Mejean A., Ravaud A., Thezenas S., Colas S., Beauval J.-B., Bensalah K., … Escudier B. (2018). Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma. N. Engl. J. Med., 379, 417–427.
21. Bex, A., Mulders, P., Jewett, M., Wagstaff, J., van Thienen, J. V., Blank, C. U., … Haanen, J. (2019). Comparison of Immediate vs Deferred Cytoreductive Nephrectomy in Patients With Synchronous Metastatic Renal Cell Carcinoma Receiving Sunitinib: The SURTIME Randomized Clinical Trial. JAMA Oncology, 5, 164. doi: 10.1001/jamaoncol.2018.5543.
22. Wanchoo, R., Karam, S., Uppal, N. N., Barta, V. S., Deray, G., Devoe, C., … Jhaveri, K. D. (2017). Adverse Renal Effects of Immune Checkpoint Inhibitors: A Narrative Review. Journal of Nephrology, 45, 160–169. doi: 10.1159/000455014.
23. Kartolo, A., Sattar, J., Sahai, V., Baetz, T., & Lakoff, J. M. (2018). Predictors of immunotherapy-induced immune-related adverse events. Current Oncology, 25(5), e403–e410. doi: 10.3747/co.25.4047.
24. Стаховський, Е. О., Вітрук, Ю. В., Войленко, О. А., Вукалович, П. С., Котов, В. А., Стаховський, О. Е., & Гаврилюк, О. М. (2015). Спосіб визначення функціонуючої паренхіми нирки при нирково-клітинному раку. (Інформ. лист). Національний інститут раку, Київ.
25. Karnofsky, D., Abelmann, W. H., Craver, L. F., & Burchenal, J. H. (1948). The use of the nitrogen mustards in the palliative treatment of carcinoma. With particular reference to bronchogenic carcinoma. Cancer, 1, 634.
26. Oken, M. M., Creech, R. H., Tormey, D. C., Horton, J., Davis, T. E., McFadden, E. T., & Carbone, P. P. (1982). Toxicity and response criteria of the Eastern Cooperative Oncology Group. American Journal of Clinical Oncology, 5(6), 649–655.
27. Charlson, M. E., Pompei, P., Ales, K. L., & MacKenzie, C. R. (1987). A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. Journal of Chronic Diseases, 40(5), 373–383. doi: 10.1016/0021-9681(87)90171-8.
28. Motzer, R. J., Bacik, J., Murphy, B. A., Russo, P., & Mazumdar, M. (2022). Interferon-alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. Journal of Clinical Oncology, 20, 289. doi: 10.1200/JCO.2002.20.1.289.
29. Heng, D. Y., Xie, W., Regan, M. M., Harshman, L. C., Bjarnason, G. A., Vaishampayan, U. N., … Choueiri, T. K. (2013). External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study. Lancet Oncology, 14, 141. doi: 10.1016/S1470-2045(12)70559-4.
30. Sobin, L. H., Gospodarowicz, M. K., & Wittekind, C. (2009). TNM classification of malignant tumors (7th ed.). Hoboken, N. J.: Wiley-Blackwell.
31. Стаховський, Е. О., Вітрук, Ю. В., Войленко, О. А., & Стаховський, О. Е. (2013). Патент України 108410. Київ: Державне патентне відомство України.
32. Стаховський, Е. О., Вітрук, Ю. В., Стаховський, О. Е., & Войленко, О. А. (2015). Патент України 109192. Київ: Державне патентне відомство України.
33. Robson, C. J., Churchill, B. M., & Anderson, W. (1963). The results of radical nephrectomy for renal cell carcinoma. Journal of Urology, 89, 37. doi: 10.1016/s0022-5347(17)62331-0.
34. Кундін, В., & Новерко, І. (2014). Сцинтиграфічна оцінка кількості функціонуючої паренхіми при пухлинних ураженнях нирок. Український радіологічний журнал, 22 (3), 89–91.
35. Kanda, Y. (2013). Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplant, 48, 452–458. doi: 10.1038/bmt.2012.244.
36. Chadban, S. J., Briganti, E. M., Kerr, P. G., Dunstan, D. W., Welborn, T. A., Zimmet, P. Z., & Atkins, R. C. (2003). Prevalence of kidney damage in Australian adults: the AusDiab kidney study. Journal of the American Society of Nephrology, 14(2), 131–138. doi: 10.1097/01.asn.0000070152.11927.4a.
Адреса для листування:
Вітрук Юрій
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: uvitruk@ukr.net
Correspondence:
Yurii Vitruk
33/43 Yulia Zdanovskaya str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: uvitruk@ukr.net














Leave a comment