Онкологічні результати органозберігаючого лікування місцево-поширеного нирково-клітинного раку
Стаховський Е.1, Вітрук Ю.1, Войленко О.1, Стаховський О.1, Кононенко О.1, Пікуль М.1, Семко С.1, Гречко Б.1, Кошель Д.1, Тимошенко А.1, Буйвол О.1, Гарбар Р.2, Яценюк Н.2
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Центр сучасної урології, Київ, Україна
Резюме. У статті представлено результати проспективного нерандомізованого дослідження оцінки ефективності резекції нирки при місцево-поширеному нирково-клітинному раку. Матеріали та методи. До проміжного аналізу залучено 112 хворих: до першої групи — 52 (46,4%) пацієнти, яким виконана резекція нирки; до другої групи — 60 (53,6%) хворих, яким виконана нефректомія. Критерії залучення в дослідження: пацієнти віком від 18 до 80 років; клінічно та гістологічно виявлений світлоклітинний нирково-клітинний рак (T3а, Т4, N0, М0); відсутність тромбозу ниркової чи нижньої порожнистої вени; об’єм функціонуючої паренхіми нирки з боку ураження >50%. Результати та висновки. Аналізуючи результати лікування та зважаючи на те, що кількість інтра- та післяопераційних ускладнень, випадків прогресування захворювання після резекції нирки, тривалість операції статистично не відрізнялися від нефректомії, а також виявлено рівнозначні показники загальної виживаності хворих з незначною перевагою на користь резекції нирки, можна констатувати безпеку, високу ефективність та доцільність органозберігаючого лікування у хворих на місцево-поширений рак нирки.
Одержано 8.12.2023
Прийнято до друку 19.12.2023
DOI: 10.32471/clinicaloncology.2663-466X.52-4.31426
ВСТУП
Вибір хірургічного методу лікування при клінічно діагностованому місцево-поширеному раку нирки залишається дискусійним. Згідно з існуючими рекомендаціями при такій стадії захворювання слід виконувати радикальну нефректомію, а резекцію нирки — якщо є клінічні показання [1, 2].
За радикальної нефректомії можна ефективно видалити пухлину, однак існує вищий ризик розвитку післяопераційної ниркової недостатності, кровотечі, інфекції та інших небажаних подій. З іншого боку, резекція нирки пов’язана зі збереженням функції нирок і, отже, може бути корисною для прогнозу та загальної виживаності шляхом зниження ризику серцево-судинних та метаболічних ускладнень [3–6].
Дотримання стандарту виконання нефректомії при місцево-поширених пухлинах є обмеженим, оскільки базується винятково на розмірі пухлини, її місцевому поширенню та оцінці можливості хірургічного видалення. Однак ураження, які один лікар вважатиме недоречними для агресивної тактики або навіть неможливими щодо резекції нирки, можуть бути стандартом органозберігаючого лікування для іншого лікаря [7, 8].
Поряд з цим, не зовсім правильною є оцінка виключно пухлини, адже потрібно досліджувати і стан навколониркової жирової клітковини, оскільки навіть пухлина до 4 см у діаметрі може бути місцево-поширеною пухлиною Т3а стадії, яка потребуватиме ад’ювантного лікування [9–11]. З іншого боку, при пухлині нирки діаметром >7 см з екзофітним характером росту, яка поширюється в паранефральну жирову клітковину, при цьому об’єм функціонуючої паренхіми нирки на стороні ураження досить великий, виконання нефректомії не є виправданим [12].
МЕТА ДОСЛІДЖЕННЯ
Визначити показання до резекції нирки при місцево-поширеному нирково-клітинному раку, оцінити безпеку її виконання та онкологічні результати.
МАТЕРІАЛИ ТА МЕТОДИ
Починаючи з квітня 2008 р., у Національному інституті раку триває проспективне нерандомізоване дослідження оцінки ефективності резекції нирки при місцево-поширеному нирково-клітинному раку (НКР). У випадку виконання резекції нирки хворого рандомізували до групи резекції нирки, якщо виконана нефректомія — до групи нефректомії. Проміжний аналіз проведено в грудні 2021 р. Упродовж 2008–2021 рр. прооперовано 934 хворих на місцево-поширений рак. Нефректомія виконана у 752 пацієнтів (80,5%), резекція нирки — у 182 (19,5%). Левову частку органовиносних операцій проведено у пацієнтів із тромбозом ниркової чи нижньої порожнистої вени, при яких органозберігаюче лікування вважається неможливим, та у хворих, у яких об’єм функціонуючої паренхіми нирки на стороні ураження був меншим 50%.
З метою коректності проведення цього дослідження та оцінки ефективності органозберігаючого лікування до проміжного аналізу залучено 112 хворих: до 1-ї групи — 52 (46,4%) пацієнти, яким виконано резекцію нирки; до 2-ї групи — 60 (53,6%) хворих, яким виконана нефректомія. Критеріями залучення в дослідження були: хворі віком від 18 до 80 років; клінічно та гістологічно світлоклітинний нирково-клітинний рак (T3а, Т4, N0, М0); відсутність тромбозу ниркової чи нижньої порожнистої вени; об’єм функціонуючої паренхіми нирки з боку ураження більше 50%. Пацієнтів із двобічними пухлинами нирки, вираженою хронічною хворобою нирок (сумарна швидкість клубочкової фільтрації (сШКФ) <30 мл/хв), супутньою онкопатологією чи будь-якими іншими системними захворюваннями не залучено в цей аналіз.
Визначення основних доопераційних характеристик пухлини та поширеності процесу, чітке стадіювання захворювання згідно із сучасною TNM-класифікацією [13], а також порівняльний аналіз та оцінку ефективності проведеного лікування в ранній та віддалений післяопераційний період проводили на основі спіральної комп’ютерної томографії (СКТ) або магнітно-резонансної томографії (МРТ).
У 66 (58,9%) випадках високого ризику виконання нефректомії (можливість виконання резекції нирки за даними NCIU нефрометрії [14] становила 50%) з метою зменшення розміру пухлини та підвищення можливості виконання органозберігаючого лікування після гістологічної верифікації діагнозу хворим проводили 2 блоки неоад’ювантної таргетної терапії препаратами сунітиніб 50 мг чи пазопаніб 800 мг [15]. Її проведення сприяло регресії пухлини від 4% до 60%, а в середньому на 22,8±12%, що дозволило у 56 (84,8%) випадках виконати резекцію нирки, у 10 (15,2%) — нефректомію, причому у 7 (5,4%) випадках — перевести неоперабельну форму раку нирки в резектабельну.
У всіх випадках резекцію нирки чи нефректомію виконували відкритим методом через передньо-латеральний чи підреберний доступ. У 21 (35%) випадку резекції нирки додатково виконана іпсілатеральна адреналектомія унаслідок поширення пухлинного процесу на нього. У 13 (21,7%) хворих, яким виконана резекція, через розміщення пухлини близько до воріт нирки та наявність високого ризику інтраопераційної крововтрати використовували центральну ішемію, яка тривала від 4 до 25 (13,1±5,8) хв, а у 47 (78,3%) пацієнтів — ішемію не використовували, гемостаз здійснювався за допомогою локальної ішемії, що забезпечувало максимальне збереження функціональної спроможності паренхіми [16].
В обсяг контрольного обстеження входили регулярні лабораторні дослідження та обов’язкове проведення СКТ чи МРТ кожні 3 міс. Усім хворим у разі прогресування захворювання за критеріями RECIST 1.1. [17] призначали послідовну системну терапію згідно з існуючими стандартами лікування. Вивчали показники локального рецидивування, а також канцер-специфічної (CSS) та загальної виживаності (OS) хворих.
Статистична обробка результатів виконана в пакеті Statistical software EZR v. 1.54 (graphical user interface for R statistical software version 4.0.3, R Foundation for Statistical Computing, Vienna, Austria) [18]. Закон розподілу кількісних показників відрізнявся від нормального, тому для їх представлення розраховано медіанне значення (Ме) та міжквартильний інтервал (QI–QIII). Показники для 2 груп порівнювали за критерієм Манна — Уїтні. Для порівняння якісних ознак використано точний критерій Фішера (у разі альтернативного закону розподілу) або критерій c2 (для 3 і більше градацій).
Аналіз виживаності проводили за Kaplan-Myer (лог-ранговий критерій порівняння). Модель пропорційних інтенсивностей Кокса використана для виокремлення змінних, що впливають на виживаність. Вплив факторної ознаки оцінювали за показником відношення ризиків (HR), розраховано 95% вірогідний інтервал (95% ВІ) показника.
При відборі мінімального набору значимих незалежних ознак у межах багатофакторних моделей логістичної регресії використано метод покрокового включення/виключення ознак (критичний поріг включення ознаки p <0,1 і для виключення р >0,2) [19].
Урахування факторів ризику в межах багатофакторної моделі Кокса дозволило стандартизувати групи за складністю випадку та визначити співвідношення ризиків обох хірургічних стратегій. При проведенні аналізу за критичний рівень значимості прийнято 0,05.
РЕЗУЛЬТАТИ
Місцево-поширені пухлини — це складні пухлини з точки зору хірургії, оскільки існує високий ризик залучення суміжних органів у пухлинний процес. Інтраопераційна оцінка повного видалення пухлини в межах здорових тканин при адекватному гемостазі та ретельній реконструкції порожнинної системи дозволили виконати резекцію нирки. Але зафіксовано випадки, коли вищезгадані умови неможливо було забезпечити, тому виконували нефректомію. Порівняльна характеристика обох досліджуваних груп хворих представлена в табл. 1.
| Показник | Оперативне втручання | Рівень значимостівідмінності, p | |||
| Резекція нирки, n=60 | Радикальна нефректомія, n=52 | ||||
| Вік, років | 54,6±13,8 | 55,1±11,4 | 0,82 | ||
| Стать, n (%) | чоловіки | 37 (61,7) | 33 (63,5) | 0,99 | |
| жінки | 23 (38,3) | 19 (36,5) | |||
| ECOG статус, бали | 0,67±0,52 | 0,62±0,49 | 0,98 | ||
| Супутня патологія, n (%) | 55 (91,7) | 46 (88,5) | 0,96 | ||
| Сумарна ШКФ мл/хв/1,73 м2 | 87,5±21,5 | 82,4±19,9 | 0,45 | ||
| RENAL score | 8,4±2,2 | 10,1±2,1 | <0,001 | ||
| Максимальний діаметр пухлини, мм | ≤40, n (%) | 11 (18,3) | 1 (1,9) | <0,001 | |
| >40–≤70, n (%) | 37 (61,7) | 11 (21,2) | |||
| >70, n (%) | 12 (20) | 40 (76,9) | |||
| RFPV, % | ≥85, n (%) | 15 (25) | 1 (1,9) | <0,004 | |
| 84–70, n (%) | 24 (40) | 11 (21,2) | |||
| 69–55, n (%) | 20 (33,3) | 23 (44,2) | |||
| <55, n (%) | 1 (1,7) | 17 (32,7) | |||
| NCIU нефрометрія, n (%) | полюс нирки | 42 (70) | 4 (7,7) | <0,0001 | |
| латерально | 11 (18,3) | 20 (38,5) | |||
| медіально | 7 (11,7) | 28 (53,8) | |||
Зважаючи на дані в табл. 1, групи хворих не відрізнялися за віком, статтю, загальним станом, кількістю пацієнтів із супутньою патологією та показником сШКФ. Хворі відрізнялися розміром пухлин, її локалізацією в нирці згідно з RENAL score [7] та NCIU нефрометрії [14], а також об’ємом функціонуючої паренхіми на стороні ураження [20].
Аналізуючи випадки резекції нирки (див. табл. 1), можна стверджувати, що вона виконана у 48 (80%) хворих із пухлиною <70 мм, у 59 (98,3%) випадках — при об’ємі функціонуючої паренхіми на стороні ураження >55%, у 53 (88,3%) хворих — при локалізації пухлини в полюсі нирки чи латерально, що забезпечувало інтраопераційний контроль за судинами нирки та підвищувало відсоток можливого виконання органозберігаючого лікування. Нефректомія ж проведена тільки у 12 (20%) хворих із пухлиною <70 мм та у 28 (80%) — при її розміщенні у воротах нирки.
Основні ускладнення, що розвивалися під час проведення оперативного втручання, представлено в табл. 2.
Таблиця 2. Інтраопераційні ускладнення при резекції нирки чи нефректомії у хворих на місцево-поширений рак
| Показник | Оперативне втручання | Рівень значимості відмінності, p | |
| Резекція нирки, n=60 | Нефректомія, n=52 | ||
| Крововтрата ≥1000 мл у хворих з ішемією, n (%) | 2 (3,3) | 3 (5,8) | 0,75 |
| Крововтрата ≥1000 мл у хворих без ішемії, n (%) | 5 (8,3) | ||
| Крововтрата у хворих з ішемією, мл | 445±290 | 301±243 | <0,0001 |
| Крововтрата у хворих без ішемії, мл | 598±503 | ||
| Гемотрансфузія, n (%) | 5 (8,3) | 2 (3,8) | 0,81 |
| Стентування нирки, n (%) | 8 (13,3) | – | |
| Травма суміжних органів, n (%) | 2 (3,3) | 5 (9,6) | 0,6 |
| Тривалість операції, хв | 102±32 | 106±25 | 0,54 |
З огляду на дані з табл. 2, загалом діагностовано кровотечу >1000 мл у 10 (8,9%) хворих, яка потребувала переливання компонентів крові у 7 (6,3%) випадках, причому статистичної різниці між видами оперативного втручання не виявлено (р >0,75). Враховуючи велику частку (81,7%) пацієнтів з розмірами пухлини >40 мм та локалізацією її в інтраполярній ділянці у 30%, з метою профілактики утворення нориць у 8 (13,3%) випадках проведено антеградне стентування чашково-мисочкового комплексу (ЧМК) нирки. Травматичне пошкодження селезінки траплялося у 2 випадках при застосуванні кожного хірургічного методу: 3,3% — при резекції нирки та 3,8% — при нефректомії, що закінчилася виконанням спленектомії. У 2 (3,8%) випадках при виконанні нефректомії була травмована капсула печінки: в одному випадку вдалося припинити кровотечу шляхом монополярної коагуляції паренхіми печінки та використання гемостатичного матеріалу; в іншому — виконати сегментарну резекцію печінки. Ще в одному (1,9%) випадку при нефректомії була виконана резекція хвоста підшлункової залози. Інтраопераційної летальності не зафіксовано в жодному випадку.
У післяопераційний період розвинулося 16 (14,3%) післяопераційних ускладнень у 12 (9,9%) хворих. Такі низькі показники ускладнень забезпечені ефективною хірургічною технікою, використанням локальної ішемії, якісного шовного матеріалу, нових гемостатичних засобів, сучасних антибактеріальних препаратів та ранньою активізацією хворих за методикою fast-track. Аналіз ускладнень у післяопераційний період представлено в табл. 3.
Таблиця 3. Післяопераційні ускладнення при резекції нирки чи нефректомії у хворих на місцево-поширений рак
| Показник | Оперативне втручання | Рівень значимості відмінності, p | |
| Резекція нирки, n=60 | Нефректомія, n=52 | ||
| Кровотеча, n (%) | 3 (5,0) | 1 (1,9) | 0,86 |
| Сечова нориця, n (%) | 3 (5,0) | – | |
| Загострення пієлонефриту чи супутньої патології, n (%) | 4 (6,7) | 1 (1,9) | 0,69 |
| Нагноєння післяопераційної рани, n (%) | 2 (3,3) | 2 (3,8) | 0,99 |
| Післяопераційний ліжко-день | 10,4±4,2 | 6,9±3,7 | <0,0001 |
Згідно з даними, наведеними в табл. 3, у післяопераційний період розвинулися 16 (14,3%) ускладнень, дещо більше після резекції нирки, ніж після нефректомії (20 проти 7,7% відповідно). Після резекції нирки у 3 (5%) хворих діагностовано кровотечу, яку в одному (1,7%) випадку вдалося припинити консервативно, ще у 2 (3,3%) — довелося виконати ревізію післяопераційної рани та повторне прошивання дефекту паренхіми нирки. Кровотеча після нефректомії у 1 (1,9%) хворого викликана повторною кровотечею з паренхіми печінки, яку ліквідовано тампонуванням рани з використанням гемостатичного матеріалу. Сечова нориця, яка розцінювалася нами як ускладнення при підтіканні сечі в рану більше 3 діб і траплялася у 3 (3,3%) випадках протягом 7–11 діб, була ліквідована за допомогою стентування нирки. Гнійно-септичні ускладнення виявляли доволі рідко: пієлонефрит з гіпертермією більше 5 діб після резекції нирки діагностований лише у 3 (5%) пацієнтів, а нагноєння післяопераційної рани — по 2 пацієнти після резекції нирки та нефректомії (3,3 та 3,8% відповідно). Ці ускладнення були куповані тривалою антибактеріальною та антипіретичною терапією. По 1 (1,7% та 1,9% відповідно) хворому після резекції нирки та нефректомії мали загострення супутньої патології у вигляді гіпертонічного кризу, який був купований гіпотензивними препаратами.
Так, рівень повторних оперативних втручань після резекції нирки та нефректомії становив лише 3,3 та 1,9%. Звичайно, що післяопераційний ліжко-день був достовірно більшим у хворих після резекції нирки, ніж після нефректомії — 10,4±4,2 проти 6,9±3,7 відповідно та був пов’язаний, в основному, з лікуванням післяопераційних ускладнень. Ускладнення, що розвинулися під час резекції нирки та в післяопераційний період, узагальнені та класифіковані за Clavien — Dindo [21] (табл. 4).
Таблиця 4. Інтра- та післяопераційні ускладнення за Clavien — Dindo при резекції нирки чи нефректомії у хворих на місцево-поширений рак
| Ускладнення за Clavien — Dindo | Оперативне втручання, n (%) | Усього
n=112 |
|
| Резекція нирки, n=60 | Нефректомія, n=52 | ||
| Grade — І | 1 (1,7) | 1 (1,9) | 2 (1,8) |
| Grade — ІІ | 8 (13,3) | 2 (3,8) | 10 (8,9) |
| Grade — ІІІ | 15 (25,0) | 6 (11,5) | 21 (18,5) |
| Усього | 24 (40,0) | 9 (17,3) | 33 (29,5) |
| Рівень значущості відмінності, p | 0,17 | ||
У 2 (1,8%) випадках ускладнення у вигляді загострення пієлонефриту не потребували додаткових призначень і були класифіковані як ускладнення І ступеня (див. табл. 4). До ускладнень ІІ ступеня за Clavien — Dindo віднесені 7 (6,2%) випадків переливання компонентів крові при інтраопераційній крововтраті >1000 мл та 3 (2,7%) випадки лікування загострення супутньої патології та пієлонефриту, які потребували медикаментозної корекції. До ускладнень ІІІ ступеня віднесено 11 (9,8%) випадків стентування сечоводу для ліквідації сечової нориці та 10 (8,5%) випадків виконання додаткових та невідкладних оперативних втручань. Ускладнень IV та V ступеня за класифікацією Clavien — Dindo в дослідженні не діагностовано, що, у першу чергу, зумовлено високою ефективністю розробленої методики резекції нирки на тлі заходів профілактики ускладнень. Загальна кількість ускладнень після резекції нирки є дещо вищою, ніж після нефректомії, однак відмінність є незначущою (p=0,17), що дозволяє рекомендувати резекцію нирки у пацієнтів з місцево-поширеним раком.
Максимальний період спостереження за хворими на місцево-поширений рак становив 97 міс, що в середньому — 43,9±22,6 міс. Прогресування захворювання діагностовано у 16 (14,3%) випадках, серед них метастатична хвороба — у 13 (11,6%), місцевий рецидив — у 3 (2,7%) випадках. Місцевий рецидив розвинувся у хворих після резекції нирки, що в одного (0,9%) пацієнта призвело до виконання нефректомії, ще в одного (0,9%) — до призначення таргетної терапії внаслідок додаткового метастазування. Проте в однієї (0,9%) хворої вдалося виконати повторну резекцію нирки. У всіх інших випадках призначали І лінію таргетної терапії. Аналіз факторів, що впливали на показник безпрогресивної виживаності, наведено в табл. 5.
Таблиця 5. Аналіз безпрогресивної виживаності хворих на місцево-поширений рак в однофакторних моделях пропорційних інтенсивностей Кокса
| Показник | Коефіцієнт моделі, b±m | Рівень значущості відмінності коефіцієнта від 0, р | Показник HR
(95% ВІ) |
|
| Вік | 0,039±0,028 | 0,176 | – | |
| Стать | жінки | Референтний | ||
| чоловіки | 0,13±0,52 | 0,797 | – | |
| Індекс маси тіла | –0,085±0,054 | 0,116 | – | |
| ECOG | 0,33±0,44 | 0,459 | – | |
| Супутня патологія | ні | Референтний | ||
| так | 1,56±1,03 | 0,130 | – | |
| NCIU | латерально | Референтний | ||
| медіально | 0,43±0,80 | 0,589 | – | |
| полюс нирки | 0,05±0,80 | 0,954 | – | |
| RENAL | –0,17±0,25 | 0,502 | – | |
| Fuhrman grade | 0,60±0,36 | 0,098 | – | |
| сШКФ | –0,005±0,010 | 0,618 | – | |
| Неоад’ювантна таргетна терапія | ні | Референтний | ||
| так | –0,01±0,52 | 0,984 | – | |
| Максимальний розмір пухлини | 0,011±0,009 | 0,223 | – | |
| RFPV | 0,002±0,020 | 0,902 | – | |
| RECIST 1.1 | 0,033±0,024 | 0,164 | – | |
| Метод лікування | нефректомія | Референтний | ||
| резекція | –0,47±0,50 | 0,346 | – | |
В однофакторних моделях зв’язку розвитку рецидиву захворювання з представленими факторами не виявлено (р >0,09) (див. табл. 5). Слід відмітити пограничне значення залежності розвитку рецидиву від агресивності пухлини за Фурманом (рис. 1).
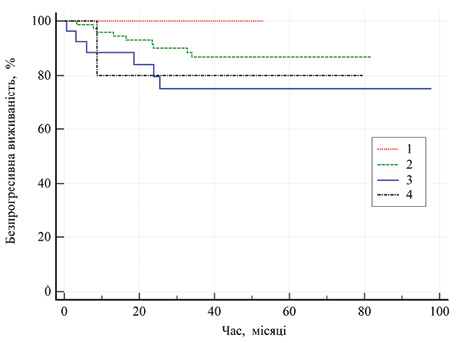
На рис. 1 усі криві перекриваються (95% ВІ), тому отримані результати є недостовірними та не мають наукової значущості. Однак варто звернути увагу на те, що все ж таки показник 5-річної виживаності при І ступені агресивності пухлини за Фурманом сягав 100%, при ІІ ступені — 86,8±4,1%, при ІІІ ступені — 75,2±8,9%, при ІV ступені — 80±17,9%.
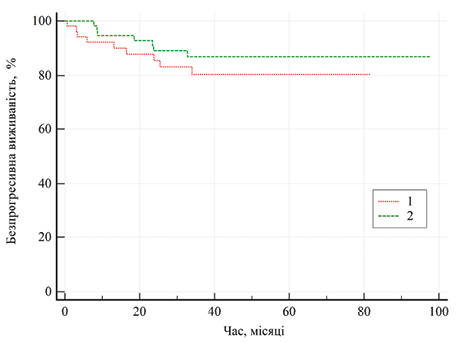
Загалом показники безпрогресивної виживаності залежно від методу хірургічного лікування представлено на рис. 2. Медіани безпрогресивної виживаності при обох методах лікування не досягнуто, однак показник 5-річної безпрогресивної виживаності хворих після резекції нирки становив 86,9±4,7%, тоді як після нефректомії — 80,4±5,9%. Також варто відмітити, що 13 (81,2%) хворих, у яких виявлено прогресування захворювання, померли в термін від 3 до 49 міс (у середньому — 16,3±14,2). У подальшому проведений аналіз факторів, що впливали на показник загальної виживаності хворих на місцево-поширений рак (табл. 6).
Таблиця 6. Аналіз загальної виживаності хворих на місцево-поширений рак в однофакторних моделях пропорційних інтенсивностей Кокса
| Показник | Коефіцієнт моделі, b±m | Рівень значимості відмінності коефіцієнта від 0, р | Показник HR
(95% ВІ) |
|
| Вік | 0,032±0,032 | 0,313 | – | |
| Стать | жінки | Референтний | ||
| чоловіки | 0,09±0,57 | 0,870 | – | |
| Індекс маси тіла | –0,08±0,060 | 0,141 | – | |
| ECOG | 0,70±0,47 | 0,154 | – | |
| Супутня патологія | ні | Референтний | ||
| так | 1,39±1,04 | 0,182 | – | |
| NCIU | латерально | Референтний | ||
| медіально | 0,33±0,80 | 0,642 | – | |
| полюс нирки | –0,58±0,87 | 0,505 | – | |
| RENAL | –0,29±0,24 | 0,240 | – | |
| Fuhrman grade | 0,71±0,40 | 0,077 | – | |
| сШКФ | –0,009±0,013 | 0,439 | – | |
| Неоад’ювантна таргетна терапія | ні | Референтний | ||
| так | –0,41±0,56 | 0,41 | – | |
| Максимальний розмір пухлини | 0,017±0,009 | 0,062 | – | |
| RFPV | –0,016±0,022 | 0,461 | – | |
| RECIST 1.1 | 0,031±0,030 | 0,294 | – | |
| Метод лікування | нефректомія | Референтний | ||
| резекція | –1,05±1,60 | 0,081 | – | |
У табл. 6 в однофакторних моделях зв’язку показника загальної виживаності від представлених факторів не виявлено (р >0,06). Слід відмітити пограничне значення залежності загальної виживаності від ступеня агресивності пухлини за Фурманом (р=0,077) та її розміру (р=0,062) (рис. 3).
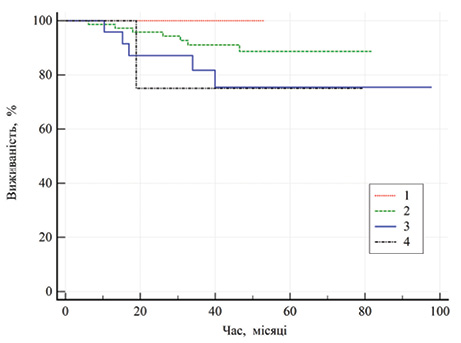
На рис. 3 усі криві перекриваються (95% ВІ), тому отримані результати є недостовірними та не мають наукової значущості. Однак варто звернути увагу на те, що показник 5-річної виживаності при І ступені агресивності пухлини за Фурманом сягав 100%, ІІ ступені — 88,7±4,2%, ІІІ ступені — 75,4±9,8%, ІV ступені — 75±21,7%.
На рис. 4 усі криві перекриваються (95% ВІ) і результати є недостовірними, однак варто звернути увагу на те, що показник 5-річної виживаності при розмірі пухлини ≤40 мм становив 90±9,5%, >40–≤70 мм — 88,4±4,6%, >70 мм — 78,3±8%.
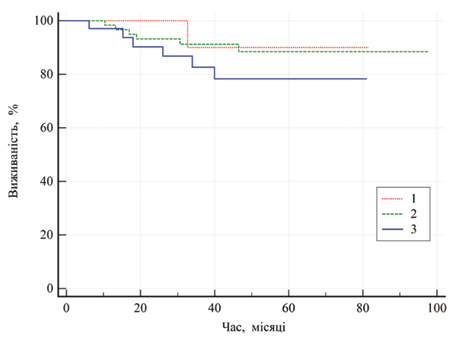
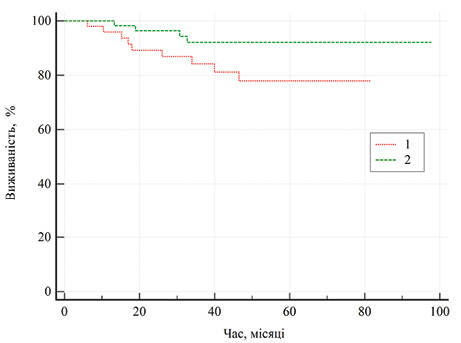
Показники загальної виживаності залежно від методу хірургічного лікування хворих на місцево-поширений рак представлено на рис. 5. Медіани загальної виживаності при обох методах лікування не досягнуто, однак показник 5-річної загальної виживаності хворих після резекції нирки становив 92,1±3,8%, а після нефректомії — 77,9±6,7%.
ОБГОВОРЕННЯ
Вибір тактики лікування хворих на місцево-поширений рак повинен базуватися на комплексній оцінці загального стану здоров’я пацієнта, поширеності пухлинного процесу, визначенні можливості виконання хірургічного видалення первинної пухлини та його методу (резекція нирки чи нефректомія), подальшої терапії захворювання з метою зниження ризику метастазування та саме лікування віддалених метастазів.
Наразі усе більшої актуальності набуває використання неоад’ювантної таргетної терапії в лікуванні хворих на місцево-поширений нирково-клітинний рак, оскільки її проведення може зменшити розміри пухлинних тромбів нижньої порожнистої вени і пухлини для зниження стадії та можливості проведення радикального оперативного лікування, зменшити розміри пухлини з метою проведення органозберігаючого лікування, а також підвищити виживаність хворих на нирково-клітинний рак високого ризику завдяки зменшенню мікрометастазування [22, 23].
Проведена нами неоад’ювантна таргетна терапія у хворих на місцево-поширений рак, яким показана нефректомія згідно з NCIU нефрометрією, дозволила зменшити розмір пухлини в середньому на 22,8±12% та у 84,8% випадках виконати резекцію нирки, причому у 5,4% хворих — перевести неоперабельну форму раку нирки в резектабельну.
Іншим важливим питанням є оцінка безпеки виконання хірургічного втручання при місцево-поширеному нирково-клітинному раку. Так, у метааналізі, проведеному Huang R. et al. [24], зафіксовано, що резекція нирки потребує більш тривалого часу операції і супроводжується більшою інтраопераційною крововтратою, ніж нефректомія, що є технічно складнішим хірургічним методом. В іншому дослідженні Bigot P. et al. [25] також встановлено вищий відсоток розвитку ускладнень після резекції нирки проти нефректомії у частоті кровотечі (3,1 проти 1,2%), сечової нориці (4,4 проти 0%) та частоті вторинних операцій (4,4 проти 2,4%), однак показники 5-річної безпрогресивної, канцер-специфічної та загальної виживаності після резекції нирки за селективними показаннями становили 85,7, 98 та 93,9% відповідно, які були значно вищими за показники у хворих після резекції нирки за імперативними показаннями (60,5, 78,5 та 70,6% відповідно).
За результатами нашого дослідження, тривалість операції статистично не відрізнялася (р=0,54) та становила 102±32 хв — при резекції нирки та 106±25 — при нефректомії. Об’єм крововтрати >1000 мл встановлено як при резекції нирки, так і нефректомії, однак статистичної різниці між видами оперативного втручання не виявлено (р=0,75).
Загальна кількість післяопераційних ускладнень у нашому дослідженні становила 14,3%, дещо більше після резекції нирки, ніж після нефректомії (20 проти 7,7% відповідно), однак вони всі були куповані хірургічними чи консервативними методами лікування. Рівень повторних оперативних втручань після резекції нирки та нефректомії становив лише 3,3 та 1,9% відповідно.
Тепер щодо виживаності: згідно з отриманими нами даними, медіани загальної виживаності при обох методах лікування не досягнуто, однак показник 5-річної загальної виживаності хворих після резекції нирки становив 92,1±3,8%, а після нефректомії — 77,9±6,7%. Слід відмітити пограничне статистично важливе значення залежності загальної виживаності від виду хірургічного лікування (р=0,081).
І наостанок, вибір на користь резекції нирки при місцево-поширеному раку не повинен базуватися на емпіричних селективних чи імперативних показаннях. Згідно з нашим дослідженням, резекція нирки виконана у 48 (80%) хворих із пухлиною розміром <70 мм та у 59 (98,3%) випадках — при об’ємі функціонуючої паренхіми на стороні ураження >55%, які є складовими частинами нефрометричної оцінки визначення показань до резекції нирки або нефректомії — NCIU нефрометрії.
ВИСНОВКИ
Аналізуючи результати лікування та зважаючи на те, що кількість інтра- та післяопераційних ускладнень, випадків прогресування захворювання після резекції нирки та тривалість операції статистично не відрізнялися від нефректомії, а також виявлено рівнозначні показники загальної виживаності хворих з незначною перевагою на користь резекції нирки, можна констатувати безпеку, високу ефективність та доцільність органозберігаючої терапії у хворих на місцево-поширений рак нирки.
З метою покращення ефективності лікування хворих на місцево-поширений нирково-клітинний рак необхідно призначати неоад’ювантну таргетну терапію, що підвищить відсоток регресії пухлини, можливість проведення нефронозберігаючого лікування та збільшить об’єм функціонуючої паренхіми нирки.
Показання до резекції нирки чи нефректомії та ймовірність їх виконання при місцево-поширеному раку треба визначати на основі розробленої нефрометричної системи оцінки пухлинного ураження нирки (NCIU нефрометрії). При ймовірності резекції >55%, незважаючи на розміри пухлини, доцільно виконувати органозберігаюче лікування.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Va EAU Guidelines on Renal Cell Carcinoma 2023. Retrieved from: uroweb.org/guidelines/renal-cell-carcinoma.
2. NCCN Guidelines on Kidney Cancer, Version 3.2023. Retrieved from: http://www.nccn.org/guidelines/guidelines-detail?category=1&id=1440.
3. Huang, W., Levey, A. S., Serio, A. M., Snyder, M., Vickers, A. J., Raj, G. V., … Russo, P. (2006). Chronic kidney disease after nephrectomy in patients with renal cortical tumours: a retrospective cohort study. Lancet Oncology, 7(9), 735–740. doi: 10.1016/S1470-2045(06)70803-8.
4. Go, A. S., Chertow, G. M., Fan, D., McCulloch, C. E., & Hsu, C. Y. (2004). Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. New England Journal of Medicine, 351(13), 1296–1305. doi: 10.1056/NEJMoa041031.
5. Karellas, M. E., O’Brien, M. F., Jang, T. L., Bernstein, M., & Russo, P. (2010). Partial Nephrectomy for Selected Renal Cortical Tumours of >/= 7 cm. BJU International, 106(10), 1484–1487. doi: 10.1111/j.1464-410X.2010.09405.x.
6. Long, C. J., Canter, D. J., Kutikov, A., Li, T., Simhan, J., Smaldone, M., Teper, E., … Uzzo, R. G. (2012). Partial Nephrectomy for Renal Masses >/= 7 cm: Technical, Oncological and Functional Outcomes. BJU International, 109(10), 1450–1456. doi: 10.1111/j.1464-410X.2011.10608.x.
7. Вітрук, Ю. В., Стаховський, Е. О., Войленко, О. А., Стаховський, О. Е., Вукалович, П. С., Котов, В. А., & Гаврилюк, О. М. (2013). Сучасні системи оцінки пухлинного ураження нирки (огляд літератури). Клиническая онкология, 3(11), 98–103.
8. Kutikov, A., & Uzzo, R. G. (2009). The R.E.N.A.L. nephrometry score: a comprehensive standardized system for quantitating renal tumor size, location and depth. Journal of Urology, 182, 844–853. doi: 10.1016/j.juro.2009.05.035.
9. de Saint Aubert, N., Audenet, F., Mccaig, F., Delavaud, C., Verkarre, V., Le Guilchet, T., … Timsit, M. O. (2018). Nephron Sparing Surgery in Tumours Greater Than 7cm. Progres en Urologie, 28(6), 336–343. doi: 10.1016/j.purol.2018.03.009.
10. Vilaseca, A., Guglielmetti, G., Vertosick, E. A., Sjoberg, D. D., Grasso, A., Benfante, N. E., … Touijer, K. A. (2020). Value of Partial Nephrectomy for Renal Cortical Tumors of cT2 or Greater Stage: A Risk-Benefit Analysis of Renal Function Preservation Versus Increased Postoperative Morbidity. European Urology Oncology, 3(3), 65–71. doi: 10.1016/j.euo.2019.04.003.
11. Massari, F., Di Nunno, V., Mollica, V., Graham, J., Gatto, L., & Heng, D. (2019). Adjuvant Tyrosine Kinase Inhibitors in Treatment of Renal Cell Carcinoma: A Meta-Analysis of Available Clinical Trials. Clinical Genitourinary Cancer, 17, e339. doi: 10.1016/j.clgc.2018.12.011.
12. Стаховський, Е. О., Войленко, О. А., Вітрук, Ю. В., Стаховський, О. Е., & Вукалович, П. С. (2016). Вибір тактики хірургічного лікування хворих на нирково-клітинний рак. (Метод. рекомендації). Національний інститут раку, Київ.
13. Sobin, L. H., Gospodarowicz, M. K., & Wittekind, C. (2009). TNM classification of malignant tumors (7th ed.). Hoboken, NJ: Wiley-Blackwell.
14. Стаховський, Е. О., Вітрук, Ю. В., Войленко, О. А., & Стаховський, О. Е. (2013). Патент України 108410. Київ: Державне патентне відомство України.
15. Voylenko, O. A., Stakhovsky, O. E., Vitruk, I. V., Kononenko, O. A., Pikul, M. V., Semko, S. L., & Stakhovsky, E. O. (2021). Efficacy of Neoadjuvant Targeted Therapy in Treatment of Patients with Localised Clear-Cell Renal Cell Carcinoma. Advances in Urology. Advances in Urology, 2021, 6674637. doi: 10.1155/2021/6674637.
16. Стаховський, Е. О., Вітрук, Ю. В., Стаховський, О. Е., & Войленко, О. А. Патент України 109192. Київ: Державне патентне відомство України.
17. Eisenhauer, E. A., Therasse, P., Bogaerts, J., Schwartz, L. H., Sargent, D., Ford, R., … Verweij, J. (2009). New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1). EJCANCER, 45, 228–247. doi: 10.1016/j.ejca.2008.10.026.
18. Kanda, Y. (2013). Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplant, 48, 452–458. doi: 10.1038/bmt.2012.244.
19. Гур’янов, В. Г., Лях, Ю. Є., Парій, В. Д., Короткий, О. В., Чалий, О. В., Чалий, К. О., & Цехмістер, Я. В. (2018). Посібник з біостатистики. Аналіз результатів медичних досліджень у пакеті EZR (R–statistics). Київ: Вістка.
20. Стаховський, Е. О., Вітрук, Ю. В., Войленко, О. А., Вукалович, П. С., Котов, В. А., Стаховський, О. Е., & Гаврилюк, О. М. (2015). Спосіб визначення функціонуючої паренхіми нирки при нирково-клітинному раку. (Інформ. лист). Національний інститут раку, Київ.
21. Clavien, P. A., Barkun, J., de Oliveira, M. L., Vauthey, J. N., Dindo, D., Schulick, R. D., … Makuuchi, M. (2009). The Clavien-Dindo classification of surgical complications: five-year experience. Annals of Surgery, 250, 187–196. doi: 10.1097/SLA.0b013e3181b13ca2.
22. Grivas, N. (2019). Neoadjuvant targeted therapy for advanced renal cell carcinoma: Where do we stand? Annals of Urology, 11(1), 115–116. doi: 10.4103/0974-7796.250549.
23. Bindayi, A., Hamilton, Z. A., McDonald, M. L., Yim, K., Millard, F., McKay, R. R., … Derweesh, I. H. (2018). Neoadjuvant therapy for localized and locally advanced renal cell carcinoma. Urology Oncology, 36(1), 31–37. doi: 10.1016/j.urolonc.2017.07.015.
24. Huang, R., Zhang, C., Wang, X., & Hu, H. (2021). Partial Nephrectomy Versus Radical Nephrectomy for Clinical T2 or Higher Stage Renal Tumors: A Systematic Review and Meta-Analysis. Frontiers in Oncology, 11, 680842. doi: 10.3389/fonc.2021.680842.
25. Bigot, P., Hétet, J. F., Bernhard, J. C., Fardoun, T., Audenet, F., Xylinas, E., … Patard, J. J. (2014). Nephron-Sparing Surgery for Renal Tumors Measuring More Than 7 cm: Morbidity, and Functional and Oncological Outcomes. Clinical Genitourinary Cancer, 12(1), e19–27. doi: 10.1016/j.clgc.2013.09.004.
Адреса для листування:
Вітрук Юрій
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: uvitruk@ukr.net
Correspondence:
Yurii Vitruk
33/43 Yulia Zdanovskaya str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: uvitruk@ukr.net














Leave a comment