Минуле та сьогодення в діагностиці та лікуванні Т-клітинних лімфом: короткий огляд медичної літератури та клінічний випадок
Рудюк Т.О.1, Титоренко І.Б.1, Алексик О.М.1, Калмикова А.В.2, Крячок І.А.1
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Медична лабораторія CSD, Київ, Україна
Резюме. Периферичні Т-клітинні лімфоми (ПТКЛ) — це група неходжкінських лімфом (НХЛ), які, як правило, мають поганий прогноз. Клінічні прояви захворювання можуть бути дуже варіабельними і часто можуть імітувати інфекційний або аутоімунний процеси. У роботі представлений клінічний випадок Т-клітинної лімфоми неспецифікованого типу (NOS) у жінки віком 57 років.
Одержано 30.10.2023
Прийнято до друку 10.11.2023
DOI: 10.32471/clinicaloncology.2663-466X.51-3.31280
Вступ
На сьогодні більшість первинних шкірних Т-клітинних лімфом (ПШТКЛ) представлені грибоподібним мікозом та CD30+ лімфопроліферативними захворюваннями (ЛПЗ), проте виділено окрему групу ПТКЛ. У 2016 р. Всесвітньою організацією охорони здоров’я (ВООЗ) розроблено класифікацію, яка включає 12 підтипів ПТКЛ, які розрізняються за клінічними, гістологічними та фенотипічними ознаками [1].
Найрідкісніші підтипи, що становлять від <1 до 2%, включають індолентні лімфоми, такі як первинна Т-клітинна шкірна лімфома малих середніх лімфоцитів, первинна шкірна акральна CD8+ Т-клітинна лімфома (акральна CD8+ Т-клітинна лімфома) та підшкірна панікулітоподібна Т-клітинна лімфома, а також агресивні варіанти захворювання, такі як первинна шкірна CD8+ агресивна епідермотропна цитотоксична Т-клітинна лімфома та первинна шкірна гамма/дельта Т-клітинна лімфома [2].
Через свою надзвичайну гетерогенність цей вид лімфом був переглянутий у 4-му виданні класифікації ВООЗ [3]. Новоутворення, відмінні від ангіоімунобластної Т-клітинної лімфоми (AITL), але з фолікулярних Т-хелперів, які раніше були включені до розділу «ПТКЛ-неспецифікований варіант», були перенесені в нову групу вузлових ПТКЛ. Вони характеризуються особливою морфологією (клітини малого та середнього розміру з прозорою цитоплазмою), експресією щонайменше 2, але переважно 3 ТФХ-асоційованих маркерів (серед яких BCL6, CD10, PD1/CD279, ICOS/CD278, SAP, CXCL13 та CCR5), профілем експресії генів та мутаційним різновидом [4–5].
На сьогодні реєстри Т-клітинного проєкту (TКП) та COMPLETE-реєстр проводять проспективне дослідження, в яке залучають пацієнтів з ПТКЛ. Вони містять інформацію про характеристики пацієнтів, клініко-патологічні особливості, лікування та прогноз [6]. Дійсно, дані цих реєстрів підтверджують, що ПТКЛ-неспецифікований варіант є найпоширенішим підтипом ПТКЛ у Північній Америці та Європі, частота якого коливається від 22 до 36% [7]. В Азії найбільшу поширеність має Т-клітинна лімфома/лейкемія дорослих — близько 25%, а ПТКЛ-неспецифікований варіант посідає 2-ге місце — 22%. Щодо расової приналежності, то в даних популяційного онкологічного реєстру США з нагляду, епідеміології та кінцевих результатів (Surveillance, Epidemiology and Results — SEER) зафіксовано вищий рівень захворюваності на ПТКЛ-неспецифікований варіант у осіб негроїдної раси порівняно з іспаномовними та неіспаномовними особами європеоїдної раси, жителями островів Азії/Тихого океану, американськими індіанцями та корінними жителями Аляски [8]. Середній вік на момент встановлення діагнозу становить близько 60 років, а співвідношення чоловіків і жінок становить приблизно 1,9:1. ПТКЛ-неспецифікований варіант у дітей зустрічається рідко. Фактори ризику включають целіакію, псоріаз в анамнезі, куріння сигарет протягом 40 і більше років порівняно з некурцями, а також сімейний анамнез гематологічних злоякісних новоутворень [9]. У невеликому відсотку випадків неопластичні клітини є носіями інфекції вірусу Епштейна — Барр (ВЕБ), хоча ВЕБ-позитивність частіше виявляють у В-клітинах.
Згідно з даними Національного канцер-реєстру України цей тип НХЛ не виділяється окремо, загальна кількість Т-НХЛ в Україні становить 127 осіб за 2020 р.
ПТКЛ-неспецифікований варіант (NOS) частіше вражає лімфатичні вузли, хоча може поширюватися й на будь-яку анатомічну ділянку. Стадію III–IV виявляють у 85% випадків [10]. Лейкемічне поширення, як і еритродермію, діагностують рідко. Пухлина може, у першу чергу, локалізуватися на шкірі, шлунково-кишковому тракті (ШКТ), легенях і центральній нервовій системі. У більшості хворих виявляють В-симптоми та наявність ≥3 факторів негативного прогнозу згідно з Міжнародним прогностичним індексом (international prognostic index — IPI). Еозинофілію, свербіж або гемофагоцитоз відмічають рідко. Анемію (Кумбс-негативну) виявляють близько у 35% випадків, тоді як гіпергаммаглобулінемію (≥16 г/дл) — менш ніж у 25% пацієнтів [11].
Останніми роками запропоновано кілька клінічних прогностичних індексів. IPI — інструмент, який застосовується до всіх НХЛ, але не існує спеціально розробленої прогностичної моделі для ПТКЛ-неспецифікованого варіанта [12]. А. Gallamini та співавтори розробили прогностичний індекс (ПІ) для ПТКЛ-неспецифікованого варіанта (NOS), який включає 4 показники, такі як вік (<60 років), Шкалу функціонального стану згідно з Eastern Cooperative Oncology Group (ECOG) ≥2, рівень лактатдегідрогенази (ЛДГ) вище верхньої межі норми та ураження кісткового мозку [13]. Згідно з результатами італійського кооперативного дослідження результат ПТКЛ-неспецифікованого варіанта суттєво відрізнявся залежно від наявності 1, 2, 3 і більше факторів прогнозу. У подальшому в цьому дослідженні була спроба заміни критерію ураження кісткового мозку на рівень експресії Ki-67 ≥80%, що призвело до більш ефективної прогностичної моделі (модифікований ПІ) [14].
На основі даних, зібраних у межах Міжнародної мережі Т-клітинних проєктів, запропонована додаткова шкала (International peripheral T-cell lymphoma Project score – IPTCLP), яка враховує рівень сироваткового альбуміну, ECOG, стадію захворювання та абсолютну кількість нейтрофілів [15].
Нарешті, Міжнародний проєкт з вивчення ПТКЛ розробив ПІ, що включав наявність В-симптомів, обʼєм пухлинної маси ≥10 см, підвищений рівень С-реактивного білка в плазмі крові, велику кількість трансформованих пухлинних клітин і кількість тромбоцитів <150×109/л, який негативно впливав як на загальну виживаність (ЗВ), так і на виживаність без прогресування (ВБП) при однофакторному аналізі, хоча тільки обʼєм пухлинної маси залишався прогностично значущим як для ЗВ, так і для ВБП, а тромбоцитопенія для ВБП — при багатоваріантному аналізі. У цьому дослідженні ПІ та IPI залишалися прогностично значущими як для ЗВ, так і для ВБП [10].
Клінічний випадок
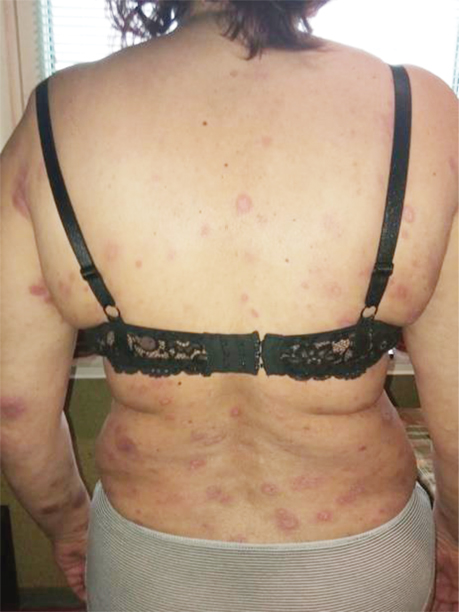
Пацієнтка А., 57 років, звернулася зі скаргами на червоні плями на шкірі обличчя, шиї, верхніх та нижніх кінцівок, тулуба, що турбували її протягом місяця. Вона заперечувала втрату ваги, однак відмічала постійно підвищену температуру тіла до 39 °С протягом 1 міс. Стаж куріння — 20 років (рис. 1).
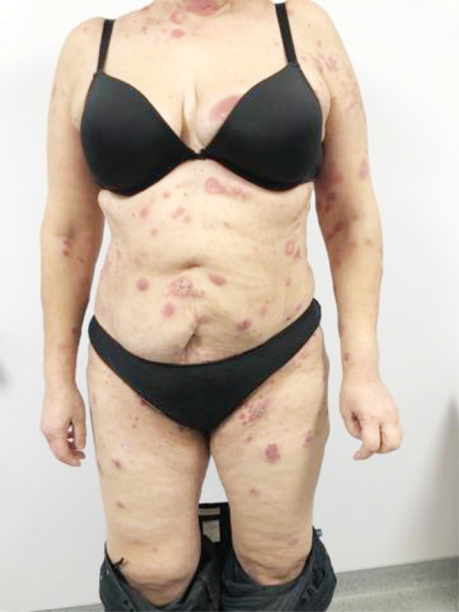
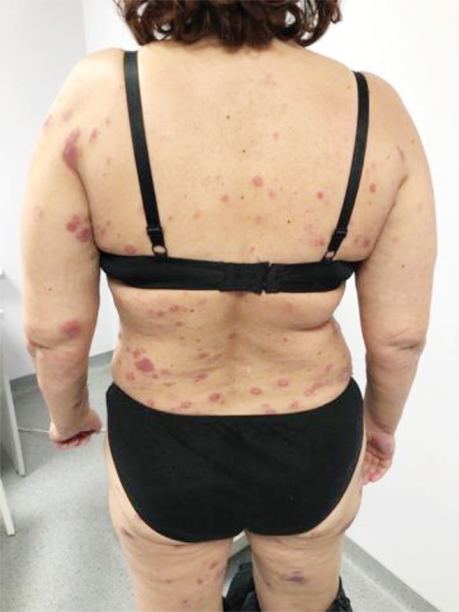
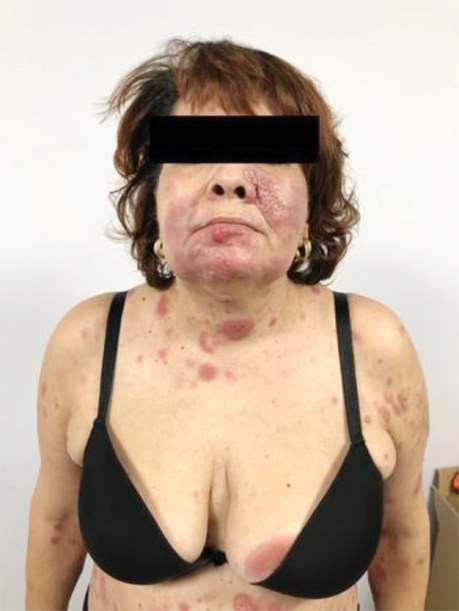
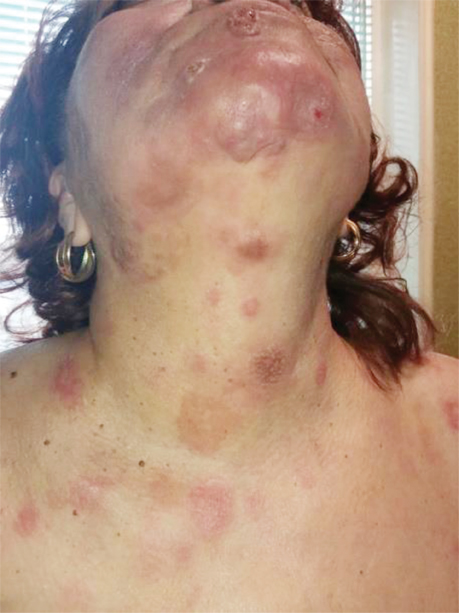
На момент госпіталізації виявлено еритематозні утворення на н/3 шиї та обличчі (рис. 2).
Проведено ексцизійну біопсію одного із новоутворень шкіри, за результатами якої встановлено, що отриманий фенотип характерний для Т-клітинної лімфоми, більше даних — щодо грибовидного мікозу, ІІ стадія.
Згодом зроблено також імунофенотипування клітин кісткового мозку: Т-клітини гетерогенні, наявні всі субпопуляції, коефіцієнт CD4/CD8 = 1,25. Рівень пан-Т-клітинного антигену CD7 — 85,6%. Дані щодо синдрому Сезарі в отриманому біоматеріалі відсутні.
Початкові лабораторні показники плазми крові та кісткового мозку були в межах норми. У цитоморфологічному дослідженні кісткового мозку зафіксовано, що препарати кісткового мозку помірноклітинні, еритроїдний паросток звужений (18,4%), нормобластичного типу кровотворення, гранулоцитарний паросток збережений — 67,2%, без затримки дозрівання, мегакаріоцитарний паросток кількісно збережений (3–5 мегакаріоцитарний у препаратах). Клітин Сезарі в наведених лікарських засобах не виявлено.
На компʼютерній томографії (КТ) шиї, органів грудної порожнини (ОГП), органів черевної порожнини (ОЧП) та заочеревинного простору, органів малого таза (ОМТ) виявлені збільшені шийні, підщелепні, аксилярні, тазові, пахові групи лімфатичних вузлів до 2 см.
Результати інфекційного обстеження: не виявлено антитіл до вірусу імунодефіциту людини (ВІЛ), HBsAg та anti-HCV.
Враховуючи симптоматичний перебіг захворювання, було ухвалено рішення про проведення 1-ї лінії терапії: пацієнтка отримала інтерферон 3 млн Од підшкірно (п/ш) 3 р/тиж (9 млн Од), з поступовим підвищенням дози інтерферону до 5 млн Од п/ш протягом 3 тиж (15 днів), сумарно 75 млн Од. Однак позитивної клінічної динаміки не було досягнуто (рис. 3).
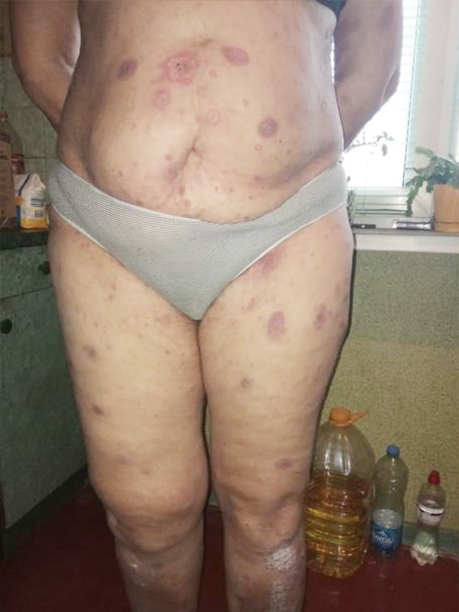
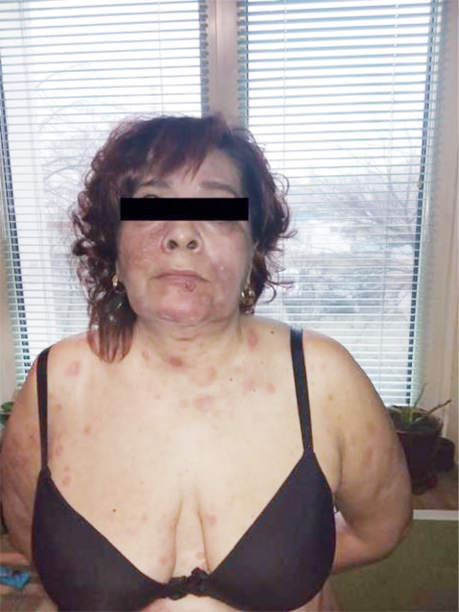
Зважаючи на відсутність відповіді на лікування, консиліумно ухвалили рішення про проведення 2-ї лінії терапії: інтерферон 5 млн щоденно впродовж 31 дня п/ш поєднано з метотрексатом 20 мг 1 р/тиж внутрішньо та 4 мг метипредом. Клінічно відмічено негативну динаміку на терапію (рис. 4).
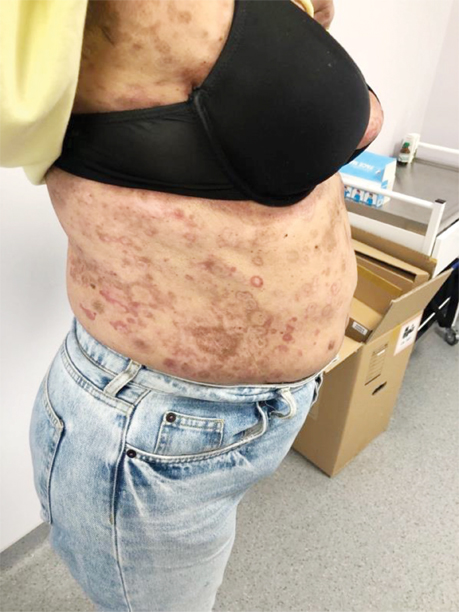
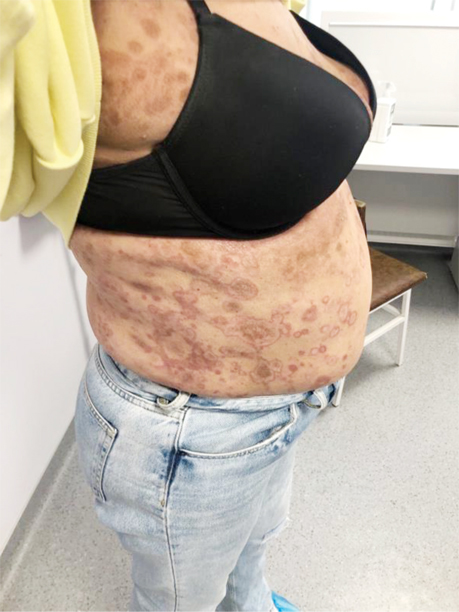
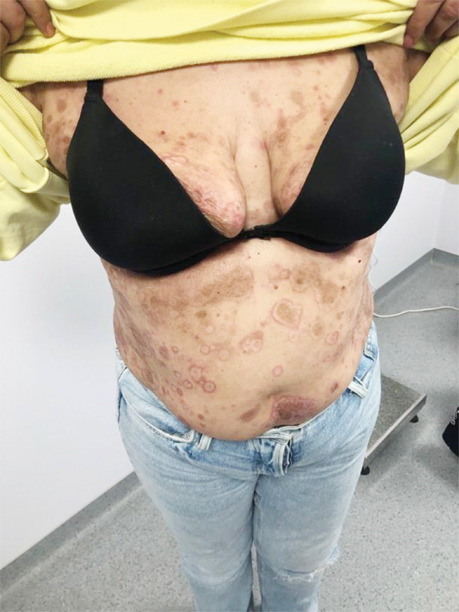
Враховуючи первинно-рефрактерний перебіг захворювання та збільшення вираженості симптомів пацієнтці було призначено 3 курси поліхіміотерапії (ПХТ) за схемою CHOP: циклофосфамід 750 мг/м2, вінкристин 1,4 мг/м2, доксорубіцин 50 мг/м2 та преднізолон 60 мг/м2.
Згідно з результатами КТ-контролю шиї, ОГП, ОЧП та заочеревинного простору, ОМТ з внутрішньовенним контрастуванням на етапі лікування на шиї та в ділянці підборіддя наявні поодинокі, розміром до 5 мм лімфатичні вузли; у над-, підключичних ділянках лімфатичні вузли не збільшені, в аксилярних ділянках з обох сторін відмічені поодинокі лімфатичні вузли розміром до 8 мм. Заочеревинні лімфатичні вузли не збільшені, виявлено поодинокі, уздовж здухвинних судин лімфатичні вузли розміром до 6 мм та брижові лімфатичні вузли розміром до 5 мм. У здухвинній ділянці праворуч зафіксовано декілька лімфатичних вузлів розміром до 12 мм, ліворуч — поодинокі розміром 7 мм. У пахових ділянках виявлено поодинокі лімфатичні вузли розміром до 12×10 мм праворуч та до 8 мм ліворуч. За даними КТ відмічено позитивну динаміку.
Однак ефект від ПХТ був короткотривалим, у звʼязку із чим розпочато 4-ту лінію терапії гемцитабіном 1200 мг/м2 в 1-й, 8-й та 15-й дні в монорежимі.
Враховуючи агресивний перебіг захворювання та короткотривалий ефект від терапії гістологічні препарати були переглянуті в незалежній патогістологічній лабораторії (рис. 5).
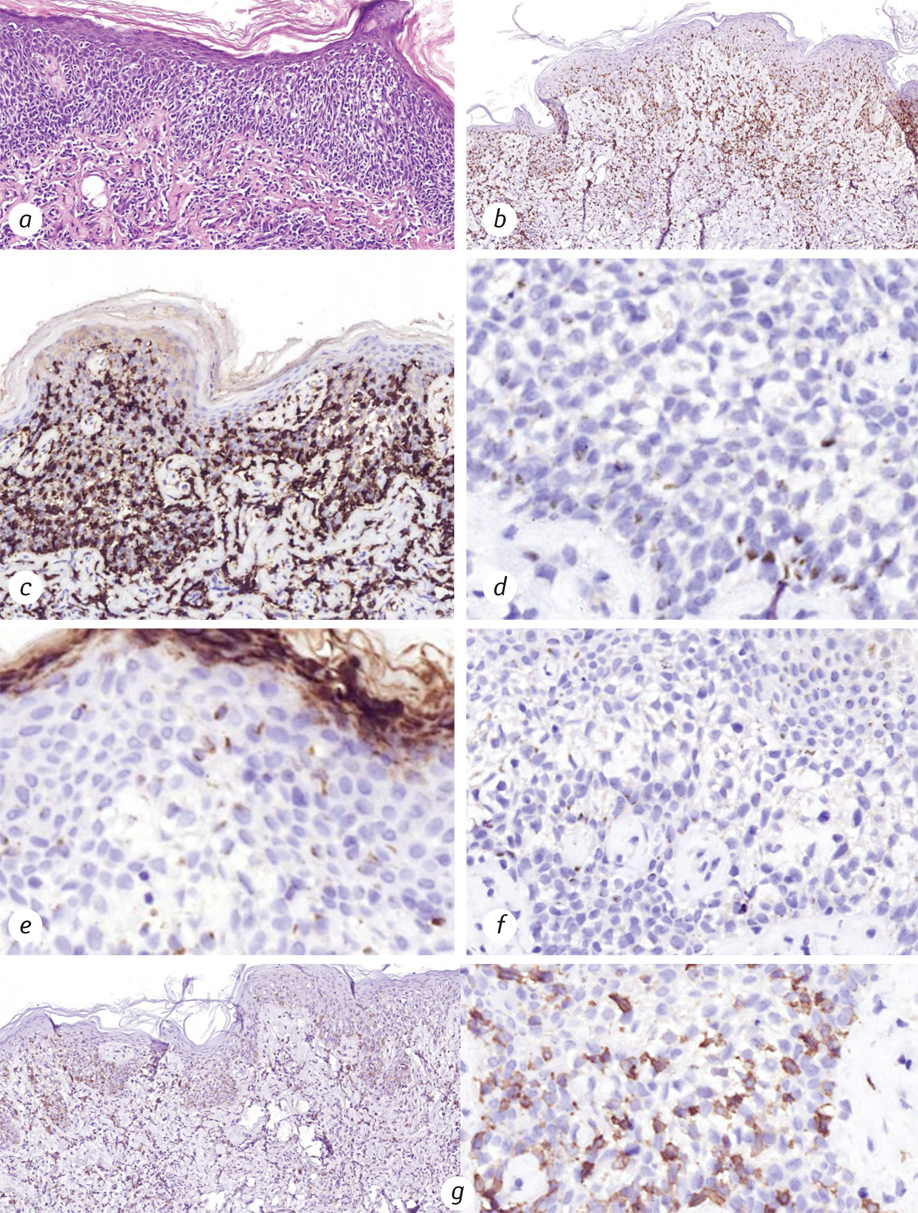
За результатами дослідження виявлено наступні зміни: епідерміс з ознаками гіперкератозу, помірного нерівномірного акантозу. У підлеглій дермі зафіксовано щільний периваскулярний та помірний дифузний інфільтрат, що складався з атипових лімфоцитів малого розміру з вираженими ознаками епідермотропізму. Клітини, що знаходилися в епідермісі, мали збільшені гіперхромні ядра неправильної форми та світле «гало» навколо. Поміж клітин інфільтрату в дермі виявлено домішки сегментоядерних лейкоцитів. Для встановлення імунофенотипу клітини пухлини було виконане імуногістохімічне дослідження, за результатами якого клітини пухлини були позитивні на CD3, CD7, гранзим В, перфорин, у частині клітин відмічено експресію TIA-1, близько 15% епідермотропних лімфоцитів були позитивними на CD30; клітини пухлини були негативні на CD4, CD8, TCRα, TCRβ, TCRδ та CD56.
Отже, така морфологічна картина та імунофенотип клітин пухлини дозволили класифікувати лімфому як агресивну епідермотропну ПТКЛ, найбільш імовірно, неспецифіковану в інший спосіб.
Наступним варіантом вибору терапії було призначення 2 курсів хіміотерапії за схемою: бендамустин 120 мг/м2 в монорежимі 1–2 дні. Проведено КТ-контроль шиї, ОГП, ОЧП та заочеревинного простору, ОМТ з внутрішньовенним контрастуванням: прогресування процесу зі збільшенням лімфатичних вузлів шиї, надключичних праворуч, аксилярних, заочеревинних, здухвинних та пахових лімфатичних вузлів, з ураженням підшкірно-жирової клітковини. Виявлено ознаки лімфостазу в грудних залозах.
У звʼязку з негативною клінічною картиною та первинно-рефрактерною формою захворювання пацієнтці було рекомендовано проведення спеціальної терапії, а саме застосування брентуксимабу ведотину 1,8 мг/кг маси тіла 16 циклів у монорежимі.
Обговорення
ПТКЛ — це рідкісний вид НХЛ, який становить лише 6–10% від загальної кількості таких випадків по всьому світу. Серед різних видів Т-клітинних лімфом ПТКЛ-неспецифікований варіант (NOS) становить понад чверть усіх випадків захворювань на ПТКЛ.
Хоча ПТКЛ може бути класифікована за різними критеріями, такими як лейкемічна/дисемінована, вузлова, позавузлова або шкірна форма, іноді, через різноманітність клінічних проявів, її можуть класифікувати як «невизначений тип» (NOS).
Ця форма лімфоми має складний перебіг та прогноз через свій характерний агресивний розвиток та обмежені варіанти лікування. Вона виникає зі зрілих Т-лімфоцитів, які часто називаються «пост-тимічними» або «периферичними».
На сьогодні ПТКЛ-неспецифікований варіант лімфом має несприятливий прогноз, а лікування є викликом для гематологів. Насправді цей підтип лімфоми проявляє низьку чутливість до схем терапії на основі антрациклінів, які успішно застосовуються для лікування В-клітинних новоутворень (наприклад CHOP (циклофосфамід, доксорубіцин, вінкристин і преднізон)). Лише 40% пацієнтів залишаються живими через 36 міс при застосуванні стандартної терапії [13]. У разі рецидиву прогноз ще гірший, ЗВ становить близько 20% протягом 3 років [15].
Основне обмеження сучасних знань щодо терапії ПТКЛ-неспецифікованого варіанта пов’язане з тим, що стратегії лікування розроблені на основі даних декількох досліджень, які охоплювали пацієнтів зі змішаними підгрупами ПТКЛ [16–18].
Найбільш поширеним на сьогодні є підхід, запропонований F. d’Amore та співавторами у 2012 р. [19], який полягає в застосуванні індукційної схеми CHOEP (циклофосфамід, доксорубіцин, вінкристин, преднізон та етопозид) з подальшим проведенням аутологічної трансплантації стовбурових клітин (ауто-ТГСК), як консолідації 1-ї лінії терапії.
У сучасних рекомендаціях з лікування ПТКЛ-неспецифікованої лімфоми показане додавання етопозиду до стандартної CHOP (схема CHOEP) в якості 1-ї лінії терапії у пацієнтів молодого віку (<60 років) [20]. Ця рекомендація ґрунтується на даних ретроспективного дослідження 289 пацієнтів з ПТКЛ-неспецифікованим варіантом, які отримували 6–8 циклів стандартної CHOP або CHOEP, яке встановило перевагу безрецидивної виживаності (БРВ) при застосуванні схеми CHOEP у пацієнтів віком до 60 років з нормальним рівнем ЛДГ. Слід зазначити, що в цьому дослідженні переважна більшість пацієнтів мали анапластичну великоклітинну лімфому (АВКЛ) (n=191), і лише 24% (n=70) з усієї когорти — ПТКЛ-неспецифіковану [21].
F. Ellin та співавтори довели в ретроспективному дослідженні аналогічну перевагу ВБП у пацієнтів молодого віку (<60 років), які отримували терапію за схемою СHOEP, з них 34% пацієнтів мали діагноз ПТКЛ-неспецифікованого варіанта [22].
На жаль, дані ретроспективних досліджень часто важко інтерпретувати, а ПТКЛ особливо схильна до похибок інтерпретації, враховуючи гетерогенність підтипів ПТКЛ, які вивчають у клінічних дослідженнях, що часто ускладнює узагальнення результатів, обмежуючи їх застосування у клінічній онкогематологічній практиці.
У будь-якому разі додавання етопозиду до схеми CHOP кардинально не змінило несприятливого результату лікування ПТКЛ-неспецифікованого варіанта, тому виникає необхідність використання альтернативних підходів та схем лікування.
F. d’Amore та співавтори проаналізували гетерогенну когорту з різними гістологічними підтипами ПТКЛ, яким проведено аутологічну та алогенну трансплантацію стовбурових клітин (ауто-, ало-ТСК), і встановили, що вони були живі ще протягом 5 років [19].
Не дивлячись на широке використання цих методів лікування, роль консолідації 1-ї лінії ауто-ТГСК все ж залишається дискусійною. S.I. Park та співавтори виявили, що ауто-ТГСК при 1-й повній ремісії (ПР) може бути використана для пацієнтів з ПТКЛ високої групи ризику, однак вона не дає значної переваги у БПВ та ЗВ за умови обмеженого аналізу конкретного підвиду ПТКЛ-неспецифікованого варіанта [23].
Роль консолідації ало-ТСК 1-ї лінії оцінено в ретроспективних і проспективних дослідженнях. Так, N. Schmitz та співавтори в рандомізованому дослідженні 3-ї фази вивчали роль консолідації ало-ТСК при 1-й ПР у пацієнтів з ПТКЛ [24]. У цьому дослідженні не зафіксовано значної переваги в ЗВ ало-ТСК через вищу летальність порівняно з ауто-ТГСК. Однак була більш виражена реакція «трансплантат проти лімфоми» (graft-versus-lymphoma — GvL) і відповідно більш низька частота розвитку рецидивів.
Загалом, ало-ТСК є цінним терапевтичним методом для пацієнтів з рецидивом/рефрактерним захворюванням. Визначення найбільш оптимальних термінів, режиму кондиціонування та типу донора продовжує залишатися об’єктом досліджень [25].
Однак загальним висновком більшості досліджень, які оцінюють ефективність стратегій лікування 1-ї лінії, є те, що значна частина пацієнтів не досягає ПВ при застосуванні схем, заснованих на CHOP-схемах, а рефрактерність до лікування 1-ї лінії є основним несприятливим прогностичним фактором для виживаності.
В останні кілька років нові таргетні препарати, як правило, виявили нижчі результати лікування порівняно з В-клітинними лімфомами, що, імовірно, пов’язано з відсутністю ефективних та систематичних досліджень щодо виявлення клітин-мішеней.
Інгібітори гістондеацетилази (HDACi) помітно ефективніші принаймні у 20–25% пацієнтів з ПТКЛ (NOS), що узгоджується з результатами доклінічних досліджень, в яких зафіксовано геномні зміни під час використання епігенетичних модуляторів в аналогічній частці випадків. Навпаки, HDACi зумовлюють вищу ефективність при НХЛ, де геномні зміни епігенетичних модуляторів відіграють основну патогенетичну роль. Крім того, ефективність HDACi, мабуть, не змінюється залежно від попередньої терапії, що дає змогу припустити деяку схильну вразливість, яка не має однакових механізмів перехресної резистентності з традиційною хіміотерапією [26].
Такі спостереження дають змогу припустити, що HDACi можуть синергувати з цілою низкою препаратів, активних щодо ПТКЛ (NOS), і тому можуть відігравати значущу роль у комбінованій терапії.
P.B. Johnston та співавтори проводили дослідження, де вивчали комбінації HDACi з традиційною хіміотерапією, які надали багатообіцяючі результати, але згідно з даними E. Bachy та співавторів доцільність додавання HDACi до традиційної хіміотерапії CHOP беруть під сумнів [27, 28].
Моноклональне анти-CD30 антитіло SGN-30, кон’юговане з монометил-ауристатином E брентуксимаб-ведотин (БВ), представляє собою ще один цікавий інструмент для лікування CD30+ ПТКЛ. У дослідженні ECHELON-2 додавання БВ до схеми CHP (CHOP без вінкристину) встановлено значну перевагу БПВ та ЗВ в 1-й лінії терапії. Однак оскільки у 75% залучених у дослідження пацієнтів діагностовано АВКЛ (яка характеризується наявністю CD30+), а дослідження не мало достатньої потужності для встановлення переваг за терміном лікування для окремих підтипів ПТКЛ, ці результати можна вважати такими, що змінюють практику тільки для АВКЛ [29]. Відповідно до різної та непостійної експресії молекули CD30 у клітинах ПТКЛ-неспецифікованого варіанта, відомості дослідження ECHELON-2 не можуть бути екстрапольовані та узагальнені на всі підтипи ПТКЛ без ризику виникнення значних похибок в інтерпретації. У звʼязку із цим, Європейське агентство з лікарських засобів (European Medicines Agency — EMA) схвалило застосування БВ у комбінації з CHP тільки для лікування первинних хворих на АВКЛ.
S.M. Horwitz та співавтори відмічають можливу роль у лікуванні інгібіторів PI3K у дослідженні GATA-3 (GATA binding protein 3) ПТКЛ-неспефікованого варіанта, що має бути доведено в майбутніх клінічних дослідженнях [30].
На сьогодні існують інші потенційні терапевтичні мішені, такі як BCL2, CD38, CD52 та PDGFRα/β [31]. Експресія PDGFRα/β може бути підставою для застосування інгібіторів тирозинкіназ [26, 27], інші молекули — мішені для специфічних інгібіторів малих молекул і моноклональних антитіл (наприклад венетоклакс, даратумумаб і Campath-1) [32].
При використанні антитіл проти CD52 Campath-1 виявлено суперечливі результати внаслідок високої частоти розвитку інфекцій через глибоку імунну супресію, спричинену таргетним впливом на CD52, що обмежує його ефективність. У дослідженні Campath-1 у комбінації з хіміотерапією CHOP не змогли зафіксувати перевагу експериментальної групи в БПВ та ЗВ, незважаючи на вищі показники відповіді [33, 34].
L. Falchi та співавтори встановили в дослідженні 2-ї фази високу ефективність комбінації ромідепсину з 5-азацитидином, а застосування інгібітора PI3K дувелісиб забезпечило високу частоту відповідей як при прийомі одного препарату, так і в комбінації [35, 36].
Наразі вивчають нові імунотерапевтичні підходи до лікування ПТКЛ.
Що стосується інгібіторів імунних контрольних точок, то дані 1-ї фази виявили багатообіцяючу ефективність у невеликій когорті хворих на ПТКЛ, що послужило підставою для проведення подальшого клінічного дослідження [37].
N.N. Bennani та співавтори висловили побоювання з приводу недостатньої ефективності та розвитку можливих негативних ефектів анти-PD-1-терапії у пацієнтів з ПТКЛ, таких як гіперпрогресія, однак відносна кількість пацієнтів з ПТКЛ (NOS), залучених до цих досліджень, була надто маленькою, щоб зробити якісь певні висновки для цього конкретного підтипу ПТКЛ [38, 39].
У дослідженні ефективності та безпеки антитіл проти PD1 гептанолімабу у хворих на ПТКЛ Y. Shi та співавтори виявили, що загальна частота відповідей (ЗЧВ) для підгрупи ПТКЛ (NOS) становила 17,9% [40]. Однак у цьому дослідженні найбільшу ЗЧВ відмічено в підгрупі NK/T-клітинних лімфом [41].
На сьогодні роль інших видів імунотерапії, таких як біспецифічні антитіла та CAR T-клітинна терапія, наразі не може бути вирішена через недостатню кількість клінічних досліджень щодо ПТКЛ (NOS).
З 2000 р. знання про патобіологію та патофізіологію ПТКЛ (NOS) поступово розширюються завдяки застосуванню цілої низки фенотипічних і молекулярних методів. Вони дали змогу відокремити підтипи, які мають прогностичне, а також потенційне терапевтичне значення, що сприяло розробці нових схем лікування. Однак відомості про ефективність цих нових схем усе ще відсутні, зокрема через рідкісність ПТКЛ (NOS).
У майбутньому в межах спеціальних спільних досліджень необхідно вивчити цінність нових стратегій терапії залежно від підтипів ПТКЛ.
Список використаної літератури
1. Swerdlow, S. H., Campo, E., Pileri, S. A., Harris, N. L., Stein, H., Siebert, R., … Jaffe, E. S. (2016). The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood, 127, 2375–2390. doi: 10.1182/blood-2016-01-643569.
2. Willemze, R., Jaffe, E. S., Burg, G., Cerroni, L., Berti, E., Swerdlow, S. H., … Meijer, C. J. (2005). WHO-EORTC classification for cutaneous lymphomas. Blood, 105, 3768–3785. doi: 10.1182/blood-2004-09-3502.
3. Swerdlow, S. H., Campo, E., Harris, N. L., Jaffe, E. S., Pileri, S. A., Stein, H., & Thiele, J. (2017). WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, 4th ed.; International Agency for Research on Cancer: Lyon, France. doi: 10.1182/blood-2016-01-643569.
4. Laurent, C., Fazilleau, N., & Brousset, P. (2010). A novel subset of T-helper cells: Follicular T-helper cells and their markers. Haematologica, 95, 356–358. doi: 10.3324/haematol.2009.019133.
5. Pileri, S. A. (2015). Follicular helper T-cell-related lymphomas. Blood, 126, 1733–1734. doi: 10.1182/blood-2015-08-665075.
6. Vose, J., Armitage, J., & Weisenburger, D. (2008). International T-Cell Lymphoma Project. International peripheral T-cell and natural killer/T-cell lymphoma study: Pathology findings and clinical outcomes. Journal of Clinical Oncology, 26, 4124–4130. doi: 10.1200/JCO.2008.16.4558.
7. Bellei, M., Nabhan, C., Pesce, E. A., Conte, L., Vose, J. M., Foss, F., & Federico, M. (2015). The Value and Relevance of the T Cell Lymphoma Registries and International Collaborations: The Case of COMPLETE and the T-Cell Project. Current Hematologic Malignancy Reports, 10, 448–455. doi: 10.1007/s11899-015-0291-0.
8. Adams, S. V., Newcomb, P. A., & Shustov, A. R. (2016). Racial patterns of peripheral T-cell lymphoma incidence and survival in the United States. Journal of Clinical Oncology, 34, 963–971. doi: 10.1200/JCO.2015.63.5540.
9. Wang, S. S., Flowers, C. R., Kadin, M. E., Chang, E. T., Hughes, A. M., Ansell, S. M., … Weisenburger, D. D. (2014). Medical history, lifestyle, family history, and occupational risk factors for peripheral T-cell lymphomas: The InterLymph non-Hodgkin lymphoma subtypes project. Journal of the National Cancer Institute Monographs, 48, 66–75. doi: 10.1093/jncimonographs/lgu012.
10. Weisenburger, D. D., Savage, K. J., Harris, N. L., Gascoyne, R. D., Jaffe, E. S., MacLennan, K. A., … Vose, J. M. (2011). T-cell Lymphoma Project. Peripheral T-cell lymphoma, not otherwise specified: A report of 340 cases from the international peripheral T-cell lymphoma project. Blood, 117, 3402–3408. doi: 10.1182/blood-2010-09-310342.
11. Pileri, A., Pellegrini, C., Agostinelli, C., Grandi, V., Patrizi, A., Zinzani, P. L., & Pimpinelli, N. (2017). Erythroderma and non-Hodgkin T-cell lymphoma: What else, apart from Mycosis Fungoides and Sézary syndrome? European Journal of Dermatology, 27, 49–53. doi: 10.1684/ejd.2016.2915.
12. International Non-Hodgkin’s Lymphoma Prognostic Factors Project. (1993). A predictive model for aggressive non-Hodgkin’s lymphoma. New England Journal of Medicine, 329, 987–994. doi: 10.1056/NEJM199309303291402.
13. Gallamini, A., Stelitano, C., Calvi, R., Bellei, M., Mattei, D., Vitolo, U., … Federico, M. (2004). Peripheral T-cell lymphoma unspecified (PTCL-U): A new prognostic model from a retrospective multicentric clinical study. Blood, 103, 2474–2479. doi: 10.1182/blood-2003-09-3080.
14. Went, P., Agostinelli, C., Gallamini, A., Piccaluga, P. P., Ascani, S., Sabattini, E., … Pileri, S. A. (2006). Marker expression in peripheral T-cell lymphoma: A proposed clinical-pathologic prognostic score. Journal of Clinical Oncology, 24, 2472–2479. doi: 10.1200/JCO.2005.03.6327.
15. Federico, M., Bellei, M., Marcheselli, L., Schwartz, M., Manni, M., Tarantino, V., … Advani, R. H. (2018). Peripheral T cell lymphoma, not otherwise specified (PTCL-NOS). A new prognostic model developed by the International T cell Project Network. British Journal of Haematology, 181, 760–769. doi: 10.1111/bjh.15258.
16. Bellei, M., & Federico, M. (2019). The outcome of peripheral T-cell lymphoma patients failing first-line therapy: A report from the prospective International T-Cell Project. Haematologica, 104, e178. doi: 10.3324/haematol.2017.186577.
17. Corradini, P., Vitolo, U., Rambaldi, A., Miceli, R., Patriarca, F., Gallamini, A., … Dodero, A. (2014). Intensified chemo-immunotherapy with or without stem cell transplantation in newly diagnosed patients with peripheral T-cell lymphoma. Leukemia, 28, 1885–1891. doi: 10.1038/leu.2014.79.
18. Corradini, P., Tarella, C., Zallio, F., Dodero, A., Zanni, M., Valagussa, P., … Cortelazzo, S. (2006). Long-term follow-up of patients with peripheral T-cell lymphomas treated up-front with high-dose chemotherapy followed by autologous stem cell transplantation. Leukemia, 20, 1533–1538. doi: 10.1038/sj.leu.2404306.
19. D’Amore, F., Relander, T., Lauritzsen, G. F., Jantunen, E., Hagberg, H., Anderson, H., … Toldbod, H. E. (2012). Up-front autologous stem-cell transplantation in peripheral T-cell lymphoma: NLG-T-01. Journal of Clinical Oncology, 30, 3093–3099. doi: 10.1200/JCO.2011.40.2719.
20. D’Amore, F., Gaulard, P., Trümper, L., Corradini, P., Kim, W. S., Specht, L., … Ladetto, M. (2015). ESMO Guidelines Committee. Peripheral T-cell lymphomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, 26 (Suppl. 5), v108–v115. doi: 10.1093/annonc/mdv201.
21. Schmitz, N., Trümper, L., Ziepert, M., Nickelsen, M., Ho, A. D., Metzner, B., … Pfreundschuh, M. (2010). Treatment and prognosis of mature T-cell and NK-cell lymphoma: An analysis of patients with T-cell lymphoma treated in studies of the German High-Grade Non-Hodgkin Lymphoma Study Group. Blood, 116, 3418–3425. doi: 10.1182/blood-2010-02-270785.
22. Ellin, F., Landström, J., Jerkeman, M., & Relander, T. (2014). Real-world data on prognostic factors and treatment in peripheral T-cell lymphomas: A study from the Swedish Lymphoma Registry. Blood, 124, 1570–1577. doi: 10.1182/blood-2014-04-573089.
23. Park, S. I., Horwitz, S. M., Foss, F. M., Pinter-Brown, L. C., Carson, K. R., Rosen, S. T., … Shustov, A. R. (2019). COMPLETE Investigators. The role of autologous stem cell transplantation in patients with nodal peripheral T-cell lymphomas in first complete remission: Report from COMPLETE, a prospective, multicenter cohort study. Cancer, 125, 1507–1517. doi: 10.1002/cncr.31861.
24. Schmitz, N., Truemper, L., Bouabdallah, K., Ziepert, M., Leclerc, M., Cartron, G., … Tournilhac, O. (2021). A randomized phase 3 trial of autologous vs allogeneic transplantation as part of first-line therapy in poor-risk peripheral T-NHL. Blood, 137, 2646–2656. doi: 10.1182/blood.2020008825.
25. Corradini, P., Dodero, A., Zallio, F., Caracciolo, D., Casini, M., Bregni, M., … Tarella, C. (2004). Graft-versus-lymphoma effect in relapsed peripheral T-cell non-Hodgkin’s lymphomas after reduced-intensity conditioning followed by allogeneic transplantation of hematopoietic cells. Journal of Clinical Oncology, 22, 2172–2176. doi: 10.1200/JCO.2004.12.050.
26. O’Connor, O. A., Horwitz, S., Masszi, T., Van Hoof, A., Brown, P., Doorduijn, J., … Shustov, A. (2015). Belinostat in Patients With Relapsed or Refractory Peripheral T-Cell Lymphoma: Results of the Pivotal Phase II BELIEF (CLN-19) Study. Journal of Clinical Oncology, 33, 2492–2499. doi: 10.1200/JCO.2014.59.2782.
27. Johnston, P. B., Cashen, A. F., Nikolinakos, P. G., Beaven, A. W., Barta, S. K., Bhat, G., … Foss, F. M. (2021). Belinostat in combination with standard cyclophosphamide, doxorubicin, vincristine and prednisone as first-line treatment for patients with newly diagnosed peripheral T-cell lymphoma. Experimental Hematology & Oncology, 10, 15. doi: 10.1186/s40164-021-00203-8.
28. Bachy, E., Camus, V., Thieblemont, C., Casasnovas, R. O., Ysebaert, L., Damaj, G. L., … Delarue, R. (2020). Final Analysis of the Ro-CHOP Phase III Study (Conducted by LYSA): Romidepsin Plus CHOP in Patients with Peripheral T-Cell Lymphoma. Blood, 136 (Suppl. 1), 32–33. doi: 10.3390/cancers13184535.
29. Horwitz, S., O’Connor, O. A., Pro, B., Illidge, T., Fanale, M., Advani, R., … Trümper, L. (2019). ECHELON-2 Study Group. Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma (ECHELON-2): A global, double-blind, randomised, phase 3 trial. Lancet, 393, 229–240. doi: 10.1016/S0140-6736(18)32984-2.
30. Horwitz, S. M., Koch, R., Porcu, P., Oki, Y., Moskowitz, A., Perez, M., … Weinstock, D. M. (2018). Activity of the PI3K-δ,γ inhibitor duvelisib in a phase 1 trial and preclinical models of T-cell lymphoma. Blood, 131, 888–898. doi: 10.1182/blood-2017-08-802470.
31. Lindauer, M., & Hochhaus, A. (2014). Dasatinib. Recent Results in Cancer Research, 201, 27–65. doi: 10.1007/978-3-642-54490-3_2.
32. Piccaluga, P. P., Rossi, M., Agostinelli, C., Ricci, F., Gazzola, A., Righi, S., … Pileri, S. A. (2014). Platelet-derived growth factor alpha mediates the proliferation of peripheral T-cell lymphoma cells via an autocrine regulatory pathway. Leukemia, 28, 1687–1697. doi: 10.1038/leu.2014.50.
33. Gallamini, A., Zaja, F., Patti, C., Billio, A., Specchia, M. R., Tucci, A., … Tarella, C. (2007). Alemtuzumab (Campath-1H) and CHOP chemotherapy as first-line treatment of peripheral T-cell lymphoma: Results of a GITIL (Gruppo Italiano Terapie Innovative nei Linfomi) prospective multicenter trial. Blood, 110, 2316–2323. doi: 10.1182/blood-2007-02-074641.
34. Wulf, G. G., Altmann, B., Ziepert, M., D’Amore, F., Held, G., Greil, R., … Trümper, L. (2021). ACT-2 study investigators. Alemtuzumab plus CHOP versus CHOP in elderly patients with peripheral T-cell lymphoma: The DSHNHL2006-1B/ACT-2 trial. Leukemia, 35, 143–155. doi: 10.1038/s41375-020-0838-5.
35. Falchi, L., Ma, H., Klein, S., Lue, J. K., Montanari, F., Marchi, E., … O’Connor, O. A. (2021). Combined oral 5-azacytidine and romidepsin are highly effective in patients with PTCL: A multicenter phase 2 study. Blood, 137, 2161–2170. doi: 10.1182/blood.2020009004.
36. Horwitz, C. M., Moskowitz, A. J., Jacobsen, E. D., Mehta-Shah, N., Khodadoust, M. S., Fisher, D. C., … Weinstock, D. M. (2018). The Combination of Duvelisib, a PI3K-δ,γ Inhibitor, and Romidepsin Is Highly Active in Relapsed/Refractory Peripheral T-Cell Lymphoma with Low Rates of Transaminitis: Results of Parallel Multicenter, Phase 1 Combination Studies with Expansion Cohorts. Blood, 132 (Suppl. 1), 683. doi: 10.1182/blood-2018-99-115241.
37. Lesokhin, A. M., Ansell, S. M., Armand, P., Scott, E. C., Halwani, A., Gutierrez, M., … Timmerman, J. (2016). Nivolumab in Patients With Relapsed or Refractory Hematologic Malignancy: Preliminary Results of a Phase Ib Study. Journal of Clinical Oncology, 34, 2698–2704. doi: 10.1200/JCO.2015.65.9789.
38. Bennani, N. N., Pederson, L. D., Atherton, P., Micallef, I., Colgan, J. P., Thanarajasingam, G., … Ansell, S. M. (2019). A Phase II Study of Nivolumab in Patients with Relapsed or Refractory Peripheral T-Cell Lymphoma. Blood, 134 (Suppl. 1), 467. doi: 10.1136/jitc-2022-004984.
39. Barta, S. K., Zain, J., MacFarlane, A. W., Smith, S. M., Ruan, J., Fung, H. C., … Oki, Y. (2019). Phase II Study of the PD-1 Inhibitor Pembrolizumab for the Treatment of Relapsed or Refractory Mature T-cell Lymphoma. Clinical Lymphoma, Myeloma & Leukemia, 19, 356–364.e3. doi: 10.12998/wjcc.v11.i7.1458.
40. Shi, Y., Wu, J., Wang, Z., Zhang, L., Wang, Z., Zhang, M., … Wang, Q. (2021). Efficacy and safety of geptanolimab (GB226) for relapsed or refractory peripheral T cell lymphoma: An open-label phase 2 study (Gxplore-002). Journal of Hematology & Oncology, 14, 12. doi: 10.1186/s13045-021-01033-1.
41. Kwong, Y. L., Chan, T. S. Y., Tan, D., Kim, S. J., Poon, L. M., Mow, B., … Tse, E. (2017). PD1 blockade with pembrolizumab is highly effective in relapsed or refractory NK/T-cell lymphoma failing l-asparaginase. Blood, 129, 2437–2442. doi: 10.1182/blood-2016-12-756841.
Адреса для листування:
Рудюк Тимур Олегович
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
Е-mail: tymur.rudiuk@gmail.com.
Correspondence:
Tymur Rudiuk
33/43 Yulia Zdanovskaya str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: tymur.rudiuk@gmail.com














Leave a comment