Талазопаріб у лікуванні раку грудної залози. Аналіз даних з реальної клінічної практики
Резюме. Рак грудної залози (РГЗ) переважає серед онкологічних захворювань та інших причин смертності у жінок в Україні, незмінно випереджаючи іншу онкопатологію. При ранньому виявленні РГЗ зазвичай має сприятливий прогноз. Напроти, метастатичне захворювання, хоча й піддається лікуванню, залишається практично невиліковним із загальною виживаністю (ЗВ) приблизно 3 роки та 5-річною — лише у 25% [1]. Поліпшена доступність усе більш ефективних системних терапевтичних методів поєднано з раннім виявленням позитивно впливає на показники виживаності, хоча лікування пацієнтів з метастатичним (м)РГЗ все ще зосереджено, в першу чергу, на подовженні виживаності та підтримці якості життя [2]. Але, незважаючи на збільшення кількості жінок, що живуть із мРГЗ, та варіантів їх лікування, про результати в рутинній клінічній практиці відомо замало [3]. Це особливо вірно для лікування поза стратегіями 2-ї або 3-ї лінії та тягаря побічних дій, тактика щодо яких під час клінічних досліджень може відрізнятися. У таких умовах аналіз даних з реальної клінічної практики є життєво важливим для покращання лікування РГЗ.
DOI: 10.32471/clinicaloncology.2663-466X.51-3.31058
 РГЗ продовжує залишатися провідною за розповсюдженістю онкопатологією: в Україні у 2021 р. на нього приходилося 22% усіх нових випадків [4]. У загальній нозологічній структурі смертності цей вид раку також переважає: у 2021 р. він спричинив 4769 смертей серед жінок, тобто 20% усіх летальних випадків унаслідок злоякісних новоутворень. Фактори ризику розвитку РГЗ включають сімейний анамнез, вік, чинники навколишнього середовища та способу життя, а також гормональні впливи. Ризик розвитку РГЗ приблизно у 2 рази вищий, якщо захворюванням уражений один з родичів 1-го ступеня, і підвищується у 5 разів, якщо родич хворів на РГЗ у молодому віці [5].
РГЗ продовжує залишатися провідною за розповсюдженістю онкопатологією: в Україні у 2021 р. на нього приходилося 22% усіх нових випадків [4]. У загальній нозологічній структурі смертності цей вид раку також переважає: у 2021 р. він спричинив 4769 смертей серед жінок, тобто 20% усіх летальних випадків унаслідок злоякісних новоутворень. Фактори ризику розвитку РГЗ включають сімейний анамнез, вік, чинники навколишнього середовища та способу життя, а також гормональні впливи. Ризик розвитку РГЗ приблизно у 2 рази вищий, якщо захворюванням уражений один з родичів 1-го ступеня, і підвищується у 5 разів, якщо родич хворів на РГЗ у молодому віці [5].
При цьому до 10% пацієнтів із РГЗ мають успадковані (гермінальні, зародкові) мутації ДНК, що часто призводять до втрати функції генів, пов’язаних із відновленням ДНК та активацією контрольних точок клітинного циклу. Решта ~90% випадків спричинені набутими (соматичними) генетичними та епігенетичними змінами [6].
Загалом, вибір лікування РГЗ базується на клінічних хактеристиках, історії хвороби та перевагах для пацієнта [3]. На обрання варіантів також впливає статус рецепторів до гормонів (естрогену, прогестерону) та людського епідермального фактора росту 2-го типу (human epidermal growth factor 2 — HER2) пухлини.
Також слід взяти до уваги, що гермінальні мутації з втратою функції у 2 важливих генах сприйнятливості до РГЗ, які мають вирішальне значення для відповіді на пошкодження ДНК, — gBRCA1 і gBRCA2, виявляють принаймні у 5% пацієнтів з РГЗ і приблизно у 30% пацієнтів з позитивною сімейною історією РГЗ або яєчників [5, 7]. У носіїв мутацій gBRCA1 або gBRCA2 ризик розвитку РГЗ до досягнення віку 80 років досягає 70% порівняно з 10% ризиком для жінок у загальній популяції [8, 9]. Аномалії типу gBRCA особливо поширені в певних популяціях, наприклад, серед євреїв-ашкеназів. У той же час мутація BRCA1/2 виявляється лише як соматична у 10% пацієнтів із мРГЗ та місцево-поширеним (мп)РГЗ. Соматичні мутації BRCA (sBRCA) розпізнаються ще досить рідко і вважаються недостатньо використаною можливістю для додаткової цільової терапії. Деякі дослідження, включаючи описане нижче ViTAL, поступово заповнюють цей пробіл.
Мутації BRCA і стан гормональних рецепторів взаємопов’язані. Так, аномалії типу gBRCA мають до 23% пацієнтів із потрійно негативним (ПН) РГЗ і приблизно 5% — із HR+. При цьому особи з аномалією gBRCA1 мають більшу ймовірність розвитку потрійного негативного РГЗ, тоді як з gBRCA2 — гормонопозитивного (HR+) РГЗ [5].
Для клітин із патогенними мутаціями в генах BRCA 1/2 характерним є дефіцит механізму відновлення дволанцюгового розриву ДНК (шляхом гомологічної рекомбінації), внаслідок чого наступає значна залежність від шляху відновлення одноланцюгового розриву, який регулюється ферментом полі(аденозиндифосфат-рибоза)полімеразою (Polyadenosine 5′-diphosphoribose — PARP). Тому інгібування PARP у клітинах з мутацією BRCA1/2 спричиняє їх загибель внаслідок накопичення незворотних пошкоджень ДНК [10].
Наявність мутацій gBRCA 1/2 пов’язана з більш молодим віком при встановленні діагнозу, агресивним перебігом захворювання та вищим ризиком його рецидиву [11]. Донедавна основою лікування пацієнтів із ПНРГЗ та мутацією gBRCA була хіміотерапія, тоді як при HR+ пухлинах із мутацією gBRCA — гормональна терапія [12]. Однак, незважаючи на агресивне лікування, у багатьох пацієнтів виявляють рецидив або віддалені метастази уже при початковому діагнозі. Отже, доступність ефективних пероральних лікарських засобів, направлених на інгібування PARP, є надзвичайно важливою з огляду на незадоволену потребу у варіантах терапії при наявності мутацій gBRCA 1/2 [5].
Так, тест на gBRCA, який має встановлену прогностичну роль в оцінці ризику РГЗ, може бути використаний для планування терапії. Зокрема, рекомендації Європейського товариства медичної онкології (European Society for Medical Oncology — ESMO) щодо мРГЗ передбачають врахування статусу gBRCA1/2 у пацієнтів із HER2-негативним захворюванням [13]. Також тестування для планування терапії підтримано в оновлених рекомендаціях щодо РГЗ Національної загальної онкологічної мережі, США (National Comprehensive Cancer Network — NCCN) [14].
Пропоновані стратегії щодо виявлення мутацій gBRCA та терапії інгібіторами PARP у пацієнтів з HER2-негативним РГЗ наведено в рис. 1.
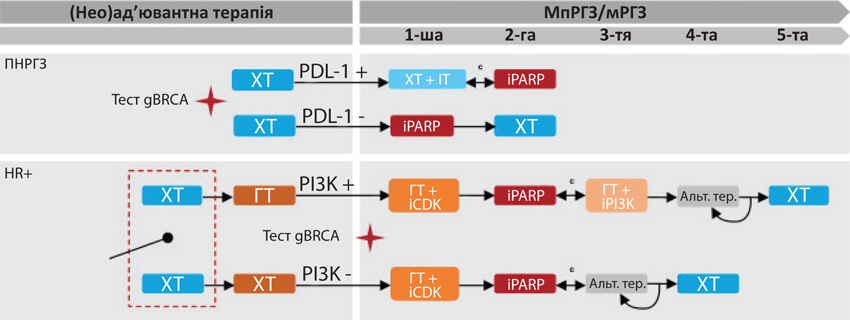
Інгібітори PARP
У 2018–2019 рр. в США (в Україні у 2020 та 2021 рр. відповідно) зареєстровано 2 інгібітори PARP для лікування дорослих пацієнтів із патогенною або умовно патогенною мутацією gBRCA при HER2-негативному РГЗ — олапариб і талазопаріб. Відмінності між цими препаратами включають активність захоплення PARP і деякі особливості профілів безпеки.
Зокрема, талазопаріб (препарат Талзенна, що представляє компанія «Пфайзер») — це інгібітор PARP, схвалений для лікування дорослих з HER2-негативним мпРГЗ або мРГЗ за наявності патогенної або умовно-патогенної мутації gBRCA (табл. 1). Доклінічні дослідження свідчать, що талазопаріб є дуже потужним інгібітором PARP із сильним каталітичним інгібуванням та активністю захоплення PARP приблизно в 100 разів вищою, ніж у інших інгібіторів PARP [15]. Для відбору пацієнтів, яким буде призначено лікування РГЗ препаратом талазопарібу, необхідно проводити виявлення патогенної або умовно-патогенної мутації gBRCA у лабораторії з відповідним досвідом та використанням валідованого методу.
|
Назви діючої речовини та препарату |
Талазопарібу тозилат, Талзенна (Talzenna) |
|
Фармакотерапевтична група |
Інші антинеопластичні засоби. Код АТХ L01X X60 |
|
Механізм дії |
Інгібітори PARP1 і PARP2, які відіграють роль у відновленні ДНК |
|
Фармакодинаміка |
Селективна протипухлинна активність щодо клітин з дефіцитом BRCA1 або BRCA2 |
|
Фармакокінетика |
Лінійна; концентрація в плазмі крові максимальна через 1–2 год; досягає рівноважного стану протягом 2–3 тиж |
|
Найчастіша побічна реакція |
Анемія |
Рекомендована доза препарату талазопарібу становить 1 мг перорально 1 раз на добу разом із їжею або окремо. Для зниження дози доступні капсули по 0,25 мг. Терапію слід продовжувати до прогресування захворювання або неприйнятної токсичності.
Талазопаріб є потужним інгібітором PARP (зокрема PARP-1 і -2). In vitro спорідненість зв’язування талазопарібу з ізоформами PARP-1 і -2 була подібною (1,2 і 0,9 нмоль/л). Крім того, концентрація, при якій відбувалося 50% неінгібування PARP-1, була більш ніж у 3 рази нижчою для талазопарібу порівняно з інгібіторами PARP олапарибом, рукапарибом і веліпарибом (0,57 проти 1,94, 1,98 і 4,73 нмоль/л відповідно). У концентрації 10 мкмоль/л талазопаріб не стимулював і не інгібував жодних інших досліджуваних рецепторів, іонних каналів або ферментів [16].
Талазопаріб чинив селективну протипухлинну дію in vitro, спрямовану на пухлинні клітини з мутаціями BRCA1, BRCA2 із ефективністю, що у 20–200 разів вища порівняно із олапарибом, рукапарибом і веліпарибом [17].
Клінічні дослідження талазопарібу
У дослідженні І фази монотерапія талазопарібом (1 мг 1 р/добу) сприяла частоті об’єктивної відповіді у 50% та клінічної користі (відсоток пацієнтів, які досягли повної, часткової відповіді або принаймні стабілізації захворювання) на рівні 86% через 24 тиж у 18 пацієнтів із мутацією BRCA1/2 (gBRCA), пов’язаною з прогресуючою формою РГЗ. Найпоширенішими побічними явищами, пов’язаними з талазопарібом, були анемія, тромбоцитопенія й легка та помірна втома [18].
У дослідженні ІІ фази ABRAZO (ClinicalTrials.gov, NCT02034916) талазопаріб також виявив протипухлинну активність у 2 когортах пацієнтів із метастатичним РГЗ та мутацією gBRCA: частота об’єктивної відповіді становила 21% у пацієнтів, у яких раніше зафіксовано відповідь на хіміотерапію препаратами платини, і 37% у пацієнтів, які раніше отримували 3 або більше ліній хіміотерапії поширеного РГЗ, окрім препаратів платини [19].
За результатами дослідження III фази EMBRACA (NCT01945775) встановлено, що лікування талазопарібом порівняно з протокольною неспецифічною монохіміотерапією на основі платини за вибором лікаря (тобто капецитабін, ерибулін, гемцитабін або вінорельбін) забезпечує статистично значуще збільшення виживаності без прогресування (ВБП) на тлі застосування талазопарібу (медіана ВБП становила 8,6 проти 5,6 міс у групах талазопарібу та контролю відповідно; відношення ризиків (ВР) 0,54; 95% довірчий інтервал (ДІ) 0,41–0,71; p<0,001)) і значно вищу частоту об’єктивної відповіді (ЧОВ) (62,6% проти 27,2%; ВР 5,0; 95% ДІ 2,9–8,8; p<0,001). Медіана тривалості відповіді на терапію у групі талазопарібу становила 6,9 міс, тоді як у групі монохіміотерапії цей показник зафіксовано на рівні 3,9 міс.
Останнім часом кілька дослідників повідомили про характеристики пацієнтів, схеми лікування та його результати у пацієнтів із поширеним РГЗ, які приймали талазопаріб, у реальних умовах у Франції [20, 21], Туреччині [22] та США [23, 24].
Дослідження ViTAL
1-м із досліджень за реальними даними стало ViTAL — амбіспективне (ретроспективний аналіз проспективної бази даних) багатоцентрове поздовжнє дослідження, метою якого є вивчення ефективності та безпеки талазопарібу в реальних умовах серед пацієнтів із місцево-поширеним або метастатичним HER2-РГЗ із sBRCA або gBRCA. Це дослідження охоплює 2 когорти:
1) пацієнти, включені до французької програми раннього доступу з листопада 2018 р. до вересня 2019 р. [20];
2) пацієнти, які отримували лікування відповідно до короткої характеристики продукту (Summary of Product Characteristics) після початку маркетингу препарату з грудня 2019 до жовтня 2021 р. [21].
Первинною кінцевою точкою була медіана часу до невдачі лікування (ЧНЛ) талазопарібом, визначеного як «час між датою першої та останньої дози або смерті».
Вторинними кінцевими точками були:
- безпека талазопарібу;
- ЧНЛ наступною терапією;
- ЗВ;
- тривалість контролю метастазів у центральну нервову систему (ЦНС) та час до їх місцевого лікування для пацієнтів із метастазами у ЦНС при включенні;
- задоволення пацієнтів лікуванням талазопарібом, оцінене за допомогою Анкети задоволеності терапією раку (Сancer therapy satisfaction questionnaire) на 3-му та 6-му міс.
Зроблено висновок, що значення первинної кінцевої точки у дослідженні ViTAL узгоджується з результатами дослідження EMBRACA (табл. 2). Так, медіана ЧНЛ для талазопарібу становила 8,6 міс у пацієнтів 1-ї та 9,1 міс — 2-ї когорти (рис. 2). Після припинення лікування 83% пацієнтів 1-ї когорти отримували наступне лікування з ЧНЛ 2,4 міс (95% ДІ 1,7–3,3). У 2-й когорті ці показники становили 69% та 3,9 міс (95% ДІ 2,1–4,7) відповідно. Найпоширенішими наступними методами лікування були неплатинова (63%; 67%) і платинова терапія (23%; 6%) у 1-й та 2-й когортах відповідно.
|
Ознака |
EMBRACA |
ViTAL, когорта 1 |
ViTAL, когорта 2 |
Турція, ранній доступ |
США |
|
Кількість учасників, що отримували талазопаріб |
287 |
86 |
80 |
47 |
84 |
|
Медіана віку (років) |
45 |
51 |
51 |
42 |
61 |
|
ПН |
45% |
47% |
35% |
36% |
64% |
|
Гормонопозитивний |
55% |
53% |
65% |
64% |
36% |
|
BRCA-1 |
46% |
48% |
64% |
38% |
64% |
|
BRCA-2 |
54% |
52% |
32% |
45% |
36% |
|
gBRCA |
100% |
94% |
– |
– |
100% |
|
ECOG PS 0 або 1 |
97,6 |
94% |
85% |
– |
70% |
|
Медіана ЧНЛ або рВБП (міс) |
8,6 (рВБП) |
8,6 (ЧНЛ) |
9,1 (ЧНЛ) |
6,5 (рВБП, усі учасники); 9,9 (рВБП, 1–3-тя лінії) |
8,5 (ЧНЛ) 8,7 (рВБП) |
|
Раніше отримали 1–3-тю, тільки 1-шу або ≥2 ліній хіміотерапії |
37% (1-шу) 61% (1–3-тю) |
33% (1-шу) 52% (≥2) |
36% (1-шу) 26% (≥2) |
49% (1–3-тю); 51% (≥4) |
89% (1–3-тю) |
|
Не отримували хіміотерапії |
39% |
15% |
38% |
0 |
0 |
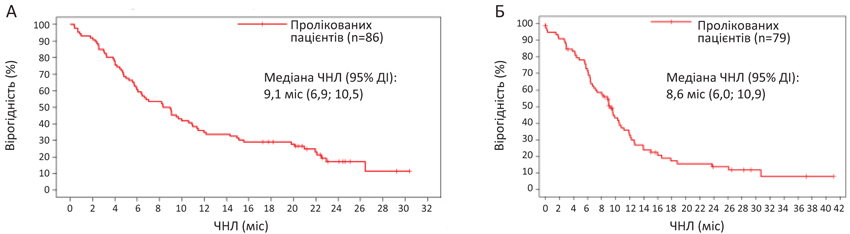
Результати ViTAL в обох когортах відповідають таким, виявленим у дослідженні EMBRACA. Зокрема, у обох когортах:
- чим раніше розпочато лікування талазопарібом, тим вищою встановлено його активність;
- пацієнти із BRCA2 отримали більше користі, ніж із BRCA1;
- у частини пацієнтів із ПНРГЗ відповідь зберігалася протягом тривалого часу.
Так, у 1-й когорті 35% пацієнтів продовжували застосовувати талазопаріб через 12 міс після початку лікування. Також суттєво, що у 5 пацієнтів з мутацією sBRCA медіана ЧНЛ становила 9,1 міс [20].
Що стосується безпеки, 69 із 86 пацієнтів 1-ї когорти (80%) зазнали остаточного припинення лікування талазопарібом через прогресування захворювання (87%), токсичність (7%), смерть, пов’язану з раком (3%), або з інших причин (1,5%). Принаймні одне побічне явище (ПЯ) зареєстроване у 71% пацієнтів. Гематологічні ПЯ (будь-якого ступеня тяжкості) виявляли у 44% пацієнтів (анемію — у 26%, тромбоцитопенію — у 10%, нейтропенію — у 8%). Найпоширенішими негематологічними ПЯ були алопеція (6%) і астенія (5%). Пов’язані серйозні гематологічні ПЯ виникли у 8% пацієнтів, зокрема анемія — у 7%. Супутні серйозні негематологічні побічні ефекти (блювання, пієлонефрит) зафіксовані у 2% пацієнтів. Побічні ефекти, пов’язані з тимчасовим припиненням, модифікацією дози та остаточним припиненням прийому препарату, виникли у 38, 21 та 7% пацієнтів відповідно [20].
У 2-й когорті по меншій мірі 1 ПЯ зафіксоване у 74% пацієнтів: 41% — анемія, 19% — нейтропенія, 15% — тромбоцитопенія, 25% — астенія, 19% — нудота, 11% — діарея, по 10% — головний біль та втома. Серйозні ПЯ, пов’язані з лікуванням, встановлені у 9% пацієнтів, зокрема анемія у 3% та тромбоцитопенія — у 4%. Модифікацію дози, тимчасове або постійне переривання лікування внаслідок непереносимості талазопарібу застосували у 33, 38 та 6% відповідно [21].
Турецьке дослідження
10,6% пацієнтів досягли повної відповіді на терапію під час дослідження за реальними даними в Туреччині [22]. Важливо, що серед його учасників більше половини отримували лікування талазопарібом в якості терапії 4-ї та наступних ліній. Медіана реальної ВБП (рВБП) у всіх учасників була нижчою, ніж у дослідженнях EMBRACA та ViTAL, і становила 6,5 міс. Між тим серед тих, хто отримував талазопаріб в якості 1–3-ї ліній терапії, медіана рВБП була порівнянною із такою у EMBRACA та ViTAL — 9,9 міс. Частота об’єктивної відповіді (objective response rate — ORR) становила 31,9%, а контролю захворювання — 61,7%. Більше користі в цьому дослідженні, на відміну від ViTAL, отримали пацієнти з BRCA1 (ВБП 12,6 міс), ніж із BRCA2 (5,1 міс).
Принаймні 1 ПЯ виявлено у 61,7% пацієнтів, а токсичність 3–4-го ступеня — у 14 (29,8%). Найбільш поширеним ПЯ була гематологічна цитотоксичність.
Дані з США
У дослідженні за реальними даними з США пацієнти були старшими за віком (середній вік на початку лікування талазопарібом становив 62 проти 45 років у EMBRACA), мали гірший статус (2 та більше бали за ECOG на початку лікування талазопарібом мали 29,8% учасників проти 2,1% у EMBRACA) [23, 25]. Також більша частка учасників отримувала талазопаріб у пізніших лініях терапії (45,2% пацієнтів в американському дослідженні — у межах 3-ї або 4-ї ліній, тоді як у EMBRACA таких було 3,8%).
Незважаючи на ці відмінності, медіана ВБП і ЧОВ, що зафіксовані для цієї реальної когорти в США, узгоджувалися з даними для пацієнтів у групі талазопарібу дослідження EMBRACA. Медіана ВБП талазопарібу серед реальних пацієнтів у США становила 8,5 міс, а ЧОВ — 63,1%; у пацієнтів EMBRACA медіана ВБП для талазопарібу становила 8,6 міс, а ЧОВ — 62,6% (рис. 3). Медіана ЗВ 11,6 міс від початку прийому талазопарібу, що зафіксована в цьому реальному дослідженні, була нижчою, ніж медіана ЗВ 19,3 міс, що встановлена в дослідженні EMBRACA. Однак і пацієнти в дослідженні за реальними даними були старшого віку та з гіршим функціональним статусом.
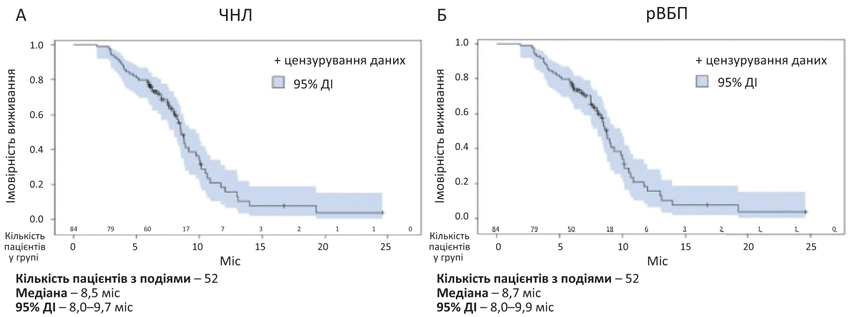
Помітні відмінності між цим реальним дослідженням і EMBRACA встановлені також щодо частоти переливання компонентів крові під час лікування талазопарібом, зниження дози талазопарібу або припинення його прийому. Серед пацієнтів, які приймали талазопаріб у дослідженні EMBRACA, 39,2%, отримали щонайменше 1 переливання еритроцитів і 3,5% — тромбоцитів; показники в американському дослідженні становили 8,3 і 0,0% відповідно. Зниження дози талазопарібу через побічні ефекти в дослідженні EMBRACA зафіксоване у 53,1 і 62,6% пацієнтів відповідно. У дослідженні, за даними реальної практики з США, 14,3% пацієнтів знизили дозу талазопарібу з будь-якої причини, а 6,0% тимчасово припинили прийом препарату з будь-якої причини. Ці відмінності могли бути результатом вимог протоколу щодо підтримувальної терапії та модифікації дозування відповідно до рівня гемоглобіну в дослідженні EMBRACA, що можуть не відповідати рутинній клінічній практиці в реальних умовах.
Висновки та перспективні напрямки
Терапія інгібіторами PARP є бажаним доповненням до арсеналу лікування пацієнтів з місцево-поширеним або метастатичним HER2-негативним РГЗ з мутацією gBRCA. Пероральний прийом талазопарібу, враховуючи його профіль безпеки та пов’язані показники якості життя, забезпечує ліпші результати порівняно з хіміотерапією і потенційно може покращити прихильність пацієнтів. Найбільш поширені побічні ефекти, які виявлено під час лікування інгібіторами PARP, загалом піддаються лікуванню, але пацієнти повинні перебувати під регулярним наглядом [5].
Майбутні напрямки застосування терапії інгібіторами PARP пов’язані із раннім виявленням соматичних мутацій BRCA та інших, які призводять до дефіциту гомологічного репараційного відновлення в первинних пухлинах і метастазах. Терапія інгібіторами PARP зараз досліджується у пацієнтів з мутаціями гена гомологічної репарації, відмінними від gBRCA, у неоад’ювантних і ад’ювантних умовах [5]. Проте застосування терапії інгібіторами PARP на ранніх стадіях РГЗ та у пацієнтів без мутацій gBRCA потребує підтвердження ефективності у клінічних випробуваннях і ще має отримати ухвалення від регуляторних органів. Посилене виявлення генетичних аномалій на ранніх стадіях захворювання вимагатиме ширшого доступу до тестування, а також перевірки прогностичних моделей. Крім того, враховуючи, що інгібітори імунних контрольних точок, які спрямовані на ліганд програмованої клітинної смерті 1 (PD-L1) і його рецептор, зараз досліджуються в комбінації з інгібіторами PARP у пацієнтів з РГЗ, може бути доцільним додаткове визначення рівнів PD-L1 у пацієнтів. Отже, широке запровадження терапії талазопарібом, імовірно, матиме значні позитивні наслідки для лікування пацієнтів з РГЗ.
Список використаної літератури знаходиться в редакції.
Дар’я Полякова














Leave a comment