Роль мутації Т790М у першій та другій лініях терапії пацієнтів з EGFR-позитивним недрібноклітинним раком легені
Стороженко С.А.1, Шпарик Я.В.2
- 1Медичний дім «Одрекс», м. Одеса
- 2Комунальне некомерційне підприємство Львівської обласної ради «Львівський онкологічний регіональний лікувально-діагностичний центр» м. Львів
Резюме. Рідкісні мутації гена EGFR (epidermal growth factor receptor — рецептора епідермального фактора росту), зокрема інсерції у 20-му екзоні, становлять приблизно 10% від усіх онкогенних EGFR-мутацій недрібноклітинного раку легені (НДРЛ) — аденокарциноми. Мутація Т790М, більш відома як мутація резистентності до інгібіторів тирозинкінази EGFR І–ІІ поколінь, також є інсерцією у 20-му екзоні та іноді (близько 2–4% випадків) може виявлятися de novo у вигляді подвійної мутації. Разом з тим було показано, що при застосуванні ультрачутливих методів генетичної діагностики рівень поширеності подвійних мутацій — Т790М + Del19ex або L858R досягає 79%, що є негативним прогностичним фактором для пацієнтів з НДРЛ. Тому сьогодні виникає питання: якою є роль мутації Т790М у першій та другій лініях терапії при EGFR-позитивному НДРЛ та яким чином наявність подвійних мутацій впливає на вибір лікування пацієнтів з раком легені. При цьому відомо, що інсерції 20-го екзона та Т790М зокрема не чутливі до ІТК EGFR ранніх поколінь. Разом з тим ІТК ІІІ покоління, зокрема осимертиніб, демонструють активність щодо пухлин із цими мутаціями, і тому можуть бути обґрунтованим вибором для терапії пацієнтів з НДРЛ та цими мутаціями.
DOI: 10.32471/clinicaloncology.2663-466X.49-1.30277
Відкриття активуючих мутацій у гені EGFR (epidermal growth factor receptor — рецептор епідермального фактора росту) різко змінило погляд на клінічну картину недрібноклітинного раку легені (НДРЛ). Ранні дослідження інгібіторів тирозинкінази (ІТК) EGFR першого покоління продемонстрували вражаючу ефективність порівняно з попередніми стандартами лікування пацієнтів з НДРЛ на той час — хіміотерапією. Подальша розробка таргетних молекул наступного покоління ще більше підвищила рівень загальної виживаності пацієнтів з EGFR-позитивним НДРЛ — до понад 3 років [1].
Більша частина мутацій EGFR виникає у вигляді делецій у 19-му екзоні (del19ex) і точкових мутацій у 21-му екзоні (L858R). ІТК EGFR першого покоління, такі як ерлотиніб та гефітиніб, демонструють певну ефективність щодо цих двох типів активуючих мутацій, що також можна стверджувати і про ІТК другого та третього поколінь, такі як афатиніб, дакомітиніб та осимертиніб. Розробка методів спрямованої на EGFR терапії, які діють на рівні молекулярних механізмів пригнічення внутрішньоклітинних ферментів, зокрема EGFR-тирозинкіназ, призвело до необхідності визначення відповідних генетичних мутацій. І сьогодні проведення молекулярно-генетичної діагностики та пошук драйверних мутацій різних генів (EGFR, ALK та ін.) є важливою складовою процесу вибору терапії при поширеному НДРЛ. У той час як перші кроки в генетичній діагностиці здійснювалися за допомогою методу полімеразної ланцюгової реакції, який здатний визначати лише обмежений попередньо заданий пул мутацій, зазвичай — поширені класичні мутації, зараз розроблено складніші платформи секвенування як для клінічних, так і для дослідницьких цілей. Розробка сучасних методів секвенування разом із зусиллями дослідників сприяли виявленню широкого спектра активуючих мутацій EGFR, включаючи інсерції у 20-му екзоні EGFR (ins20) та точкові мутації, такі як G719X, S768I, L861Q, серед інших [2].
Мутації ins20 EGFR становлять приблизно 10% усіх онкогенних мутацій EGFR [2, 3] і є третім найпоширенішим класом після класичних мутацій EGFR del19ex і L858R. ins20 представляють собою групу мутацій, що характеризуються дещо відмінною чутливістю до ІТК різних поколінь, однак якщо узагальнювати, то зазвичай вони не чутливі до ІТК EGFR 1-го та 2-го поколінь [3]. Проте в останні роки спостерігається значний прогрес у розробці ефективної таргетної терапії для цих пацієнтів завдяки застосуванню ІТК EGFR ІІІ покоління.
Мутація T790M у 20-му екзоні, більш відома як мутація резистентності до терапії ІТК І покоління, ерлотинібу та гефітинібу. Це пов’язано з тим, що мутація T790M викликає конформаційну зміну кишені аденозинтрифосфату, яка збільшує спорідненість рецептора до його природного субстрату, одночасно зменшуючи його спорідненість і чутливість до терапії ІТК EGFR І покоління, тим самим опосередковуючи резистентність до лікування [4].
Мутація T790M у 20-му екзоні відносно рідко виявляється de novo у вигляді другої (подвійної) мутації [5]. Цікаво, що мутації T790M de novo виникають одночасно з мутаціями L858R приблизно у 80% випадків, а з мутаціями del19ex — лише приблизно у 20% [6]. Можливо, що з цим пов’язана дещо краща чутливість пухлин з мутаціями del19ex порівняно з мутаціями L858R до терапії осимертинібом. Оскільки за результатами клінічного дослідження FLAURA в групі осимертинібу за наявності у пацієнтів del19ex в гені EGFR медіана виживаності без прогресування (ВБП) становила 21,4 міс, тоді як при заміні нуклеотидів у 21-му екзоні (мутація L858R) медіана ВБП досягалася вже через 14,4 міс лікування. Разом із тим справедливим буде відмітити, що статистично значуща перевага осимертинібу перед препаратами групи порівняння — ерлотинібом та гефітинібом — зберігалася незалежно від виду EGFR-мутації [29]. Тому можемо припустити, що «приєднання» мутацій T790M відбувається ще на ранніх етапах розвитку пухлини, але через незначну кількість таких клітин їх неможливо виявити сучасними методами. При застосуванні ІТК 1–2-го поколінь клітини з типовими мутаціями в 19-му та 21-му екзонах гинуть, тоді як клон клітин з мутаціями T790M чисельно збільшується, що призводить до прогресування хвороби і можливості виявлення клітин з такими мутаціями сучасними молекулярно-діагностичними методами.
Мутація T790M de novo є предиктором меншої тривалості відповіді на ІТК EGFR порівняно з пацієнтами без мутації T790M [7, 8]. Крім того, серед T790M-позитивних пацієнтів була більша частка тих, хто ніколи не палив, порівняно з хворими без цієї мутації (83% порівняно з 62%; p=0,047) [9].
Поширеність мутації T790M de novo значно варіює за результатами різних досліджень, що часто пов’язано із чутливістю методів, які було застосовано для її визначення. Наприклад, дослідження IRESSA Pan-Asia Study, у якому для визначення частоти мутації T790M застосовували метод ампліфікованих праймерів (amplification-refractory mutation system — ARMS), виявило наявні раніше мутації T790M у 11 із 261 пацієнта з мутаціями EGFR. Таким чином, рівень мутації T790M de novo становив 4,2% [10]. В іншому дослідженні із застосування методу мас-спектрометрії для визначення мутацій T790M de novo цей показник становив близько 25% пацієнтів [11]. Для хворих із мутацією T790M характерними є менші період часу до прогресування захворювання після лікування ІТК EGFR (медіана 6,3 міс порівняно з 11,5 міс; р <0,001) і загальна виживаність (ЗВ) (медіана 16,1 міс порівняно з 26,5 міс; р=0,065) порівняно з пацієнтами, що не мають мутації T790M.
У цьому контексті варто звернути увагу на те, що клітини пухлини є генетично гетерогенними, даючи початок різним клонам, у рамках яких також можуть відбуватися мутаційні зміни. Відповідно, якщо в ході аналізу зразка пухлини було виявлено наявність генетичного матеріалу з T790M-мутаціями і пацієнта було віднесено до групи T790M-позитивних, це не означає, що всі клітини пухлини цього хворого мають таку мутацію. За рівнем поширеності мутації T790M у біологічному матеріалі, отриманому в ході біопсії, виділяють пацієнтів з низькою та високою частотою мутації T790M — до або понад 28,1% Т790М-позитивних клітин відповідно. Цей поділ ґрунтується на клінічних результатах лікування таких осіб. Відповідно, хворі з високою частотою мутації T790M мають гірші клінічні результати при застосуванні ІТК EGFR, ніж пацієнти з низькою частотою мутації T790M. Зокрема, серед T790M-позитивних хворих особи з високою частотою T790M мають менший час до прогресування захворювання порівняно з хворими з низькою частотою T790M (медіана 2,4 міс порівняно з 6,7 міс; р=0,009) і ЗВ (медіана 9,1 міс порівняно з 18,7 міс; р=0,018). Варто відмітити, що частота мутації T790M, за якої ризик прогресування захворювання на фоні терапії ІТК EGFR починає зростати, оцінюється на рівні 3,2% клітин у досліджуваному зразку.
Що стосується стратегій виявлення, то T790M може потребувати більш чутливих методів визначення у зв’язку з низьким вмістом мутованих алелів або низькою якістю зразка. Важливо відзначити цікаве спостереження: згідно з даними літератури, використання низькочутливих методів молекулярної діагностики не дозволяє виявити мутацію Т790М de novo одночасно зі стандартною мутацією (найчастіше це мутація L858R), проте у разі використання ультрачутливої діагностики ця мутація виявляється у близько 79% випадків порівняно із 7% при низькочутливих методах [12, 13]. Таким чином, справжня поширеність мутації T790M de novo була недооцінена. Потрібні дослідження з використанням високочутливих методів, щоб з’ясувати, чи буде клінічний результат лікування пацієнтів з НДРЛ та мутацією L858R відрізнятися від такого без другорядного субклону T790M. Тестування на наявність T790M у пацієнтів нелікованих ІТК EGFR, особливо у хворих з мутацією L858R, може допомогти у прийнятті рішення щодо лікування, наприклад, щодо використання ІТК ІІІ покоління [14] як терапії першої лінії чи рятівної терапії замість ІТК І–ІІ покоління.
З іншого боку, виходячи з того, що у 79% випадків у пацієнтів з НДРЛ може бути наявна подвійна мутація, застосування ерлотинібу/гефітинібу в якості першої лінії терапії може суттєво обмежувати ефективність цих препаратів та пояснювати більш швидке прогресування захворювання. Відомо, що набуття мутації T790M є основним механізмом розвитку резистентності до терапії при застосуванні ІТК EGFR І і ІІ поколінь при НДРЛ, що спостерігається у більш ніж половини пацієнтів [15] (рис. 1). Водночас ІТК EGFR ІІІ покоління — осимертиніб — можна вважати препаратом першої лінії для лікування пацієнтів з мутацією T790M de novo. У дослідженні AURA, у якому вивчали вплив осимертинібу в якості першої лінії терапії у пацієнтів з мутаціями EGFR при НДРЛ, 6 із 7 хворих (з мутацією L858R) з de novo T790M продемонстрували часткову відповідь, тривалість відповіді коливалася від 6,9 до 27,7 міс [16]. На противагу цьому в дослідженні IPASS лише 3 (60%) пацієнти з мутацією T790M de novo (з L858R), що отримували гефітиніб — ІТК І покоління — досягли часткової відповіді, 1 (20%) досяг стабілізації захворювання (з делецію в 19-му екзоні), а в 1 (20%) відбулося прогресування захворювання (без додаткових мутацій) [17].
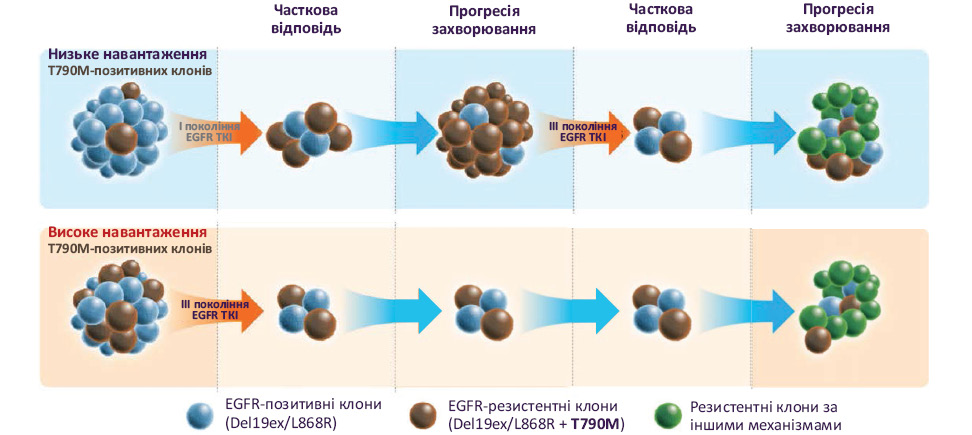
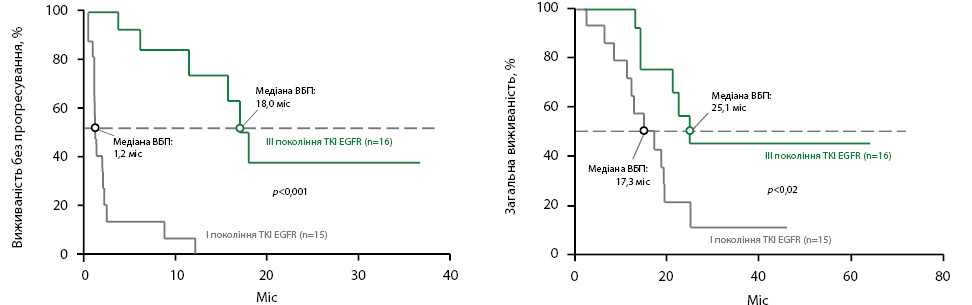
В іншому дослідженні ІТК ІІІ покоління продемонстрували перевагу порівняно з ІТК І покоління щодо ВБП та ЗВ у хворих з мутацією Т790М EGFR de novo [18].Так, медіана ВБП у пацієнтів з НДРЛ та мутацією Т790М EGFR de novo, які отримували осимертиніб, становила 18,0 міс (95% довірчий інтервал (ДІ) 15,1–20,9 міс), що було статистично достовірно значно більше, ніж у хворих, яким призначали ІТК І покоління (1,2 міс, 95% ДІ 0,9–1,6 міс, р <0,001). Подібні результати також спостерігалися щодо ЗВ з 25,1 міс (95% ДІ не піддається обчисленню) у групі осимертинібу та 17,3 міс (95% ДІ 9,3–25,4 міс) у групі ІТК І покоління (р=0,02) [18] (рис. 2).
Таким чином, мутація Т790М насправді наявна у більшості пацієнтів з EGFR-позитивним НДРЛ, навіть якщо її не виявлено за допомогою стандартних методів діагностики ПЛР. Це треба враховувати під час вибору таргетної терапії. У цьому контексті увагу привертає осимертиніб, перевагою якого є більш широкий спектр терапевтичної дії на різні мутації гена EGFR, у тому числі і на інсерції у 20-му екзоні, зокрема Т790М.
Клінічний випадок
Прикладом ефективного застосування осимертинібу у пацієнта з подвійною мутацією є наступний клінічний випадок.
Пацієнт 72 років, мешканець Львова, не курив, після початку війни (березень 2022 р.) з’явилися скарги на незначну загальну слабкість і покашлювання, оцінка за Шкалою функціонального стану Східної об’єднаної онкологічної групи (Eastern Cooperative Oncology Group — ECOG) 0–1.
Комп’ютерна томографія (КТ) трьох зон від 4 квітня 2022 р. показала неоперабельний рак лівої легені — утворення в корені 8×9 см, ураження паратрахеальних лімфовузлів і множинні дисемінати в обох легенях.
Магнітно-резонансна томографія (МРТ) головного мозку від 18 квітня 2022 р. показала наявність 2 утворень 6×7 мм i 5×5 мм у мозочку (безсимптомні).
Бронхоскопію і біопсію пухлини бронха було проведено 5 квітня 2022 р., гістологічний підтип пухлини визначено як аденокарциному.
Хворий готувався до паліативної хіміотерапії з імунотерапією (помірна експресія PD-L1 — 10%), а також стереотаксичного опромінення утворень головного мозку в Польщі. У пацієнта було виявлено подвійну мутацію EGFR — L858R (21-й екзон) та Т790М (20-й екзон), ALK-мутація не спостерігалася.
25 квітня 2022 р. пацієнт розпочав прийом осимертинібу. 24 травня 2022 р. повторна МРТ головного мозку для визначення полів опромінення в Польщі показала повну регресію утворень. Таким чином, у пацієнта були метастази в центральну нервову систему (ЦНС) і їх навіть планували опромінювати, однак на фоні застосування осимертинібу, який проникає через гематоенцефалічний бар’єр, метастази повністю зникли — було зафіксовано повну відповідь у ЦНС. Тож, осимертиніб при метастазах у ЦНС продемонстрував високу ефективність та є безпечнішим варіантом лікування порівняно з опроміненням головного мозку, враховуючи можливі ускладнення останнього.
18 липня 2022 р. контрольна КТ органів грудної клітки і ЦНС показала виражену часткову регресію утворень у легенях, зберігається повна регресія утворень у ЦНС.
30 вересня 2022 р. контрольна KT продемонструвала продовження часткової регpeciї.
Протягом періоду застосування осимертинібу жодних побічних ефектів не зафіксовано.
У квітні 2023 р. за результатами КТ виявлено прогресування захворювання, що стало причиною відміни поточної терапії осимертинібом з подальшим призначенням хіміоімунотерапії з атезолізумабом (+ бевацизумаб) від 21 квітня 2023 р. згідно з рекомендаціями ESMO 2023 [30]. Загальний прийом осимертинібу становив 12 міс.
Роль мутації Т790М EGFR у другій лінії терапії при НДРЛ
Мутація Т790М більш відома як мутація набутої резистентності у відповідь на терапію ITK EGFR І покоління, такими як гефітиніб та ерлотиніб. Часто резистентність до терапії ITK EGFR І покоління розвивається протягом перших ≈10 міс та у більш ніж 50% випадків пояснюється наявністю мутації Т790М [19, 20]. За наявності цієї мутації ІТК III покоління можуть бути ефективною опцією для другої лінії лікування, наприклад осимертиніб, проте перед призначенням необхідно провести генетичне тестування на визначення наявності/відсутності мутації Т790М. Дуже важливо, що без мутації Т790М осимертиніб у другій лінії терапії не застосовується.Разом з тим треба зазначити, що навіть з урахуванням поширеності мутації Т790М на рівні близько 50%, за даними клінічних досліджень та реальної клінічної практики, можливість застосування осимертинібу в другій лінії буде тільки у 30% пацієнтів [21]. Чому так відбувається?
Якщо 10 хворих з мутацією EGFR починають прийом гефітинібу/ерлотинібу/афатинібу чи інших ІТК ранніх поколінь, то з них лише ≈7 взагалі зможуть отримати терапію другої лінії, а інші 3 помирають під час першої лінії або отримують тільки паліативну допомогу у зв’язку з ECOG-статусом та непереносимістю хіміотерапії [22–23]. Із цих 7 тільки 5 зможуть отримати результат тестування, іншим може бути протипоказана ребіопсія, або виникнуть складнощі з проведенням повторної біопсії, або ж вони матимуть недостатню кількість або низьку якість матеріалу та/або отримають хибно-негативний результат аналізу за плазмою крові [24–26]. І тільки приблизно 3 з 5 пацієнтів отримають позитивний результат генетичного аналізу на мутацію Т790М EGFR [19, 20]. Таким чином, лише 3 з 10 хворих матимуть можливість отримати осимертиніб у другій лінії терапії.
Щодо самого аналізу, то також постає питання, який саме аналіз замовляти та який матеріал потрібно відправляти до лабораторії? У цьому контексті варто зазначити, що сьогодні в першу чергу рекомендовано визначати наявність мутації T790M EGFR за плазмою крові (liquid biopsy), і на це є кілька причин. По-перше, пухлина є гетерогенною і при прогресії лише її частина має новий клон клітин з мутацією Т790М. Питання — яка саме чатина має Т790М-позитивні клітини? Тому під час проведення ребіопсії можна просто не потрапити голкою в ту частину пухлини, де знаходяться клітини, що несуть мутацію Т790М (рис. 3).
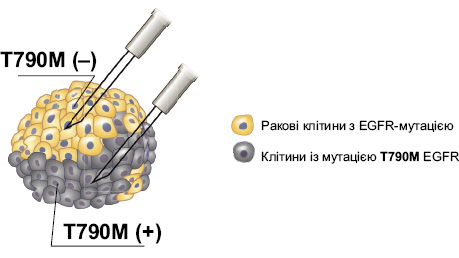
По-друге, на цьому етапі захворювання пацієнти часто мають порушений функціональний статус, що може ускладнювати проведення ребіопсії. Саме тому малоінвазивні методи діагностики є пріоритетнішими. При цьому на останніх стадіях захворювання концентрація пухлинної ДНК, що циркулює в крові, є досить високою, та сучасні набори молекулярно-генетичної діагностики з використанням плазми крові в якості біологічного матеріалу мають досить високу чутливість — виявляють концентрацію у крові <0,1% мутантних копій за семилогарифмічною шкалою розведення, а ефективність становить близько 80% (тобто тільки 20% результатів можуть бути хибно-негативними) [27]. Варто пам’ятати, що у разі отримання негативного результату з використанням плазми крові, згідно з рекомендаціями Європейського товариства медичної онкології (European Society for Medical Oncology — ESMO) та Національної загальної онкологічної мережі (National Comprehensive Cancer Network — NCCN), на наступному етапі необхідно провести дослідження вже з використанням пухлинної тканини. Якщо ж результат, отриманий з використанням плазми крові, є позитивним — пошук закінчено, мутацію виявлено, можна починати лікування.
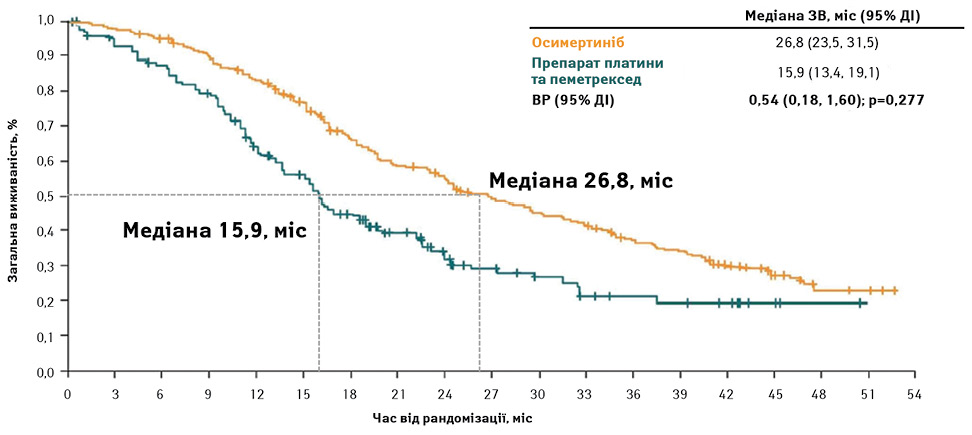
На сьогодні в Україні одним з препаратів, який ефективно пригнічує розростання EGFR-позитивної пухлини з мутацією Т790М, є осимертиніб. У дослідженні AURA3 порівнювали ефективність осимертинібу та терапії препаратом платини і пеметрекседом у пацієнтів з місцево-поширеним або метастатичним НДРЛ після прогресування захворювання під час першої лінії терапії ІТК ЕGFR І або ІІ покоління, зумовленого мутацією Т790М [28]. Відповідно до отриманих результатів медіана ВБП у групі хворих, які отримували осимертиніб, була більш ніж у 2 рази вищою порівняно з групою хіміотерапії. При цьому 86% пацієнтів з групи платини/пеметрекседу переходили на терапію осимертинібом. Медіана часу до наступної терапії в групі платини/пеметрекседу становила 6 міс, у групі осимертинібу — 16 міс. ЗВ в групі, що отримувала осимертиніб, становила 26,8 міс порівняно з 15,9 міс у групі препарату платини та пеметрекседу (рис. 4).
Клінічний випадок С.А. Стороженко
Наш практичний досвід підтверджує ефективність застосування осимертинібу в якості другої лінії терапії у пацієнтів з НДРЛ та мутацією T790M EGFR. Зокрема, хочемо представити клінічний випадок пацієнтки, яка вже майже 3 роки приймає осимертиніб в якості другої лінії терапії, на фоні якої спостерігається позитивна динаміка перебігу пухлинного процесу.
Жінка 47 років (1966 р.н.), що ніколи не палила, захворіла в жовтні 2013 р. Вона звернулася за медичною допомогою зі скаргами на задишку при незначному фізичному навантаженні та кашель. На КТ виявлено вогнища в середній та нижній частці правої легені, ураження плеври. Встановлено морфологічний діагноз — НДРЛ, клінічне стадіювання — Т4N1M0, стадія IIIа. Статус за ECOG — 1.
Пацієнтку було прооперовано 29 січня 2014 р., зокрема, проведено резекцію S 4–5 правої легені, плевродез. Відповідно до гістологічного висновку у хворої було уражено дві крайові ділянки легені, розміри пухлин становили 6×2×0,5 см та 4×1×0 см з вростанням G2–3 аденокарциноми з ураженням плеври.
На наступному етапі протягом 02.2014–06.2014 р. проведено 6 курсів поліхіміотерапії за схемою: цисплатин, паклітаксел, відмічалася позитивна динаміка щодо відповіді на лікування. Далі в період з 08.07.2014 р. до 25.07.2014 р. проведено курс променевої терапії на ділянку пухлини правої легені, лімфовузлів межистіння, регіонарних лімфовузлів — сумарна доза опромінення становила 40 Гр.
У березні 2015 р. зафіксовано прогресування пухлинного процесу в легенях та розвиток плевриту праворуч. 2 квітня 2015 р. було взято плевральну пункцію та проведено евакуацію ексудату. Цитограма дозволила діагностувати аденокарциному. Відповідно, у квітні 2015 р. було призначено 4 курси поліхіміотерапії за схемою: паклітаксел, цисплатин. У результаті досягнуто об’єктивного поліпшення за даними КТ та стабілізації пухлинного процесу.
Останній курс поліхіміотерапії проведено в червні 2015 р., 26 червня 2015 р. — правосторонню відеоторакоскопію та радіочастотну термоабляцію — плевродез.
Майже через пів року пацієнтка звернулася до лікаря зі скаргами на кровохаркання, у зв’язку із чим було виконано ендоваскулярну емболізацію правої бронхіальної артерії. Крім того, на КТ виявлено обструкцію правого бронха пухлиною.
17 грудня 2015 р. проведено трансторакальну радіочастотну абляцію утворення нижньої частки правої легені, а через 5 днів — ендобронхіальну радіочастотну абляцію пухлини правого головного бронха.
У квітні 2016 р. зафіксовано подальше прогресування процесу. 7 квітня 2016 р. виконано правосторонню відеоторакоскопію та радіочастотну абляцію, плевродез. З 4 квітня 2016 р. проведено 6 курсів поліхіміотерапії за схемою карбоплатин, доцетаксел, у результаті чого було досягнуто стабілізації процесу.
У вересні 2016 р. пацієнтка почала застосування ерлотинібу, який приймала протягом 8 міс по 150 мг/добу, на 9-й місяць перейшла на дозу 100 мг у зв’язку з розвитком висипу на шкірі. 1 серпня 2017 р. за даними КТ було зафіксовано стабілізацію процесу. 9 травня 2018 р. у хворої було діагностовано оперізувальний лишай у ділянці правого стегна, у зв’язку із чим протягом 1 міс вона не приймала ерлотиніб. Згідно з результатами КТ 3 липня 2018 р. було відмічено позитивну динаміку перебігу захворювання, а 7 лютого 2019 р. — стабілізацію процесу
12 лютого 2019 р. виявлено прогресування процесу в черевній порожнині — ураження яєчників, канцероматоз, вільна рідина в черевній порожнині. 26 лютого 2019 р. було виконано оперативне втручання — пангістеректомію, тазову лімфодисекцію та оментектомію. За результатами гістології діагностовано аденокарциному з ураженням цервікального каналу шийки матки, обох яєчників, маткових труб, лімфовузлів зліва та справа, великого сальника. Результати імуногістохімії підтвердили, що фенотип процесу відповідає аденокарциномі легені.
У квітні 2019 р. було проведено курс поліхіміотерапії із застосуванням цисплатину та пеметрекседу, який пацієнтка важко перенесла через виражену печінкову токсичність на тлі лікування.
У квітні 2019 р. хворій виконано дослідження на виявлення мутації EGFR Т790М та підтверджено відповідну мутацію. Поряд із цим СА-125 становив 199. Пацієнтці було призначено осимертиніб у дозі 80 мг/добу, який вона приймала з червня 2019 р. У вересні 2019 р. за даними КТ-контролю спостерігалася позитивна динаміка перебігу хвороби. Пацієнтка переносила препарат задовільно, побічних явищ не відзначалося. 10 вересня 2019 р. показник СА-125 знизився до 7,55.
У грудні 2019 р. хвора перервала прийом осимертинібу з фінансових причин.
22 січня 2020 р. було виконано КТ органів грудної клітки, органів черевної порожнини та малого таза, яке підтвердило стабілізацію процесу, при цьому СА-125 був у нормі.
28 травня 2020 р. зафіксовано значне зростання СА-125, яке сягнуло 138,2, а 30 травня 2020 р. підтверджено прогресування процесу за даними КТ. З червня 2020 р. пацієнтка знову почала прийом осимертинібу, через пів року — 12 січня 2021 р. — показник СА-125 був на рівні 5,68. 13 січня 2021 р. контрольна КТ органів грудної клітки, органів черевної порожнини та малого таза продемонструвала позитивну динаміку порівняно з результатами КТ, датованими травнем 2020 р.
8 вересня 2021 р. за результатами дослідження СА-125 становив 21,2, а 22 вересня 2021 р. було підтверджено стабілізацію процесу за даними КТ. Показник СА-125 знаходився на рівні 15 у листопаді 2021 р., 7,5 у лютому 2022 р. та 6,9 у вересні 2022 р. За даними КТ станом на 19 квітня 2022 р. відмічалася позитивна динаміка. Таким чином, загальна тривалість лікування пацієнтки становила 9 років 7 міс, з них з червня 2019 до травня 2023 р. вона приймає осимертиніб.
Таким чином, осимертиніб є важливою терапевтичною альтернативою для пацієнтів з НДРЛ та мутацією Т790М у 20-му екзоні ЕGFR, як такою, що утворилася de novo, так і набутою на фоні терапії ІТК ЕGFR ранніх поколінь.
Список використаної літератури
1. Meador, C. B., Sequist, L. V., & Piotrowska, Z. (2021). Targeting EGFR Exon 20 Insertions in Non-Small Cell Lung Cancer: Recent Advances and Clinical Updates. Cancer discovery, 11(9), 2145–2157. doi.org/10.1158/2159-8290.CD-21-0226.
2. Riess, J. W., Gandara, D. R., Frampton, G. M., Madison, R., Peled, N., Bufill, J. A., … Schrock, A. B. (2018). Diverse EGFR exon 20 insertions and co-occurring molecular alterations identified by comprehensive genomic profiling of NSCLC. Journal of Thoracic Oncology, 13(10), 1560–1568.
3. Arcila, M. E., Nafa, K., Chaft, J. E., Rekhtman, N., Lau, C., Reva, B. A., … Ladanyi, M. (2013). EGFR exon 20 insertion mutations in lung adenocarcinomas: prevalence, molecular heterogeneity, and clinicopathologic characteristics. Molecular cancer therapeutics, 12(2), 220–229.
4. Yun, C. H., Mengwasser, K. E., Toms, A. V., Woo, M. S., Greulich, H., Wong, K. K., … Eck, M. J. (2008). The T790M mutation in EGFR kinase causes drug resistance by increasing the affinity for ATP. Proceedings of the National Academy of Sciences, 105(6), 2070–2075.
5. Reguart, N., & Remon, J. (2015). Common EGFR-mutated subgroups (Del19/L858R) in advanced non-small-cell lung cancer: chasing better outcomes with tyrosine kinase inhibitors. Future oncology (London, England), 11(8), 1245–1257. doi.org/10.2217/fon.15.15.
6. Yu, H. A., Arcila, M. E., Hellmann, M. D., Kris, M. G., Ladanyi, M., & Riely, G. J. (2014). Poor response to erlotinib in patients with tumors containing baseline EGFR T790M mutations found by routine clinical molecular testing. Annals of oncology, 25(2), 423–428.
7. Costa, C., Molina, M. A., Drozdowskyj, A., Giménez-Capitán, A., Bertran-Alamillo, J., Karachaliou, N., … Rosell, R. (2014). The Impact of EGFR T790M Mutations and BIM mRNA Expression on Outcome in Patients with EGFR-Mutant NSCLC Treated with Erlotinib or Chemotherapy in the Randomized Phase III EURTAC TrialBIM mRNA Expression and Survival in NSCLC. Clinical Cancer Research, 20(7), 2001–2010.
8. Ding, D., Yu, Y., Li, Z., Niu, X., & Lu, S. (2014). The predictive role of pretreatment epidermal growth factor receptor T790M mutation on the progression-free survival of tyrosine-kinase inhibitor-treated non-small cell lung cancer patients: a meta-analysis. OncoTargets and therapy, 7, 387.
9. Lee, Y. J., Lee, G. K., & Lee, Y. S. (2014). Clinicopathologic features of lung cancer patients harboring de novo EGFR T790M mutation. J. Clin. Oncol. 32(15), Abstract 8075.
10. Fukuoka, M., Wu, Y. L., Thongprasert, S., Sunpaweravong, P., Leong, S.-S., Sriuranpong, V., … Mok, T. S. K. (2011). Biomarker analyses and final overall survival results from a phase III, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS). J Clin Oncol, 29, 2866–2874.
11. Lee, Y., Lee, G. K., Lee, Y. S., Zhang, W., Hwang, J. A., Nam, B. H., … Lee, J. S. (2014). Clinical outcome according to the level of preexisting epidermal growth factor receptor T790M mutation in patients with lung cancer harboring sensitive epidermal growth factor receptor mutations. Cancer, 120(14), 2090–2098.
12. Chen, L. Y., Molina-Vila, M. A., Ruan, S. Y., Su, K. Y., Liao, W. Y., Yu, K. L., … Yang, P. C. (2016). Coexistence of EGFR T790M mutation and common activating mutations in pretreatment non-small cell lung cancer: a systematic review and meta-analysis. Lung cancer, 94, 46–53.
13. Fujita, Y., Suda, K., Kimura, H., Matsumoto, K., Arao, T., Nagai, T., … Nishio, K. (2012). Highly sensitive detection of EGFR T790M mutation using colony hybridization predicts favorable prognosis of patients with lung cancer harboring activating EGFR mutation. Journal of Thoracic Oncology, 7(11), 1640–1644.
14. Finlay, M. R. V., Anderton, M., Ashton, S., Ballard, P., Bethel, P. A., Box, M. R., … Wrigley, G. L. (2014). Discovery of a potent and selective EGFR inhibitor (AZD9291) of both sensitizing and T790M resistance mutations that spares the wild type form of the receptor. J. Med. Chem., 57(20), 8249–8267.
15. Chang, J. W. C., Huang, C. Y., Fang, Y. F., Chang, C. F., Yang, C. T., Kuo, C. H. S., … Wu, C. E. (2022). Epidermal growth factor receptor tyrosine kinase inhibitors for de novo T790M mutation: A retrospective study of 44 patients. Thoracic Cancer, 13, 1888–1897.
16. Ramalingam, S. S., Yang, J. C., Lee, C. K., Kurata, T., Kim, D. W., John, T., … Jänne, P. A. (2018). Osimertinib as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer. J Clin Oncol, 36(9), 841–849.
17. Fukuoka, M., Wu, Y. L., Thongprasert, S., Sunpaweravong, P., Leong, S. S., Sriuranpong, V., … Mok, T. S. (2011). Biomarker analyses and final overall survival results from a phase III, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non–small-cell lung cancer in Asia (IPASS). Journal of clinical oncology, 29(21), 2866–2874.
18. Zhang, B., Xu, J., Zhang, X., Gu, P., Wang, H., Wang, S., … Han, B. (2018). Coexistence of sensitive and resistant epidermal growth factor receptor (EGFR) mutations in pretreatment non-small cell lung cancer (NSCLC) patients: First or third generation tyrosine kinase inhibitors (TKIs)?. Lung Cancer, 117, 27–31.
19. Sun, J. M., Ahn, M. J., Choi, Y. L., Ahn, J. S., & Park, K. (2013). Clinical implications of T790M mutation in patients with acquired resistance to EGFR tyrosine kinase inhibitors. Lung cancer, 82(2), 294–298.
20. Li, W., Ren, S., Li, J., Li, A., Fan, L., Li, X., … Schmid-Bindert, G. (2014). T790M mutation is associated with better efficacy of treatment beyond progression with EGFR-TKI in advanced NSCLC patients. Lung cancer, 84(3), 295–300.
21. Seto, T., Nogami, N., Yamamoto, N., Atagi, S., Tashiro, N., Yoshimura, Y., … Saka, H. (2018). Real-world EGFR T790M testing in advanced non-small-cell lung cancer: a prospective observational study in Japan. Oncology and therapy, 6(2), 203–215.
22. Lee, C. K., Davies, L., Wu, Y. L., Mitsudomi, T., Inoue, A., Rosell, R., … Yang, J. C. H. (2017). Gefitinib or erlotinib vs chemotherapy for EGFR mutation-positive lung cancer: individual patient data meta-analysis of overall survival. JNCI: Journal of the National Cancer Institute, 109(6), djw279.
23. Paz-Ares, L., Tan, E. H., O’Byrne, K., Zhang, L., Hirsh, V., Boyer, M., … Park, K. (2017). Afatinib versus gefitinib in patients with EGFR mutation-positive advanced non-small-cell lung cancer: overall survival data from the phase IIb LUX-Lung 7 trial. Annals of Oncology, 28(2), 270–277.
24. Arcila, M. E., Oxnard, G. R., Nafa, K., Riely, G. J., Solomon, S. B., Zakowski, M. F., … Ladanyi, M. (2011). Rebiopsy of lung cancer patients with acquired resistance to EGFR inhibitors and enhanced detection of the T790M mutation using a locked nucleic acid-based assay. Clinical cancer research : an official journal of the American Association for Cancer Research, 17(5), 1169–1180. doi.org/10.1158/1078-0432.CCR-10-2277.
25. Yoon, H. J., Lee, H. Y., Lee, K. S., Choi, Y. L., Ahn, M. J., Park, K., … Yi, C. A. (2012). Repeat biopsy for mutational analysis of non–small cell lung cancers resistant to previous chemotherapy: adequacy and complications. Radiology, 265(3), 939–948.
26. Oxnard, G. R., Arcila, M. E., Sima, C. S., Riely, G. J., Chmielecki, J., Kris, M. G., … Miller, V. A. (2011). Acquired resistance to EGFR tyrosine kinase inhibitors in EGFR-mutant lung cancer: distinct natural history of patients with tumors harboring the T790M mutation. Clinical cancer research, 17(6), 1616–1622.
27. Jensen, S. G., Epistolio, S., Madsen, C. L., Kyneb, M. H., Riva, A., Paganotti, A., … Frattini, M. (2021). A new sensitive and fast assay for the detection of EGFR mutations in liquid biopsies. PloS one, 16(6), e0253687.
28. John, T., Akamatsu, H., Delmonte, A., Su, W. C., Lee, J. S., Chang, G. C., … Wu, Y. L. (2018). EGFR mutation analysis for prospective patient selection in AURA3 phase III trial of osimertinib versus platinum-pemetrexed in patients with EGFR T790M-positive advanced non-small-cell lung cancer. Lung Cancer, 126, 133–138.
29. Soria, J. C., Ohe, Y., Vansteenkiste, J., Reungwetwattana, T., Chewaskulyong, B., Lee, K. H., … Ramalingam, S. S. (2018). Osimertinib in untreated EGFR-mutated advanced non–small-cell lung cancer. New England journal of medicine, 378(2), 113–125. [Article and supplementary appendix].
30. Hendriks, L. E., Kerr, K. M., Menis, J., Mok, T. S., Nestle, U., Passaro, A., … Reck, M. (2023). Oncogene-addicted metastatic non-small-cell lung cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of Oncology, 34(4), 339–357.














Leave a comment