Гепатоцелюлярна карцинома: епідеміологія, діагностика, лікування
Лукашенко А.В., Пацко В.В., Остапенко Ю.В., Черченко К.Д.
Резюме. Гепатоцелюлярна карцинома (ГЦК) є однією з провідних причин смертності від злоякісних новоутворень. За кілька останніх десятиліть значного прогресу було досягнуто у вивченні епідеміології, факторів ризику та молекулярного профайлу ГЦК. Оновлено підходи до методів профілактики, скринінгу, діагностики та лікування пацієнтів із цією патологією, завдяки чому знижено смертність у багатьох країнах з високим рівнем захворюваності на ГЦК. Тим не менш, захворюваність та смертність продовжують зростати у всьому світі, у більшості випадків діагноз ГЦК встановлюють на пізніх стадіях [1]. У цьому огляді буде висвітлено переваги та загальні перспективи сучасних підходів, які можуть реально вплинути на загальне зниження навантаження ГЦК на соціум у найближчі кілька десятиліть.
Одержано 7.03.2023
Прийнято до друку 20.03.2023
DOI: 10.32471/clinicaloncology.2663-466X.49-1.30217
Епідеміологія
ГЦК становить близько 80% від усіх злоякісних новоутворень печінки [2] та є однією з найпоширеніших причин смерті від онкозахворювань [1]. У 2020 р. у всьому світі було діагностовано 905 700 випадків цієї патології, а 830 200 людей померли від неї [1] (рис. 1, рис. 2).
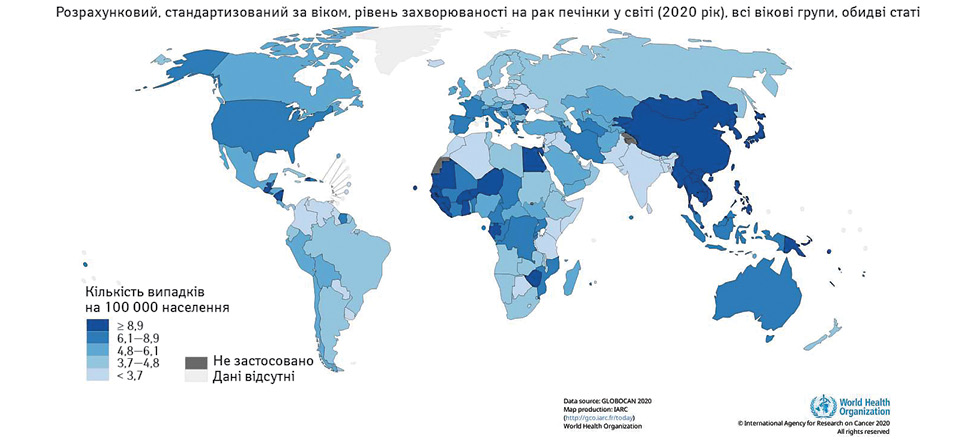
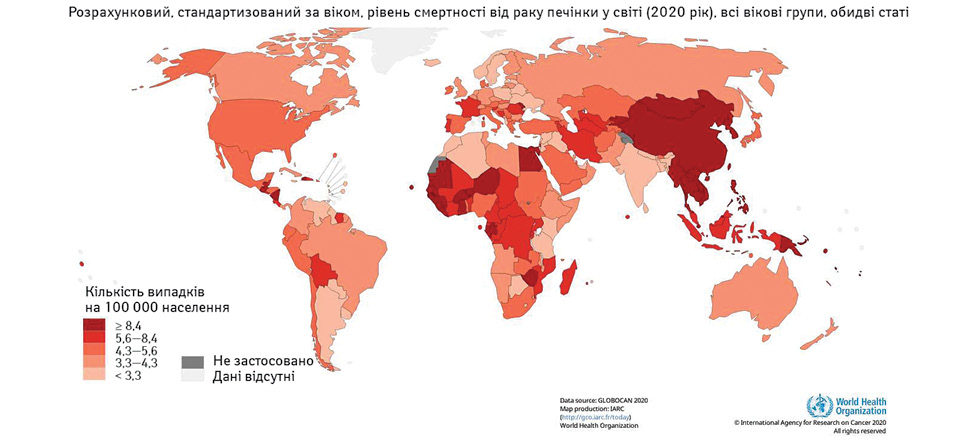
Суттєва варіабельність ГЦК за показниками захворюваності та смертності залежно від географічного регіону спричинена різницею у впливі екологічних та інфекційних факторів ризику, доступності медичної інформації та допомоги, а також можливостях виявлення захворювання на ранній стадії. Майже 85% випадків ГЦК припадає на країни з низьким та середнім рівнем доходу, зокрема Східну Азію та Південну Африку [3, 4]. Тим не менш, тенденції до значного зростання захворюваності на цю патологію спостерігаються в західному світі, країнах Європейського Союзу і США.
 За даними М. Mohammadian та співавторів [5], в Україні діагностують 1700 нових випадків ГЦК щороку, смертність від цієї хвороби становить більше 2200 осіб на рік.
За даними М. Mohammadian та співавторів [5], в Україні діагностують 1700 нових випадків ГЦК щороку, смертність від цієї хвороби становить більше 2200 осіб на рік.
На відміну від багатьох інших злоякісних захворювань, частота яких поступово знижується, кількість випадків ГЦК у всьому світі зростає [1]. Це захворювання займає друге місце після раку легені серед злоякісних новоутворень, що значно зменшують тривалість життя за аналізований період 2005–2015 рр., а саме на 4,6% [3, 4].
Відповідно до стандартизованого за віком показника захворюваності (Age standardized incidence rate — ASIRs), існує глобальна тенденція до повільного зниження захворюваності на ГЦК, починаючи з кінця 1990-х років, проте загальна кількість випадків продовжує збільшуватися паралельно з глобальним зростанням середньої тривалості життя у світі [6].
Якби вікова структура населення у 2015 р. була такою ж, як і у 2005 р., кількість випадків ГЦК становила б на 8% менше у 2015 р. у порівняно з 2005 р.
Частота виникнення цієї патології у США підвищилася у 2–3 рази за останні три десятиліття, що насамперед пов’язано з поширенням інфекції вірусного гепатиту С (ВГС) у когорті осіб, народжених у період 1945–1965 рр., а також зі збільшенням кількості випадків жирової трансформації печінки, викликаної ожирінням, в останні два десятиліття [6].
Вік виникнення ГЦК варіює в різних частинах світу. У Японії, Північній Америці та європейських країнах медіана захворюваності відповідає 60 рокам та старше, на відміну від країн Азії та африканського регіону, де це захворювання діагностують у віковому проміжку 30–60 років [7]. У досліджені BRIDGE за участю 18 031 пацієнта з ГЦК на території 14 країн встановили середній вік виникнення хвороби 69; 65 та 62 роки в Японії, Європі та Північній Америці відповідно, у той час як у Південній Кореї та Китаї її діагностували переважно в 59 та 52 роки відповідно [7]. Достовірних даних щодо населення Африки недостатньо, але територіальне дослідження, опубліковане у 2015 р., показало, що вік виникнення ГЦК у Центральній Африці є значно меншим. Аналіз даних 1552 пацієнтів з 14 медичних центрів у 7 африканських країнах показав медіану діагностування цієї патології в 45 років.
Для ГЦК, спричинених вірусним гепатитом В (ВГВ), середній вік виявлення пухлини становить 32,5–37,6 року [8]. Ранній вік виникнення патології характерний для пацієнтів з Центральної Африки, але також був відмічений під час аналізу даних 59 907 осіб із США за період 2000–2012 рр. Дуже ранній вік (<40 років) розвитку ГЦК максимально асоційований із фактом народження в Західній Африці (скориговане відношення ризиків (СВР) 16,3; 95% довірчий інтервал (ДІ) 9,2–27,9; p <0,01), Центральній/Південній та на інших територіях Африки (СВР 11,0; 95% ДІ 4,5–23,7; p <0,01), Океанії (СВР 4,9; 95% ДІ 2,9–8,0; p <0,01), Східній Африці (СВР 3,5; 95% ДІ 1,5–6,8; p <0,01) [9]. Важливо, що у країнах Західної Африки, що характеризуються найменшим віком виникнення ГЦК, проживає близько 384 млн осіб — майже 30% населення Африки.
Загальна виживаність (ЗВ) пацієнтів із ГЦК варіює досить сильно в різних частинах світу [7, 10]: у Тайвані та Японії вона є набагато більшою, ніж у Центральній Африці, де медіана виживаності становить усього 2,5 міс, що свідчить як про недостатність програм раннього виявлення, так і низьку доступність ефективного лікування [7, 10]. Тайвань та Японія мають найкращі результати лікування пацієнтів з ГЦК, у цих країнах існує розвинена система виявлення груп ризику та регулярне їх обстеження, що включає дослідження онкомаркерів (альфа-фетопротеїн (АФП; alpha fetoprotein — AFP), AFP-L3, дес-гама-карбокси-протромбін (des-gamma-carboxy prothrombin — DCP)) та якісне ультразвукове дослідження печінки для визначення ранніх вогнищевих змін [11]. Отже, >70% хворих на ГЦК, діагностовану в різних медичних центрах цих країн, підлягають радикальному лікуванню. Прогноз для пацієнтів із цією патологією в Південній Кореї, Китаї або Північній Америці, чи Європі є не таким сприятливим, як у Тайвані або Японії, адже у >60% первинних хворих виявляють розповсюджені пухлини [7]. Серед країн Африки найвищі показники ЗВ пацієнтів з ГЦК відмічено в Єгипті. Що чітко пов’язано з нижчим рівнем пізнього діагностування в цій державі — 69% порівняно з 95% в інших африканських країнах (p <0,01), і можливістю в 76% хворих із Єгипту отримувати спеціальне лікування (у порівнянні з 3% в інших африканських країнах, p <0,01).
Фактори ризику
ВГВ, ВГС та цироз печінки. Хронічні ВГВ та ВГС призводять до 80% ГЦК в усьому світі [3, 12]. Хронічна інфекція ВГВ є провідною причиною виникнення ГЦК у державах Східної Азії та більшості африканських країн, за винятком Північної Африки, де серед причин ГЦК превалює ВГС [7, 8]. На сьогодні у близько 257 млн населення світу виявлено хронічний ВГВ, ця хвороба є і буде причиною 20 млн смертей між 2015 та 2030 р., у тому числі внаслідок гострої або хронічної форм ВГВ, що призведе до цирозу печінки та ГЦК, 5 млн смертей будуть спричинені безпосередньо ГЦК [13]. У близько 57 млн людей прогнозовано виникне хронічний ВГС, серед яких у 10–20% розвинуться тяжкі ускладнення, такі як цироз печінки, із декомпенсованою печінковою недостатністю та ГЦК [6, 14]. Вірус гепатиту С — основний чинник виникнення ГЦК у Північній Америці, Європі, Японії, деяких країнах Центральної Азії, включаючи Монголію, Північної Африки, Середнього Сходу, частково в Єгипті [7, 10].
В Україні інфекції, викликані ВГB і ВГC, є одними з ключових проблем охорони здоров’я. Відповідно до даних Центру аналізу захворювань (Center for Disease Analysis Foundation — CDAF), серед дорослого населення кількість інфікованих ВГВ у 2020 р. становила 531 000, а ВГС — 1 342 000 [15], захворюваність є вищою серед чоловіків та осіб літнього віку, основне занепокоєння викликає показник пацієнтів, які отримали специфічне противірусне лікування, він становить менше 1% на рік. Поширеність ВГС і ВГВ є вищою серед груп ризику, таких як люди, які вживають ін’єкційні наркотики (HBsAg — 8,5% і анти-HCV — 56,3%) [16] або мають ВІЛ-інфекцію [17, 18].
У більшості випадків, зокрема у високорозвинених країнах, ГЦК пов’язана із цирозом печінки, що виник внаслідок затяжного хронічного гепатиту після інфікування ВГВ або ВГС. Загалом частота розвитку ГЦК на рік становить 2–5% серед пацієнтів із цирозом печінки, зумовленим ВГВ або ВГС [19]. Однак ГЦК, асоційована із ВГВ, часто виникає і за відсутності цирозу печінки (30–50% випадків в ендемічних осередках, таких як Східна Азія та більшість країн Африки) [10]. На противагу цьому у когортних дослідженнях у США, де інфекція ВГВ не є ендемічною, було показано, що у понад 90% пацієнтів із ГЦК на фоні ВГВ відмічали цироз печінки [20]. Різниця в типі передачі ВГВ, початку та перебігу інфекції та впливах навколишнього середовища може пояснити вищу частоту ГЦК у хворих на ВГВ без цирозу в ендемічних районах поширення ВГВ.
Стеатогепатит та цукровий діабет. Стеатогепатит, або неалкогольна жирова хвороба печінки (НАЖХП), є одним з найбільш поширених захворювань печінки та основним фактором ризику виникнення ГЦК у розвинених країнах [21, 22]. Від 10 до 20% випадків цієї онкопатології у США спричинені НАЖХП [23, 24]. У великих популяційних дослідженнях не було доведено достовірного зв’язку між НАЖХП та ГЦК, проте відмічено зростання ризику виникнення цього онкологічного захворювання у 2,6 раза у пацієнтів з НАЖХП порівняно із загальною популяцією. Цукровий діабет та/або ожиріння також є значними факторами ризику виникнення НАЖХП, яка в подальшому призводить до ГЦК у 37% первинних хворих у США. Виникнення цієї онкопатології в більшості випадків пов’язане з анамнезом хронічної хвороби печінки, НАЖХП-асоційовані ГЦК у порівнянні із ГЦК, спричиненими вірусними гепатитами, частіше виникають у пацієнтів літнього віку, тому варто на це зважати під час інтерпретації досліджень, що включають осіб віком від 65 років, у цій групі може переважати кількість ГЦК, спричинених НАЖХП. НАЖХП-асоційована ГЦК також може виникати за відсутності цирозу печінки [23, 25]. Популяційне дослідження, проведене в Міннесоті, до якого було включено 93 учасники, показало, що у 27% хворих на НАЖХП-асоційовану ГЦК не відмічали цирозу печінки. В іншому дослідженні (Veterans Health Administration study), до якого увійшли 1500 пацієнтів з ГЦК, встановили, що у осіб з НАЖХП-асоційованою ГЦК виявляли 5-кратне підвищення ризику виникнення цієї онкопатології без цирозу печінки порівняно з ГЦК, що була спричинена ВГС [26].
Цукровий діабет підвищує ймовірність виникнення ГЦК у 2–3 рази [19, 27, 28]. Інсулінорезистентність та подальша продукція активних форм кисню спричиняють запальні зміни в паренхімі печінки та запускають механізми канцерогенезу [29–31]. В одному з досліджень було висловлено припущення, що цукровий діабет підвищує ризик ГЦК у пацієнтів із цирозом печінки, однак це потребує подальшого вивчення [19, 28].
Алкоголь. Алкогольний цироз печінки є другою найпоширенішою причиною виникнення ГЦК у пацієнтів у США та Європі [7]. Метааналіз 19 досліджень (n=5650), проведений Світовим фондом дослідження раку (World Cancer Research Fund), показав статистично значуще зростання ймовірності розвитку вказаної патології на 4% за кожні 10 г алкоголю, що вживалися за добу [32]. Однак абсолютний ризик виникнення ГЦК у пацієнтів із цирозом печінки, спричиненим вживанням алкоголю, виявився нижчим, ніж у осіб з вірус-індукованим цирозом [33, 34]. У національному популяційному дослідженні, проведеному в Данії, було виявлено, що кумулятивний 5-річний ризик розвитку ГЦК становить 1,0% (95% ДІ 0,8–1,3%) серед усього населення цієї країни з вперше встановленим діагнозом «цироз печінки, спричинений алкоголем» у період 1993–2005 рр. (n=8482) [34]. Водночас популяційне дослідження за участю 3106 осіб із цирозом печінки, проведене у Сполученому Королівстві в період 1987–2006 рр., показало, що у пацієнтів з алкогольним цирозом печінки відмічали вдвічі нижчий ризик виникнення ГЦК порівняно з хворими з цирозом, спричиненим хронічною вірусною інфекцією [34]. Ретроспективне когортне дослідження, що включало 450 осіб з алкогольним цирозом печінки, продемонструвало, що старший вік (≥55 років) та тромбоцитопенія як ускладнення цирозу (кількість тромбоцитів <125,000 на мм3) можуть бути незалежними факторами підвищеного ризику розвитку ГЦК [35].
Афлатоксин та аристохолієва кислота. Афлотоксин є мікотоксином із сильним гепатокарциногенним ефектом, що уражає багато зернових рослин та олійних культур [36]. Ураження рослин цим токсином значною мірою поширене в ареалах із високим рівнем захворюваності на ГЦК. Наприклад, >90% загального населення деяких країн Західної Африки уражені афлатоксином внаслідок неналежної обробки зерна після збирання, на відміну від мінімального ураження у західних країнах [37]. Провідну роль у печінковому канцерогенезі відіграє афлатоксин В1 (AFB1), що продукується Aspergillus sp. Афлатоксинове навантаження вважається основною причиною раннього початку ГЦК серед населення багатьох країн Субсахарської Африки [12, 36, 38]. AFB1 переважно спричинює мутацію кодону 249 у гені-супресорі пухлинного росту TP53 (АГГ до АГТ), викликаючи заміну аргініну серином (R249S), що рідко спостерігається при інших злоякісних пухлинах [37]. Зміна R249S спостерігається у 50–90% випадків мутацій гена TP53 у регіонах із високим рівнем контакту з афлатоксином і на 6% рідше відмічається у пацієнтів зі США [39, 40].
Підтверджено можливу взаємодію між ВГВ та афлатоксином, що підвищує ризик виникнення ГЦК [41]. Хронічна інфекція ВГВ може запустити шлях метаболізму неактивного AFB1 у мутагенний AFB1-9,9-епоксид цитохромом P459s. Некроз гепатоцитів та регенерація при хронічному ВГВ також підвищують імовірність AFB1-індукованої мутації TP53. На додаток репарація вирізання ядра клітин, що в нормі відповідає за видалення частин ДНК AFB1, пригнічується онкогенним протеїном вірусу гепатиту В [42].
Аристохолієва кислота (АК) — мутагенний компонент, наявний у рослині, відомій як Aristolichia або Asarum (дикий китайський імбир/хвилівник), що росте в дикій природі [43]. Рослини, які містять АК, використовували у традиційній китайській фітотерапії століттями. Сучасні дослідження із застосуванням методу секвенування показали, що значний відсоток ГЦК у пацієнтів з Азії, зокрема Китаю, Тайваню, В’єтнаму та Південної Азії, пов’язаний з вищим рівнем мутацій, викликаних контактом з АК [44, 45]. Тринуклеатидний контекст, характерний для контакту з АК, включає значний пік у 5’-ЦТГ3’ (5’-ЦТГ3’ у комплементарному ланцюзі) [45]. Велике дослідження з використанням гістопрепаратів 1400 пацієнтів з різних регіонів виявило вплив АК у 78% випадків ГЦК в Тайвані, 47% — в Китаї, 29% — в Південній Азії, 13% — у Південній Кореї, 2,7% — у Японії, 4,8% — у Північній Америці та 1,7% — у країнах Європи [45]. Одне дослідження з випадковими зразками ГЦК 200 000 пацієнтів з Тайваню за період 1997–2003 рр. показало, що близько ⅓ населення мало контакт з АК [46]. Дозозалежне відношення між контактом із цією кислотою та ризиком виникнення ГЦК також було доведено у пацієнтів з Тайваню [47].
Інші причини цирозу печінки. Решта хронічних хвороб печінки, таких як захворювання жовчних протоків, генетичні або метаболічні розлади, можуть призводити до цирозу печінки і в подальшому — до виникнення ГЦК, але пропорція цих причин у генезі ГЦК становить від <5% до 10% у всьому світі [12].
Протективні фактори. Кава, статини, метформін та ацетилсаліцилова кислота показали протективний ефект проти розвитку ГЦК за даними багатьох ретроспективних досліджень [48–51]. Хоча щодо жодної із цих речовин його не було доведено у великих рандомізованих дослідженнях, вживання кави наразі рекомендоване Європейською асоціацією з вивчення печінки (European Association for the Study of the Liver — EASL) у клінічних практичних рекомендаціях щодо ГЦК [52].
Фармакологічна супресія вірусу гепатиту В або активності вірусу гепатит С високоефективними противірусними препаратами знижує ризик виникнення ГЦК на 50–80% [53–56]. Ефект спрямованого противірусного лікування (СПЛ) при ВГС став предметом широких дискусій після отримання даних щодо підвищення ризику рецидиву ГЦК у пацієнтів, які отримали СПЛ після завершення радикального лікування на ранніх стадіях ГЦК відповідно до даних чотирьох ретроспективних досліджень у госпіталях Іспанії [57]. Ретроспективне дослідження італійських учених у когортах, що включали 59 пацієнтів з ГЦК, показало схожі результати [58]. Інше ретроспективне випробування підтвердило незначну тенденцію до підвищення ризику рецидиву ГЦК після трансплантації печінки (ТП) у 5 (28%) з 18 хворих, які отримали противірусну терапію з приводу ВГС у порівнянні з 6 (10%) з 63 осіб, що не проходили такого лікування [59]. У ході невеликого одноцентрового дослідження в США було виявлено високий рівень виникнення ГЦК після противірусного лікування в пацієнтів з цирозом печінки, спричиненим вірусом гепатиту С [60]. Однак ряд досліджень показав негативні результати під час спроб довести зв’язок між СПЛ та рецидивом ГЦК [61–63]. Ретроспективне багатоцентрове дослідження, результати якого було опубліковано у 2019 р., включало 793 учасники з ВГС-асоційованою ГЦК, 38% з яких отримували СПЛ, з урахуванням додаткових варіантів, і не показало зв’язку між віддаленими результатами лікування пацієнтів з ГЦК і СПЛ (hazard ratio (HR) 0,90; 95% ДI 0,80–1,16) [63]. Загалом можливість підвищення ризику рецидиву ГЦК внаслідок застосування комплексної противірусної терапії не була підтверджена в багатоцентрових дослідженнях, тим не менше, подальші дослідження мають бути проведені для отримання точної відповіді на питання, чи є зв’язок між противірусною терапією та вірогідністю рецидиву цієї онкопатології.
Хоча асоціація між СПЛ та ризиком рецидивування ГЦК після радикального лікування залишається неясною, успішна противірусна терапія однозначно знижує ризик появи цього онкологічного захворювання de novo [64].
Молекулярні особливості канцерогенезу ГЦК. У ході інтегративних досліджень із секвенування комбінованого екзона, аналізу транскриптонів та ретельної генетичної характеристики ГЦК було виявлено гетерогенність пухлин на гістомолекулярному рівні, різниця в молекулярних особливостях відповідала клінічним даним [65–67]. За результатами одного валідованого аналізу ідентифіковано шість сталих підгруп ГЦК, визначених як G1–G6, що були пов’язані зі специфічними генетичними та клінічними характеристиками [68, 69]. Мутації у промоутері TERT (виявляли у 44–65% пацієнтів ГЦК, відповідає за регуляцію транскрипції каталітичної субодиниці теломерази), CTNNB1 (відмічали у 27–40%, кодує бета-катенін, прото-онкоген у сигнальному шляху WNT) та TP53 (описаний у 21–31% випадків, головний регулятор клітинного циклу) виявлялися найбільш частими [65, 70]. Специфічна клінічна картина цього онкозахворювання може відповідати конкретній генетичній альтерації [70]. Наприклад, промоутер TERT та мутація TP53 пов’язані зі зниженням виживаності [65, 68], трансдуктор інтерлейкіну-6-янус-кінази та активатор транскрипції шляху активації без TERT, CTNNB1 або альтерації шляху ТP53 супроводжують ГЦК, що виникає на фоні стеатогепатиту. Описані інтегровані аналізи підкреслюють молекулярне різноманіття ГЦК, відмінності в етіології та механізмах канцерогенезу [70].
Загалом близько 1/4 ГЦК мають молекулярні або генетичні альтерації, на які потенційно спрямована дія затверджених ліків, підігріваючи інтерес до використання молекулярних «підписів» у розробці таргетних терапевтичних досліджень [66, 71], випробування, у яких проспективно характеризується ГЦК методом секвенування наступного покоління у пацієнтів, що отримали системну терапію, починають показувати взаємодію між альтерацією, різними внутрішньоклітинними сигнальними шляхами та рівнем контролю захворювання у відповідь на специфічні класи системної терапії. Наприклад, у пацієнтів із ГЦК, що отримували лікування інгібіторами імунних мішеней, активація мутацій у сигнальному шляху Wnt/бета-кетаніну була пов’язана з нижчими контролем хвороби та рівнем виживаності [71].
Профілактика та спостереження
Попередження хронічних ВГB та ВГC. Первинна профілактика — важливий і, можливо, єдиний реалістичний підхід для зменшення тягаря ГЦК у країнах з обмеженими ресурсами, де вірусний гепатит є ендемічним, а варіантів лікування для пацієнтів з вірусним гепатитом та ГЦК небагато.
В ендемічних районах ВГВ переважно передається через контакт з інфікованою кров’ю, часто вертикально: від матері до дитини внутрішньоутробно або під час пологів, а також горизонтально — від членів сім’ї до немовлят та дітей [12]. Популяційне дослідження, проведене в Тайвані, показало, що захворюваність на ГЦК була в чотири рази вищою в когорті невакцинованих від ВГВ порівняно з вакцинованими [72]. У дослідженні використовували дані з двох тайванських систем реєстру про пацієнтів віком 6–26 років з діагнозом ГЦК за період 1983–2011 рр. Серед 1509 учасників 1343 були народжені до та 166 після початку програми вакцинації проти ВГВ [72]. Відносний ризик розвитку ГЦК у осіб вікових груп 6–9 років, 10–14 років, 15–19 років та 20–26 років, які були вакциновані, порівняно з тими, хто не отримував вакцину, становив 0,26 (95% ДI 0,17–0,40), 0,34 (95% ДІ 0,25–0,48), 0,37 (95% ДI 0,25–0,51) і 0,42 (95% ДI 0,32–0,56) відповідно [72]. Хоча неонатальна вакцинація від ВГВ доступна і рекомендована в більшості держав, охоплення щепленнями становить лише 40–70% у найбільших і найнаселеніших африканських країнах з високим рівнем захворюваності на ГЦК, що забезпечує чітке вікно можливостей для покращення профілактики [73]. Крім того, доведено, що противірусне лікування вагітних, які мають високе вірусне навантаження ВГВ у ІІІ триместр вагітності, знижує ризик передачі вірусу від матері до дитини, проте ці механізми вертикальної передачі вірусу ще потребують детального вивчення.
Вакцинація в Україні, за даними ВООЗ, має стійку тенденцію до зниження: з 99% у 2004 р. (перша вакцина при народженні) до 49% у 2018 р. [74]. Особливо увагу також слід зосередити на значному, майже вдвічі, зменшенні кількості новонароджених, вакцинованих проти гепатиту В, за останні 10 років (рис. 3).
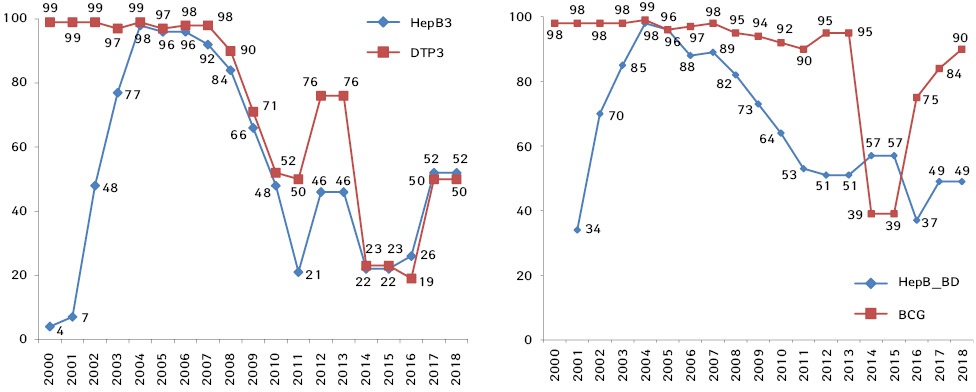
Профілактика ВГС шляхом вакцинації наразі неможлива, але мінімізація передачі вірусного гепатиту через скринінг компонентів крові перед трансфузією, використання одноразових голок та інших витратних матеріалів, а також стерилізація хірургічних та стоматологічних інструментів є ефективними стратегіями з метою зниження ризику ятрогенної передачі ВГВ та ВГС [12, 75, 76].
Скринінг ВГС у США на сьогодні рекомендований для когорти високого ризику — народжених між 1945 та 1965 р. [77]. У той час як популяційний скринінг на ВГВ та ВГС та надання противірусного лікування інфікованим особам у високоендемічних районах наразі відсутні, реалізація стратегії всесвітньої елімінації хронічного вірусного гепатиту до 2030 р. може суттєво полегшити тягар захворювання на ГЦК [54, 55, 78, 79].
Підтримання здорового способу життя
Підтримання здорового способу життя та уникнення факторів ризику розвитку ГЦК є додатковими стратегіями профілактики вказаної онкопатології. Уникнення частого вживання алкоголю та гіперкалорійної дієти, що призводить до ожиріння та метаболічного синдрому, має потенціал до зменшення ушкоджень печінки, пов’язаних з ожирінням, цирозом та, як наслідок, ГЦК [80]. Куріння — встановлений фактор ризику цього онкологічного захворювання, об’єднані дані 14 проспективних досліджень у США показали, що ризик серед осіб, які кинули палити >30 років тому, був майже еквівалентним когорті, що ніколи не курила (СВР 1,09; 95% ДІ 0,74–1,61), відповідно, відмова від паління знижує вірогідність розвитку ГЦК [81].
Зведення до мінімуму впливу афлатоксину, що потрапляє в продукти харчування — вирішальний крок для зниження навантаження від ГЦК в районах з високою захворюваністю. Метааналіз 19 досліджень показав популяційний ризик розвитку ГЦК, пов’язаної з афлатоксином, 17%, що додатково підвищувався в інфікованих ВГВ (21–23%) порівняно із неінфікованими (8–9%) [82]. У дослідженнях, включених до метааналізу, використовували визначення адуктів AFB1-альбуміну, метаболітів афлатоксину в сечі, адуктів AFB1-ДНК та анамнезу харчування: арахісове масло та кукурудза як сурогати афлатоксину. У 2014 р. робоча група Міжнародного агентства з дослідження раку (International Agency for Research on Cancer — IARC) оцінила ефективність різних стратегій втручання для зменшення впливу афлатоксинів на людину [36]. Ці заходи включають відбір генетично стійкого насіння, покращення післязбиральної обробки, первинну профілактику за допомогою ентеросорбентів, що уловлюють мікотоксини, та можливості хіміопрофілактики. Комплекс процедур, застосовуваних після збору врожаю, зокрема, може сприяти помітному зниженню рівня біомаркерів забруднення афлатоксинами у осіб, які беруть участь у цих заходах [83, 84].
Скринінг
Скринінг є стратегією вторинної профілактики для зменшення тягаря ГЦК шляхом раннього виявлення пухлини та, відповідно, раннього лікування. Він показаний пацієнтам із цирозом печінки або хронічною інфекцією ВГВ з ознаками високого ризику. Ці програми рекомендовані для країн Азії, зокрема чоловіків — носіїв ВГВ віком >40 років, жінок-носіїв ВГВ у віці >50 років, носіїв ВГВ із сімейним анамнезом ГЦК, та для країн Африки — представників негроїдної раси з хронічним ВГВ. Згідно з рекомендаціями EASL скринінг ГЦК показаний пацієнтам із хронічним ВГВ та додатковими факторами ризику відповідно до класифікації PAGE-B, що включають вік, стать та показник кількості тромбоцитів [85]. Критерії скринінгу було розроблено для прогнозування 5-річного ризику ГЦК у осіб європеоїдної раси, які отримували ентекавір або тенофовір при хронічному ВГВ. Метааналіз 47 досліджень, які сумарно включали 15 158 пацієнтів, показав ефективність скринінгу ГЦК у покращенні ЗВ у зв’язку з виявленням пухлин на ранній або дуже ранній стадії, коли пацієнти мають можливість потенційно ефективного лікування [52, 85]. Хоча переваги скринінгу визнані клінічною спільнотою та комітетами з написання рекомендацій, Національний інститут раку США (National Cancer Institute — NCI) наголошує на відсутності високоякісних рандомізованих досліджень, у яких було доведено його ефективність у зниженні смертності від ГЦК [86, 87]. Проте великі рандомізовані дослідження скринінгу цієї онкопатології провести досить складно — під час отримання інформованої згоди пацієнти віддають перевагу нагляду [88, 89].
Ультразвукове дослідження (УЗД) печінки — стандартний метод скринінгу ГЦК, що був схвалений Американською асоціацією з вивчення захворювань печінки (American Association for the Study of Liver Diseases — AASLD), EASL та Азійсько-Тихоокеанською асоціацією з вивчення хвороб печінки (Asian Pacific Association for the Study of the Liver — APASL) [52, 85, 90]. Оптимальний інтервал скринінгу має становити 6 міс, виходячи з даних досліджень про середній час подвоєння розмірів вогнища цієї патології (від 3–9 міс). Інтервал спостережень в 6 міс показав однакову ефективність з 3–4-місячними інтервалами і виявився кращим за 12-місячний [91, 92].
Серед онкомаркерів визначення рівня АФП у сироватці крові зазвичай використовується як доповнення до УЗД печінки, хоча рекомендації щодо застосування цього тесту для виявлення ГЦК залишаються відносними у зв’язку з низькою чутливістю (40–60%) і специфічністю (80–90%) за порогового рівня 20 нг/мл [93]. Дослідження за участю 1597 пацієнтів із цирозом печінки з Тайваню показало, що вимірювання рівня АФП на додаток до стандартного УЗД суттєво покращує чутливість скринінгу без суттєвої втрати специфічності. УЗД досягає чутливості 92,0% і специфічності 74,2%, тоді як комбінація УЗД і АФП підвищує чутливість 99,2%, але дещо знижують специфічність — 68,3% за ранньої діагностики ГЦК [93]. Велике популяційне дослідження із залученням 1487 осіб з позитивним поверхневим антигеном гепатиту В (HBsAg) серед місцевих жителів Аляски показало, що скринінг за допомогою лише визначення рівня АФП може виявити більшість ГЦК на резектабельній стадії та значно подовжити тривалість життя, відповідно, тест АФП може бути ефективним методом у випадках, коли УЗД не є широко доступним у зв’язку з обмеженістю ресурсів [94]. Багатоцентрове ретроспективне дослідження, проведене в США, продемонструвало ефективність скринінгу шляхом визначення рівня АФП у пацієнтів із цирозом печінки та вірусним гепатитом за рівня аланінамінотрансферази в межах фізіологічної норми [95]. Загальнонаціональне дослідження реєстру ветеранів у США підтвердило, що використання АФП для виявлення ГЦК є кращим для осіб з низьким рівнем аланінамінотрансферази в сироватці крові, що відповідало незначній вираженості запальних процесів у печінці [96]. Оцінка тенденції до зміни рівня АФП або його стандартного відхилення може підвищити ефективність та розширити показання до застосування тесту АФП у скринінгу ГЦК [97].
Інші онкомаркери, такі як AFP-L3 і DCP, використовували для спостереження за ГЦК в Японії [98, 99]. Також було запропоновано шкалу GALAD, яка розраховується на основі статі, віку, показників AFP-L3, AFP і DCP і зарекомендувала себе як високоточна методика раннього виявлення ГЦК [100, 101]. У 2018 р. багатоцентрове дослідження біомаркерів показало, що GALAD є кращою за УЗД для раннього виявлення вказаної онкопатології [102]. Це дослідження включало загалом 111 пацієнтів з ГЦК і 180 контрольних учасників із цирозом печінки або ВГВ. За порогового рівня –0,76 показник GALAD продемонстрував чутливість 91% і специфічність 85%. Ефективність оцінки за шкалою GALAD слід додатково вивчати в проспективних дослідженнях біомаркерів у порівнянні або в поєднанні з візуалізаційними тестами, у тому числі з оцінкою її економічної ефективності [102]. Шкала GALAD може бути корисним тестом, оскільки показники можна легко розрахувати на основі демографічних даних хворого та вимірювання рівня онкомаркерів з використанням невеликого об’єму периферичної крові. Якщо витрати на тест-системи буде зменшено, шкала GALAD стане ефективним тестом для спостереження в країнах з обмеженими ресурсами, де бракує ультразвукового обладнання та кваліфікованих спеціалістів.
Завдяки розвитку молекулярних технологій і геноміки було показано, що біомаркери раку, що циркулюють у матеріалах рідинної біопсії, такі як мікроРНК, специфічні пептиди, ідентифіковані протеомікою, мутації ДНК і диференціально метильовані ділянки, можуть використовуватися для спостереження та раннього виявлення ГЦК [103–107]. Проте ці показники ще не використовувалися в клінічній практиці.
Хоча переваги скринінгу ГЦК були доведені, необхідна оптимізація заходів для запобігання надмірній діагностиці. Наприклад, для пацієнтів із цирозом печінки і значною печінковою недостатністю (клас С за шкалою Чайлда — П’ю) скринінгові процедури рекомендовані лише у разі потрапляння до листа очікування ТП, оскільки за відсутності можливості трансплантації прогнозована тривалість життя є дуже короткою у зв’язку з високим ризиком смерті внаслідок прогресування печінкової недостатності [52]. Заходи для виявлення ГЦК на ранній стадії у цієї групи хворих є надмірною діагностикою, що може призвести до зайвих процедур обстеження, надмірного лікування, збільшення витрат, несприятливих фізичних наслідків і психологічної шкоди без позитивного впливу на тривалість або якість життя [108, 109].
Діагностика та стадіювання
Неінвазивна рентгенологічна діагностика. Традиційно діагноз ГЦК встановлюють на основі цитологічного або гістологічного дослідження матеріалу біопсії пухлини. Завдяки прогресу в розумінні рентгенологічних особливостей, специфічних для ГЦК, при фазовій судинній перфузії контрасту під час візуалізації поперечних зрізів, отриманих під час комп’ютерної томографії (КТ) та магнітно-резонансної томографії (МРТ), тепер можна надійно встановити діагноз ГЦК у пацієнтів із цирозом печінки, які перебувають під наглядом, без біопсії. У рекомендаціях AASLD та EASL стверджується, що діагноз ГЦК може бути встановлено рентгенологічно, якщо в печінці виявлено нову пухлину розміром ≥1 см, яка демонструє артеріальне гіперпідсилення та венозне «вимивання» в циротичній печінці за допомогою багатофазної контрастної КТ або МРТ [52, 85].
У 2011 р. було представлено систему узагальнених даних зображень печінки (Liver Imaging Reporting and Data System — LI-RADS) для стандартизації звітності та збору даних КТ та МРТ у пацієнтів з ГЦК [110]. Згідно з LI-RADS нові ураження печінки класифікуються на п’ять типів на основі розміру, ступеня інтервалу зростання та характеру контрастного підсилення пухлини [111]. Варто зауважити, що ураження з низьким класом LI-RADS 1–2 також слід ретельно контролювати в подальшому, оскільки система має низьку специфічність для прогнозування доброякісних новоутворень.
Стадіювання. Більшість систем стадіювання ГЦК було розроблено з метою прогнозування подальшого перебігу хвороби, але деякі також пропонують алгоритми лікування [112]. Класифікація Барселонської клініки з лікування раку печінки (Barcelona Clinic Liver Cancer — BCLC) є найбільш часто використовуваною стандартною системою визначення стадії ГЦК і єдиною, ефективність якої було проспективно підтверджено в дослідженнях. Згідно з BCLC виділяють п’ять стадій ЦК, вона надає прогноз середньої тривалості життя та алгоритм вибору методу лікування відповідно до стадії [113, 114]. Один з її недоліків — значна неоднорідність пухлинного навантаження, печінкової недостатності та прогнозу у групах з проміжною (BCLC-В) або поширеною стадією (BCLC-C). Кілька дослідників прагнули удосконалити систему BCLC шляхом підкласифікації стадії B на проміжні етапи. Італійська група з раку печінки (Italian Liver Cancer Group) запропонувала підкласифікацію стадії B на основі шкали Чайлда — П’ю та розповсюдження пухлини (у межах або за межами семи критеріїв) [115, 116]. Японські дослідники запропонували подальшу підкласифікацію стадії B BCLC на основі рівня білірубіну та альбуміну, що є показниками тяжкості печінкової недостатності [117, 118]. Цей підхід ще не отримав широкого застосування в рутинній клінічній практиці, тому необхідна подальша його проспективна перевірка в клінічних дослідженнях.
Гонконзька система визначення стадії раку печінки (Hong Kong Liver Cancer — HKLC) також надає рекомендації щодо лікування на додаток до прогностичної класифікації [119]. Система HKLC класифікує ГЦК на п’ять стадій із дев’ятьма підстадіями, які характеризуються різним середнім часом виживаності на основі відмінностей у розмірі пухлини, наявності судинної інвазії, стадії Чайлда — П’ю та оцінкою за шкалою Східної об’єднаної онкологічної мережі (Eastern Cooperative Oncology Group — ECOG). Декілька досліджень показали, що система визначення стадії HKLC може точно розподілити пацієнтів з ГЦК на різні прогностичні групи [112, 120, 121]. Найважливішим аспектом системи визначення стадії HKLC є розширення критеріїв потенційної терапії для пацієнтів, класифікованих як такі, що мають проміжну стадію ГЦК відповідно до системи BCLC. Загалом ефективність дослідження системи визначення стадій HKLC є багатонадійною, але необхідна подальша перевірка в проспективних випробуваннях.
Щоб звести до мінімуму суб’єктивність моделей виживаності, було запропоновано шкалу MESIAH для амбулаторних пацієнтів із ГЦК [112, 116, 122]. Ця шкала враховує вік, кількість пухлинних вогнищ, розмір найбільшого вогнища, судинну інвазію, наявність метастазів та рівні сироваткового альбуміну та АФП на додаток до оцінки за Моделлю для кінцевої стадії захворювання печінки (Model of End-stage Liver Disease — MELD). У шкалі MESIAH використано критерії MELD для визначення ступеня печінкової недостатності, а не шкалу Чайлда — П’ю, яка може бути дещо суб’єктивною при оцінці печінкової енцефалопатії чи ступеня асциту. Модель MESIAH показала більший дискримінант показника С-статистики — 0,77, порівняно з BCLC (0,71) (p <0,01). Модель була додатково перевірена в азійських та європейських когортах [121–123]. Хоча оцінка MESIAH забезпечує прогнозування, вона не дає рекомендації щодо лікування.
Подібно до моделі MESIAH система визначення стадії BALAD, яка базується на рівнях п’яти сироваткових маркерів (білірубін, альбумін, AFP-L3, АФП і DCP), показала ефективність у прогнозуванні перебігу хвороби [100, 124]. Показники білірубіну і альбуміну відображають тяжкість печінкової недостатності, а AFP-L3, АФП і DCP характеризують пухлинне навантаження і агресивність онкозахворювання [100].
Загалом стадіювання ГЦК за BCLC наразі є найбільш часто використовуваною стандартною системою, єдиною, що має надійну проспективну валідацію, незважаючи на кілька обмежень, описаних вище (рис. 4). Тому її регулярно використовують як основний стратифікувальний фактор у клінічних дослідженнях [125].
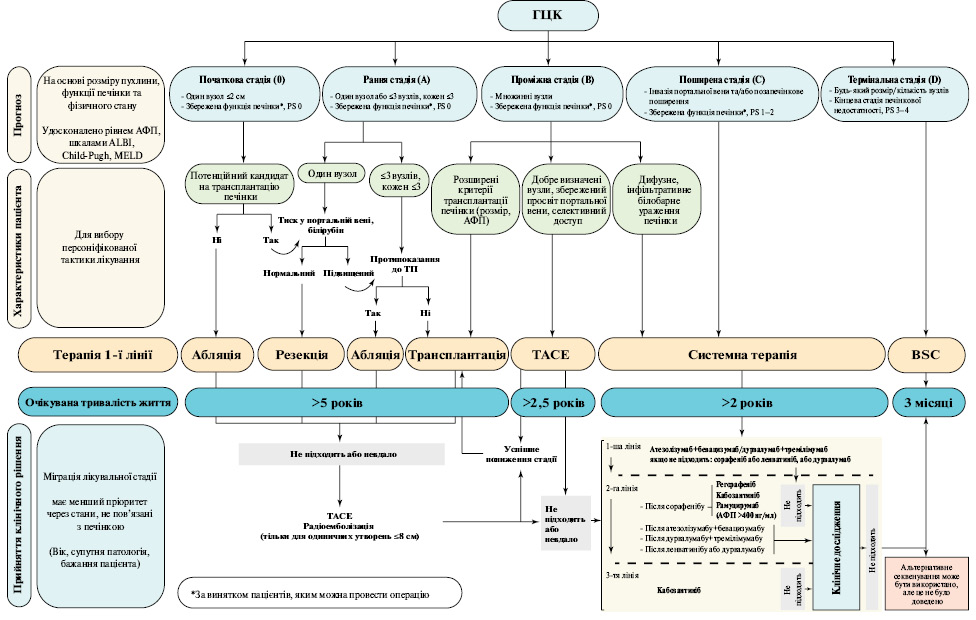
Лікування
Лікування при ГЦК передбачає складний процес прийняття рішень, враховуючи не лише стадію пухлини та супутні захворювання пацієнта, а й тяжкість печінкової недостатності, оскільки більшість методів лікування при цій патології можуть загострити первинне захворювання печінки. Доступність варіантів терапії має значні відмінності в медичних центрах різних країн з різними рівнями досвіду та ресурсів. Таким чином, лікування пацієнтів з ГЦК вимагає залучення міждисциплінарної команди для досягнення найкращого результату [126].
Резекція печінки. Хірургічне видалення є рекомендованим варіантом терапії у пацієнтів з резектабельною ГЦК за відсутності клінічно значущої портальної гіпертензії, яка визначається як градієнт печінкового венозного тиску ≥10 мм рт. ст./мм3 та пов’язана з клінічно значущою спленомегалією [127–129]. Порівняно обмежувальні критерії системи визначення стадій BCLC для рекомендації та призначення лікування були оскаржені. Багаторегіональне когортне дослідження за участю 8656 пацієнтів з ГЦК показало, що у осіб, які не були ідеальними кандидатами для операції за класифікацією BCLC, хірургічна резекція була пов’язана з кращою виживаністю порівняно з емболізацією (СВР 1,4; 95% ДІ 1,3–1,6; p <0,001) [130] або іншим місцевим чи системним лікуванням (СВР 1,8; 95% ДІ 1,4–2,3; p <0,001). Подібним чином багатоцентрове дослідження, проведене в Кореї, продемонструвало, що резекція печінки значно подовжує тривалість життя порівняно з нехірургічним лікуванням у хворих із респектабельною ГЦК стадії B за BCLC [131]. Хірургічну резекцію, яка потенційно може бути застосована в усіх умовах, слід розглядати для вибраних осіб з проміжною або розповсюдженою стадією ГЦК (рис. 5).
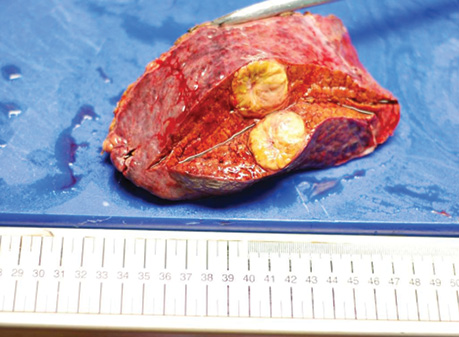
Хірургічна резекція є потенційно лікувальним методом, але майже у 70% пацієнтів після резекції діагностують прогресування хвороби [132]. Одним з важливих моментів операції є отримання гістопатологічного зразка, який може допомогти у прогнозуванні ризику прогресії ГЦК [133]. Група BCLC запропонувала та підтвердила ефективність стратегії «рятувальної трансплантації» після резекції печінки у пацієнтів з післяопераційним гістопатологічним набором даних «високого ризику», що включає мікросудинне розповсюдження пухлини та/або наявність сателітних мікрометастазів [122, 134]. В умовах країн з обмеженими ресурсами паліативне хірургічне втручання може бути важливим лікувальним вибором для хворих із вираженими симптомами та відносно збереженою функцією печінки. Паліативна операція має потенціал для суттєвого зменшення вираженості симптомів, покращення якості життя та деякого подовження медіани тривалості життя [135–137].
Трансплантація. ТП є найбільш радикальним варіантом лікування при ГЦК, оскільки дозволяє видалити як пухлину, так і хвору печінку, яка має обмежену функціональну здатність і потенціал до розвитку додаткових метахронних пухлин у полі циротичної тканини, схильної до канцерогенезу. Оскільки захворюваність на ГЦК зростає, ця хвороба стала основним показанням для ТП у США [138]. ТП — чудовий метод лікування на ранній стадії ГЦК за наявності значної печінкової недостатності, що унеможливлює резекцію печінки. Міланські критерії показань до ТП (одне утворення <5 см або 2–3 утворення <3 см кожне) були вперше встановлені більше двох десятиліть тому для визначення оптимального пухлинного навантаження, для якого у разі ТП можна досягти чудових віддалених результатів, зазвичай 5-річна ЗВ перевищує 70% [139]. Розширені критерії щодо трансплантації було запропоновано, щоб надати можливість проведення ТП пацієнтам, що не відповідають Міланським критеріям, з менш агресивною біологією пухлини, у разі неможливості використання інших методів лікування [140–142]. Серед розширених показань до ТП — критерії Каліфорнійського університету в Сан-Франциско (University of California, San Francisco (одне вогнище до 6,5 см або до трьох вогнищ, найбільше з яких ≤4,5 см, із сумою діаметрів ≤8 см) отримали найбільше визнання та показали відмінні результати після трансплантації. Щоб отримати право на ТП, хворі, які відповідають критеріям Каліфорнійського університету, повинні отримувати місцеву або локальну терапію для зниження стадії ГЦК, аби відповідати міланським критеріям [142–144]. Пухлини, стадію яких було успішно знижено попереднім лікуванням, передбачають сприятливий прогноз, і ці пацієнти мають відмінні віддалені результати після ТП [145, 146]. Ретроспективне багатоцентрове дослідження за участю 187 пацієнтів із ГЦК, у яких застосовували протокол зниження стадії в трьох трансплантаційних центрах у Каліфорнії, показало, що ТП було виконано після успішного зниження стадії 58% пацієнтів, а їх подальша 5-річна виживаність становила 80% [146].
Абляція. Черезшкірна локальна абляція є потенційно радикальним методом лікування пацієнтів з ранньою стадією ГЦК (рис. 6) [147].
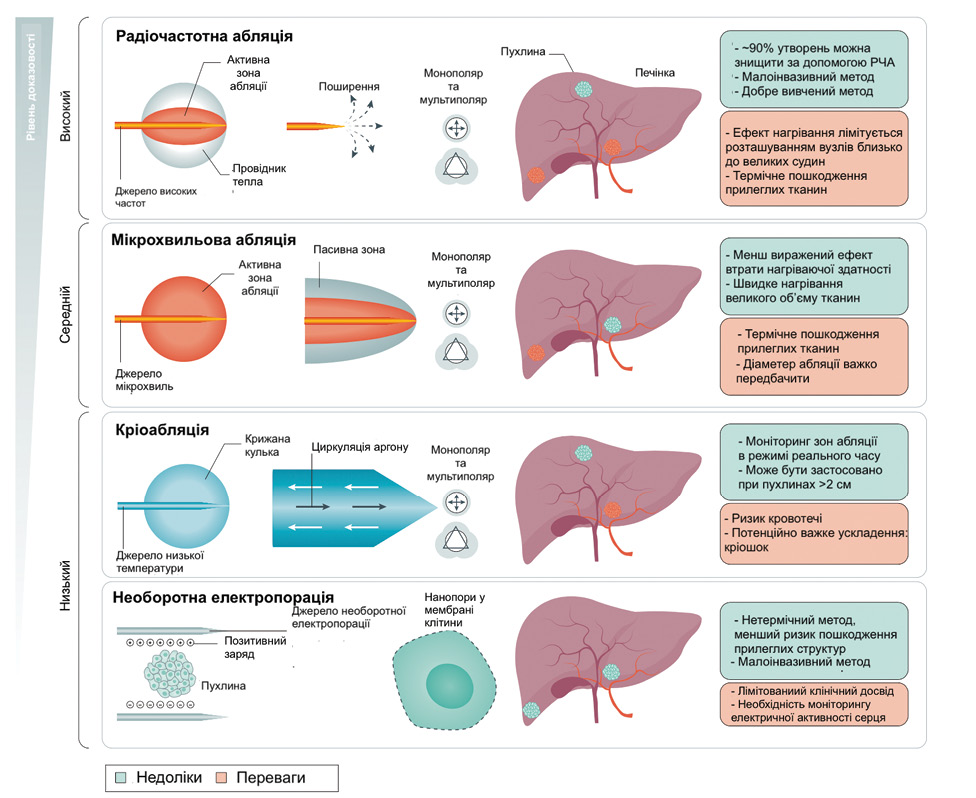
Двома найбільш часто використовуваними методами є радіочастотна та мікрохвильова абляція (рис. 7).
Мікрохвильова абляція набуває все більшої поширеності [148]. Обидва підходи індукують некроз пухлини шляхом доставки високої температури безпосередньо у вогнище ГЦК, але мікрохвильова абляція має деякі переваги перед радіочастотною завдяки вищій термічній ефективності через інший механізм генерації тепла. Мікрохвильова абляція менш сприйнятлива до ефекту тепловідведення від великих судин, прилеглих до пухлини, більш ефективна для абляції більших пухлин розміром 3–4 см і вимагає меншого часу абляції, ніж радіочастотна [149–151]. У рандомізованому контрольованому сліпому дослідженні ІІ фази, проведеному в чотирьох університетських центрах Франції та Швейцарії, порівнювали ефективність мікрохвильової (n=76) з радіочастотною абляцією (n=76) у пацієнтів з ГЦК за умови наявності до 3 вогнищ розміром 4 см або менше, які не підлягали операції. Через 2 роки для 6 (6%) із 98 вогнищ відмічали локальне прогресування пухлини в групі мікрохвильової абляції порівняно з 12 (12%) із 104 у групі радіочастотної абляції (СВР 1,6; 95% ДІ 0,7–3,9; p=0,27). Хоча швидкість локального прогресування була нижчою при мікрохвильовій абляції, вона не досягла статистичної значущості, ймовірно, через недосконалий дизайн дослідження [152]. Черезшкірне введення етанолу у вогнища ГЦК часто використовували в минулому як техніку хімічної абляції та все ще широко застосовують в умовах обмежених ресурсів [12]. Ін’єкція етанолу може бути кращим методом лікування у разі, коли пухлинний вузол прилягає до великих внутрішньопечінкових судин або жовчних протоків, щоб уникнути теплового ураження цих структур радіочастотною або мікрохвильовою енергією. Крім того, було показано, що кріоабляція є такою ж ефективною, як і радіочастотна абляція, її використовують за наявності відповідного обладнання [153–155]. Локальну абляцію зазвичай застосовують у пацієнтів, які не є кандидатами на ТП або хірургічну резекцію у зв’язку із супутніми захворюваннями або печінковою недостатністю. Локальну абляцію також можна використовувати як проміжну терапію у хворих, що очікують на ТП [156]. Найкращий підхід до лікування пацієнтів з невеликими пухлинами, які підходять як для резекції, так і для локальної абляції, викликає суперечки. На основі метааналізу трьох РКД у найновіших публікаціях AASLD рекомендовано при резектабельній ГЦК у дорослих із цирозом печінки і печінковою недостатністю не вище класу А за шкалою Чайлда — П’ю проводити резекцію, а не абляцію [157–160].
Трансартеріальна емболізація та променева терапія. Трансартеріальна хіміоемболізація (Transarterial chemoembolization — TACE) є ефективним варіантом лікування пацієнтів з ГЦК проміжної стадії. TACE включає два основних протипухлинні механізми — внутрішньоартеріальну інфузію цитотоксичних хіміотерапевтичних засобів і доставку емболів в артерію, яка живить пухлину, що викликає ішемічний некроз пухлини. Найпоширенішими препаратами, які використовуються під час звичайної ТАСЕ, є доксорубіцин, епірубіцин або цисплатин [161]. ТАСЕ — це найбільш часто використовуваний місцево-регіонарний метод лікування у пацієнтів з ГЦК, які перебувають у листі очікування ТП, щоб запобігти прогресуванню пухлини. Було показано, що TACE покращує ЗВ у осіб з неоперабельним ГЦК у рандомізованих клінічних дослідженнях (РКД), проведених у Європі та Азії [162, 163]. Додаткове використання хіміотерапевтичних агентів у TACE порівняно із застосуванням м’якої емболізації лише пластиковими мікросферами, що називається трансартеріальною емболізацією (ТАЕ), було оскаржено, оскільки є деякі докази того, що більша частина протипухлинного ефекту досягається за допомогою TACE у зв’язку з ішемією, спричиненою оклюзією судинного постачання пухлини. У РКД, що включало 101 пацієнта (51 отримував TAE і 50 — доксорубіцинові мікросфери TACE), не виявлено різниці в показниках відповіді на лікування, виживаності без прогресування (ВБП), ЗВ або побічних ефектах TACE між двома групами, що свідчить про відсутність додаткової користі від хіміотерапії під час TACE [164]. У цьому РКД медіана тривалості життя в обох групах становила лише 21 міс, що було менше, ніж очікувалося, оскільки інші дослідження показували медіану тривалості життя до 30–40 міс після застосування TACE [114, 165]. Виживаність пацієнтів після ТАСЕ залежить від розповсюдження пухлини та наявної печінкової недостатності і демонструє значну варіабельність між різними країнами світу. Проспективне дослідження за участю 173 пацієнтів з ГЦК із Греції, які не підходили під критерії радикального лікування, показало медіану тривалості життя 43 міс після TACE з використанням мікросфер зі спеціальним покриттям, наповнених доксорубіцином. Загальна 5-річна виживаність становила 23% у хворих із печінковою недостатністю класу А за шкалою Чайлда — П’ю порівняно з 13% у пацієнтів класу В (p=0,03) [165]. Схематично методи трансартеріальної емболізації зображено на рис. 8 [147].
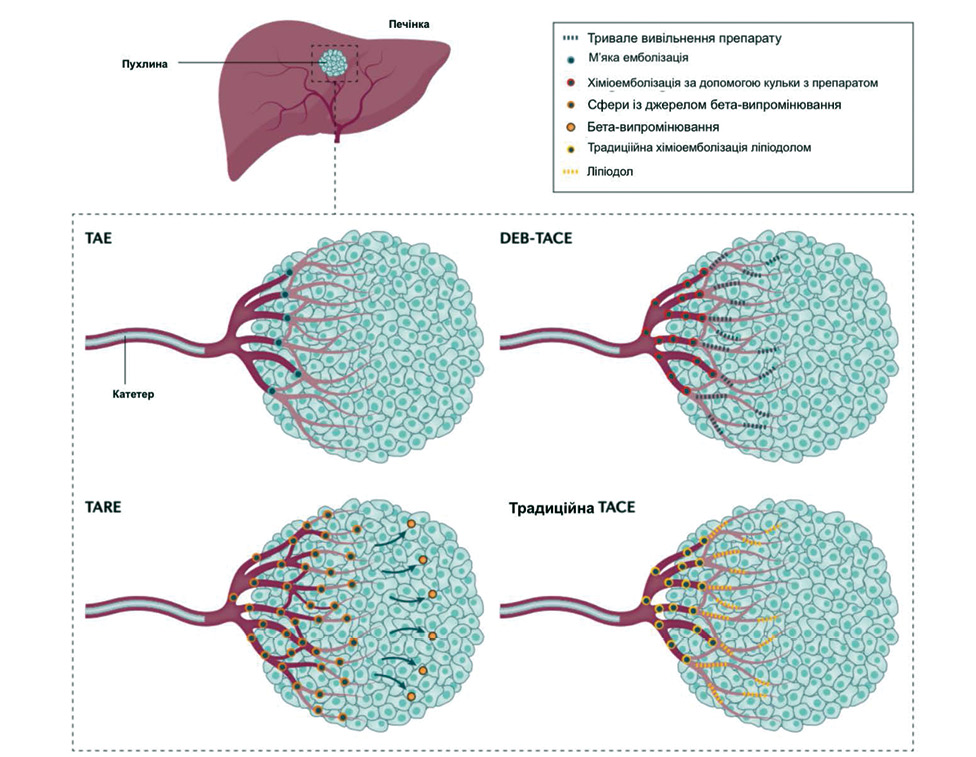
Оскільки докази відсутності користі від хіміотерапевтичного засобу при ТАСЕ порівняно з ТАЕ отримано в одноцентровому дослідженні з невеликою кількістю пацієнтів, необхідні подальші РКД для можливої зміни клінічних рекомендацій. З огляду на багатонадійну ефективність і схвалення нових системних методів лікування хворих на пізніх стадіях ГЦК, потенціал для використання таких методів замість звичайних хіміотерапевтичних засобів для ТАСЕ також потребує вивчення.
Трансартеріальна радіоемболізація (trans-arterial radioembolization — TARE) є ще одним методом ефективної локорегіональної терапії для первинного лікування при неоперабельній ГЦК, а також для зниження стадії перед ТП або для проведення лобарної абляції (променевої лобектомії), яка викликає компенсаторну гіпертрофію нелікованої, неураженої частини печінки та полегшує подальшу хірургічну резекцію. TARE — це форма внутрішньопухлинної брахітерапії, що включає доставку радіоактивних мікросфер, наповнених β-випромінюючим ізотопом ітрію-90, в артерії, що живлять ГЦК, потенційно досягаючи доз опромінення, вищих за ті, які можна отримати за допомогою зовнішнього опромінення. На відміну від TACE, TARE має мінімальний ефект емболії в басейні печінкової артерії, отже, може бути використана у пацієнтів з тромбозом або інвазією ворітної вени [166]. Ефективність та безпека TARE були ретельно оцінені протягом останнього десятиліття [167–172]. Метааналіз, який включав 284 осіб, яким було проведено ТАСЕ, і 269, що отримали ТАРЕ, не показав статистично значущої різниці у виживаності між двома групами (СВР 1,06; 95% ДІ 0,81–1,46; p=0,57) [171]. Пацієнти в групі TACE відмічали більш інтенсивний больовий синдром після лікування порівняно з тими, хто отримував TARE (відносний ризик (ВР) 0,51; 95% ДІ 0,36–0,72; p <0,01), але меншу суб’єктивну втому (ВР 1,68; 95% ДІ 1,08–2,62; p <0,01) [171]. TARE було запропоновано як варіант лікування хворих із з місцево-поширеною ГЦК. У РКД, проведених у Європі та Азійсько-Тихоокеанському регіоні, оцінювали безпеку та ефективність TARE порівняно з медикаментозною терапією сорафенібом у пацієнтів з локально поширеною ГЦК, і жодне з досліджень не продемонструвало переваги TARE щодо загальної тривалості життя порівняно з сорафенібом [173, 174]. Проте аналіз національної бази США 2021 р. показав, що застосування TARE асоційоване з покращенням ЗВ у пацієнтів з місцево-поширеною ГЦК у порівнянні із системною терапією [175], але дані було зібрано з різних центрів, тому вони не є однорідними. Більше того, на момент проведення цього аналізу було опубліковано дані дослідження IMbrave150 із застосування імунотерапії у комбінації з таргетною терапією, у якому було показано значне покращення ЗВ, що не було враховано в аналізі [176].
Стереотаксична променева терапія та протонно-променева терапія також продемонстрували певну ефективність у лікуванні пацієнтів з ГЦК, і перші результати виявилися еквівалентними ефективності TACE на фоні зниження профілю побічних ефектів [177–184]. Однак високоякісних даних щодо віддалених результатів стереотаксичної променевої та протонно-променевої терапії бракує, тому необхідні додаткові дослідження для визначення оптимального вибору лікування для локального лікування при ГЦК.
Системна медикаментозна терапія
Революційні зміни відбулися у сфері системної терапії пацієнтів з ГЦК за останні декілька років. Хворі з поширеними (BCLC C) або проміжними (BCLC B) стадіями ГЦК після прогресії під час локо-регіонарної терапії мають бути оцінені на предмет проведення системного лікування [185, 186]. На сьогодні Управління з контролю за харчовими продуктами та лікарськими засобами (Food and Drug Administration — FDA) схвалило та ввело в національні та міжнародні рекомендації шість препаратів для лікування пацієнтів з ГЦК, чим у 2016 р. поставило крапку в майже десятиріччі негативних результатів досліджень ІІІ фази [185–191].
Перша лінія лікування
Атезолізумаб + бевацизумаб (IMbrave150 Trial). До революційного дослідження IMbrave 150 сорафеніб був стандартом лікування при поширеній ГЦК упродовж більш як 10 років. У дослідженні IMbrave 150 було доведено, що атезолізумаб і бевацизумаб забезпечують значне збільшення ЗВ порівняно із сорафенібом як терапією першої лінії [192]. Атезолізумаб є гуманізованим моноклональним антитілом до ліганду програмованої клітинної смерті 1 (PD-L1), а бевацизумаб є інгібітором ангіогенезу, який блокує зв’язування фактора росту судинного ендотелію А. У цьому дослідженні ІІІ фази взяв участь 501 нелікований пацієнт з нерезектабельною ГЦК. Рандомізація відбувалася у співвідношенні 2:1 у групи: комбінації атезолізумабу (1200 мг) плюс бевацизумабу (15 мг/кг) кожні 3 тиж або сорафенібу (400 мг) перорально двічі на добу відповідно. Кінцевими точками були ЗВ і ВБП згідно з Критеріями оцінки відповіді при солідних пухлинах, версія 1.1 (Response Evaluation Criteria in Solid Tumors v1.1 — RECIST version 1.1). Атезолізумаб + бевацизумаб продемонстрували статистично значуще покращення як ЗВ через 12 міс (67,2% [95% ДІ 61,3–73,1] проти 54,6% [95% ДІ: 45,2–64]), так і ВБП (6,8 міс [95% ДІ 5,7–8,3] проти 4,3 міс [95% ДІ 4–5,6]) у групі сорафенібу. Частота об’єктивної відповіді (Overall response rate — ORR) була подвоєна в групі комбінованого лікування порівняно з сорафенібом. Події 3-го або 4-го ступеня спостерігалися у 38% групи атезолізумабу + бевацизумабу, причому найпоширенішою була артеріальна гіпертензія, за якою йшли протеїнурія та втома. Кровотеча є відомим побічним ефектом бевацизумабу, і пацієнти в цьому дослідженні повинні були пройти езофагогастроскопію для оцінки наявності варикозно розширених вен стравоходу та проведення лікування з цього приводу за 6 міс до включення. Позитивні результати цього випробування сприяли схваленню FDA атезолізумабу + бевацизумабу як терапії першої лінії при нерезектабельній або метастатичній ГЦК у 2020 р.
Альтернативні препарати першої лінії
Сорафеніб (дослідження SHARP) — це низькомолекулярний інгібітор мультикінази, який діє на рецептори судинного ендотеліального фактора росту (Vascular endothelial growth factor — VEGF) VEGFR1, VEGFR2 і VEGFR3, рецептор тромбоцитарного фактора росту-β (Platelet derived growth factor receptor β — PDGFRβ) і кінази сімейства Raf (переважно C-Raf, а не B-Raf). Сорафеніб був першим препаратом, схваленим для системного лікування першої лінії в пацієнтів з пізньою стадією ГЦК, і є першим протоколом системної терапії, що продемонстрував подовження тривалості життя хворих у РКД III фази: збільшення медіани загальної тривалості життя становило 2–3 міс (10,7 міс у групі сорафенібу проти 7,9 міс у групі плацебо в дослідженні SHARP і 6,5 міс у групі сорафенібу проти 4,2 міс у групі плацебо в Азійсько-Тихоокеанському дослідженні). РКД III фази визначили неефективність сорафенібу в якості допоміжного (ад’ювантного) лікування після радикальної операції (дослідження STORM) або додаткової терапії з TACE (дослідження SPACE) [193–196].
Ленватиніб (дослідження REFLECT). До 2018 р. було проведено численні випробування з негативними результатами, доки не було схвалено ленватиніб — інгібітор мультикінази, спрямований на VEGFR1-3, рецептори фактора росту фібробластів (Fibroblast growth factor receptor FGFR) FGFR1–4, PDGFRα, RET і KIT. У випробуванні ІІІ фази ленватиніб для перорального застосування виявився не гіршим за сорафеніб (середня ЗВ 13,6 проти 12,3 міс). Однак ленватиніб продемонстрував статистично значуще покращення ВБП (7,3 проти 3,6 міс) і часу до прогресування (7,4 проти 3,7 міс). Крім того, у групі ленватинібу спостерігалися вища якість життя та краща толерантність. Найпоширенішими побічними ефектами, пов’язаними з ленватинібом, були артеріальна гіпертензія, діарея та зниження маси тіла [197].
Терапія другої лінії
Регорафеніб (дослідження RESORCE) — ще один інгібітор тирозинкінази, був першим препаратом другої лінії, який продемонстрував переваги щодо виживаності пацієнтів, у яких відмічали прогресію при лікуванні сорафенібом, і був схвалений як терапія другої лінії при ГЦК у 2017 р.[198]. Пацієнти в групі регорафенібу мали подовжену середню ЗВ (10,6 міс порівняно з 7,8 міс у групі плацебо). Крім того, використання регорафенібу після прогресії під час терапії сорафенібом обумовлювало медіану виживаності 21 міс від початку лікування сорафенібом [195].
Кабозантиніб (дослідження CELESTIAL). У 2018 р. дослідження III фази CELESTIAL підтвердило ефективність препарату кабозантинібу (інгібітор тирозинкінази, включаючи рецептори MET, AXL і VEGF) у подовженні медіани тривалості життя порівняно з плацебо у пацієнтів з розповсюдженою ГЦК, які раніше отримували сорафеніб. Загалом у 707 хворих, рандомізованих у співвідношенні 2:1 для прийому кабозантинібу чи плацебо, середня ЗВ становила 10,2 міс для кабозантинібу та 8,0 міс для плацебо (СВР 0,76; 95% ДІ 0,63–0,92; p=0,005). Побічні ефекти 3-го або 4-го ступеня виникли у 68% пацієнтів у групі кабозантинібу та 36% у групі плацебо. При аналізі підгруп коефіцієнт ризику смерті становив 0,69 у пацієнтів з ГЦК, інфікованих ВГВ, і 1,11 у осіб з ГЦК, інфікованих ВГС, що свідчить про можливість модифікації ефекту кабозантинібу відповідно до наявного попереднього типу вірусного гепатиту. Кабозантиніб показав ефективність в якості терапії другої лінії, особливо у хворих із ВГВ. Цей аспект потребує додаткових досліджень [199].
Рамуцирумаб (дослідження REACH-2). У 2019 р. було отримано дані щодо ефективності антиангіогенного антагоніста VEGFR-2 рамуцирумабу в подовженні загальної тривалості життя в пацієнтів при прогресії ГЦК, що супроводжувалася підвищенням рівня АФП у сироватці крові ≥400 нг/мл [200]. Рамуцирумаб блокує активацію VEGFR-2 шляхом порушення зв’язування лігандів рецептора VEGF VEGFA, VEGFC і VEGFD. Рамуцирумаб є першим препаратом для системного лікування при ГЦК на основі біомаркерів і має потенціал вибору для терапії другої лінії в підгрупі осіб з підвищеним АФП ≥400 нг/мл. Це було перше клінічне дослідження щодо цього препарату з позитивними результатами, у подальших слід розглянути можливість визначення окремих груп хворих із відповідною біологією пухлини, щоб максимізувати ефективність лікування в майбутніх випробуваннях. Рамуцирумаб було схвалено FDA у травні 2019 р. в якості монотерапії для лікування пацієнтів з ГЦК, які раніше отримували сорафеніб і мають рівень AФП ≥400 нг/мл [201].
Ніволумаб (дослідження CheckMate 040 та 459) та пембролізумаб (дослідження KEYNOTE 224 та 240). Ніволумаб — це повністю людське моноклональне антитіло до імуноглобуліну G4, яке порушує передавання сигналів імунної контрольної точки PD-1. Цей лікарський засіб став першим схваленим імунопрепаратом для лікування хворих на ГЦК з ORR 20% і медіаною виживаності 16 міс з прийнятними профілями безпеки у осіб, у яких зафіксовано прогресію або непереносимість під час приймання сорафенібу. Він також показав багатонадійні результати у пацієнтів, які раніше не отримували лікування [202]. Результати не залежали від експресії PD-L1. На жаль, у дослідженні ІІІ фази, у якому порівнювали ніволумаб із сорафенібом як терапію першої лінії при прогресуванні ГЦК, отримано негативні результати щодо первинної кінцевої точки ЗВ, хоча ніволумаб мав більш сприятливий профіль безпеки (CheckMate 459). Пембролізумаб, інше антитіло до PD-1, показав обнадійливі результати в дослідженні ІІ фази (KEYNOTE 224), що сприяло його прискореному схваленню FDA як терапії другої лінії. Однак у наступному дослідженні ІІІ фази пембролізумаб не продемонстрував статистично значущого покращення ЗВ або ВБП відповідно до заздалегідь заданих критеріїв протоколу (KEYNOTE 240) [203].
Дурвалумаб + тремілімумаб (дослідження HIMALAYA). Дурвалумаб — повністю людське високоафінне моноклональне антитіло до імуноглобуліну G1 капа, що селективно блокує взаємодію PD-L1 з PD-1. Тремілімумаб — антитіло до імуноглобуліну G2 до цитотоксичного асоційованого з Т-лімфоцитами антигену 4 (Cytotoxic T-lymphocyte associated protein 4 — CTLA4). У червні 2022 р. було опубліковано результати дослідження HIMALAYA, у якому було показано достовірно вищу ефективність комбінації препаратів тремілімумабу (1 введення 300 мг) та дурвалумабу (1500 мг кожні 4 тиж) у порівнянні з монотерапією дурвалумабом (1500 мг кожні 4 тиж) та у порівнянні з монотерапією сорафенібом (400 мг щоденно). Усього було включено 1171 пацієнта, медіана ЗВ становила 16,43 міс (95% ДІ 14,16–19,58) у групі дурвалумабу+тремілімумабу, 16,56 міс (95% ДІ, 14,06–19,12) — у групі дурвалумабу та 13,77 міс (95% ДІ 12,25–16,13) — у групі сорафенібу. Загальна 36-місячна виживаність — 30,7; 24,7 і 20,2% відповідно. Медіана ВБП не сильно відрізняється між групами [204]. Відповідно, у жовтні 2022 р. FDA схвалило цю комбінацію для лікування хворих із нерезектабельною або метастатичною ГЦК [205].
Лікування пацієнтів з ГЦК в умовах різних фінансових спроможностей. Терапія при ГЦК є можливою навіть у країнах з проміжним або низьким рівнем ресурсів, однак не всі види лікування є однаково економічно ефективними та гарантовано впливають на подовження тривалості життя без урахування можливостей країни фінансово забезпечити повний діагностично-лікувальний комплекс. При ГЦК на ранніх стадіях найкращими є потенційно радикальні методи терапії: абляція, резекція або ТП. У разі ГЦК проміжної стадії слід запропонувати локальне лікування, таке як TACE, TAE або TARE. Ці методи сучасної терапії потребують відповідного обладнання і кваліфікованих спеціалістів, тому сорафеніб може бути альтернативою в країнах з обмеженими ресурсами. Для пацієнтів на пізніх стадіях ГЦК застосування інгібіторів цільової рецепторної тирозинкінази або імунотерапії є єдиним можливим протипухлинним лікуванням, тому зниження вартості ліків є критично важливим, особливо для країн з обмеженими ресурсами. Особам з термінальною стадією ГЦК слід забезпечити найкращу паліативну терапію [206].
Глобальні стратегії в попередженні, діагностиці та лікуванні ГЦК
Щоб зменшити тягар ГЦК у всьому світі, необхідно інтенсивно впливати на чотири основні напрямки: запобігання інфекції ВГВ та ВГС; лікування пацієнтів із хронічними ВГВ, ВГC і іншими хронічними захворюваннями печінки; зменшувати вплив дієтичних та метаболічних факторів ризику; покращувати ранню діагностику та лікування при вказаній онкопатології. Точні оцінки ефекту конкретних заходів відсутні, але слід враховувати, що жоден із них сам по собі не буде достатнім для значного зменшення кількості смертей від ГЦК. Ці заходи необхідно об’єднати в організований і структурований план дій для отримання реального шансу врівноважити зростання кількості випадків захворювання внаслідок збільшення чи старіння населення. У додатку наведено структуру глобальних рекомендацій, враховуючи досягнутий на сьогодні прогрес, а також нові дії, які здаються необхідними та можливими на основі останніх досягнень у профілактиці та лікуванні ГЦК [207]. Ця система включає первинну профілактику, у тому числі охоплення вакцинацією проти ВГВ, контроль хронічного вірусного гепатиту за допомогою противірусного лікування та зменшення факторів ризику, пов’язаних із середовищем та способом життя, вторинну профілактику, включаючи раннє виявлення ГЦК за допомогою програм епіднагляду, і третинну профілактику через універсальний доступ до найбільш відповідних методів терапії з урахуванням ресурсу країни.
| Додаток 1. Рекомендації щодо глобального зниження тягаря ГЦК |
| Досягнення достатнього рівня вакцинації проти ВГВ
Розгортання програм неонатальної вакцинації проти ВГВ Моніторинг довгострокового захисту (ефективності вакцини) Вивчення взаємодії з іншими інфекціями Оцінка користі введення імуноглобуліну проти ВГВ вагітним для запобігання передачі вірусу від матері до дитини Інформування та навчання населення, вирішення питань про зміну сприйняття вакцинації |
| Контроль захворювань, що пов’язані з ВГС- та ВГВ-інфекціями
Просування скринінгу ВГС та ВГВ серед осіб високого ризику Просування універсального доступу до фармакологічного лікування при ВГС- та ВГВ-інфекціях |
| Зниження ризиків з боку навколишнього середовища та способу життя
Сприяння вирощуванню замінних культур з нижчим ризиком забруднення афлатоксином Впровадження суворішого контролю за рівнем забруднення афлатоксинами Сприяння здоровому харчуванню та фізичним вправам для профілактики метаболічного синдрому та НАЖХП Сприяння відмові від алкоголю та куріння Контроль впливу канцерогенів і токсинів у навколишньому середовищі та на робочому місці |
| Покращення раннього виявлення, стадіювання та лікування
Розроблення загальнонаціональних програм виявлення ГЦК у осіб з груп ризику Розроблення та впровадження покращених стратегій раннього виявлення ГЦК за допомогою неінвазивних засобів: біомаркерів та радіологічної діагностики Підвищення уваги на необхідність раннього виявлення в умовах країн з низькими ресурсами, де ГЦК часто розвивається рано без попереднього цирозу печінки Сприяння універсальному доступу до найкращих варіантів лікування незалежно від контексту ресурсів, включаючи доступ до цільової терапії та імунотерапії Розвиток обізнаності про захворювання печінки, підтримка пацієнтів і сімей і доступ до паліативного лікування |
На сьогодні лише вакцинація немовлят проти ВГВ була впроваджена як структурована всесвітня програма і як частина Розширеної програми імунізації з використанням мультивалентних вакцин, що зазвичай вводяться, починаючи з 6–8 тиж після народження. Насамперед це сталося завдяки зусиллям Всесвітньої організації охорони здоров’я (ВООЗ), Дитячого фонду ООН (ЮНІСЕФ) і Глобального альянсу вакцин та імунізації (Global Alliance for Vaccines and Immunisation), державно-приватного глобального партнерства в галузі охорони здоров’я, заснованого Фондом Білла та Мелінди Гейтс (Bill & Melinda Gates Foundation — BMGF), об’єднаних спільною метою покращення доступу до вакцин для дітей, які живуть у найбідніших країнах світу, у співпраці з місцевими національними системами охорони здоров’я. Проте охоплення населення Розширеною програмою імунізації залишається <75% приблизно в одній третині цих держав, особливо в країнах з обмеженими медичними ресурсами. Таким чином, незважаючи на великі надії на загальну вакцинацію проти ВГВ, кількість смертей від ГЦК продовжуватиме зростати в наступні десятиліття, якщо не буде покращено охоплення населення щепленнями та інші заходи профілактики. Зокрема, відсутні зусилля щодо запобігання передачі інфекції від матері до дитини шляхом вакцинації проти ВГВ новонароджених протягом перших 24 год життя, а також виявлення та лікування ВГВ в антиген-позитивних вагітних, які, найімовірніше, передають інфекцію ВГВ немовлятам [74]. На додаток до вакцинації проти ВГВ скринінг ВГВ та ВГС у групах високого ризику та загальний доступ до фармакологічного лікування при хронічних інфекціях ВГВ та ВГС можуть значно зменшити глобальний тягар ГЦК.
Для активного зниження впливу афлатоксину потрібен багаторівневий план дій, але пасивне зменшення відбуватиметься спонтанно у зв’язку з диверсифікацією дієти, оскільки багато країн з обмеженими ресурсами переходять від статусу з низьким рівнем доходу до статусу із середнім рівнем доходу [207]. Однак очікується, що економічне зростання та диверсифікація дієти обумовлюють багато змін, які можуть призвести до підвищення захворюваності на ГЦК. Перехід до західних гіперкалорійних дієт і малорухливого способу життя, що відбувається в багатьох традиційно слаборозвинених регіонах, спричиняє швидке зростання ожиріння населення з подальшим розвитком метаболічного синдрому та цукрового діабету [208]. А це, у свою чергу, збільшує поширеність факторів ризику розвитку раку печінки як у носіїв, так і у тих, хто не є носіями ВГВ, включаючи осіб, у яких носійство було попереджено неонатальною вакцинацією [80]. Моніторинг описаних тенденцій буде важливим для розрізнення позитивних і негативних наслідків змін, пов’язаних з розвитком. Таким чином, стримування епідемії ГЦК вимагатиме ретельного та раціонального управління глобальними екосистемами, беручи до уваги економічне зростання, зміни в сільськогосподарській та дієтичній практиці, зменшення кількості ендемічних захворювань, таких як вірусний гепатит, ожиріння, спосіб життя та фактори ризику, такі як алкоголь і куріння.
Доступ до діагностики, лікування та паліативної допомоги є низьким у країнах з обмеженими економічними ресурсами в більшості ендемічних зон ГЦК. Однак глобальні тенденції щодо захворювань печінки вказують на те, що існує чудове вікно можливостей для скринінгу, раннього виявлення та раннього лікування хворих на цю патологію [209]. Технологічно інтенсивні методи терапії, такі як ТП або локальне лікування за допомогою ТАСЕ, часто є недоступними в країнах із низьким або середнім рівнем ресурсів. Таким чином, найкращі альтернативні методи терапії повинні бути забезпечені відповідно до стадії ГЦК. Позитивні результати випробувань інгібіторів кінази та інгібіторів імунних контрольних точок за останні кілька років, ймовірно, сприятимуть розширенню доступу та зниженню вартості системної терапії при розповсюджених формах цієї онкопатології в усьому світі. Для всіх описаних методів діагностики і лікування ГЦК вирішальне значення має можливість доступу до них у пацієнтів з груп ризику. Одним з напрямків розвитку можуть бути стратегії впровадження процедур місцевої абляції та хірургічної резекції, для яких можливо організувати порівняно недорогі рішення, що також включають навчання з гепатобіліарної хірургії, анестезії та періопераційного догляду [210].
Усі аспекти зусиль, спрямованих на зменшення тягаря ГЦК у світі, вимагають термінової протипухлинної пропаганди на місцевому, урядовому та регіональному рівнях. Основні напрями включають розробку та впровадження ефективних програм скринінгу та епіднагляду, а також покращення доступу до недорогих діагностичних та терапевтичних методів. Крім того, необхідно сприяти впровадженню трансформаційних технологій, включаючи eHealth або мобільні додатки сфери охорони здоров’я, нові недорогі платформи пристроїв для покращення скринінгу на вірусні гепатити, нові технології для епіднагляду за ГЦК, включаючи молекулярні аналізи, технології на основі пристрою для УЗД або інших форм візуалізації печінки, наприклад визначення неоангіогенезу.
Зростання національних, регіональних і глобальних мереж, спрямованих на боротьбу з епідемією вірусного гепатиту та ГЦК, стало однією з найважливіших подій за останні 10 років. Ці мережі стимулювали розробку нових рекомендацій ВООЗ щодо ВГВ і ВГС, прийняття резолюцій, що визнають хронічний вірусний гепатит основною причиною захворюваності та смертності в усьому світі на Всесвітній асамблеї охорони здоров’я, а також включення усунення вірусного гепатиту в усьому світі до глобальних цілей сталого розвитку [211]. Цими мережами, які об’єдналися у Всесвітній альянс з гепатиту (World Hepatitis Alliance), було організовано всесвітні саміти з гепатиту у 2015 та 2017 р. Ці зустрічі зібрали представників ключових зацікавлених сторін та сприяли розробці планів дій для досягнення глобальної ліквідації вірусних гепатитів до 2030 р. [13].
Особливістю описаних вище ініціатив, що відрізняє їх від попередніх зусиль із боротьби з ВІЛ-інфекцією в усьому світі, є визнання факту, що робота з ліквідації вірусного гепатиту має включати широкі заходи для зміцнення інфраструктури системи охорони здоров’я в країнах з низьким і середнім рівнем доходу, де проживає переважна більшість інфікованих [212]. Створення Глобального фонду з ліквідації вірусного гепатиту в листопаді 2017 р. є ключовим кроком і зобов’язанням глобального філантропічного сектору мобілізації ресурсів для досягнення описаних цілей.
Список використаної літератури
1. Fitzmaurice, C., Allen, C., Barber, R. M., Barregard, L., Bhutta, Z. A., Brenner, H., … Khubchandani, J. (2017). Global, Regional, and National Cancer Incidence, Mortality, Years of Life Lost, Years Lived With Disability, and Disability-Adjusted Life-years for 32 Cancer Groups, 1990 to 2015: A Systematic Analysis for the Global Burden of Disease Study. JAMA Oncology, 3(4), 524–548. doi.org/10.1001/jamaoncol.2016.5688.
2. El-Serag, H. B., & Rudolph, K. L. (2007). Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology, 132(7), 2557–2576. doi.org/10.1053/j.gastro.2007.04.061.
3. El-Serag, H. B. (2012). Epidemiology of Viral Hepatitis and Hepatocellular Carcinoma. Gastroenterology, 142(6), 1264-1273.e1. doi.org/10.1053/j.gastro.2011.12.061.
4. Tang, A., Hallouch, O., Chernyak, V., Kamaya, A., & Sirlin, C. B. (2017). Epidemiology of hepatocellular carcinoma: target population for surveillance and diagnosis. Abdominal Radiology, 43(1), 13–25. doi.org/10.1007/s00261-017-1209-1.
5. Mohammadian, M., Allah Bakeshei, K., & Mohammadian-Hafshejani, A. (2020). International epidemiology of liver cancer: geographical distribution, secular trends and predicting the future. Journal of Preventive Medicine and Hygiene, 61(2), E259–E289. doi.org/10.15167/2421-4248/jpmh2020.61.2.1244.
6. Hajarizadeh, B., Grebely, J., & Dore, G. J. (2013). Epidemiology and natural history of HCV infection. Nature Reviews Gastroenterology & Hepatology, 10(9), 553–562. doi.org/10.1038/nrgastro.2013.107.
7. Park, J.-W., Chen, M., Colombo, M., Roberts, L. R., Schwartz, M., Chen, P.-J., … Sherman, M. (2015). Global patterns of hepatocellular carcinoma management from diagnosis to death: the BRIDGE Study. Liver International, 35(9), 2155–2166. doi.org/10.1111/liv.12818.
8. Yang, J. D., Gyedu, A., Afihene, M. Y., Duduyemi, B. M., Micah, E., Kingham, P. T., … Okonkwo, U. (2015). Hepatocellular Carcinoma Occurs at an Earlier Age in Africans, Particularly in Association With Chronic Hepatitis B. American Journal of Gastroenterology, 110(11), 1629–1631. doi.org/10.1038/ajg.2015.289.
9. Yang, J. D., Altekruse, S. F., Nguyen, M. H., Gores, G. J., & Roberts, L. R. (2017). Impact of country of birth on age at the time of diagnosis of hepatocellular carcinoma in the United States. Cancer, 123(1), 81–89. doi.org/10.1002/cncr.30246.
10. Yang, J. D., Mohamed, E. A., Aziz, A. O. A., Shousha, H. I., Hashem, M. B., Nabeel, M. M., … Anthony, R. (2017). Characteristics, management, and outcomes of patients with hepatocellular carcinoma in Africa: a multicountry observational study from the Africa Liver Cancer Consortium. The Lancet Gastroenterology & Hepatology, 2(2), 103–111. doi.org/10.1016/s2468-1253(16)30161-3.
11. Kudo, M. (2017). Management of Hepatocellular Carcinoma in Japan as a World-Leading Model. Liver Cancer, 7(2), 134–147. doi.org/10.1159/000484619.
12. Yang, J. D., & Roberts, L. R. (2010). Hepatocellular carcinoma: a global view. Nature Reviews Gastroenterology & Hepatology, 7(8), 448–458. doi.org/10.1038/nrgastro.2010.100.
13. World Health Organization. (2016). Global health sector strategy on viral hepatitis 2016–2021. Towards ending viral hepatitis. Retrieved from https://apps.who.int/iris/handle/10665/246177.
14. Heffernan, A., Cooke, G. S., Nayagam, S., Thursz, M., & Hallett, T. B. (2019). Scaling up prevention and treatment towards the elimination of hepatitis C: a global mathematical model. The Lancet, 393(10178), 1319–1329. doi.org/10.1016/s0140-6736(18)32277-3.
15. Countries Dashboard — CDA Foundation. (n.d.). Retrieved from https://cdafound.org/polaris-countries-dashboard.
16. Центр громадського здоров’я. (n.d.). Статистика ЗПТ. Retrieved from https://www.phc.org.ua/ kontrol-zakhvoryuvan/zalezhnist-vid-psikhoaktivnikh-rechovin/zamisna-pidtrimuvalna-terapiya-zpt/statistika-zpt.
17. Vitek, C. R., Čakalo, J.-I., Kruglov, Y. V., Dumchev, K. V., Salyuk, T. O., Božičević, I., … Rutherford, G. W. (2014). Slowing of the HIV Epidemic in Ukraine: Evidence from Case Reporting and Key Population Surveys, 2005–2012. PLoS ONE, 9(9), e103657. doi.org/10.1371/journal.pone.0103657.
18. HIV-hepatitis C co-infection in Mykolaiv, Ukraine. (n.d.). Retrieved from https://msfaccess.org/hiv-hepatitis-c-co-infection-mykolaiv-ukraine.
19. Yang, J. D., Mohamed, H. A., Cvinar, J. L., Gores, G. J., Roberts, L. R., & Kim, R. W. (2016). Diabetes Mellitus Heightens the Risk of Hepatocellular Carcinoma Except in Patients With Hepatitis C Cirrhosis. American Journal of Gastroenterology, 111(11), 1573–1580. doi.org/10.1038/ajg.2016.330.
20. Chayanupatkul, M., Omino, R., Mittal, S., Kramer, J. R., Richardson, P., Thrift, A. P., … Kanwal, F. (2017). Hepatocellular carcinoma in the absence of cirrhosis in patients with chronic hepatitis B virus infection. Journal of Hepatology, 66(2), 355–362. doi.org/10.1016/j.jhep.2016.09.013.
21. Younossi, Z. M., Blissett, D., Blissett, R., Henry, L., Stepanova, M., Younossi, Y., … Beckerman, R. (2016). The economic and clinical burden of nonalcoholic fatty liver disease in the United States and Europe. Hepatology, 64(5), 1577–1586. doi.org/10.1002/hep.28785.
22. Younossi, Z. M., Koenig, A. B., Abdelatif, D., Fazel, Y., Henry, L., & Wymer, M. (2016). Global Epidemiology of Nonalcoholic Fatty Liver disease-Meta-analytic Assessment of prevalence, incidence, and Outcomes. Hepatology, 64(1), 73–84. doi.org/10.1002/hep.28431.
23. Younossi, Z. M., Otgonsuren, M., Henry, L., Venkatesan, C., Mishra, A., Erario, M., & Hunt, S. (2015). Association of nonalcoholic fatty liver disease (NAFLD) with hepatocellular carcinoma (HCC) in the United States from 2004 to 2009. Hepatology, 62(6), 1723–1730. doi.org/10.1002/hep.28123.
24. Yang, J. D., Ahmed Mohammed, H., Harmsen, W. S., Enders, F., Gores, G. J., & Roberts, L. R. (2017). Recent Trends in the Epidemiology of Hepatocellular Carcinoma in Olmsted County, Minnesota. Journal of Clinical Gastroenterology, 51(8), 742–748. doi.org/10.1097/mcg.0000000000000810.
25. Welzel, T. M., Graubard, B. I., Quraishi, S., Zeuzem, S., Davila, J. A., El-Serag, H. B., & McGlynn, K. A. (2013). Population-Attributable Fractions of Risk Factors for Hepatocellular Carcinoma in the United States. American Journal of Gastroenterology, 108(8), 1314–1321. doi.org/10.1038/ajg.2013.160.
26. Mittal, S., El-Serag, H. B., Sada, Y. H., Kanwal, F., Duan, Z., Temple, S., … Davila, J. A. (2016). Hepatocellular Carcinoma in the Absence of Cirrhosis in United States Veterans Is Associated With Nonalcoholic Fatty Liver Disease. Clinical Gastroenterology and Hepatology, 14(1), 124–131.e1. doi.org/10.1016/j.cgh.2015.07.019.
27. El–Serag, H. B., Hampel, H., & Javadi, F. (2006). The Association Between Diabetes and Hepatocellular Carcinoma: A Systematic Review of Epidemiologic Evidence. Clinical Gastroenterology and Hepatology, 4(3), 369–380. doi.org/10.1016/j.cgh.2005.12.007.
28. Huang, S.-F., Chang, I.-C., Hong, C.-C., Yen, T.-C., Chen, C.-L., Wu, C.-C., … Liaw, Y.-F. (2018). Metabolic risk factors are associated with non-hepatitis B non-hepatitis C hepatocellular carcinoma in Taiwan, an endemic area of chronic hepatitis B. Hepatology Communications, 2(6), 747–759. doi.org/10.1002/hep4.1182.
29. Balkwill, F., & Mantovani, A. (2001). Inflammation and cancer: back to Virchow? The Lancet, 357(9255), 539–545. doi.org/10.1016/s0140-6736(00)04046-0.
30. Hirosumi, J., Tuncman, G., Chang, L., Görgün, C. Z., Uysal, K. T., Maeda, K., … Hotamisligil, G. S. (2002). A central role for JNK in obesity and insulin resistance. Nature, 420(6913), 333–336. doi.org/10.1038/nature01137.
31. Hui, L., Zatloukal, K., Scheuch, H., Stepniak, E., & Wagner, E. F. (2008). Proliferation of human HCC cells and chemically induced mouse liver cancers requires JNK1-dependent p21 downregulation. The Journal of Clinical Investigation, 118(12), 3943–3953. doi.org/10.1172/JCI37156.
32. Diet, Nutrition, Physical Activity and Cancer: a Global Perspective. A summary of the Third Expert Report. (2018). Retrieved from https://www.wcrf.org/ wp-content/ uploads/2021/02/ Summary-of-Third-Expert-Report-2018.pdf.
33. West, J., Card, T. R., Aithal, G. P., & Fleming, K. M. (2017). Risk of hepatocellular carcinoma among individuals with different aetiologies of cirrhosis: a population-based cohort study. Alimentary Pharmacology & Therapeutics, 45(7), 983–990. doi.org/10.1111/apt.13961.
34. Jepsen, P., Ott, P., Andersen, P. K., Sørensen, H. T., & Vilstrup, H. (2012). Risk for Hepatocellular Carcinoma in Patients With Alcoholic Cirrhosis. Annals of Internal Medicine, 156(12), 841. doi.org/10.7326/0003-4819-156-12-201206190-00004.
35. Mancebo, A., González-Diéguez, M. L., Cadahía, V., Varela, M., Pérez, R., Navascués, C. A., … Rodríguez, M. (2013). Annual incidence of hepatocellular carcinoma among patients with alcoholic cirrhosis and identification of risk groups. Clinical Gastroenterology and Hepatology, 11(1), 95–101. doi.org/10.1016/j.cgh.2012.09.007.
36. Mycotoxin Control In Low- And Middle-Income Countries. (2015). In C. P. Wild, J. D. Miller, & J. D. Groopman (Eds.), PubMed. Lyon (FR): International Agency for Research on Cancer. Retrieved from https://www.ncbi.nlm.nih.gov/books/NBK350558.
37. Gouas, D., Shi, H., & Hainaut, P. (2009). The aflatoxin-induced TP53 mutation at codon 249 (R249S): Biomarker of exposure, early detection and target for therapy. Cancer Letters, 286(1), 29–37. doi.org/10.1016/j.canlet.2009.02.057.
38. Weng, M.-W., Lee, H.-W., Choi, B., Wang, H.-T., Hu, Y., Mehta, M., … Tang, M.-S. (2017). AFB1 hepatocarcinogenesis is via lipid peroxidation that inhibits DNA repair, sensitizes mutation susceptibility and induces aldehyde-DNA adducts at p53 mutational hotspot codon 249. Oncotarget, 8(11), 18213–18226. doi.org/10.18632/oncotarget.15313.
39. Helleday, T., Eshtad, S., & Nik-Zainal, S. (2014). Mechanisms underlying mutational signatures in human cancers. Nature Reviews Genetics, 15(9), 585–598. doi.org/10.1038/nrg3729.
40. Shen, H.-M., & Ong, C.-N. (1996). Mutations of the p53 tumor suppressor gene and ras oncogenes in aflatoxin hepatocarcinogenesis. Mutation Research/Reviews in Genetic Toxicology, 366(1), 23–44. doi.org/10.1016/s0165-1110(96)90005-6.
41. Ross, R. K., Yu, M. C., Henderson, B. E., Yuan, J.-M., Qian, G.-S., Tu, J.-T., … Groopman, J. D. (1992). Urinary aflatoxin biomarkers and risk of hepatocellular carcinoma. The Lancet, 339(8799), 943–946. doi.org/10.1016/0140-6736(92)91528-g.
42. Kew, M. C. (2003). Synergistic interaction between aflatoxin B1 and hepatitis B virus in hepatocarcinogenesis. Liver International, 23(6), 405–409. doi.org/10.1111/j.1478-3231.2003.00869.x.
43. Arlt, V. M. (2002). Aristolochic acid as a probable human cancer hazard in herbal remedies: a review. Mutagenesis, 17(4), 265–277. doi.org/10.1093/mutage/17.4.265.
44. Rosenquist, T. A., & Grollman, A. P. (2016). Mutational signature of aristolochic acid: Clue to the recognition of a global disease. DNA Repair, 44, 205–211. doi.org/10.1016/j.dnarep.2016.05.027.
45. Ng, A. W. T., Poon, S. L., Huang, M. N., Lim, J. Q., Boot, A., Yu, W., … Rozen, S. G. (2017). Aristolochic acids and their derivatives are widely implicated in liver cancers in Taiwan and throughout Asia. Science Translational Medicine, 9(412), eaan6446. doi.org/10.1126/scitranslmed.aan6446.
46. Hsieh, S.-C., Lin, I.-Hsin., Tseng, W.-L., Lee, C.-H., & Wang, J.-D. (2008). Prescription profile of potentially aristolochic acid containing Chinese herbal products: an analysis of National Health Insurance data in Taiwan between 1997 and 2003. Chinese Medicine, 3(1), 13. doi.org/10.1186/1749-8546-3-13.
47. Chen, C., Yang, Y., Lin, M., Lee, C., Tsan, Y., Lai, M., … Chen, P. (2018). Herbal medicine containing aristolochic acid and the risk of hepatocellular carcinoma in patients with hepatitis B virus infection. International Journal of Cancer, 143(7), 1578–1587. doi.org/10.1002/ijc.31544.
48. Bravi, F., Tavani, A., Bosetti, C., Boffetta, P., & La Vecchia, C. (2017). Coffee and the risk of hepatocellular carcinoma and chronic liver disease. European Journal of Cancer Prevention, 26(5), 368–377. doi.org/10.1097/cej.0000000000000252.
49. Singh, S., Singh, P. P., Singh, A. G., Murad, M. H., & Sanchez, W. (2013). Statins Are Associated With a Reduced Risk of Hepatocellular Cancer: A Systematic Review and Meta-analysis. Gastroenterology, 144(2), 323–332. doi.org/10.1053/j.gastro.2012.10.005.
50. Zhou, Y.-Y., Zhu, G.-Q., Liu, T., Zheng, J.-N., Cheng, Z., Zou, T.-T., … Zheng, M.-H. (2016). Systematic Review with Network Meta-Analysis: Antidiabetic Medication and Risk of Hepatocellular Carcinoma. Scientific Reports, 6(1). doi.org/10.1038/srep33743.
51. Sahasrabuddhe, V. V., Gunja, M. Z., Graubard, B. I., Trabert, B., Schwartz, L. M., Park, Y., … McGlynn, K. A. (2012). Nonsteroidal Anti-inflammatory Drug Use, Chronic Liver Disease, and Hepatocellular Carcinoma. JNCI: Journal of the National Cancer Institute, 104(23), 1808–1814. doi.org/10.1093/jnci/djs452.
52. Galle, P. R., Forner, A., Llovet, J. M., Mazzaferro, V., Piscaglia, F., Raoul, J.-L., … Vilgrain, V. (2018). EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. Journal of Hepatology, 69(1), 182–236. doi.org/10.1016/j.jhep.2018.03.019.
53. Kim, W. R., Loomba, R., Berg, T., Aguilar Schall, R. E., Yee, L. J., Dinh, P. V., … Marcellin, P. (2015). Impact of long-term tenofovir disoproxil fumarate on incidence of hepatocellular carcinoma in patients with chronic hepatitis B. Cancer, 121(20), 3631–3638. doi.org/10.1002/cncr.29537.
54. van der Meer, A. J., Veldt, B. J., Feld, J. J., Wedemeyer, H., Dufour, J.-F., Lammert, F., … Janssen, H. L. A. (2012). Association Between Sustained Virological Response and All-Cause Mortality Among Patients With Chronic Hepatitis C and Advanced Hepatic Fibrosis. JAMA, 308(24), 2584. doi.org/10.1001/jama.2012.144878.
55. El-Serag, H. B., Kanwal, F., Richardson, P., & Kramer, J. (2016). Risk of hepatocellular carcinoma after sustained virological response in Veterans with hepatitis C virus infection. Hepatology, 64(1), 130–137. doi.org/10.1002/hep.28535.
56. Kanwal, F., Kramer, J., Asch, S. M., Chayanupatkul, M., Cao, Y., & El-Serag, H. B. (2017). Risk of Hepatocellular Cancer in HCV Patients Treated With Direct-Acting Antiviral Agents. Gastroenterology, 153(4), 996–1005.e1. doi.org/10.1053/j.gastro.2017.06.012.
57. Reig, M., Mariño, Z., Perelló, C., Iñarrairaegui, M., Ribeiro, A., Lens, S., … Bruix, J. (2016). Unexpected high rate of early tumor recurrence in patients with HCV-related HCC undergoing interferon-free therapy. Journal of Hepatology, 65(4), 719–726. doi.org/10.1016/j.jhep.2016.04.008.
58. Conti, F., Buonfiglioli, F., Scuteri, A., Crespi, C., Bolondi, L., Caraceni, P., … Brillanti, S. (2016). Early occurrence and recurrence of hepatocellular carcinoma in HCV-related cirrhosis treated with direct-acting antivirals. Journal of Hepatology, 65(4), 727–733. doi.org/10.1016/j.jhep.2016.06.015.
59. Conti, F., Buonfiglioli, F., Scuteri, A., Crespi, C., Bolondi, L., Caraceni, P., … Brillanti, S. (2016). Early occurrence and recurrence of hepatocellular carcinoma in HCV-related cirrhosis treated with direct-acting antivirals. Journal of Hepatology, 65(4), 727–733. doi.org/10.1016/j.jhep.2016.06.015.
60. Ravi, S., Axley, P., Jones, D., Kodali, S., Simpson, H., McGuire, B. M., & Singal, A. K. (2017). Unusually High Rates of Hepatocellular Carcinoma After Treatment With Direct-Acting Antiviral Therapy for Hepatitis C Related Cirrhosis. Gastroenterology, 152(4), 911–912. doi.org/10.1053/j.gastro.2016.12.021.
61. ANRS collaborative study group on hepatocellular carcinoma (ANRS CO22 HEPATHER, CO12 CirVir and CO23 CUPILT cohorts). Electronic address: stanislas.pol@aphp.fr. (2016). Lack of evidence of an effect of direct-acting antivirals on the recurrence of hepatocellular carcinoma: Data from three ANRS cohorts. Journal of Hepatology, 65(4), 734–740. doi.org/10.1016/j.jhep.2016.05.045.
62. Petta, S., Cabibbo, G., Barbara, M., Attardo, S., Bucci, L., Farinati, F., … Benvegnù, L. (2017). Hepatocellular carcinoma recurrence in patients with curative resection or ablation: impact of HCV eradication does not depend on the use of interferon. Alimentary Pharmacology & Therapeutics, 45(1), 160–168. doi.org/10.1111/apt.13821.
63. Singal, A. G., Rich, N. E., Mehta, N., Branch, A., Pillai, A., Hoteit, M., … Bhamidimarri, K. R. (2019). Direct-Acting Antiviral Therapy Not Associated With Recurrence of Hepatocellular Carcinoma in a Multicenter North American Cohort Study. Gastroenterology, 156(6), 1683-1692.e1. doi.org/10.1053/j.gastro.2019.01.027.
64. Nahon, P., Layese, R., Bourcier, V., Cagnot, C., Marcellin, P., Guyader, D., … Bourlière, M. (2018). Incidence of Hepatocellular Carcinoma After Direct Antiviral Therapy for HCV in Patients With Cirrhosis Included in Surveillance Programs. Gastroenterology, 155(5), 1436–1450.e6. doi.org/10.1053/j.gastro.2018.07.015.
65. Ally, A., Balasundaram, M., Carlsen, R., Chuah, E., Clarke, A., Dhalla, N., … Wong, T. (2017). Comprehensive and Integrative Genomic Characterization of Hepatocellular Carcinoma. Cell, 169(7), 1327–1341.e23. doi.org/10.1016/j.cell.2017.05.046.
66. Schulze, K., Imbeaud, S., Letouzé, E., Alexandrov, L. B., Calderaro, J., Rebouissou, S., … Nault, J.-C. (2015). Exome sequencing of hepatocellular carcinomas identifies new mutational signatures and potential therapeutic targets. Nature Genetics, 47(5), 505–511. doi.org/10.1038/ng.3252.
67. Hoshida, Y., Nijman, S. M. B., Kobayashi, M., Chan, J. A., Brunet, J.-P.., Chiang, D. Y., … Golub, T. R. (2009). Integrative Transcriptome Analysis Reveals Common Molecular Subclasses of Human Hepatocellular Carcinoma. Cancer Research, 69(18), 7385–7392. doi.org/10.1158/0008-5472.can-09-1089.
68. Amaddeo, G., Cao, Q., Ladeiro, Y., Imbeaud, S., Nault, J.-C., Jaoui, D., … Zucman-Rossi, J. (2014). Integration of tumour and viral genomic characterisations in HBV-related hepatocellular carcinomas. Gut, 64(5), 820–829. doi.org/10.1136/gutjnl-2013-306228.
69. Boyault, S., Rickman, D. S., de Reyniès, A., Balabaud, C., Rebouissou, S., Jeannot, E., … Zucman-Rossi, J. (2007). Transcriptome classification of HCC is related to gene alterations and to new therapeutic targets. Hepatology, 45(1), 42–52. doi.org/10.1002/hep.21467.
70. Calderaro, J., Couchy, G., Imbeaud, S., Amaddeo, G., Letouzé, E., Blanc, J.-F., … Zucman-Rossi, J. (2017). Histological subtypes of hepatocellular carcinoma are related to gene mutations and molecular tumour classification. Journal of Hepatology, 67(4), 727–738. doi.org/10.1016/j.jhep.2017.05.014.
71. Harding, J. J., Nandakumar, S., Armenia, J., Khalil, D. N., Albano, M., Ly, M., … Solit, D. B. (2018). Prospective Genotyping of Hepatocellular Carcinoma: Clinical Implications of Next-Generation Sequencing for Matching Patients to Targeted and Immune Therapies. Clinical Cancer Research, 25(7), 2116–2126. doi.org/10.1158/1078-0432.ccr-18-2293.
72. Chang, M.-H., You, S.-L., Chen, C.-J., Liu, C.-J., Lai, M.-W., Wu, T.-C., … Lo, G.-H. (2016). Long-term Effects of Hepatitis B Immunization of Infants in Preventing Liver Cancer. Gastroenterology, 151(3), 472–480.e1. doi.org/10.1053/j.gastro.2016.05.048.
73. Burton, A., Kowalski, R., Gacic-Dobo, M., Karimov, R., & Brown, D. (2012). A Formal Representation of the WHO and UNICEF Estimates of National Immunization Coverage: A Computational Logic Approach. PLoS ONE, 7(10), e47806. doi.org/10.1371/journal.pone.0047806.
74. Hepatitis B Country Profile Ukraine. (2000). Retrieved from https://med.stanford.edu/content/dam/sm/liver/documents/ research/GlobalHepatitisBVaccinationCoverage/ EURO/Ukraine.pdf.
75. Jourdain, G., Ngo-Giang-Huong, N., Harrison, L., Decker, L., Khamduang, W., Tierney, C., … Suriyachai, P. (2018). Tenofovir versus Placebo to Prevent Perinatal Transmission of Hepatitis B. New England Journal of Medicine, 378(10), 911–923. doi.org/10.1056/nejmoa1708131.
76. Eke, A. C., Eleje, G. U., Eke, U. A., Xia, Y., & Liu, J. (2017). Hepatitis B immunoglobulin during pregnancy for prevention of mother‐to‐child transmission of hepatitis B virus. The Cochrane Database of Systematic Reviews, 2017(2). doi.org/10.1002/14651858.CD008545.pub2.
77. Smith, B. D., Morgan, R. L., Beckett, G. A., Falck-Ytter, Y., Holtzman, D., & Ward, J. W. (2012). Hepatitis C Virus Testing of Persons Born During 1945–1965: Recommendations From the Centers for Disease Control and Prevention. Annals of Internal Medicine, 157(11), 817. doi.org/10.7326/0003-4819-157-9-201211060-00529.
78. Papatheodoridis, G. V., Lampertico, P., Manolakopoulos, S., & Lok, A. (2010). Incidence of hepatocellular carcinoma in chronic hepatitis B patients receiving nucleos(t)ide therapy: A systematic review. Journal of Hepatology, 53(2), 348–356. doi.org/10.1016/j.jhep.2010.02.035.
79. Thomas, D. L. (2019). Global Elimination of Chronic Hepatitis. New England Journal of Medicine, 380(21), 2041–2050. doi.org/10.1056/nejmra1810477.
80. Patel, N. S., Hooker, J., Gonzalez, M., Bhatt, A., Nguyen, P., Ramirez, K., … Loomba, R. (2017). Weight Loss Decreases Magnetic Resonance Elastography Estimated Liver Stiffness in Nonalcoholic Fatty Liver Disease. Clinical Gastroenterology and Hepatology, 15(3), 463–464. doi.org/10.1016/j.cgh.2016.09.150.
81. Petrick, J. L., Campbell, P. T., Koshiol, J., Thistle, J. E., Andreotti, G., Beane-Freeman, L. E., … Purdue, M. P. (2018). Tobacco, alcohol use and risk of hepatocellular carcinoma and intrahepatic cholangiocarcinoma: The Liver Cancer Pooling Project. British Journal of Cancer, 118(7), 1005–1012. doi.org/10.1038/s41416-018-0007-z.
82. Liu, Y., Chang, C.-C. H., Marsh, G. M., & Wu, F. (2012). Population attributable risk of aflatoxin-related liver cancer: Systematic review and meta-analysis. European Journal of Cancer, 48(14), 2125–2136. doi.org/10.1016/j.ejca.2012.02.009.
83. Turner, P., Sylla, A., Gong, Y., Diallo, M., Sutcliffe, A., Hall, A., & Wild, C. (2005). Reduction in exposure to carcinogenic aflatoxins by postharvest intervention measures in west Africa: a community-based intervention study. The Lancet, 365(9475), 1950–1956. doi.org/10.1016/s0140-6736(05)66661-5.
84. Chen, J.-G.., Egner, P. A., Ng, D., Jacobson, L. P., Munoz, A., Zhu, Y.-R., … Kensler, T. W. (2013). Reduced Aflatoxin Exposure Presages Decline in Liver Cancer Mortality in an Endemic Region of China. Cancer Prevention Research, 6(10), 1038–1045. doi.org/10.1158/1940-6207.capr-13-0168.
85. Marrero, J. A., Kulik, L. M., Sirlin, C. B., Zhu, A. X., Finn, R. S., Abecassis, M. M., … Heimbach, J. K. (2018). Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology, 68(2), 723–750. doi.org/10.1002/hep.29913.
86. Papatheodoridis, G., Dalekos, G., Sypsa, V., Yurdaydin, C., Buti, M., Goulis, J., … Esteban, R. (2016). PAGE-B predicts the risk of developing hepatocellular carcinoma in Caucasians with chronic hepatitis B on 5-year antiviral therapy. Journal of Hepatology, 64(4), 800–806. doi.org/10.1016/j.jhep.2015.11.035.
87. Singal, A. G., Pillai, A., & Tiro, J. (2014). Early Detection, Curative Treatment, and Survival Rates for Hepatocellular Carcinoma Surveillance in Patients with Cirrhosis: A Meta-analysis. PLoS Medicine, 11(4), e1001624. doi.org/10.1371/journal.pmed.1001624.
88. Sung, H., Ferlay, J., Siegel, R. L., Laversanne, M., Soerjomataram, I., Jemal, A., & Bray, F. (2021). Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 71(3), 209–249. doi.org/10.3322/caac.21660.
89. Poustchi, H., Farrell, G. C., Strasser, S. I., Lee, A. U., McCaughan, G. W., & George, J. (2011). Feasibility of conducting a randomized control trial for liver cancer screening: Is a randomized controlled trial for liver cancer screening feasible or still needed? Hepatology, 54(6), 1998–2004. doi.org/10.1002/hep.24581.
90. Tan, C. H., Low, S.-C. A., & Thng, C. H. (2011). APASL and AASLD Consensus Guidelines on Imaging Diagnosis of Hepatocellular Carcinoma: A Review. International Journal of Hepatology, 2011, 1–11. doi.org/10.4061/2011/519783.
91. Santi, V., Trevisani, F., Gramenzi, A., Grignaschi, A., Mirici-Cappa, F., Poggio, P. D., … Bernardi, M. (2010). Semiannual surveillance is superior to annual surveillance for the detection of early hepatocellular carcinoma and patient survival. Journal of Hepatology, 53(2), 291–297. doi.org/10.1016/j.jhep.2010.03.010.
92. Trinchet, J.-C., Chaffaut, C., Bourcier, V., Degos, F., Henrion, J., Fontaine, H., … Groupe d’Etude et de Traitement du Carcinome Hépatocellulaire (GRETCH). (2011). Ultrasonographic surveillance of hepatocellular carcinoma in cirrhosis: a randomized trial comparing 3- and 6-month periodicities. Hepatology (Baltimore, Md.), 54(6), 1987–1997. doi.org/10.1002/hep.24545.
93. Chang, T.-S., Wu, Y.-C., Tung, S.-Y., Wei, K.-L., Hsieh, Y.-Y., Huang, H.-C., … Huang, Y.-H. (2015). Alpha-Fetoprotein Measurement Benefits Hepatocellular Carcinoma Surveillance in Patients with Cirrhosis. American Journal of Gastroenterology, 110(6), 836–844. doi.org/10.1038/ajg.2015.100.
94. McMahon, B. (2000). Screening for Hepatocellular Carcinoma in Alaska Natives Infected With Chronic Hepatitis B: A 16-Year Population-Based Study. Hepatology, 32(4), 842–846. doi.org/10.1053/jhep.2000.17914.
95. Yang, J. D., Dai, J., Singal, A. G., Gopal, P., Addissie, B. D., Nguyen, M. H., … Roberts, L. R. (2017). Improved Performance of Serum Alpha-Fetoprotein for Hepatocellular Carcinoma Diagnosis in HCV Cirrhosis with Normal Alanine Transaminase. Cancer Epidemiology, Biomarkers & Prevention, 26(7), 1085–1092. doi.org/10.1158/1055-9965.EPI-16-0747.
96. El-Serag, H. B., Kanwal, F., Davila, J. A., Kramer, J., & Richardson, P. (2014). A New Laboratory-Based Algorithm to Predict Development of Hepatocellular Carcinoma in Patients With Hepatitis C and Cirrhosis. Gastroenterology, 146(5), 1249–1255.e1. doi.org/10.1053/j.gastro.2014.01.045.
97. Tayob, N., Lok, A. S. F., Do, K.-A., & Feng, Z. (2016). Improved Detection of Hepatocellular Carcinoma by Using a Longitudinal Alpha-Fetoprotein Screening Algorithm. Clinical Gastroenterology and Hepatology, 14(3), 469-475.e2. doi.org/10.1016/j.cgh.2015.07.049.
98. Marrero, J. A., Feng, Z., Wang, Y., Nguyen, M. H., Befeler, A. S., Roberts, L. R., … Schwartz, M. (2009). α-Fetoprotein, Des-γ Carboxyprothrombin, and Lectin-Bound α-Fetoprotein in Early Hepatocellular Carcinoma. Gastroenterology, 137(1), 110–118. doi.org/10.1053/j.gastro.2009.04.005.
99. Lok, A. S., Sterling, R. K., Everhart, J. E., Wright, E. C., Hoefs, J. C., Di Bisceglie, A. M., … HALT-C Trial Group. (2010). Des-gamma-carboxy prothrombin and alpha-fetoprotein as biomarkers for the early detection of hepatocellular carcinoma. Gastroenterology, 138(2), 493–502. doi.org/10.1053/j.gastro.2009.10.031.
100. Berhane, S., Toyoda, H., Tada, T., Kumada, T., Kagebayashi, C., Satomura, S., … Yeo, W. (2016). Role of the GALAD and BALAD-2 Serologic Models in Diagnosis of Hepatocellular Carcinoma and Prediction of Survival in Patients. Clinical Gastroenterology and Hepatology, 14(6), 875–886.e6. doi.org/10.1016/j.cgh.2015.12.042.
101. Johnson, P. J., Pirrie, S. J., Cox, T. F., Berhane, S., Teng, M., Palmer, D., … Satomura, S. (2014). The detection of hepatocellular carcinoma using a prospectively developed and validated model based on serological biomarkers. Cancer Epidemiology, Biomarkers & Prevention, 23(1), 144–153. doi.org/10.1158/1055-9965.EPI-13-0870.
102. Yang, J. D., Addissie, B. D., Mara, K. C., Harmsen, W. S., Dai, J., Zhang, N., … Nguyen, M. H. (2018). GALAD Score for Hepatocellular Carcinoma Detection in Comparison with Liver Ultrasound and Proposal of GALADUS Score. Cancer Epidemiology Biomarkers & Prevention, 28(3), 531–538. doi.org/10.1158/1055-9965.epi-18-0281.
103. Lin, X.-J., Chong, Y., Guo, Z.-W., Xie, C., Yang, X.-J., Zhang, Q., … Lin, G. (2015). A serum microRNA classifier for early detection of hepatocellular carcinoma: a multicentre, retrospective, longitudinal biomarker identification study with a nested case-control study. The Lancet. Oncology, 16(7), 804–815. doi.org/10.1016/S1470-2045(15)00048-0.
104. Zhao, Y., Xue, F., Sun, J., Guo, S., Zhang, H., Qiu, B., … Xia, Q. (2014). Genome-wide methylation profiling of the different stages of hepatitis B virus-related hepatocellular carcinoma development in plasma cell-free DNA reveals potential biomarkers for early detection and high-risk monitoring of hepatocellular carcinoma. Clinical Epigenetics, 6(1). doi.org/10.1186/1868-7083-6-30.
105. Liao, W., Mao, Y., Ge, P., Yang, H., Xu, H., Lu, X., … Zhong, S. (2015). Value of Quantitative and Qualitative Analyses of Circulating Cell-Free DNA as Diagnostic Tools for Hepatocellular Carcinoma. Medicine, 94(14), e722. doi.org/10.1097/md.0000000000000722.
106. Shang, S., Plymoth, A., Ge, S., Feng, Z., Rosen, H. R., Sangrajrang, S., … Beretta, L. (2011). Identification of osteopontin as a novel marker for early hepatocellular carcinoma. Hepatology, 55(2), 483–490. doi.org/10.1002/hep.24703.
107. Kisiel, J. B., Dukek, B. A., V.S.R. Kanipakam, R., Ghoz, H. M., Yab, T. C., Berger, C. K., … Roberts, L. R. (2019). Hepatocellular Carcinoma Detection by Plasma Methylated DNA: Discovery, Phase I Pilot, and Phase II Clinical Validation. Hepatology, 69(3),1180–1192. doi.org/10.1002/hep.30244.
108. Atiq, O., Tiro, J., Yopp, A. C., Muffler, A., Marrero, J. A., Parikh, N. D., … Singal, A. G. (2016). An assessment of benefits and harms of hepatocellular carcinoma surveillance in patients with cirrhosis. Hepatology, 65(4), 1196–1205. doi.org/10.1002/hep.28895.
109. Rich, N. E., Parikh, N. D., & Singal, A. G. (2017). Overdiagnosis: An Understudied Issue in Hepatocellular Carcinoma Surveillance. Seminars in Liver Disease, 37(4), 296–304. doi.org/10.1055/s-0037-1608775.
110. Mitchell, D. G., Bruix, J., Sherman, M., & Sirlin, C. B. (2014). LI‐RADS (Liver Imaging Reporting and Data System): Summary, discussion, and consensus of the LI‐RADS Management Working Group and future directions. Hepatology, 61(3), 1056–1065. doi.org/10.1002/hep.27304.
111. Tang, A., Bashir, M. R., Corwin, M. T., Cruite, I., Dietrich, C. F., Do, R. K. G., … Sirlin, C. B. (2018). Evidence Supporting LI-RADS Major Features for CT- and MR Imaging–based Diagnosis of Hepatocellular Carcinoma: A Systematic Review. Radiology, 286(1), 29–48. doi.org/10.1148/radiol.2017170554.
112. Liu, P.-H., Hsu, C.-Y., Hsia, C.-Y., Lee, Y.-H., Su, C.-W., Huang, Y.-H., … Huo, T.-I. (2016). Prognosis of hepatocellular carcinoma: Assessment of eleven staging systems. Journal of Hepatology, 64(3), 601–608. doi.org/10.1016/j.jhep.2015.10.029.
113. Llovet, J., Brú, C., & Bruix, J. (1999). Prognosis of Hepatocellular Carcinoma: The BCLC Staging Classification. Seminars in Liver Disease, 19(03), 329–338. doi.org/10.1055/s-2007-1007122.
114. Forner, A., Reig, M., & Bruix, J. (2018). Hepatocellular carcinoma. The Lancet, 391(10127), 1301–1314. doi.org/10.1016/s0140-6736(18)30010-2.
115. Giannini, E. G., Moscatelli, A., Pellegatta, G., Vitale, A., Farinati, F., Ciccarese, F., … Baroni, G. S. (2016). Application of the Intermediate-Stage Subclassification to Patients With Untreated Hepatocellular Carcinoma. The American Journal of Gastroenterology, 111(1), 70–77. doi.org/10.1038/ajg.2015.389.
116. Kudo, M., Chung, H., Haji, S., Osaki, Y., Oka, H., Seki, T., … Matsunaga, T. (2004). Validation of a new prognostic staging system for hepatocellular carcinoma: the JIS score compared with the CLIP score. Hepatology (Baltimore, Md.), 40(6), 1396–1405. doi.org/10.1002/hep.20486.
117. Hiraoka, A., Kumada, T., Nouso, K., Tsuji, K., Itobayashi, E., Hirooka, M., … Michitaka, K. (2016). Proposed New Sub-Grouping for Intermediate-Stage Hepatocellular Carcinoma Using Albumin-Bilirubin Grade. Oncology, 91(3), 153–161. doi.org/10.1159/000447061.
118. Johnson, P. J., Berhane, S., Kagebayashi, C., Satomura, S., Teng, M., Reeves, H. L., … Toyoda, H. (2015). Assessment of Liver Function in Patients With Hepatocellular Carcinoma: A New Evidence-Based Approach — The ALBI Grade. Journal of Clinical Oncology, 33(6), 550–558. doi.org/10.1200/jco.2014.57.9151.
119. Yau, T., Tang, V. Y. F., Yao, T.-J., Fan, S.-T., Lo, C.-M., & Poon, R. T. P. (2014). Development of Hong Kong Liver Cancer Staging System With Treatment Stratification for Patients With Hepatocellular Carcinoma. Gastroenterology, 146(7), 1691–1700.e3. doi.org/10.1053/j.gastro.2014.02.032.
120. Sohn, J. H., Duran, R., Zhao, Y., Fleckenstein, F., Chapiro, J., Sahu, S., … Geschwind, J.-F. (2017). Validation of the Hong Kong Liver Cancer Staging System in Determining Prognosis of the North American Patients Following Intra-arterial Therapy. Clinical Gastroenterology and Hepatology, 15(5), 746–755.e4. doi.org/10.1016/j.cgh.2016.10.036.
121. Wu, L., Bartlett, A., Plank, L., & McCall, J. (2016). Validation of the Hong Kong liver cancer staging system in hepatocellular carcinoma patients treated with curative intent. Journal of Hepatology, 64(4), 978–979. doi.org/10.1016/j.jhep.2015.12.008.
122. Yang, J. D., Kim, W. R., Park, K. W., Chaiteerakij, R., Kim, B., Sanderson, S. O., … Park, J.-W. (2012). Model to estimate survival in ambulatory patients with hepatocellular carcinoma. Hepatology, 56(2), 614–621. doi.org/10.1002/hep.25680.
123. Farinati, F., Vitale, A., Spolverato, G., Pawlik, T. M., Huo, T., Lee, Y.-H., … Morisco, F. (2016). Development and Validation of a New Prognostic System for Patients with Hepatocellular Carcinoma. PLoS Medicine, 13(4), e1002006. doi.org/10.1371/journal.pmed.1002006.
124. Toyoda, H., Kumada, T., Osaki, Y., Oka, H., Urano, F., Kudo, M., & Matsunaga, T. (2006). Staging hepatocellular carcinoma by a novel scoring system (BALAD score) based on serum markers. Clinical Gastroenterology and Hepatology, 4(12), 1528–1536. doi.org/10.1016/j.cgh.2006.09.021.
125. Reig, M., Forner, A., Rimola, J., Ferrer-Fàbrega, J., Burrel, M., Garcia-Criado, Á., … Bruix, J. (2022). BCLC strategy for prognosis prediction and treatment recommendation: The 2022 update. Journal of Hepatology, 76(3), 681–693. doi.org/10.1016/j.jhep.2021.11.018.
126. Serper, M., Taddei, T. H., Mehta, R., D’Addeo, K., Dai, F., Aytaman, A., … Kaplan, D. E. (2017). Association of Provider Specialty and Multidisciplinary Care With Hepatocellular Carcinoma Treatment and Mortality. Gastroenterology, 152(8), 1954–1964. doi.org/10.1053/j.gastro.2017.02.040.
127. Berzigotti, A., Reig, M., Abraldes, J. G., Bosch, J., & Bruix, J. (2015). Portal hypertension and the outcome of surgery for hepatocellular carcinoma in compensated cirrhosis: A systematic review and meta-analysis. Hepatology, 61(2), 526–536. doi.org/10.1002/hep.27431.
128. Boleslawski, E., Petrovai, G., Truant, S., Dharancy, S., Duhamel, A., Salleron, J., … Pruvot, F. R. (2012). Hepatic venous pressure gradient in the assessment of portal hypertension before liver resection in patients with cirrhosis. The British Journal of Surgery, 99(6), 855–863. doi.org/10.1002/bjs.8753.
129. Teh, S. H., Christein, J., Donohue, J., Que, F., Kendrick, M., Farnell, M., … Nagorney, D. M. (2005). Hepatic resection of hepatocellular carcinoma in patients with cirrhosis: Model of End-Stage Liver Disease (MELD) score predicts perioperative mortality. Journal of Gastrointestinal Surgery, 9(9), 1207–1215; discussion 1215. doi.org/10.1016/j.gassur.2005.09.008.
130. Roayaie, S., Jibara, G., Tabrizian, P., Park, J.-W., Yang, J., Yan, L., … Sherman, M. (2015). The role of hepatic resection in the treatment of hepatocellular cancer. Hepatology, 62(2), 440–451. doi.org/10.1002/hep.27745.
131. Kim, H., Ahn, S. W., Hong, S. K., Yoon, K. C., Kim, H.-S., Choi, Y. R., … Suh, K.-S. (2017). Survival benefit of liver resection for Barcelona Clinic Liver Cancer stage B hepatocellular carcinoma. British Journal of Surgery, 104(8), 1045–1052. doi.org/10.1002/bjs.10541.
132. Tabrizian, P., Jibara, G., Shrager, B., Schwartz, M., & Roayaie, S. (2015). Recurrence of Hepatocellular Cancer After Resection. Annals of Surgery, 261(5), 947–955. doi.org/10.1097/sla.0000000000000710.
133. Hoshida, Y., Villanueva, A., Kobayashi, M., Peix, J., Chiang, D. Y., Camargo, A., … Thung, S. (2008). Gene expression in fixed tissues and outcome in hepatocellular carcinoma. The New England Journal of Medicine, 359(19), 1995–2004. doi.org/10.1056/NEJMoa0804525.
134. Ferrer-Fàbrega, J., Forner, A., Liccioni, A., Miquel, R., Molina, V., Navasa, M., … Fuster, J. (2016). Prospective validation of ab initio liver transplantation in hepatocellular carcinoma upon detection of risk factors for recurrence after resection. Hepatology, 63(3), 839–849. doi.org/10.1002/hep.28339.
135. Hammad, A. Y., Robbins, J. R., Turaga, K. K., Christians, K. K., Gamblin, T. C., & Johnston, F. M. (2017). Palliative interventions for hepatocellular carcinoma patients: analysis of the National Cancer Database. Annals of Palliative Medicine, 6(1), 265–235. doi.org/10.21037/apm.2016.11.02.
136. Hawkins, M. A., & Dawson, L. A. (2006). Radiation therapy for hepatocellular carcinoma. Cancer, 106(8), 1653–1663. doi.org/10.1002/cncr.21811.
137. Hayashi, S. (2014). Palliative external-beam radiotherapy for bone metastases from hepatocellular carcinoma. World Journal of Hepatology, 6(12), 923. doi.org/10.4254/wjh.v6.i12.923.
138. Yang, J. D., Larson, J. J., Watt, K. D., Allen, A. M., Wiesner, R. H., Gores, G. J., … Leise, M. D. (2017). Hepatocellular Carcinoma Is the Most Common Indication for Liver Transplantation and Placement on the Waitlist in the United States. Clinical Gastroenterology and Hepatology, 15(5), 767–775.e3. doi.org/10.1016/j.cgh.2016.11.034.
139. Mazzaferro, V., Regalia, E., Doci, R., Andreola, S., Pulvirenti, A., Bozzetti, F., … Gennari, L. (1996). Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. The New England Journal of Medicine, 334(11), 693–699. doi.org/10.1056/NEJM199603143341104.
140. Yao, F. Y., Hirose, R., LaBerge, J. M., Davern, T. J., Bass, N. M., Kerlan, R. K., … Roberts, J. P. (2005). A prospective study on downstaging of hepatocellular carcinoma prior to liver transplantation. Liver Transplantation, 11(12), 1505–1514. doi.org/10.1002/lt.20526.
141. Mazzaferro, V., Llovet, J. M., Miceli, R., Bhoori, S., Schiavo, M., Mariani, L., … Rossi, M. (2009). Predicting survival after liver transplantation in patients with hepatocellular carcinoma beyond the Milan criteria: a retrospective, exploratory analysis. The Lancet. Oncology, 10(1), 35–43. doi.org/10.1016/S1470-2045(08)70284-5.
142. Yao, F. (2001). Liver transplantation for hepatocellular carcinoma: Expansion of the tumor size limits does not adversely impact survival. Hepatology, 33(6), 1394–1403. doi.org/10.1053/jhep.2001.24563.
143. Yao, F. (2002). Liver transplantation for hepatocellular carcinoma: Comparison of the proposed UCSF criteria with the Milan criteria and the Pittsburgh modified TNM criteria. Liver Transplantation, 8(9), 765–774. doi.org/10.1053/jlts.2002.34892.
144. Yao, F. Y., Xiao, L., Bass, N. M., Kerlan, R., Ascher, N. L., & Roberts, J. P. (2007). Liver Transplantation for Hepatocellular Carcinoma: Validation of the UCSF-Expanded Criteria Based on Preoperative Imaging. American Journal of Transplantation, 7(11), 2587–2596. doi.org/10.1111/j.1600-6143.2007.01965.x.
145. Yao, F. Y., Kerlan, R. K., Hirose, R., Davern, T. J., Bass, N. M., Feng, S., … Roberts, J. P. (2008). Excellent Outcome Following Down-Staging of Hepatocellular Carcinoma Prior to Liver Transplantation: An Intention-to-Treat Analysis. Hepatology (Baltimore, Md.), 48(3), 819–827. doi.org/10.1002/hep.22412.
146. Mehta, N., Guy, J., Frenette, C. T., Dodge, J. L., Osorio, R. W., Minteer, W. B., … Yao, F. Y. (2018). Excellent Outcomes of Liver Transplantation Following Down-Staging of Hepatocellular Carcinoma to Within Milan Criteria: A Multicenter Study. Clinical Gastroenterology and Hepatology, 16(6), 955–964. doi.org/10.1016/j.cgh.2017.11.037.
147. Llovet, J. M., De Baere, T., Kulik, L., Haber, P. K., Greten, T. F., Meyer, T., & Lencioni, R. (2021). Locoregional therapies in the era of molecular and immune treatments for hepatocellular carcinoma. Nature Reviews Gastroenterology & Hepatology, 18(5), 293–313. doi.org/10.1038/s41575-020-00395-0.
148. Shiina, S., Sato, K., Tateishi, R., Shimizu, M., Ohama, H., Hatanaka, T., … Imai, Y. (2018). Percutaneous Ablation for Hepatocellular Carcinoma: Comparison of Various Ablation Techniques and Surgery. Canadian Journal of Gastroenterology & Hepatology, 2018, 4756147. doi.org/10.1155/2018/4756147.
149. Yu, J., Yu, X., Han, Z., Cheng, Z., Liu, F., Zhai, H., … Liang, P. (2016). Percutaneous cooled-probe microwave versus radiofrequency ablation in early-stage hepatocellular carcinoma: a phase III randomised controlled trial. Gut, 66(6), 1172–1173. doi.org/10.1136/gutjnl-2016-312629.
150. Liu, W., Zheng, Y., He, W., Zou, R., Qiu, J., Shen, J., … Yuan, Y. (2018). Microwave vs radiofrequency ablation for hepatocellular carcinoma within the Milan criteria: a propensity score analysis. Alimentary Pharmacology & Therapeutics, 48(6), 671–681. doi.org/10.1111/apt.14929.
151. Kang, T. W., Lim, H. K., & Cha, D. I. (2018). Percutaneous ablation for perivascular hepatocellular carcinoma: Refining the current status based on emerging evidence and future perspectives. World Journal of Gastroenterology, 24(47), 5331–5337. doi.org/10.3748/wjg.v24.i47.5331.
152. Vietti Violi, N., Duran, R., Guiu, B., Cercueil, J.-P., Aubé, C., Digklia, A., … Denys, A. (2018). Efficacy of microwave ablation versus radiofrequency ablation for the treatment of hepatocellular carcinoma in patients with chronic liver disease: a randomised controlled phase 2 trial. The Lancet Gastroenterology & Hepatology, 3(5), 317–325. doi.org/10.1016/s2468-1253(18)30029-3.
153. Kim, G. M., Won, J. Y., Kim, M. D., Park, S. I., Lee, D. Y., Shin, W., … Kim, S. U. (2016). Cryoablation of Hepatocellular Carcinoma with High-Risk for Percutaneous Ablation: Safety and Efficacy. CardioVascular and Interventional Radiology, 39(10), 1447–1454. doi.org/10.1007/s00270-016-1384-4.
154. Littrup, P. J., Aoun, H. D., Adam, B., Krycia, M., Prus, M., & Shields, A. (2016). Percutaneous cryoablation of hepatic tumors: long-term experience of a large U.S. series. Abdominal Radiology, 41(4), 767–780. doi.org/10.1007/s00261-016-0687-x.
155. Xu, Y., Shen, Q., Liu, P., Xu, Z., Wu, P., Lu, Z., … Qian, G. (2017). Microwave ablation for the treatment of hepatocellular carcinoma that met up-to-seven criteria: feasibility, local efficacy and long-term outcomes. European Radiology, 27(9), 3877–3887. doi.org/10.1007/s00330-017-4740-0.
156. Lee, M. W., Raman, S. S., Asvadi, N. H., Siripongsakun, S., Hicks, R. M., Chen, J., … Lu, D. S. K. (2017). Radiofrequency ablation of hepatocellular carcinoma as bridge therapy to liver transplantation: A 10-year intention-to-treat analysis. Hepatology, 65(6), 1979–1990. doi.org/10.1002/hep.29098.
157. Heimbach, J. K., Kulik, L. M., Finn, R. S., Sirlin, C. B., Abecassis, M. M., Roberts, L. R., … Marrero, J. A. (2017). AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology, 67(1), 358–380. doi.org/10.1002/hep.29086.
158. Huang, J., Yan, L., Cheng, Z., Wu, H., Du, L., Wang, J., … Zeng, Y. (2010). A Randomized Trial Comparing Radiofrequency Ablation and Surgical Resection for HCC Conforming to the Milan Criteria. Annals of Surgery, 252(6), 903–912. doi.org/10.1097/SLA.0b013e3181efc656.
159. Feng, K., Yan, J., Li, X., Xia, F., Ma, K., Wang, S., … Dong, J. (2012). A randomized controlled trial of radiofrequency ablation and surgical resection in the treatment of small hepatocellular carcinoma. Journal of Hepatology, 57(4), 794–802. doi.org/10.1016/j.jhep.2012.05.007.
160. Chen, M.-S., Li, J.-Q., Zheng, Y., Guo, R.-P., Liang, H.-H., Zhang, Y.-Q., … Lau, W. Y. (2006). A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma. Annals of Surgery, 243(3), 321–328. doi.org/10.1097/01.sla.0000201480.65519.b8.
161. Lencioni, R., de Baere, T., Soulen, M. C., Rilling, W. S., & Geschwind, J.-F. H. (2016). Lipiodol transarterial chemoembolization for hepatocellular carcinoma: A systematic review of efficacy and safety data. Hepatology, 64(1), 106–116. doi.org/10.1002/hep.28453.
162. Lo, C. (2002). Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology, 35(5), 1164–1171. doi.org/10.1053/jhep.2002.33156.
163. Llovet, J. M., Real, M. I., Montaña, X., Planas, R., Coll, S., Aponte, J., … Barcelona Liver Cancer Group. (2002). Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet (London, England), 359(9319), 1734–1739. doi.org/10.1016/S0140-6736(02)08649-X.
164. Brown, K. T., Do, R. K., Gonen, M., Covey, A. M., Getrajdman, G. I., Sofocleous, C. T., … Abou-Alfa, G. K. (2016). Randomized Trial of Hepatic Artery Embolization for Hepatocellular Carcinoma Using Doxorubicin-Eluting Microspheres Compared With Embolization With Microspheres Alone. Journal of Clinical Oncology, 34(17), 2046–2053. doi.org/10.1200/jco.2015.64.0821.
165. Malagari, K., Pomoni, M., Moschouris, H., Bouma, E., Koskinas, J., Stefaniotou, A., … Kelekis, D. (2012). Chemoembolization With Doxorubicin-Eluting Beads for Unresectable Hepatocellular Carcinoma: Five-Year Survival Analysis. CardioVascular and Interventional Radiology, 35(5), 1119–1128. doi.org/10.1007/s00270-012-0394-0.
166. Kulik, L. M., Carr, B. I., Mulcahy, M. F., Lewandowski, R. J., Atassi, B., Ryu, R. K., … Salem, R. (2008). Safety and efficacy of 90Y radiotherapy for hepatocellular carcinoma with and without portal vein thrombosis. Hepatology (Baltimore, Md.), 47(1), 71–81. doi.org/10.1002/hep.21980.
167. Sangro, B., Carpanese, L., Cianni, R., Golfieri, R., Gasparini, D., Ezziddin, S., … Urigo, C. (2011). Survival after yttrium-90 resin microsphere radioembolization of hepatocellular carcinoma across Barcelona clinic liver cancer stages: A European evaluation. Hepatology, 54(3), 868–878. doi.org/10.1002/hep.24451.
168. Salem, R., Lewandowski, R. J., Kulik, L., Wang, E., Riaz, A., Ryu, R. K., …Vogelzang, R. L. (2011). Radioembolization Results in Longer Time-to-Progression and Reduced Toxicity Compared With Chemoembolization in Patients With Hepatocellular Carcinoma. Gastroenterology, 140(2), 497–507.e2. doi.org/10.1053/j.gastro.2010.10.049.
169. Mazzaferro, V., Sposito, C., Bhoori, S., Romito, R., Chiesa, C., Morosi, C., … Spreafico, C. (2013). Yttrium-90 radioembolization for intermediate-advanced hepatocellular carcinoma: A phase 2 study. Hepatology, 57(5), 1826–1837. doi.org/10.1002/hep.26014.
170. Salem, R., Gordon, A. C., Mouli, S., Hickey, R., Kallini, J., Gabr, A., … Lewandowski, R. J. (2016). Y90 Radioembolization Significantly Prolongs Time to Progression Compared With Chemoembolization in Patients With Hepatocellular Carcinoma. Gastroenterology, 151(6), 1155–1163.e2. doi.org/10.1053/j.gastro.2016.08.029.
171. Lobo, L., Yakoub, D., Picado, O., Ripat, C., Pendola, F., Sharma, R., … Yechieli, R. (2016). Unresectable Hepatocellular Carcinoma: Radioembolization Versus Chemoembolization: A Systematic Review and Meta-analysis. CardioVascular and Interventional Radiology, 39(11), 1580–1588. doi.org/10.1007/s00270-016-1426-y.
172. Carr, B. I., Kondragunta, V., Buch, S. C., & Branch, R. A. (2010). Therapeutic equivalence in survival for hepatic arterial chemoembolization and yttrium 90 microsphere treatments in unresectable hepatocellular carcinoma: a two-cohort study. Cancer, 116(5), 1305–1314. doi.org/10.1002/cncr.24884.
173. Chow, P. K. H., Gandhi, M., Tan, S.-B., Khin, M. W., Khasbazar, A., Ong, J., … Jong, Y. W. (2018). SIRveNIB: Selective Internal Radiation Therapy Versus Sorafenib in Asia-Pacific Patients With Hepatocellular Carcinoma. Journal of Clinical Oncology, 36(19), 1913–1921. doi.org/10.1200/jco.2017.76.0892.
174. Vilgrain, V., Pereira, H., Assenat, E., Guiu, B., Ilonca, A. D., Pageaux, G.-P., …Seitz, J.-F. (2017). Efficacy and safety of selective internal radiotherapy with yttrium-90 resin microspheres compared with sorafenib in locally advanced and inoperable hepatocellular carcinoma (SARAH): an open-label randomised controlled phase 3 trial. The Lancet Oncology, 18(12), 1624–1636. doi.org/10.1016/s1470-2045(17)30683-6.
175. Hong, T. S., Wo, J. Y., Yeap, B. Y., Ben-Josef, E., McDonnell, E. I., Blaszkowsky, L. … Ferrone, C. R. (2016). Multi-Institutional Phase II Study of High-Dose Hypofractionated Proton Beam Therapy in Patients With Localized, Unresectable Hepatocellular Carcinoma and Intrahepatic Cholangiocarcinoma. Journal of Clinical Oncology, 34(5), 460–468. doi.org/10.1200/jco.2015.64.2710.
176. Ahn, J. C., Lauzon, M., Luu, M., Friedman, M. L., Kosari, K., Nissen, N., … Yang, J. D. (2021). Transarterial Radioembolization Versus Systemic Treatment for Hepatocellular Carcinoma with Macrovascular Invasion: Analysis of the U.S. National Cancer Database. Journal of Nuclear Medicine, 62(12), 1692–1701. doi.org/10.2967/jnumed.121.261954.
177. Bush, D. A., Smith, J. C., Slater, J. D., Volk, M. L., Reeves, M. E., Cheng, J., Grove, R., & de Vera, M. E. (2016). Randomized Clinical Trial Comparing Proton Beam Radiation Therapy with Transarterial Chemoembolization for Hepatocellular Carcinoma: Results of an Interim Analysis. International Journal of Radiation Oncology, Biology, Physics, 95(1), 477–482. doi.org/10.1016/j.ijrobp.2016.02.027.
178. Fukuda, K., Okumura, T., Abei, M., Fukumitsu, N., Ishige, K., Mizumoto, M., … Hyodo, I. (2017). Long-term outcomes of proton beam therapy in patients with previously untreated hepatocellular carcinoma. Cancer Science, 108(3), 497–503. doi.org/10.1111/cas.13145.
179. Hong, T. S., Wo, J. Y., Yeap, B. Y., Ben-Josef, E., McDonnell, E. I., Blaszkowsky, L. S., … Ferrone, C. R. (2016). Multi-Institutional Phase II Study of High-Dose Hypofractionated Proton Beam Therapy in Patients With Localized, Unresectable Hepatocellular Carcinoma and Intrahepatic Cholangiocarcinoma. Journal of Clinical Oncology, 34(5), 460–468. doi.org/10.1200/jco.2015.64.2710.
180. Igaki, H., Mizumoto, M., Okumura, T., Hasegawa, K., Kokudo, N., & Sakurai, H. (2018). A systematic review of publications on charged particle therapy for hepatocellular carcinoma. International Journal of Clinical Oncology, 23(3), 423–433. doi.org/10.1007/s10147-017-1190-2.
181. Sapir, E., Tao, Y., Schipper, M. J., Bazzi, L., Novelli, P. M., Devlin, P., … Feng, M. (2018). Stereotactic Body Radiation Therapy as an Alternative to Transarterial Chemoembolization for Hepatocellular Carcinoma. International Journal of Radiation Oncology, Biology, Physics, 100(1), 122–130. doi.org/10.1016/j.ijrobp.2017.09.001.
182. Sapisochin, G., Barry, A., Doherty, M., Fischer, S., Goldaracena, N., Rosales, R., … Grant, D. R. (2017). Stereotactic body radiotherapy vs. TACE or RFA as a bridge to transplant in patients with hepatocellular carcinoma. An intention-to-treat analysis. Journal of Hepatology, 67(1), 92–99. doi.org/10.1016/j.jhep.2017.02.022.
183. Teraoka, Y., Kimura, T., Aikata, H., Daijo, K., Osawa, M., Honda, F., … Nagata, Y. (2018). Clinical outcomes of stereotactic body radiotherapy for elderly patients with hepatocellular carcinoma. Hepatology Research, 48(2), 193–204. doi.org/10.1111/hepr.12916.
184. Zeng, Z.-C., Seong, J., Yoon, S. M., Cheng, J. C.-H., Lam, K.-O., Lee, A.-S., …Hu, Y. (2017). Consensus on Stereotactic Body Radiation Therapy for Small-Sized Hepatocellular Carcinoma at the 7th Asia-Pacific Primary Liver Cancer Expert Meeting. Liver Cancer, 6(4), 264–274. doi.org/10.1159/000475768.
185. Marrero, J. A., Kulik, L. M., Sirlin, C. B., Zhu, A. X., Finn, R. S., Abecassis, M. M., … Heimbach, J. K. (2018). Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology, 68(2), 723–750. doi.org/10.1002/hep.29913.
186. Galle, P. R., Forner, A., Llovet, J. M., Mazzaferro, V., Piscaglia, F., Raoul, J.-L., … Vilgrain, V. (2018). EASL Clinical Practice Guidelines, Management of hepatocellular carcinoma. Journal of Hepatology, 69(1), 182–236. doi.org/10.1016/j.jhep.2018.03.019.
187. Kudo, M., Finn, R. S., Qin, S., Han, K.-H., Ikeda, K., Piscaglia, F., … Tamai, T. (2018). Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. The Lancet, 391(10126), 1163–1173. doi.org/10.1016/s0140-6736(18)30207-1.
188. Bruix, J., Qin, S., Merle, P., Granito, A., Huang, Y.-H., Bodoky, G., …Finn, R. S. (2017). Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet, 389(10064), 56–66. doi.org/10.1016/s0140-6736(16)32453-9.
189. Zhu, A. X., Kang, Y.-K., Yen, C.-J., Finn, R. S., Galle, P. R., Llovet, J. M., …Okusaka, T. (2019). Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and increased α-fetoprotein concentrations (REACH-2): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet Oncology, 20(2), 282–296. doi.org/10.1016/s1470-2045(18)30937-9.
190. Abou-Alfa, G. K., Meyer, T., Cheng, A.-L., El-Khoueiry, A. B., Rimassa, L., Ryoo, B.-Y., … Borgman-Hagey, A. E. (2018). Cabozantinib in Patients with Advanced and Progressing Hepatocellular Carcinoma. New England Journal of Medicine, 379(1), 54–63. doi.org/10.1056/nejmoa1717002/
191. Finn, R. S., Ryoo, B.-Y., Merle, P., Kudo, M., Bouattour, M., Lim, H. Y., …Cheng, A.-L. (2020). Pembrolizumab As Second-Line Therapy in Patients With Advanced Hepatocellular Carcinoma in KEYNOTE-240: A Randomized, Double-Blind, Phase III Trial. Journal of Clinical Oncology, 38(3), 193–202. doi.org/10.1200/jco.19.01307.
192. Finn, R. S., Qin, S., Ikeda, M., Galle, P. R., Ducreux, M., Kim, T.-Y., … Zhu, A. X. (2020). Atezolizumab plus Bevacizumab in Unresectable Hepatocellular Carcinoma. New England Journal of Medicine, 382(20), 1894–1905. doi.org/10.1056/nejmoa1915745.
193. Llovet, J. M., Ricci, S., Mazzaferro, V., Hilgard, P., Gane, E., Blanc, J.-F., …Giannaris, T. (2008). Sorafenib in Advanced Hepatocellular Carcinoma. New England Journal of Medicine, 359(4), 378–390. doi.org/10.1056/nejmoa0708857.
194. Cheng, A.-L., Kang, Y.-K., Chen, Z., Tsao, C.-J., Qin, S., Kim, J. S., … Voliotis, D. (2009). Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma: a phase III randomised, double-blind, placebo-controlled trial. The Lancet Oncology, 10(1), 25–34. doi.org/10.1016/s1470-2045(08)70285-7.
195. Bruix, J., Takayama, T., Mazzaferro, V., Chau, G.-Y., Yang, J., Kudo, M., … Llovet, J. M. (2015). Adjuvant sorafenib for hepatocellular carcinoma after resection or ablation (STORM): a phase 3, randomised, double-blind, placebo-controlled trial. The Lancet Oncology, 16(13), 1344–1354. doi.org/10.1016/s1470-2045(15)00198-9.
196. Lencioni, R., Llovet, J. M., Han, G., Tak, W. Y., Yang, J., Guglielmi, A., …Bruix, J. (2016). Sorafenib or placebo plus TACE with doxorubicin-eluting beads for intermediate stage HCC: The SPACE trial. Journal of Hepatology, 64(5), 1090–1098. doi.org/10.1016/j.jhep.2016.01.012.
197. Kudo, M., Finn, R. S., Qin, S., Han, K.-H., Ikeda, K., Piscaglia, F., … Tamai, T. (2018). Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. The Lancet, 391(10126), 1163–1173. doi.org/10.1016/s0140-6736(18)30207-1.
198. Bruix, J., Qin, S., Merle, P., Granito, A., Huang, Y.-H., Bodoky, G., …Finn, R. S. (2017). Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet, 389(10064), 56–66. doi.org/10.1016/s0140-6736(16)32453-9.
199. Abou-Alfa, G. K., Meyer, T., Cheng, A.-L., El-Khoueiry, A. B., Rimassa, L., Ryoo, B.-Y., … Borgman-Hagey, A. E. (2018). Cabozantinib in Patients with Advanced and Progressing Hepatocellular Carcinoma. New England Journal of Medicine, 379(1), 54–63. doi.org/10.1056/nejmoa1717002.
200. Zhu, A. X., Kang, Y.-K., Yen, C.-J., Finn, R. S., Galle, P. R., Llovet, J. M., …Okusaka, T. (2019). Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and increased α-fetoprotein concentrations (REACH-2): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet Oncology, 20(2), 282–296. doi.org/10.1016/s1470-2045(18)30937-9.
201. Spratlin, J. L., Cohen, R. B., Eadens, M., Gore, L., Camidge, D. R., Diab, S., …Eckhardt, S. G. (2010). Phase I Pharmacologic and Biologic Study of Ramucirumab (IMC-1121B), a Fully Human Immunoglobulin G1Monoclonal Antibody Targeting the Vascular Endothelial Growth Factor Receptor-2. Journal of Clinical Oncology, 28(5), 780–787. doi.org/10.1200/jco.2009.23.7537.
202. El-Khoueiry, A. B., Sangro, B., Yau, T., Crocenzi, T. S., Kudo, M., Hsu, C., … Dastani, H. B. (2017). Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-label, non-comparative, phase 1/2 dose escalation and expansion trial. The Lancet, 389(10088), 2492–2502. doi.org/10.1016/s0140-6736(17)31046-2.
203. Zhu, A. X., Finn, R. S., Edeline, J., Cattan, S., Ogasawara, S., Palmer, D., …Cheng, A.-L. (2018). Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (KEYNOTE-224): a non-randomised, open-label phase 2 trial. The Lancet Oncology, 19(7), 940–952. doi.org/10.1016/S1470-2045(18)30351-6.
204. Abou-Alfa, G. K., Lau, G., Kudo, M., Chan, S. L., Kelley, R. K., Furuse, J., …Azevedo, S. (2022). Tremelimumab plus Durvalumab in Unresectable Hepatocellular Carcinoma. NEJM Evidence. doi.org/10.1056/evidoa2100070.
205. Amit, G., & Singal, M. D. (2022). Dr. Singal on the FDA Approval of Durvalumab With Tremelimumab in Unresectable HCC. Retrieved from https://www.onclive.com/ view/dr-singal-on-the-fda-approval-of-durvalumab-with-tremelimumab-in-unresectable-hcc.
206. Yang, J. D., Hainaut, P., Gores, G. J., Amadou, A., Plymoth, A., & Roberts, L. R. (2019). A global view of hepatocellular carcinoma: trends, risk, prevention and management. Nature Reviews Gastroenterology & Hepatology, 16(10), 589–604. doi.org/10.1038/s41575-019-0186-y.
207. Hainaut, P., & Boyle, P. (2008). Curbing the liver cancer epidemic in Africa. The Lancet, 371(9610), 367–368. doi.org/10.1016/s0140-6736(08)60181-6.
208. Goh, L.-Y., & Goh, K.-L. (2013). Obesity: An epidemiological perspective from Asia and its relationship to gastrointestinal and liver cancers. Journal of Gastroenterology and Hepatology, 28, 54–58. doi.org/10.1111/jgh.12293.
209. Petrick, J. L., Kelly, S. P., Altekruse, S. F., McGlynn, K. A., & Rosenberg, P. S. (2016). Future of Hepatocellular Carcinoma Incidence in the United States Forecast Through 2030. Journal of Clinical Oncology, 34(15), 1787–1794. doi.org/10.1200/jco.2015.64.7412.
210. Kjesbu, I. E., Laursen, C. B., Graven, T., Holden, H. M., Rømo, B., Newton Andersen, G., … Dalen, H. (2017). Feasibility and Diagnostic Accuracy of Point-of-Care Abdominal Sonography by Pocket-Sized Imaging Devices, Performed by Medical Residents. Journal of Ultrasound in Medicine, 36(6), 1195–1202. doi.org/10.7863/ultra.16.05077.
211. Waheed, Y. (2015). Transition from millennium development goals to sustainable development goals and hepatitis. Pathogens and Global Health, 109(8), 353–353. doi.org/10.1080/20477724.2015.1126035.
212. Kenya Outreach Mission. (2017). Retrieved from http://www.ihpba.org/ includes/moxiemanager/ data/files/ IHPBA%20Outreach%20Kenya%202017% 20Leaflet% 20WEBSITE.pdf.
Адреса для листування:
Пацко Вероніка
Державне некомерційне підприємство«Національний інститут раку»
03022 Київ, вул. Юлії Здановської, 33/43
Національний інститут раку
Е-mail: veronikapatskooncologist@gmail.com
Сorrespondence:
Veronika Patsko
Nonprofit Organization National Cancer Institute
Yulii Zdanovskoi str. 33/43, Kyiv, 03022
E-mail: veronikapatskooncologist@gmail.com














Leave a comment