Практичні настанови Європейської асоціації клінічного харчування та метаболізму (ESPEN): клінічне харчування при онкологічних захворюваннях
Мускарітолі Мауріціо1, Арендс Ян2, Бахман Патрик3, Баракос Вікі4, Бартелемі Ніколь5, Бертц Гартмут2, Боццеті Федеріко6, Гютерер Елізабет7, Айсенрінг Елізабет8, Кааса Штайн9, Крзнаріч Зелько10, Лейрд Барі11, Ларсон Марія12, Лавіано Алесандро1, Мюлебах Штефан13, Ольдерволь Ліне14, Раваско Паула15, Зольгайм С. Тора16, Штрасер Флоріан17, Шуерен де ван дер Маріан18, Прейзер Жан-Шарль19, Бішоф К. Штефан20, Скрипник Ігор21, Швець Олег22
- 1Кафедра трансляційної та точної медицини Університету Ла Сапієнца, Рим, Італія
- 2Відділення медицини І, Медичний центр Університету Фрайбурга, медичний факультет, Університет Фрайбурга, Німеччина
- 3Регіональний центр боротьби з раком Леона Берарда, Ліон, Франція
- 4Кафедра онкології, Альбертський університет, Едмонтон, Канада
- 5Університетська лікарня, Льєж, Бельгія
- 6Міланський університет, Мілан, Італія
- 7Відділення онкології, кафедра медицини І, Віденський медичний університет, Австрія
- 8Університет Бонда, Ґолд-Кост, Австралія
- 9Норвезький університет природничих та технічних наук, Тронгейм, Норвегія
- 10Університетський медичний центр та Школа медицини, Загреб, Хорватія
- 11Інститут генетики та молекулярної медицини Единбурзького університету, Велика Британія
- 12Карлстадський університет, Швеція
- 13Базельський університет, Швейцарія
- 14Центр кризової психології Бергенського університету, Норвегія; Кафедра громадської охорони здоров’я та сестринської справи факультету медицини та медичних наук Норвезького університету природничих та технічних наук, Тронгейм, Норвегія
- 15Лісабонський університет, Лісабон, Португалія
- 16Онкологічна клініка, Лікарня Святого Олава, Університетська лікарня Тронгейма, Кафедра клінічної та молекулярної медицини, Норвегія; Факультет медицини та медичних наук Норвезького університету природничих і технічних наук, Тронгейм, Норвегія
- 17Онкологічна паліативна медицина, клініка онкології/гематології, відділення внутрішньої медицини та центр паліативної допомоги, Кантональний госпіталь Санкт-Ґаллена, Швейцарія
- 18Університет прикладних наук HAN, Неймеген, Нідерланди
- 19Університетська клініка Еразма, Вільний університет Брюсселя, Брюссель, Бельгія
- 20Кафедра клінічного харчування, Гоенгаймський університет, Штутгарт, Німеччина
- 21Українська гастроентерологічна асоціація, Полтава, Україна
- 22Асоціація дієтологів України, Київ, Україна
Резюме. За матеріалами: Арендс, Я., Бахман, П., Баракос, В., Бартелемі, Н., Бертц, Г., Боццеті, Ф., … Прейзер, Ж. Ш. (2017). Настанови ESPEN з харчування онкологічних пацієнтів. Clinical Nutrition, 36, 11–48. doi.org/10.1016/j.clnu.2016.07.015. Анотація. Ці практичні настанови засновані на сучасних наукових настановах ESPEN з харчування онкологічних пацієнтів. Для спрощення використання у клінічній практиці настанови ESPEN було скорочено та переведено в блок-схеми. Практичні настанови призначені для всіх фахівців, зокрема лікарів, дієтологів, нутриціологів і медичних сестер, які працюють з пацієнтами онкологічного профілю. У цілому представлено 43 рекомендації з короткими коментарями щодо корекції нутритивних і метаболічних розладів у пацієнтів з онкологічними захворюваннями. Рекомендаціям, що надаються у зв’язку із захворюванням, передують загальні рекомендації з оцінки нутритивного статусу хворих онкологічного профілю. Ця практична настанова надає рекомендації медичним працівникам, які беруть участь у лікуванні таких пацієнтів, для забезпечення оптимального харчування.
DOI: 10.32471/clinicaloncology.2663-466X.49-1.30037
Вступ
Злоякісні новоутворення посідають друге місце серед основних причин смертності у світі, та, за прогнозами, кількість нових випадків суттєво зростатиме впродовж наступних десятиліть. Мальнутриція є спільною ознакою хворих на рак і виникає внаслідок як самої пухлини, так і медикаментозної та хірургічної протипухлинної терапії. Недостатність харчування негативно впливає на якість життя та переносимість лікування, було підраховано, що до 10–20% пацієнтів онкологічного профілю помирають через наслідки мальнутриції, а не через саму пухлину. Таким чином, харчування має вирішальне значення в комбінованій протипухлинній терапії. Переконливі докази вказують на те, що проблеми з харчуванням слід враховувати в межах алгоритму лікування та діагностики ще з моменту виявлення раку та контролювати паралельно з провадженням протипухлинної терапії. Проте в усьому світі мальнутриція, пов’язана з онкологічним захворюванням, досі в достатній мірі не виявляється, недооцінюється та неоптимально лікується в комплексному веденні пацієнтів. Ці клінічні настанови, засновані на доказах, були розроблені з метою перетворення сучасних найкращих доказів і позиції експертів у рекомендації для мультидисциплінарних команд, які відповідають за виявлення, запобігання та лікування зворотних проявів мальнутриції в онкологічних пацієнтів дорослого віку.
Методологія
Ці практичні настанови містять 43 рекомендації та засновані на практичній та науковій версіях настанов Європейської асоціації клінічного харчування та метаболізму (European Society for Clinical Nutrition and Metabolism — ESPEN) з харчування [1] онкологічних пацієнтів [2]. Початкову настанову було скорочено за рахунок обмеження коментарів у вигляді зібраних доказів та літератури, на яких засновані рекомендації. Самі рекомендації не були змінені, але подання змісту, коли це можливо, було представлено у графічному вигляді блок-схемами для прийняття рішень. Оригінальна версія настанов була розроблена відповідно до рамкових рекомендацій ESPEN для конкретних захворювань [3] і теми, які повинні бути охоплені, визначалися в ході декількох раундів обговорення та модифікації, пошуку метааналізів, систематичних оглядів і порівняльних досліджень, заснованих на клінічних питаннях згідно з принципом PICO (Patient — Intervention — Comparison — Outcome). Докази оцінювали й суміщали з метою розробки клінічних рекомендацій за допомогою Системи класифікації, оцінки, розробки та експертизи рекомендацій (Grades of Recommendation Assessment, Development and Evaluation — GRADE). Усі рекомендації були не лише засновані на фактичних даних, але й пройшли процес знаходження консенсусу, у результаті якого було досягнуто певного відсотка згоди (%). Якщо було можливо, залучалися представники різних професійних груп (лікарі, дієтологи, медсестри та інші), а також представники пацієнтських асоціацій. Членів робочої групи з розробки клінічних настанов було відібрано асоціацією ESPEN у такий спосіб, аби до групи входили представники ряду професій та галузей експертних знань. Процес розробки клінічних настанов відбувався за дорученням та фінансової підтримки асоціації ESPEN та Європейського партнерства протидії онкологічним захворюванням (European Partnership for Action Against Cancer — EPAAC) за ініціативою ЄС. Підготовка скороченої версії та розповсюдження настанови частково фінансувалися Об’єднаним європейським товариством гастроентерологів (United European Gastroenterology — UEG), а також асоціацією ESPEN. Докладнішу інформацію про методологію дивіться у повній версії настанов ESPEN [2] та настанов ESPEN для конкретних захворювань [3]. Практична настанова ESPEN «Клінічне харчування при онкологічних захворюваннях» була структурована відповідно до блок-схеми, що охоплює всі аспекти харчування при онкологічних захворюваннях (рис. 1).
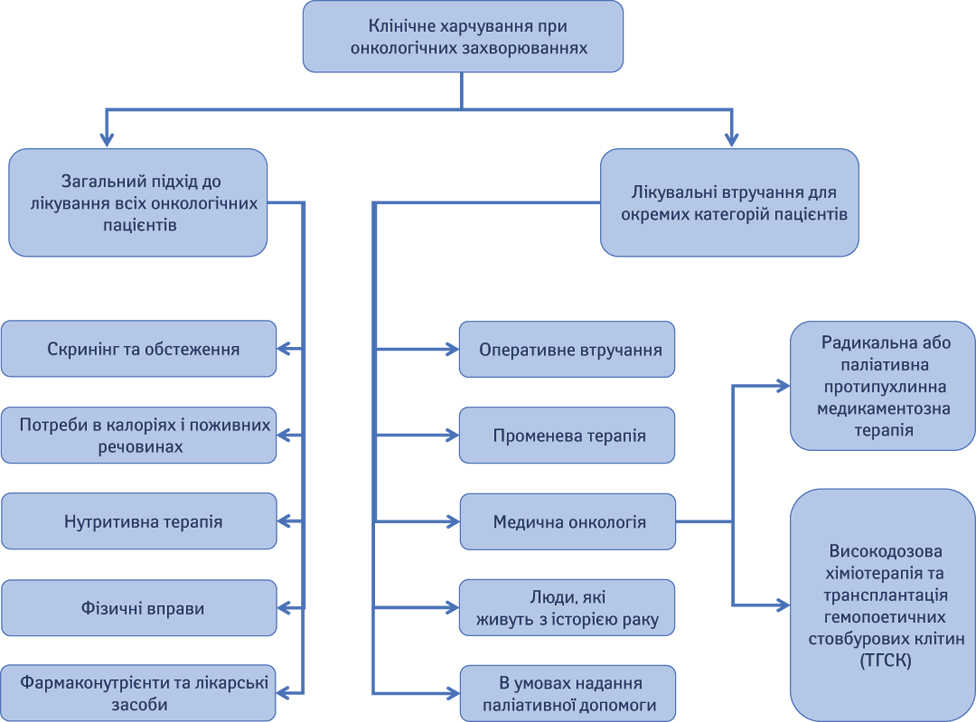
1. ЗАГАЛЬНИЙ ПІДХІД ДО ЛІКУВАННЯ ВСІХ ОНКОЛОГІЧНИХ ПАЦІЄНТІВ
1.1. Скринінг та оцінка (рис. 2).
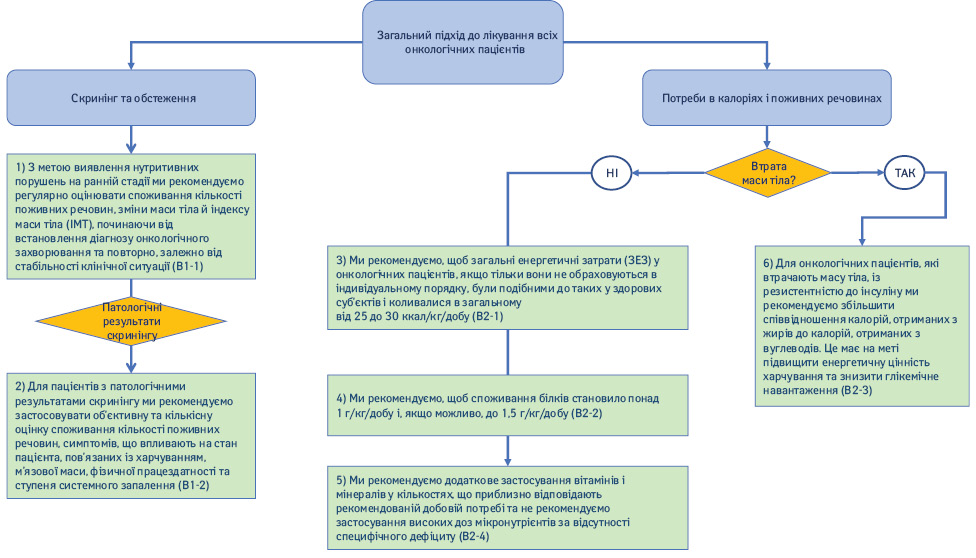
1) З метою виявлення ранніх стадій нутритивних порушень ми рекомендуємо регулярно оцінювати надходження поживних речовин, зміни маси тіла й індексу маси тіла (ІМТ), починаючи від встановлення діагнозу онкологічного захворювання та при повторних обстеженнях залежно від стабільності клінічної ситуації (Рекомендація B1-1; сила рекомендації — сильна, рівень доказовості — дуже низький, сильний консенсус).
2) Для пацієнтів з патологічними результатами скринінгу ми рекомендуємо застосовувати об’єктивну та кількісну оцінку надходження поживних речовин, симптомів, що впливають на стан хворого, пов’язаних із харчуванням, м’язової маси, фізичної працездатності та ступеня системного запалення (Рекомендація B1-2; сила рекомендації — сильна, рівень доказовості — дуже низький, консенсус).
1.2. Потреби в калоріях і поживних речовинах.
3) Ми рекомендуємо, щоб загальні енергетичні витрати (ЗЕВ) в онкологічних пацієнтів, якщо тільки вони не обраховуються в індивідуальному порядку, були подібними до аналогічних у здорових суб’єктів та становили від 25 до 30 ккал/кг/добу (Рекомендація B2-1; сила рекомендації — сильна, рівень доказовості — низький, консенсус).
Коментар. Добре відомо, що неповноцінна дієта зумовлює хронічну недостатність харчування. Для того, щоб підтримати стабільний нутритивний статус, харчування має відповідати потребам пацієнта в калоріях, що є сумою енергетичних витрат у стані спокою (ЕВСС), на фізичну активність і в незначній кількості — аліментарно-індукований термогенез. В онкологічних пацієнтів ЕВСС при визначенні за допомогою непрямої калориметрії, «золотого» стандарту, можуть бути незміненими, підвищеними або зниженими щодо цього показника в осіб з групи контролю без пухлин [4]. У великому дослідженні за участю групи Лундхольма [5] приблизно 50% усіх онкологічних пацієнтів, які втрачали масу тіла, були в гіперметаболічному стані, якщо порівнювати з відповідними контрольними групами, схожими за фізичною активністю, складом тіла, віком і втратою маси тіла. Так само серед первинно діагностованих онкологічних хворих у 47% виявлено гіперметаболічний стан, і вони продемонстрували вище співвідношення визначеного у порівнянні з передбачуваним показником ЕВСС на кілограм безжирової маси тіла [6]. У той час як у багатьох онкологічних пацієнтів ЕВСС підвищені, коли розглядають показник ЗЕВ, виявляють, що його значення є нижчим у пацієнтів на пізніх стадіях онкологічних захворювань у порівнянні з прогнозованими значеннями у здорових осіб; основною причиною є зниження повсякденної фізичної активності [7, 8]. У підсумку при запровадженні нутритивної підтримки необхідно орієнтуватися на показники ЗЕВ, аналогічні тим, які визначаються у здорових осіб з групи контролю. ЗЕВ можна визначати за допомогою стандартних формул обчислення ЕВСС і стандартних значень для рівня фізичної активності [8].
4) Ми рекомендуємо, щоб споживання білків становило понад 1 г/кг/добу та, якщо можливо, до 1,5 г/кг/добу (Рекомендація B2-2; сила рекомендації — сильна, рівень доказовості — помірний, твердий консенсус).
Коментар. В онкологічних пацієнтів не пригнічується синтез м’язових білків. Декілька досліджень демонструють, що цей процес не порушується та зберігається відповідь на надходження амінокислот з їжею, нехай і з підвищеною потребою в амінокислотах (білках), ніж у здорових осіб молодого віку [9]. Дані стосовно відмінностей у поживній цінності білків в онкологічних пацієнтів обмежені [10–12].
5) Ми рекомендуємо додаткове застосування вітамінів і мінералів у кількостях, що приблизно відповідають рекомендованій добовій фізіологічній потребі та не рекомендуємо застосування високих доз мікронутрієнтів за відсутності підтвердженого специфічного дефіциту (Рекомендація B2-4; сила рекомендації — сильна, рівень доказовості — низький, твердий консенсус).
Коментар. Встановлено, що 50% усіх онкологічних пацієнтів споживають медичні продукти чи засоби альтернативної медицини [13]; значна їх частка припадає на полівітамінні дієтичні добавки. Дефіцит вітаміну D пов’язували із захворюваністю на рак [14], але метааналіз 40 рандомізованих контрольованих досліджень (РКД) показав, що додаткове застосування вітаміну D у поєднанні з кальцієм чи без не знижувало частоту наслідків для опорно-рухового апарату або інших систем органів більш ніж на 15% в осіб, які не проживають у будинках для літніх людей, з нерандомізованою вибіркою [15]. За результатами інших систематичних оглядів було зроблено схожий висновок [16]. В одному РКД за участю 14 641 лікаря зі США вивчали ефект додаткового комбінованого застосування вітаміну Е (400 МО/добу) та вітаміну С (500 мг/добу) впродовж у середньому десяти років, при цьому не виявлено жодного впливу на частоту виникнення злоякісних захворювань [17]. Ані тривале додаткове застосування вітаміну Е (400 МО/добу), ані використання селену (200 мкг у перерахунку на селенометіонін) не збільшували частоту виникнення злоякісних пухлин передміхурової залози [18].
6) Для онкологічних пацієнтів, які втрачають масу тіла та мають резистентність до інсуліну, ми рекомендуємо збільшити співвідношення калорій, отриманих з жирів, до калорій, отриманих з вуглеводів. Це необхідно для підвищення енергетичної цінності харчування та обмеження глікемічного навантаження (Рекомендація B2-3; сила рекомендації — сильна, рівень доказовості — низький, консенсус).
Коментар. У пацієнтів з резистентністю до інсуліну спостерігається порушення засвоєння й окислення глюкози міоцитами; проте утилізація жирів залишається нормальною або підвищується, що також свідчить на користь вищого співвідношення жирів до вуглеводів. В онкологічних пацієнтів відбувається ефективна мобілізація жирів і використання їх як джерела енергії [19]. У порівнянні зі здоровими суб’єктами метаболічний кліренс різних ліпідних емульсій був підвищеним в онкологічних пацієнтів зі стабільною масою тіла, та ще вищим у хворих, які втрачали масу тіла [20]. Крім того, існують додаткові переваги використання ліпідів замість глюкози при різних схемах парентерального харчування (ПХ). Видається доцільним докласти зусиль для зниження ризику інфекцій, пов’язаних із гіперглікемією, на які, незважаючи на те, що вони також трапляються у пацієнтів неонкологічного профілю, схожим чином можна очікувати і в онкологічних хворих із резистентністю до інсуліну. Проте дотепер не проведено клінічні дослідження, у яких би порівнювався вплив різних ліпідних емульсій на клінічні результати в онкологічних пацієнтів, тому роль цих альтернативних варіантів емульсій усе ще до кінця не з’ясована.
1.3. Нутритивні інтервенції (рис. 3).
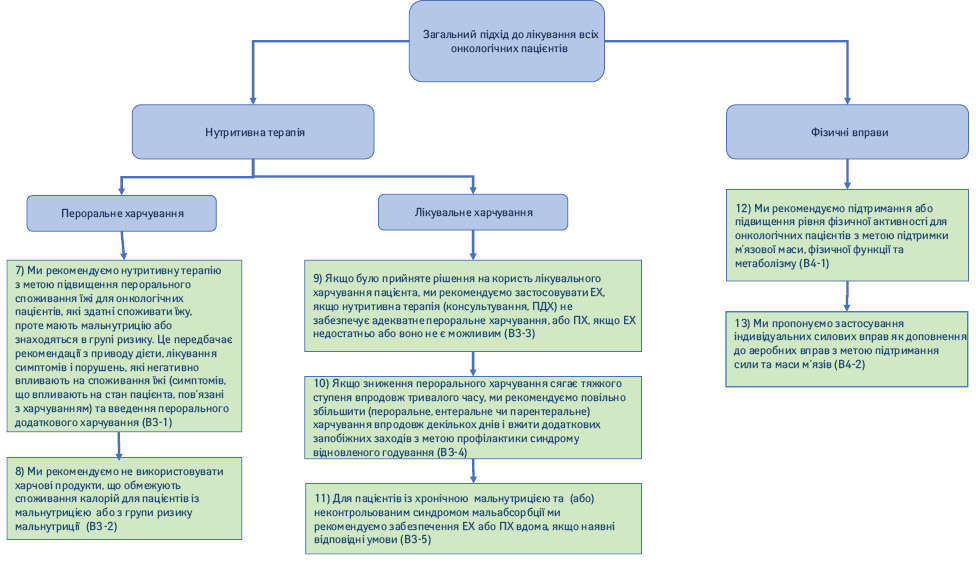
7) Ми рекомендуємо нутритивні інтервенції з метою підвищення перорального споживання їжі для онкологічних пацієнтів, які здатні споживати їжу, проте мають ознаки мальнутриції або знаходяться в групі ризику. Це передбачає рекомендації з приводу дієти, лікування симптомів і порушень, які негативно впливають на споживання їжі (симптомів, що впливають на стан пацієнта та пов’язані з харчуванням) і застосування перорального додаткового харчування (ПДХ) (Рекомендація B3-1; сила рекомендації — сильна, рівень доказовості — помірний, консенсус).
Коментар. Дієтотерапію бажано розпочати тоді, коли пацієнти ще не перейшли в стан важкої мальнутриції. Першою формою нутритивної підтримки має бути консультування з приводу харчування, щоб полегшити контроль симптомів, і заохочення до споживання збагаченої білками й висококалорійної їжі та рідини, які добре засвоюються; перевагу слід надавати висококалорійній і високобілковій дієті як методу підтримки та покращення нутритивного статусу. Рекомендоване додаткове застосування ПДХ у тих випадках, коли використання висококалорійної дієти не є ефективним при досягненні цілей, пов’язаних із харчуванням. Лікувальне харчування показане, якщо пацієнти не можуть харчуватися належним чином (наприклад менше 50% від потреби протягом більше одного тижня або лише 50–75% від потреби протягом більше двох тижнів). Якщо було прийнято рішення на користь додаткового харчування пацієнта, ми рекомендуємо застосовувати ентеральне харчування (ЕХ), якщо дієтотерапія (консультування, ПДХ) не забезпечує належного перорального харчування, або ПХ, якщо ЕХ недостатньо або воно є неможливим. Доведено, що дієтотерапія в онкологічних пацієнтів з ознаками мальнутриції або у тих, хто перебуває в групі ризику щодо мальнутриції, сприяє нормалізації маси тіла та засвоєнню калорій, але не виживаності [21, 22]. Існують переконливі докази того, що у хворих, які отримують (ад’ювантну) променеву терапію, нутритивна підтримка покращує деякі аспекти якості життя [23], проте ці результати досі не підтверджені для пацієнтів, які отримують хіміотерапію [21, 24].
8) Ми рекомендуємо не використовувати дієтичні підходи, що обмежують споживання калорій, у пацієнтів із мальнутрицією або в групі ризику мальнутриції (Рекомендація B3-2; сила рекомендації — сильна, рівень доказовості — низький, твердий консенсус).
Коментар. Ми не рекомендуємо жодну з дієт, які не засновані на клінічних доказах, не мають доведеної ефективності й потенційно можуть бути шкідливими. Не існує дієт, про які відомо, що вони лікують злоякісні захворювання або запобігають рецидивам таких хвороб. У багатьох випадках аргументи на підтримку цих дієт не засновані ані на науковому обґрунтуванні, ані на надійних доказах, а джерелом інформації є індивідуальний досвід, неверифіковані публікації в популярній літературі та в інтернеті, без відповідних джерел у рецензованій літературі [25]. Ці дієти підвищують ризик недостатнього споживання калорій, жирів та білків, а також загальний ризик недостатності мікронутрієнтів. Немає клінічних досліджень, які б продемонстрували користь кетогенної дієти в онкологічних пацієнтів [26, 27]. Через свою низьку смакову привабливість кетогенні дієти можуть призвести до недостатнього споживання калорій і втрати маси тіла [27]. Незначний ряд спостережень і невелике рандомізоване клінічне дослідження продемонстрували добру переносимість голодування у людей [28, 29], але без чітких доказів користі голодування під час хіміотерапії ми не можемо рекомендувати використання цього підходу до, під час або після застосування протипухлинних засобів. Така рекомендація також обумовлена відомими ризиками мальнутриції та через те, що пацієнти можуть піддатися спокусі пролонгувати епізоди голодування.
9) Якщо було прийнято рішення на користь запровадження додаткового харчування пацієнта, ми рекомендуємо застосовувати ЕХ, якщо дієтотерапія (консультування, ПХД) не забезпечує належного перорального харчування, або ПХ, якщо ЕХ недостатньо або воно є неможливим (Рекомендація B3-3; сила рекомендації — сильна, рівень доказовості — помірний, твердий консенсус).
Коментар. В онкологічних пацієнтів з порушенням процесів травлення або всмоктування їжі, які не здатні приймати їжу, за допомогою лікувального харчування можна стабілізувати нутритивний статус. У хворих із пухлинами, які перешкоджають пероральному споживанню або пасажу їжі вздовж верхніх відділів шлунково-кишкового тракту, нутритивний статус можна стабілізувати за допомогою ЕХ [30, 31]. У разі тяжкої кишкової недостатності внаслідок радіаційного ентериту, хронічної кишкової непрохідності, синдрому короткої петлі, канцероматозу очеревини або хілотораксу нутритивний статус можна підтримати шляхом ПХ [32–34]. Повідомлялося про те, що в онкологічних пацієнтів з пухлинами голови та шиї частота ускладнень була нижчою при застосуванні назогастральних зондів у порівнянні з вигодовуванням через черезшкірні ендоскопічні гастростоми (ЧЕГ), у той час як показник ефективності був високим [35]. Ми рекомендуємо збільшувати інвазивність підходу до харчування тільки після ретельної оцінки відсутності забезпечення надходження належної кількості поживних речовин більш фізіологічним пероральним шляхом. Клінічна практика, протипоказання, ускладнення та моніторинг ЕХ і ПХ не відрізняються для онкологічних пацієнтів і осіб з доброякісними захворюваннями [36]. Враховуючи особливості конкретного пацієнта та його сім’ї, потенційні ризики та шкоду, а також недостатню ефективність лікувального харчування, слід зважити користь та шкоду запланованих інтервенцій. Як правило, ризики ПХ переважують його користь у пацієнтів з прогнозом на життя менше 2 міс.
10) Якщо зниження перорального харчування сягає тяжкого ступеня впродовж тривалого часу, ми рекомендуємо повільно збільшити харчування (пероральне, ентеральне чи парентеральне) впродовж декількох днів і вжити додаткових запобіжних заходів з метою профілактики синдрому відновленого годування (Рекомендація B3-4; сила рекомендації — сильна, рівень доказовості — низький, консенсус).
Коментар. Класичними біохімічними ознаками синдрому відновленого годування є гіпофосфатемія, проте також можуть бути ознаки дисбалансу натрію та рідини, зміни метаболізму глюкози, білків і жирів, дефіцит тіаміну, гіпокаліємія та гіпомагніємія. Перед і під час відновлення харчування важливо забезпечувати споживання вітаміну В1 у добовій дозі 200–300 мг, а також застосовувати збалансований комплекс мікронутрієнтів. Слід проводити моніторинг таких електролітів і заміщувати їх за необхідності пероральним, ентеральним або парентеральним шляхом: калій (потреба становить приблизно 24 ммоль/кг/добу), фосфор (потреба становить приблизно 0,3–0,6 ммоль/кг/добу) та магній (потреба становить приблизно 0,2 ммоль/кг/добу для парентерального застосування або 0,4 ммоль/кг/добу при пероральному застосуванні).
11) Для пацієнтів із хронічною недостатністю надходження поживних речовин та (або) неконтрольованим синдромом мальабсорбції ми рекомендуємо забезпечення ЕХ або ПХ вдома за наявності відповідних умов (Рекомендація B3-5; сила рекомендації — сильна, рівень доказовості — низький, твердий консенсус).
Коментар. Припинення лікувального харчування або прийняття рішення про те, щоб не розпочинати лікувальне харчування у пацієнта, який неспроможний споживати їжу, відбувається тільки за умови термінального стану хворого. Існують дані, що вказують на користь застосування домашнього ЕХ або ПХ в онкологічних пацієнтів із хронічними порушеннями споживання або всмоктування їжі навіть на останніх стадіях злоякісного захворювання, допоки прогноз на життя сягає більше декількох тижнів [37, 38]. Користь може бути підтверджена фактом, що деякі онкологічні пацієнти продовжують жити впродовж багатьох місяців та років винятково на ПХ, тобто такого часового проміжку, протягом якого будь-яка особа без їжі за інших умов загинула б від голодного виснаження [32, 39]. Перш ніж розпочати програму тренінгів з домашнього ПХ, важливо оцінити когнітивні та фізичні можливості пацієнта.
1.4. Фізична активність.
12) Ми рекомендуємо підтримання або підвищення рівня фізичної активності в онкологічних пацієнтів з метою підтримки м’язової маси, фізичної функції та метаболізму (Рекомендація B4-1; сила рекомендації — сильна, рівень доказовості — високий, консенсус).
Коментар. Фізична активність добре переноситься та є безпечною на різних стадіях злоякісних захворювань, а пацієнти на пізніх стадіях захворювання здатні й хочуть бути залучені до фізичної активності [40, 41]. Вона включає тренування середньої інтенсивності вдома під наглядом (50–75% від максимальної частоти серцевих скорочень у спокої або від аеробної витривалості), три тренування на тиждень тривалістю 10–60 хв кожне. Фізична активність в онкологічних пацієнтів пов’язана з підтриманням або значним покращенням аеробної витривалості, сили м’язів, якості життя, пов’язаної зі здоров’ям, самоствердження, а також зі зниженням рівня втоми й тривожності [42–44]. Для деяких пацієнтів рекомендації щодо фізичної активності мають складатися зі спонукання до щоденних прогулянок з метою зниження ризиків атрофії внаслідок відсутності активності.
13) Ми пропонуємо застосування індивідуальних силових вправ як доповнення до аеробних вправ з метою підтримання сили та маси м’язів (Рекомендація B4-2; сила рекомендації — слабка, рівень доказовості — низький, твердий консенсус).
Коментар. Онкологічні пацієнти загалом повідомляють про низький рівень фізичної активності, а відсутність активності, як і протипухлинне лікування, [45, 46] чинять суттєвий несприятливий вплив на м’язову масу [47]. У нещодавньому систематичному огляді було показано, що аеробні навантаження, як і силові, покращують силу м’язів верхньої та нижньої частини тіла більшою мірою, ніж звичайна медична допомога, а також існують певні докази того, що силові вправи, ймовірно, є ефективнішими для збільшення сили м’язів, ніж аеробні [44].
1.5. Фармаконутрієнти та фармакологічні речовини (рис. 4).
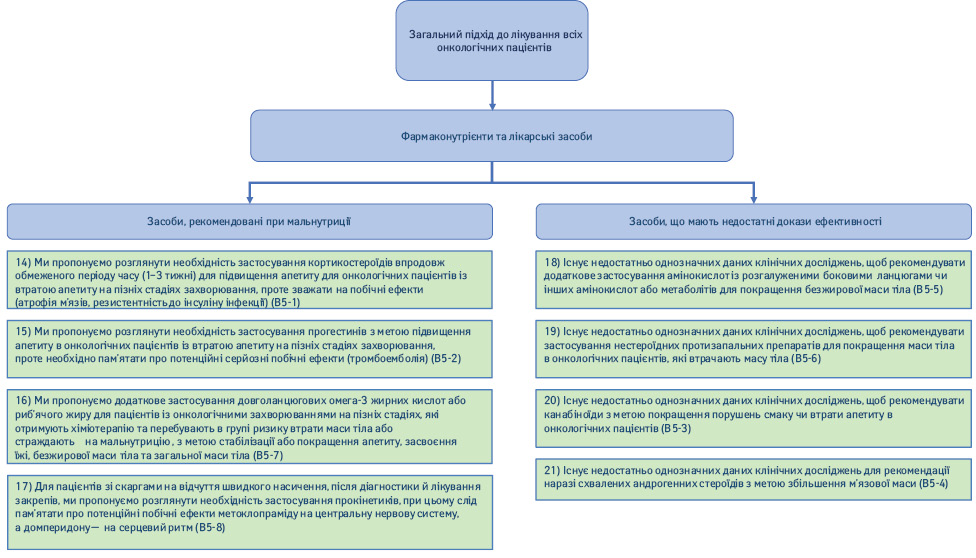
14) Ми пропонуємо розглянути необхідність застосування кортикостероїдів впродовж обмеженого періоду часу (1–3 тиж) для підвищення апетиту в онкологічних пацієнтів з втратою апетиту на пізніх стадіях захворювання, проте слід зважати на побічні ефекти (атрофія м’язів, резистентність до інсуліну, інфекції) (Рекомендація B5-1; сила рекомендації — слабка, рівень доказовості — високий, консенсус).
Коментар. Систематичний огляд фармакотерапії у разі втрати апетиту, асоційованої зі злоякісними захворюваннями, та втрати маси тіла у пацієнтів дорослого віку з негематологічними злоякісними захворюваннями Yavuzsen та співавторів (2005) виявив лише два класи препаратів (прогестини та кортикостероїди), які демонструють достатню доказовість щодо ефективності та безпеки при стимуляції апетиту під час їх застосування в онкологічних пацієнтів. Антианоректичний ефект кортикостероїдів є тимчасовим і зникає через декілька тижнів [48], коли з’являються прояви міопатії та імуносупресії; резистентність до інсуліну є раннім проявом метаболічного побічного ефекту, остеопенія — віддаленим проявом. Внаслідок цих побічних ефектів, зокрема при тривалому використанні, кортикостероїди можуть бути кращим вибором для пацієнтів з короткою передбачуваною тривалістю життя, особливо якщо вони мають прояви інших симптомів, таких як біль або нудота, які також можуть бути усунені за рахунок застосування цього класу препаратів.
15) Ми пропонуємо розглянути необхідність застосування прогестинів з метою підвищення апетиту в онкологічних пацієнтів з втратою апетиту на пізніх стадіях захворювання, проте необхідно пам’ятати про потенційні серйозні побічні ефекти (тромбоемболія) (Рекомендація B5-2; сила рекомендації — слабка, рівень доказовості — високий, консенсус).
Коментар. Прогестини (мегестролу ацетат і медроксипрогестерону ацетат) підвищують апетит і масу тіла, але не безжирову масу тіла; вони можуть спричиняти розвиток імпотенції, незначні вагінальні кров’янисті виділення, тромбоемболію та смерть у деяких випадках [49–51].
16) Ми пропонуємо додаткове застосування довголанцюгових омега-3 жирних кислот або риб’ячого жиру у пацієнтів на пізніх стадіях онкологічного захворювання, які отримують хіміотерапію та перебувають у групі ризику втрати маси тіла або у яких відмічають недостатність харчування, з метою стабілізації або покращення апетиту, засвоєння їжі, безжирової маси тіла та загальної маси тіла (Рекомендація B5-7; сила рекомендації — слабка, рівень доказовості — низький, твердий консенсус).
Коментар. Незважаючи на дані деяких систематичних оглядів, таких як Dewey та співавторів (2007), що свідчать про відсутність достатніх доказів на підтримку рекомендації щодо застосування довголанцюгових омега-3 жирних кислот для лікування пацієнтів з кахексією внаслідок онкологічного захворювання [52], два нещодавні огляди продемонстрували, що довголанцюгові жирні кислоти покращують апетит, масу тіла, знижують ризик післяопераційних ускладнень та поліпшують якість життя онкологічних хворих, які втрачають масу тіла [53], як і довголанцюгові омега-3 жирні кислоти в подібній популяції пацієнтів під час хіміо- і/або променевої терапії, та сприятливий вплив у порівнянні з контрольною групою, переважно щодо збереження стабільного складу тіла [54]. Цікаво, що існує декілька повідомлень про захисні властивості риб’ячого жиру від токсичних ефектів хіміотерапії, таких як периферична нейропатія [55, 56]. При застосуванні у звичайних дозах риб’ячий жир і довголанцюгові омега-3 жирні кислоти зазвичай добре переносяться. Є повідомлення про незначні прояви з боку шлунково-кишкового тракту (ШКТ); смак, рибний післясмак або відрижка рибою можуть вплинути на комплаєнтність [57]. Останнім часом застосування ібрутинібу було пов’язане з виникненням носових кровотеч у пацієнтів, які приймають добавки у вигляді риб’ячого жиру; тому хворих, які отримують ібрутиніб, необхідно повідомити про важливість уникнення використання добавок з вмістом риб’ячого жиру. Враховуючи неоднозначність ефектів, про які повідомлялося, і водночас наявність декількох досліджень, результати яких були опубліковані протягом декількох останніх років і повідомляли про користь харчування, вагомі обґрунтування з точки зору біології, лише незначні побічні ефекти й відсутність жодних переконливо серйозних даних щодо безпеки, було розроблено слабку рекомендацію стосовно застосування риб’ячого жиру та довголанцюгових омега-3 жирних кислот.
17) У пацієнтів зі скаргами на відчуття швидкого насичення після діагностики й лікування запорів ми пропонуємо розглянути необхідність застосування прокінетиків, при цьому слід пам’ятати про потенційні побічні ефекти метоклопраміду на центральну нервову систему, а домперидону — на серцевий ритм (Рекомендація B5-8; сила рекомендації — слабка, рівень доказовості — помірний, консенсус).
Коментар. Прокінетики, такі як метоклопрамід або домперидон, стимулюють спорожнення шлунка та часто використовуються для корекції відчуття швидкого насичення [58]. У двох РКД порівнювали метоклопрамід у дозі 40 або 80 мг/добу з плацебо у пацієнтів зі злоякісними захворюваннями на пізніх стадіях і хронічною нудотою та спостерігали полегшення нудоти, проте не відмічали впливу на апетит чи споживання калорій [59, 60].
18) Існує недостатньо однозначних даних клінічних досліджень, щоб рекомендувати додаткове застосування амінокислот з розгалуженими боковими ланцюгами чи інших амінокислот або метаболітів для поліпшення відсотка безжирової маси тіла (Рекомендація B5-5; сила рекомендації — відсутня, рівень доказовості — низький, твердий консенсус).
Коментар. Зменшення кількості м’язових білків є характерною ознакою кахексії на фоні онкологічного захворювання, а використання організмом амінокислот, які надходять із харчуванням, зазвичай є порушеним на фоні частої анаболічної резистентності. Результати досліджень демонструють, що при онкологічних захворюваннях метаболізм білків, порушений внаслідок кахексії, та анаболічну резистентність м’язів можна контролювати шляхом одночасного додаткового застосування інсуліну та амінокислот [61]. Тривала терапія інсуліном перед сном жодним чином не впливала на безжирову масу тіла. За результатами рандомізованого дослідження за участю 338 пацієнтів з кахексією на фоні онкологічного захворювання при щоденному застосуванні інсуліну (0,11 МО/кг/добу) додатково до основної супровідної терапії збільшувалася частка жиру в усьому організмі, але воно не впливало на безжирову масу тіла [62]. Стверджується, що β-гідрокси-β-метилбутират, метаболіт лейцину, у звичайній дозі 3 г/добу має антикатаболітичний ефект, який зменшує до мінімуму розпад білків. У більшому РКД за участю 472 онкологічних пацієнтів з кахексією намагалися порівняти дію пероральної комбінації β-гідрокси-β-метилбутирату, аргініну та глутаміну з ізоазотистою сумішшю контролю, проте безуспішно у зв’язку з труднощами з дотриманням схеми лікування впродовж 8 тиж; лише 37% пацієнтів завершили протокол, при цьому значущої різниці між групами дослідження не спостерігалося [63].
19) Існує недостатньо однозначних даних клінічних досліджень, щоб рекомендувати застосування нестероїдних протизапальних препаратів (НПЗП) для відновлення маси тіла в онкологічних пацієнтів, які втрачають масу тіла (Рекомендація B5-6; сила рекомендації — відсутня, рівень доказовості — низький, твердий консенсус).
Коментар. НПЗП можуть знижувати вивільнення гострофазних білків і цитокінів клітинами пухлини та організму. Докази є надто обмеженими, щоб рекомендувати НПЗП чи інші протизапальні лікарські засоби при кахексії поза межами клінічних досліджень. НПЗП можуть збільшити масу тіла в онкологічних пацієнтів з кахексією, також існують дані щодо їх впливу на фізичну працездатність, якість життя, зі слів хворих, та показники запалення [64–66]. Причиною того, що НПЗП не рекомендується застосовувати з метою корекції кахексії поза межами клінічних досліджень є суперечливість результатів вже завершених випробувань та їх низька якість [67], проте застереженням також є потенційно тяжкі побічні ефекти НПЗП, незважаючи на те, що в результаті огляду літератури знайдено повідомлення про застосування цих лікарських засобів при кахексії, у яких ідеться про майже відсутню токсичність [68].
20) Існує недостатньо однозначних даних клінічних досліджень, щоб рекомендувати канабіноїди з метою покращення порушень смаку чи втрати апетиту в онкологічних пацієнтів (Рекомендація B5-3; сила рекомендації — відсутня, рівень доказовості — низький, консенсус).
Коментар. Тетрагідроканабінол (ТГК) є основним психоактивним складником канабісу, доступний на ринку під торговою назвою Дронабінол. У проспективному рандомізованому плацебо-контрольованому багатоцентровому дослідженні за участю 164 пацієнтів з онкологічними захворюваннями на пізніх стадіях та синдромом втрати апетиту-кахексії застосування екстракту канабісу або ТГК у дозі 5 мг на добу протягом 6 тиж не сприяло покращенню апетиту чи якості життя [69]. Проте застосування ТГК (2,5 мг двічі на добу) протягом 18 днів, яке вивчалося в невеликому пілотному РКД за участю пацієнтів на пізніх стадіях онкологічного захворювання, поганим апетитом і хемосенсорними порушеннями, обумовило покращення хемосенсорики, краще смакове сприйняття їжі та покращення апетиту порівняно з плацебо [70]. Отже, незважаючи на те, що дронабінол має здатність до покращення хемосенсорного сприйняття й апетиту у хворих із втратою апетиту на фоні онкологічного захворювання, обмежена кількість однозначних доказів не підкріплює цю рекомендацію.
21) Існує недостатньо однозначних даних клінічних досліджень для рекомендації наразі схвалених андрогенних стероїдів з метою збільшення м’язової маси (Рекомендація B5-4; сила рекомендації — відсутня, рівень доказовості — низький, консенсус).
Коментар. Досліджувався вплив ендогенних і екзогенних речовин на гальмування процесу втрати м’язової маси (протеолізу) або стимуляції синтезу білків. Серед них розглядали анаболічні або анаболічні андрогенні стероїди, оскільки вони імітують чоловічі статеві гормони (тестостерон і дигідротестостерон і менш активний андростендіон) за рахунок підвищення синтезу білків. У пацієнтів з онкологічними захворюваннями на пізніх стадіях часто спостерігається знижений рівень вільного тестостерону [71]. Типовим представником андрогенів, дію якого досліджували в онкологічних пацієнтів, є нандролону деканоат (200 мг/тиж для внутрішньом’язового введення) та оксандролон або флуоксиместерон перорально (20 мг/добу). У рандомізованому дослідженні за участю 37 хворих на недрібноклітинний рак легені, які проходили хіміотерапію, нандролону деканоат (200 мг/тиж) порівнювали зі схемою без застосування додаткової терапії; у групі, у якій застосовували нандролон, спостерігалася тенденція до зменшення втрати маси тіла [72]. В одному РКД за участю 475 онкологічних пацієнтів з кахексією порівнювали ефект препаратів стероїдів, прогестину й флуоксиместерону. При застосуванні флуоксиместерону (20 мг/добу) спостерігався менший стимулювальний вплив на апетит у порівнянні з мегестролу ацетатом (800 мг/добу) та дексаметазоном (3 мг/добу), у той час як показник припинення застосування препарату внаслідок токсичності був приблизно однаковим в усіх трьох групах [73].
2. ЛІКУВАЛЬНІ ІНТЕРВЕНЦІЇ ДЛЯ ОКРЕМИХ КАТЕГОРІЙ ПАЦІЄНТІВ
2.1. Хірургічні втручання (рис. 5).
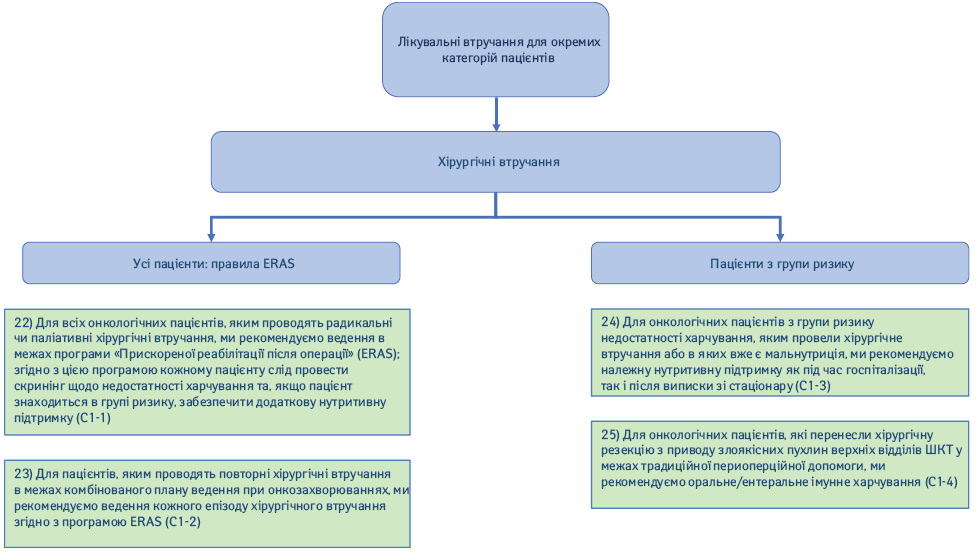
22) Для всіх онкологічних пацієнтів, яким проводять радикальні чи паліативні хірургічні втручання, ми рекомендуємо ведення в межах програми «Прискореної реабілітації після операції» (Enhanced Recovery After Surgery – ERAS); згідно з цією програмою кожному хворому слід провести скринінг мальнутриції та, якщо пацієнт знаходиться в групі ризику, забезпечити додаткову нутритивну підтримку (Рекомендація С1-1; сила рекомендації — сильна, рівень доказовості — високий, консенсус).
Коментар. Сучасні хірургічні стандарти щодо онкологічних пацієнтів, яким проводять хірургічне втручання, передбачають лікування згідно з програмою ERAS, метою якої є мінімізація стресу від оперативного втручання, підтримання нутритивного статусу, зменшення ускладнень і оптимізація показника одужання. Нутритивні складові ERAS — уникнення голодування, передопераційне навантаження рідиною й вуглеводами та відновлення перорального вживання їжі в перший післяопераційний день. Дані свідчать про те, що коли всі пацієнти отримують таку оптимізовану нутритивну й метаболічну допомогу, це сприяє мінімізації метаболічної відповіді на хірургічне втручання.
23) Для пацієнтів, яким проводять повторні хірургічні втручання в межах комбінованого плану ведення при онкозахворюваннях, ми рекомендуємо ведення кожного епізоду хірургічного втручання згідно з програмою ERAS (Рекомендація С1-2; сила рекомендації — сильна, рівень доказовості — низький, консенсус).
Коментар. Пацієнти, яким надають допомогу в межах комбінованого плану ведення при онкозахворюваннях, мають особливий ризик прогресивного погіршення нутритивного статусу. З метою мінімізації покрокового погіршення нутритивного статусу під час такої складної протипухлинної терапії важливо мінімізувати нутритивний/метаболічний вплив повторних хірургічних втручань і вести кожен епізод оперативного втручання в контексті алгоритмів ERAS.
24) Для онкологічних пацієнтів з групи ризику мальнутриції, яким провели хірургічне втручання або в яких вже є мальнутриція, ми рекомендуємо належну нутритивну підтримку як під час госпіталізації, так і після виписки зі стаціонару (Рекомендація С1-3; сила рекомендації — сильна, рівень доказовості — помірний, консенсус).
Коментар. Для пацієнтів з групи помірного чи високого нутритивного ризику (особливо тих, хто переніс оперативне втручання з приводу злоякісних пухлин верхніх відділів ШКТ) слід розглянути можливість рутинної післяопераційної нутритивної підтримки (де можливо — пероральним або ентеральним шляхом), і слід зважити доцільність подовження такої підтримки, коли пацієнт виписується за місцем проживання [74, 75].
25) Для онкологічних пацієнтів, які перенесли хірургічну резекцію верхніх відділів ШКТ з приводу злоякісних пухлин в межах традиційної периопераційної допомоги, ми рекомендуємо оральне/ентеральне імунне харчування (аргінін, омега-3 жирні кислоти, нуклеотиди) (Рекомендація С1-4; сила рекомендації — сильна, рівень доказовості — високий, твердий консенсус).
Коментар. Онкологічні пацієнти зі злоякісними пухлинами верхніх відділів ШКТ, які вважаються хворими групи високого нутритивного ризику, мали менше ускладнень після застосування преопераційного ПХ [76]. Згодом було продемонстровано, що в онкологічних пацієнтів зі злоякісними пухлинами верхніх відділів ШКТ, яких вели згідно з традиційною схемою периопераційної допомоги, спостерігалося зменшення кількості післяопераційних інфекційних ускладнень у разі забезпечення так званого орального/ентерального «імуномодулювального харчування» в периопераційний період [77]. Термін «імуномодулювальне харчування», або «імунне харчування» означає вживання рідких сумішей, збагачених специфічними поживними речовинами (аргінін, омега-3 жирні кислоти, нуклеотиди).
2.2. Променева терапія (рис. 6).
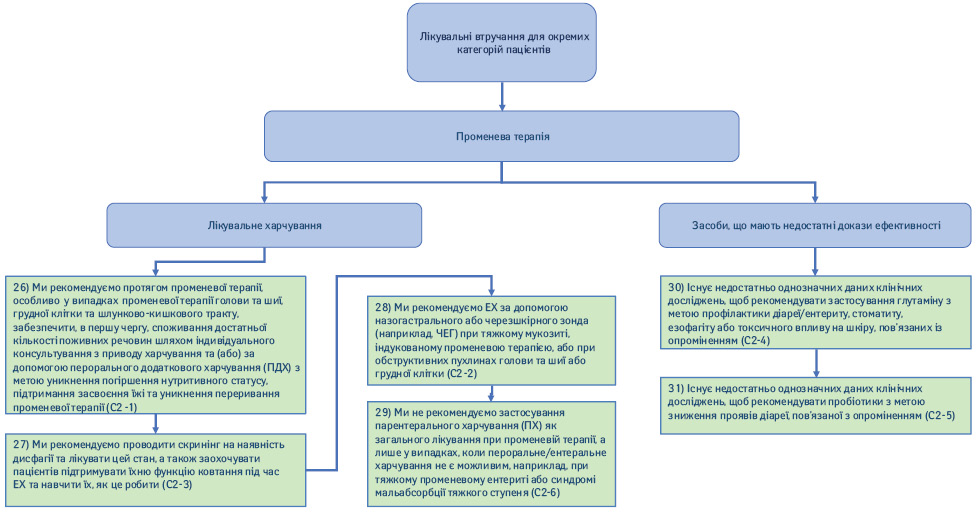
26) Ми рекомендуємо під час променевої терапії, особливо що стосується променевої терапії голови та шиї, грудної клітки та ШКТ, забезпечити в першу чергу споживання достатньої кількості поживних речовин, застосовуючи індивідуальне консультування з приводу харчування та/або за допомогою ПДХ з метою уникнення погіршення нутритивного статусу, підтримання засвоєння їжі та уникнення переривання променевої терапії (Рекомендація С2-1; сила рекомендації — сильна, рівень доказовості — помірний, твердий консенсус).
Коментар. Променева терапія голови та шиї або стравоходу призводить до розвитку мукозиту, зниження засвоєння їжі та втрати маси тіла у майже 80% пацієнтів [78–89]. Променева терапія ділянки таза також пов’язана з виникненням симптомів з боку ШКТ у майже 80% пацієнтів [90]. З цих причин усі хворі, які отримують променеву терапію ШКТ або голови та шиї, повинні пройти ретельну оцінку харчування, належне консультування з приводу харчування та, за необхідності, нутритивну підтримку відповідно до симптомів і нутритивного статусу [23, 91]. Якщо є необхідність у нутритивній підтримці, її слід розпочати якнайшвидше, та якщо споживання калорій є недостатнім, рекомендується призначити ПДХ [80] або запропонувати ЕХ [79].
27) Ми рекомендуємо проводити скринінг на наявність дисфагії та лікувати цей стан, а також заохочувати та навчати пацієнтів того, як підтримувати їхню функцію ковтання під час ЕХ (Рекомендація С2-3; сила рекомендації — сильна, рівень доказовості — низький, твердий консенсус).
Коментар. Консенсусна група нещодавно рекомендувала проводити оцінку всіх пацієнтів з групи ризику на предмет порушення функції ковтання до та під час лікування та регулярно під час подальшого спостереження, а також щодо належного призначення та нагляду за виконанням ковтальних вправ у всіх пацієнтів з дисфагією. Таким чином, слід регулярно проводити оцінку наявності та профілактики дисфагії, а також лікувальні втручання з цього приводу.
28) Ми рекомендуємо ЕХ за допомогою назогастрального або черезшкірного зонда (наприклад черезшкірні ендоскопічні гастростоми) при тяжкому мукозиті, індукованому променевою терапією, або при обструктивних пухлинах голови та шиї або грудної клітки (Рекомендація С2-2; сила рекомендації — сильна, рівень доказовості — низький, твердий консенсус).
Коментар. У пацієнтів з обструктивними злоякісними пухлинами голови та шиї або стравоходу та за умови очікуваного тяжкого мукозиту ротової порожнини чи стравоходу, спричиненого опроміненням, існує високий ризик втрати маси тіла, зниження фізичної працездатності, дегідратації, зниження переносимості лікування та підвищений ризик вимушеного переривання лікування. У ситуаціях підвищеного ризику, наприклад, первинна локалізація пухлини в гіпофарингеальній ділянці, пухлина Т4, жіноча стать або комбінована радіохіміотерапія [92], проведення профілактичного ЕХ (на відміну від ЕХ, розпочатого після розвитку дисфагії) може підтримувати нутритивний статус і допомогти уникнути вимушених перерв у терапії. У декількох, здебільшого ретроспективних спостережних дослідженнях, відмічали збільшення маси тіла та нижчу частоту повторних госпіталізацій і вимушених перерв у лікуванні у пацієнтів, які отримували ранню терапію у порівнянні з пізнім початком або відсутністю ЕХ [79, 93]. ЧЕГ у порівнянні з гастростомами, введеними під радіологічним контролем, пов’язані з нижчим ризиком розвитку перитоніту та нижчою смертністю [94]. У порівнянні з назогастральними зондами ЧЕГ демонструють аналогічне підтримання маси тіла [95], нижчий ризик зміщення зонда [95], ймовірно, кращу якість життя [96], у той час як назогастральні зонди пов’язані з меншою дисфагією [95] та більш раннім відлученням після завершення променевої терапії [95]. Ризики пневмонії та інших інфекцій є подібними [95].
29) Ми не рекомендуємо застосування ПХ як загального лікування при променевій терапії, а лише у випадках, коли пероральне/ЕХ не є можливим, наприклад, при тяжкому променевому ентериті або синдромі мальабсорбції тяжкого ступеня (Рекомендація С2-6; сила рекомендації — сильна, рівень доказовості — помірний, консенсус).
Коментар. Променева терапія голови та шиї або ділянки таза пов’язана з виникненням симптомів з боку ШКТ і втратою маси тіла у майже 80% пацієнтів [81, 84, 97]. Застосування ПХ показане за відсутності достатньої оральної/ентеральної переносимості для споживання необхідної кількості калорій і поживних речовин. Те саме характерне і для хронічної тяжкої ентеральної непереносимості їжі (нудота, що не піддається лікуванню, блювання, біль у животі, синдром мальабсорбції або діарея), яку не можна побороти шляхом ЕХ. Кишкова недостатність розвивається приблизно у 5% пацієнтів [32], для яких домашнє ПХ є доцільним методом лікування, можливо, навіть кращим, ніж хірургічні інтервенції [98].
30) Існує недостатньо однозначних результатів клінічних досліджень, щоб рекомендувати застосування глутаміну з метою профілактики діареї/ентериту, стоматиту, езофагіту або токсичного впливу на шкіру, пов’язаних з опроміненням (Рекомендація С2-4; сила рекомендації — відсутня, рівень доказовості — низький, твердий консенсус).
Коментар. Є певні докази потенційних сприятливих ефектів глутаміну щодо мукозиту та токсичних уражень шкіри, пов’язаних з опроміненням. У двох невеликих рандомізованих дослідженнях повідомлялося про те, що полоскання ротової порожнини глутаміном (16 г/добу; 17 пацієнтів) [99] або внутрішньовенне введення глутаміну (0,3 г/кг/добу; 29 пацієнтів) [100] порівняно з плацебо (хлорид натрію) знизили частоту, тяжкість і тривалість мукозиту, пов’язаного з опроміненням. Глутамін пов’язаний з вищою частотою рецидивів пухлин при трансплантації гемопоетичних стовбурових клітин (ТГСК) у пацієнтів [101]; таким чином, рекомендація щодо його застосування вимагає з’ясування питання безпечності його використання та надійніших даних щодо ефективності [102].
31) Існує недостатньо однозначних даних клінічних досліджень, щоб рекомендувати пробіотики з метою зменшення проявів діареї, пов’язаної з опроміненням (Рекомендація С2-5; сила рекомендації — відсутня, рівень доказовості — низький, твердий консенсус).
Коментар. Існують дані про захисний ефект пробіотиків, проте через неоднорідність таких даних та обмежену якість досліджень надати рекомендацію неможливо. Окрім того, слід ретельно вивчити безпеку застосування пробіотиків перед тим, як ці препарати можна буде рекомендувати пацієнтам з ослабленим імунітетом [103–105].
2.3. Медична онкологія: радикальна або паліативна протипухлинна медикаментозна терапія (рис. 7).
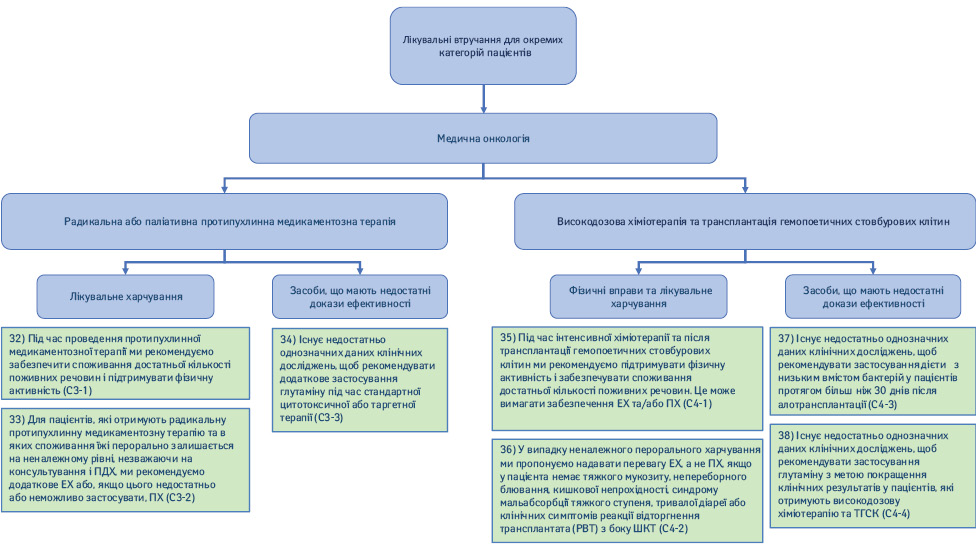
32) Під час проведення протипухлинної медикаментозної терапії ми рекомендуємо забезпечити споживання достатньої кількості поживних речовин і підтримувати фізичну активність (Рекомендація С3-1; сила рекомендації — сильна, рівень доказовості — дуже низький, твердий консенсус).
Коментар. Втрата маси тіла — частий побічний ефект таргетної терапії, а застосування інгібіторів мультикінази часто призводить до атрофії скелетних м’язів [45]. Окрім цього, результати вказують на те, що низька м’язова маса є фактором ризику токсичності у цих пацієнтів [106]. Справді, стабілізація маси тіла в осіб з онкологічними захворюваннями ШКТ і легені корелює зі значним покращенням виживаності [107, 108]. Дотепер існує мало досліджень, які демонструють, чи пов’язано це зі споживанням достатньої кількості поживних речовин, чи із самим лише лікуванням з приводу раку.
33) Пацієнтам, які отримують радикальну протипухлинну медикаментозну терапію та в яких пероральне споживання їжі залишається на неналежному рівні, незважаючи на консультування та ПДХ, ми рекомендуємо додаткове ЕХ або, якщо цього недостатньо або неможливо застосувати, ПХ (Рекомендація С3-2; сила рекомендації — сильна, рівень доказовості — дуже низький, консенсус).
Коментар. Даних про дієтотерапію, проведену згідно з потребами в калоріях під час стандартної цитостатичної терапії, недостатньо. Дослідження, у яких порівнювали ЕХ і ПХ, продемонстрували, що ЕХ є виправданим і порівняно з ПХ може бути пов’язане з нижчою частотою виникнення нейтропенії [109].
34) Існує недостатньо однозначних даних клінічних досліджень, щоб рекомендувати додаткове застосування глутаміну під час стандартної цитотоксичної або таргетної терапії (Рекомендація С3-3; сила рекомендації — відсутня, рівень доказовості — низький, твердий консенсус).
Коментар. Повідомлялося про сприятливий вплив перорального та парентерального додаткового застосування глутаміну при запаленні слизових оболонок, індукованих хіміотерапією [100], при блюванні, діареї [110, 111] та цитопенії [112]. У нещодавньому систематичному огляді, в якому проводився аналіз 15 проспективних і ретроспективних клінічних досліджень за участю онкологічних пацієнтів, які отримували хіміо-, променеву або комбіновану променеву та хіміотерапію [113], було показано, що в 11 з 15 цих досліджень повідомлялося про позитивний вплив перорального застосування глутаміну при мукозитах. Однак у 2 із 6 проспективних і плацебо-контрольованих клінічних дослідженнях було виявлено позитивний ефект глутаміну, у той час як у 4 дослідженнях не спостерігалося жодного ефекту [113]. Зважаючи на неоднорідність цих даних і недостатністю кількість інформації про вплив глутаміну на ремісію пухлини, неможливо надати рекомендацію щодо його застосування з лікувальною метою.
2.4. Медична онкологія: високодозова хіміотерапія і ТГСК.
35) Під час інтенсивної хіміотерапії та після ТГСК ми рекомендуємо підтримувати фізичну активність і забезпечувати споживання достатньої кількості поживних речовин. Це може вимагати застосування ЕХ та/або ПХ (Рекомендація С4-1; сила рекомендації — сильна, рівень доказовості — дуже низький, твердий консенсус).
Коментар. Багато пацієнтів, направлені на аутологічну, особливо на алогенну ТГСК, на момент госпіталізації мають прояви недостатності харчування. Високодозова променева/хіміотерапія пов’язана з типовим спектром побічних ефектів, зокрема нудотою, блюванням, мукозитом, діареєю та інфекціями, також негативно впливає на переносимість їжі, та пацієнти втрачають масу тіла, особливо в перші 40 днів після госпіталізації [114]. Тому хворі повинні проходити скринінг і діагностику на предмет підозри або явної мальнутриції при госпіталізації, а після — щотижня спостерігатися під час ТГСК з приводу споживання достатньої кількості поживних речовин, метаболізму та фізичної активності. У разі виявлення дефіциту слід розпочати ранню нутритивну підтримку, що включає консультування, ПДХ, ЕХ та/або ПХ, з метою уникнення або мінімізації подальшої втрати маси тіла або клітинної маси організму.
При ПХ можливі певні переваги за рахунок можливості застосування специфічних сумішей для лікувального харчування. У пацієнтів, яким проводять алотрансплантацію кісткового мозку при гемобластозах, спостерігалося зниження частоти летальних гострих реакцій відторгнення трансплантата при ПХ з високим вмістом довголанцюгових жирних кислот [115].
Оскільки за виникнення м’язової слабкості й втрату м’язової маси відповідають численні фактори (фонове злоякісне захворювання, терапія перед проведенням ТГСК, іммобілізація під час ТГСК і побічні ефекти медикаментозної терапії, наприклад, кортикостероїдами, рекомендовано заохочувати пацієнтів до м’язових тренувань, а також до підвищення їхньої фізичної активності перед, під час і після ТГСК [116, 117].
36) У випадку неналежного перорального харчування ми пропонуємо надавати перевагу ЕХ, а не ПХ, якщо у пацієнта немає тяжкого мукозиту, невпинного блювання, кишкової непрохідності, синдрому мальабсорбції тяжкого ступеня, тривалої діареї або клінічних симптомів реакції відторгнення трансплантата з боку ШКТ (Рекомендація С4-2; сила рекомендації — слабка, рівень доказовості — низький, твердий консенсус).
Коментар. Лікувальне харчування показане пацієнтам, які не можуть належним чином харчуватися пероральним шляхом. Якщо немає тяжких ушкоджень кишкового тракту, перевагу зазвичай слід надавати ЕХ. Декілька нещодавніх досліджень свідчать на підтримку ЕХ перед ПХ при алогенній ТГСК [118]. Дані демонструють тенденцію до меншої кількості ускладнень при використанні ЕХ у порівнянні з парентеральним під час процедури, особливо що стосується інфекційних ускладнень [118]. Після аутологічної ТГСК ПХ може бути необхідною тільки в невеликій кількості випадків. Після алогенної ТГСК ПХ буде необхідним частіше та впродовж більш тривалих періодів часу внаслідок розвитку тяжких токсичних мукозитів, інфекцій ШКТ і реакцій відторгнення трансплантата.
37) Існує недостатньо однозначних даних клінічних досліджень, щоб рекомендувати застосування дієти з низьким вмістом бактерій у пацієнтів протягом більш ніж 30 днів після алотрансплантації (Рекомендація С4-3; сила рекомендації — відсутня, рівень доказовості — низький, твердий консенсус).
Коментар. Через тяжку, а іноді і тривалу імуносупресію внаслідок хіміотерапії існує ризик харчових інфекцій. У 1980-х роках застосування нейтропенічних дієт після ТГСК було впроваджене з метою профілактики інфекцій, зумовлених мікроорганізмами, які населяють ШКТ [119]. У нещодавньому Кокранівському огляді було проаналізовано 619 досліджень, у яких вивчали вплив дієти з низьким вмістом бактерій під час нейтропенії, зумовленої хіміотерапією, проте серед цих випробувань було тільки 3 РКД, кожне з яких мало методологічні обмеження, та в жодному з них не враховували постнейтропенічну фазу [120]. Автори дійшли висновку про відсутність доказів на підтримку використання дієти з низьким вмістом бактерій для профілактики інфекцій і пов’язаних клінічних результатів [120].
38) Існує недостатньо однозначних даних клінічних досліджень, щоб рекомендувати застосування глутаміну з метою покращення клінічних результатів у пацієнтів, які отримують високодозову хіміотерапію і ТГСК (Рекомендація С4-4; сила рекомендації — відсутня, рівень доказовості — низький, твердий консенсус).
Коментар. Деякі поживні речовини, такі як глутамін, можуть мати вплив на фізіологічні механізми, та їх застосування було запропоноване з метою захисту слизової оболонки кишечнику від агресивного впливу хіміотерапії та променевої терапії, підтримки відновлення кровотворної та імунної систем після циторедуктивних видів лікування, оптимізації азотного балансу та синтезу білків м’язів, а також для покращення функціонування антиоксидантних систем [121]. В одному РКД, в якому порівнювали ефекти ПХ, збагаченого глутаміном, з ПХ без глутаміну у пацієнтів після аутотрансплантації, повідомлялося про тяжчі випадки оральних мукозитів і вищу частоту рецидивів у групі застосування глутаміну [101]. Упродовж останніх років було опубліковано результати тільки одного РКД за участю 120 дітей з гематологічними злоякісними захворюваннями та після ТГСК, у якому порівнювали збагачення ПХ глутаміном зі стандартним ПХ, що не впливало на тяжкість чи тривалість мукозиту, приживлення, реакцію відторгнення трансплантата, частоту рецидивів чи смертність [122]. Виходячи з цієї інформації, використання глутаміну після ТГСК не рекомендується.
2.5. Люди, що живуть з історією раку (рис. 8).
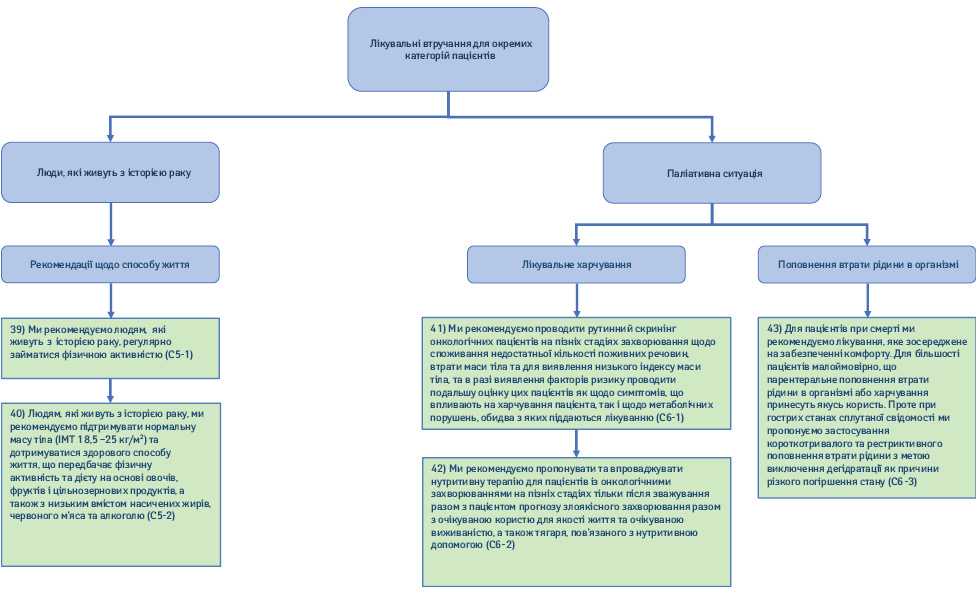
39) Ми рекомендуємо людям, які живуть з історією раку, регулярно займатися фізичною активністю (Рекомендація С5-1; сила рекомендації — сильна, рівень доказовості — низький, консенсус).
Коментар. Існує потужне теоретичне підґрунтя для рекомендацій людям, які живуть з історією раку, займатися фізичною активністю. Фізична активність — це ефективна стратегія для покращення аеробної здатності, фізичної форми та функціонального статусу у людей, які живуть з історією раку [43, 123, 124] (РКД і метааналіз; високий рівень доказовості). Декілька спостережних досліджень продемонстрували, що фізична активність пов’язана зі зниженням частоти рецидивів і смертності серед людей, які живуть з історією раку грудної залози та товстого кишечнику, однак на цей момент недостатньо доказів взаємозв’язку між фізичною активністю та смертністю у людей, які живуть з історією інших видів раку [125–127] (загальна виживаність: низький рівень доказовості). Попередні результати рандомізованих досліджень фізичної активності вказують на сприятливі зміни рівня циркулюючого інсуліну, метаболічних процесів за участю інсуліну та показників запалення [127].
40) Людям, які живуть з історією раку, ми рекомендуємо підтримувати нормальну масу тіла (ІМТ 18,5–25 кг/м2) та дотримуватися здорового способу життя, що передбачає фізичну активність та дієту на основі овочів, фруктів і цільнозернових продуктів і з низьким вмістом насичених жирів, червоного м’яса та алкоголю (Рекомендація С5-2; сила рекомендації — сильна, рівень доказовості — низький, твердий консенсус).
Коментар. Люди, які живуть з історією раку, повинні прагнути підтримувати нормальну масу тіла та уникати надмірного її збільшення впродовж життя, дотримуючись збалансованого споживання калорій та фізичної активності. Люди, які живуть з історією раку та мають надмірну масу тіла чи ожиріння, повинні намагатися знизити масу тіла, бажано досягаючи здорового ІМТ. Ожиріння та метаболічний синдром можуть бути незалежними факторами ризику рецидиву та зниження виживаності в онкологічних пацієнтів з раком грудної залози та шлунка [128]. Високий вміст червоного м’яса в раціоні (яловичина, свинина, баранина) пов’язаний з підвищеним ризиком розвитку раку молочної залози [129] та загальної смертності від злоякісних захворювань [130]. Невідомо, чи рослинна дієта впливає на частоту рецидивів злоякісного захворювання, зокрема, споживання овочів і фруктів обмежено захищає від злоякісних захворювань, пов’язаних з курінням або вживанням алкоголю [131]. Тому людям, які живуть з історією раку, слід рекомендувати дієту з високим вмістом фруктів та овочів. Pierce та співавтори повідомляли про зниження частоти рецидивів раку грудної залози лише у тих жінок, раціон яких містив велику кількість рослинної їжі в поєднанні з регулярною помірною фізичною активністю, порівняно з жінками з нижчою фізичною активністю та/або споживанням меншої кількості овочів і фруктів [132].
2.6. Пацієнти з онкозахворюваннями на пізніх стадіях, які не отримують протипухлинну терапію (паліативна ситуація).
41) Ми рекомендуємо проводити рутинний скринінг онкологічних пацієнтів на пізніх стадіях захворювання щодо споживання недостатньої кількості поживних речовин, втрати маси тіла і для виявлення низького ІМТ та в разі визначення факторів ризику проводити подальшу оцінку цих хворих як щодо симптомів, які впливають на харчування пацієнта, так і щодо метаболічних порушень, обидва з яких піддаються лікуванню (Рекомендація С6-1; сила рекомендації — сильна, рівень доказовості — низький, консенсус).
Коментар. Очікувана тривалість життя онкологічних пацієнтів на пізніх стадіях захворювання становить від кількох місяців до декількох років. У цих хворих дефіцити в нутритивному статусі можуть негативно впливати на їх функціональну спроможність, якість життя, переносимість протипухлинної терапії та виживаність. У пацієнтів з коротшим очікуваним терміном виживаності полегшення симптомів, що впливають на харчування, може зменшити тягар захворювання [133]. Рекомендовано не припиняти скринінг і оцінку осіб з онкологічними захворюваннями на пізніх стадіях, як описано в розділі 1.1.
42) Ми рекомендуємо пропонувати та впроваджувати нутритивні інтервенції для пацієнтів з онкологічними захворюваннями на пізніх стадіях тільки після зважування разом з хворим прогнозу злоякісного захворювання з очікуваною користю для якості життя та очікуваної виживаності, а також тягаря, пов’язаного з лікувальним харчуванням (Рекомендація С6-2; сила рекомендації — сильна, рівень доказовості — низький, консенсус).
Коментар. Слід ретельно зважити переваги нутритивної підтримки у пацієнтів з онкологічними захворюваннями на пізніх стадіях, враховуючи всі відповідні аспекти, зокрема прогноз онкологічного захворювання [134, 135]. Очікувана виживаність має найважливіше значення. Якщо очікувана виживаність становить декілька місяців або років, нутритивну підтримку слід призначити з метою забезпечення належного споживання калорій та білків, зменшення проявів метаболічних порушень та підтримки адекватного функціонального статусу та суб’єктивної якості життя. Якщо пацієнт із цієї прогностичної групи не здатний споживати їжу, лікувальне харчування може покращити виживаність [32], але рівень доказовості — слабкий (Tobberup R. et al., 2019). Якщо очікувана виживаність коливається в межах від одного до декількох тижнів, втручання мають бути неінвазивними та, перш за все, спрямованими на психосоціальну та екзистенційну підтримку. Пацієнтам з порівняно сприятливим прогнозом та очікуваною загальною виживаністю мінімум декілька місяців [135], а також особам з низькою активністю пухлини та відсутністю запальної реакції (С-реактивний білок < 10 мг/дл) [134] слід надати належне консультування та підтримку з приводу харчування, зокрема перорального, ентерального чи, якщо необхідно, ПХ або їх комбінації. Функціональний статус не повинен впливати на прийняття рішення щодо нутритивної підтримки у цих хворих, якщо функціональний статус вважається низьким через споживання недостатньої кількості поживних речовин і не дуже швидке прогресування захворювання. Пацієнти, у яких, незважаючи на онкотерапію, відмічають швидке прогресування захворювання, активне системне запалення та (або) функціональний статус ≥3 за Шкалою східної об’єднаної онкологічної групи (Eastern Cooperative Oncology Group — ECOG), з меншою імовірністю отримають користь від нутритивної підтримки. Існує розуміння, що лікувальне харчування без урахування можливих негативних наслідків у всіх хворих, які отримують протипухлинну терапію, загалом пов’язане з більшою шкодою, ніж користю [136, 137].
43) Для пацієнтів при смерті ми рекомендуємо лікування, яке зосереджене на забезпеченні комфорту. Для більшості пацієнтів малоймовірно, що парентеральне поповнення втрати рідини в організмі або харчування принесуть якусь користь. Проте при гострих станах сплутаної свідомості ми пропонуємо застосування короткотривалої та рестриктивної гідратації з метою виключення дегідратації як причини різкого погіршення (Рекомендація С6-3; сила рекомендації — сильна, рівень доказовості — низький, твердий консенсус).
Коментар. Користь від нутритивної підтримки протягом останніх тижнів життя відсутня або дуже незначна, оскільки вона жодним чином не покращить функціональний статус або комфорт пацієнта. Навпаки, протягом гіперметаболізму на термінальних стадіях нормальна кількість калорій та поживних речовин може бути надлишковою, що спричиняє метаболічний дистрес. І все ж, не так рідко родичі та особи, які здійснюють догляд за пацієнтом, можуть вимагати призначення нутритивної підтримки або поповнення втрати рідини для пацієнтів на термінальних стадіях захворювання [138]. Хворим, членам сім’ї та особам, які здійснюють догляд за пацієнтом, обов’язково слід пояснити, що метою є комфорт, а також пояснити та розповісти про переваги й недоліки продовження лікувального харчування [139]. Пацієнти, які перебувають на межі смерті, рідко відчувають голод, і вживання мінімальної кількості улюбленої їжі забезпечує належний комфорт [140]. Якщо хворого було охарактеризовано як людину на межі смерті, але він перебуває у свідомості та відчуває голод, можливо, такий діагноз було встановлено неправильно. У таких випадках слід провести повторну оцінку пацієнта, оскільки йому може знадобитися лікування. Рутинне поповнення втрати рідини не продемонструвало жодних покращень [138] або тільки обмежені ефекти [139, 141] стосовно симптомів і якості життя в онкологічних хворих, які перебувають на межі смерті [139, 141, 142]. У пацієнтів, які перебувають на межі смерті, для покращення або підтримання свідомості можна спробувати парентеральне поповнення втрати рідини. Його не слід застосовувати для полегшення симптомів спраги або сухості в роті (часто спричинені лікарськими засобами, такими як опіоїди) [139]; для полегшення симптомів у цих пацієнтів ефективними є заходи з догляду за порожниною рота [140].
Конфлікт інтересів. Конфлікт інтересів відсутній.
Подяка. Цю настанову було розроблено за підтримки ESPEN, EPAAC та UEG.
Список використаної літератури
1. Muscaritoli, M., Arends, J., Bachmann, P., Baracos, V., Barthelemy, N., Bertz, H., … Bischoff, S. C. (2021). ESPEN practical guideline: Clinical nutrition in cancer. Clinical Nutrition, 40(2021), 2898–2913. doi.org/10.1016/j.clnu.2021.02.005 0261-5614.
2. Arends, J., Bachmann, P., Baracos, V., Barthelemy, N., Bertz, H., Bozzetti, F., … Preiser, J. C. (2017). ESPEN guidelines on nutrition in cancer patients. Clinical Nutrition, 36, 11–48. doi.org/10.1016/j.clnu.2016.07.015.
3. Preiser, J.-C., & Schneider, S. M. (2011). ESPEN disease-specific guideline framework. Clinical Nutrition, 30(5), 549–552. doi: 10.1016/j.clnu.2011.07.006.
4. Knox, L. S., Crosby, L. O., Feurer, I. D., Buzby, G. P., Miller, C. L., & Mullen, J. L. (1983). Energy expenditure in malnourished cancer patients. Annals of Surgery, 197(2), 152–162. doi: 10.1097/00000658-198302000-00006.
5. Bosaeus, I., Daneryd, P., Svanberg, E., & Lundholm, K. (2001). Dietary intake and resting energy expenditure in relation to weight loss in unselected cancer patients. International Journal of Cancer, 93(3), 380–383. doi: 10.1002/ijc.1332.
6. Cao, D. X., Wu, G. H., Zhang, B., Quan, Y. J., Wei, J., Jin, H., … Waitzberg, D. L. (2010). Resting energy expenditure and body composition in patients with newly detected cancer. Clinical Nutrition, 29, 72–77. doi: 10.1016/j.nut.2022.111740.
7. Gibney, E., Elia, M., Jebb, S. A., Murgatroyd, P., & Jennings, G. (1997). Total energy expenditure in patients with small-cell lung cancer: results of a validated study using the bicarbonate-urea method. Metabolism, 46, 412–417. doi: 10.1016/s0026-0495(97)90140-2.
8. Moses, A. W., Slater, C., Preston, T., Barber, M. D., & Fearon, K. C. (2004). Reduced total energy expenditure and physical activity in cachectic patients with pancreatic cancer can be modulated by an energy and protein dense oral supplement enriched with n-3 fatty acids. British Journal of Cancer, 90, 996–1002. doi: 10.1038/sj.bjc.6601620.
9. MacDonald, A. J., Johns, N., Stephens, N., Greig, C., Ross, J. A., Small, A. C., … Preston, T. (2015). Habitual Myofibrillar Protein Synthesis Is Normal in Patients with Upper GI Cancer Cachexia. Clinical Cancer Research, 21, 1734–1740. doi: 10.1158/1078-0432.CCR-14-2004.
10. Deutz, N. E., Safar, A., Schutzler, S., Memelink, R., Ferrando, A., Spencer, H., … Wolfe, R. R. (2011). Muscle protein synthesis in cancer patients can be stimulated with a specially formulated medical food. Clinical Nutrition, 30, 759–768. doi: 10.1016/j.clnu.2011.05.008.
11. Hunter, D. C., Weintraub, M., Blackburn, G. L., & Bistrian, B. R. (1989). Branched chain amino acids as the protein component of parenteral nutrition in cancer cachexia. British Journal of Surgery, 76, 149–153. doi: 10.1002/bjs.1800760215.
12. Tayek, J. A., Bistrian, B. R., Hehir, D. J., Martin, R., Moldawer, L. L., & Blackburn, G. L. (1986). Improved protein kinetics and albumin synthesis by branched chain amino acid-enriched total parenteral nutrition in cancer cachexia. A prospective randomized crossover trial. Cancer, 58(1), 147–157. doi: 10.1002/1097-0142(19860701)58:1<147::aid-cncr2820580126>3.0.co;2-i.
13. Horneber, M., Bueschel, G., Dennert, G., Less, D., Ritter, E., & Zwahlen, M. (2012). How many cancer patients use complementary and alternative medicine: a systematic review and metaanalysis. Integrative Cancer Therapies, 11(3), 187–203. doi: 10.1177/1534735411423920.
14. Łuczyńska, A., Kaaks, R., Rohrmann, S., Becker, S., Linseisen, J., Buijsse, B., … Nieters, A. (2013). Plasma 25-hydroxyvitamin D concentration and lymphoma risk: results of the European Prospective Investigation into Cancer and Nutrition. The American Journal of Clinical Nutrition, 98(3), 827–838. doi: 10.3945/ajcn.112.054676.
15. Bolland, M. J., Grey, A., Gamble, G. D., & Reid, I. R. (2014). The effect of vitamin D supplementation on skeletal, vascular, or cancer outcomes: a trial sequential meta-analysis. Lancet Diabetes & Endocrinology, 2(4), 307–320. doi: 10.1016/S2213-8587(13)70212-2.
16. Autier, P., Boniol, M., Pizot, C., & Mullie, P. (2014). Vitamin D status and ill health: a systematic review. Lancet Diabetes & Endocrinology, 2(4), 76–89. doi: 10.1016/S2213-8587(13)70165-7.
17. Wang, L., Sesso, H. D., Glynn, R. J., Christen, W. G., Bubes, V., Manson, J. E., … Gaziano, J. M. (2014). Vitamin E and C supplementation and risk of cancer in men: posttrial follow-up in the Physicians’ Health Study II randomized trial. The American Journal of Clinical Nutrition, 100(3), 915–923. doi: 10.3945/ajcn.114.085480.
18. Klein, E. A., Thompson, I. M., Tangen, C. M., Crowley, J. J., Lucia, M. S., Goodman, P. J., … Baker, L. H. (2011). Vitamin E and the risk of prostate cancer: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA, 306(14), 1549–1556. doi: 10.1001/jama.2011.1437.
19. Waterhouse, C., & Kemperman, J. H. (1971). Carbohydrate metabolism in subjects with cancer. Cancer Research, 31, 1273–1278.
20. Körber, J., Pricelius, S., Heidrich, M., & Müller, M. J. (1999). Increased lipid utilization in weight losing and weight stable cancer patients with normal body weight. European Journal of Clinical Nutrition, 53(9), 740–745. doi: 10.1038/sj.ejcn.1600843.
21. Baldwin, C., Spiro, A, Ahern, R., & Emery, P. W. (2012). Oral nutritional interventions in malnourished patients with cancer: a systematic review and meta-analysis. Journal of the National Cancer Institute, 104(5), 371–385. doi: 10.1093/jnci/djr556.
22. Bourdel-Marchasson, I., Blanc-Bisson, C., Doussau, A., Germain, C., Blanc, J. F., Dauba, J., … Fonck, M. (2014). Nutritional advice in older patients at risk of malnutrition during treatment for chemotherapy: a two-year randomized controlled trial. PLoS One, 9(9), e108687. doi: 10.1371/journal.pone.0108687.
23. Langius, J. A., Zandbergen, M. C., Eerenstein, S. E., van Tulder, M. W., Leemans, C. R., Kramer, M. H., … Weijs, P. J. (2013). Effect of nutritional interventions on nutritional status, quality of life and mortality in patients with head and neck cancer receiving (chemo)radiotherapy: a systematic review. Clinical Nutrition, 32(5), 671–678. doi: 10.1016/j.clnu.2013.06.012.
24. Baldwin, C., Spiro, A., McGough, C., Norman, A. R., Gillbanks, A., Thomas, K., … Andreyev, H. J. (2011). Simple nutritional intervention in patients with advanced cancers of the gastrointestinal tract, non-small cell lung cancers or mesothelioma and weight loss receiving chemotherapy: a randomised controlled trial. Journal of Human Nutrition and Dietetics, 24(5), 431–440. doi: 10.1111/j.1365-277X.2011.01189.x.
25. Dansinger, M. L., Gleason, J. A., Griffith, J. L., Selker, H. P., & Schaefer, E. J. (2005). Comparison of the Atkins, Ornish, Weight Watchers, and Zone diets for weight loss and heart disease risk reduction: a randomized trial. JAMA, 293(1), 43–53. doi: 10.1001/jama.293.1.43.
26. Rieger, J., Bähr, O., Maurer, G. D., Hattingen, E., Franz, K., Brucker, D., … Steinbach, J. P. (2014). ERGO: a pilot study of ketogenic diet in recurrent glioblastoma. International Journal of Oncology, 44(6), 1843–1852. doi: 10.3892/ijo.2014.2382.
27. Schmidt, M., Pfetzer, N., Schwab, M., Strauss, I., & Kämmerer, U. (2011). Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer: A pilot trial. Nutrition & Metabolism, 8(1), 54. doi: 10.1186/1743-7075-8-54.
28. de Groot, S., Vreeswijk, M. P., Welters, M. J., Gravesteijn, G., Boei, J. J., Jochems, A., … Kroep, J. R. (2015). The effects of short-term fasting on tolerance to (neo) adjuvant chemotherapy in HER2-negative breast cancer patients: a randomized pilot study. BMC Cancer, 15, 652. doi: 10.1038/s41467-020-16138-3.
29. Safdie, F. M., Dorff, T., Quinn, D., Fontana, L., Wei, M., Lee, C., Cohen, P., & Longo, V. D. (2009). Fasting and cancer treatment in humans: A case series report. Aging (Albany N Y), 1(12), 988–1007. doi: 10.18632/aging.100114.
30. Corry, J., Poon, W., McPhee, N., Milner, A., Cruickshank, D., Porceddu, S., … Peters, L. J. (2008). Randomized study of percutaneous endoscopic gastrostomy versus nasogastric tubes for enteral feeding in head and neck cancer patients treated with (chemo) radiation. Journal of Medical Imaging and Radiation Oncology, 52(5), 503–510. doi: 10.1111/j.1440-1673.2008.02003.x.
31. Nugent, B., Parker, M. J., & McIntyre, I. A. (2010). Nasogastric tube feeding and percutaneous endoscopic gastrostomy tube feeding in patients with head and neck cancer. Journal of Human Nutrition and Dietetics, 23, 277–284. doi: 10.1111/j.1365-277X.2010.01047.x.
32. Bozzetti, F., Santarpia, L., Pironi, L., Thul, P., Klek, S., Gavazzi, C., … Mariani, L. (2014). The prognosis of incurable cachectic cancer patients on home parenteral nutrition: a multi-centre observational study with prospective follow-up of 414 patients. Annals of Oncology, 25, 487–493. doi: 10.1093/annonc/mdt549.
33. Brennan, M. F., Pisters, P. W., Posner, M., Quesada, O., & Shike, M. (1994). A prospective randomized trial of total parenteral nutrition after major pancreatic resection for malignancy. Annals of Surgery, 220(4), 436–441. doi: 10.1097/00000658-199410000-00003.
34. Scolapio, J. S., Ukleja, A., Burnes, J. U., & Kelly, D. G. (2002). Outcome of patients with radiation enteritis treated with home parenteral nutrition. American Journal of Gastroenterology, 97, 662–666. doi: 10.1111/j.1572-0241.2002.05546.x.
35. Sheth, C. H., Sharp, S., & Walters, E. R. (2013). Enteral feeding in head and neck cancer patients at a UK cancer centre. Journal of Human Nutrition and Dietetics, 26(5), 421–428. doi: 10.1111/jhn.12029.
36. Staun, M., Hebuterne, X., Shaffer, J., Haderslev, K. V., Bozzetti, F., Pertkiewicz, M., … Pironi, L. (2007). Management of intestinal failure in Europe. A questionnaire based study on the incidence and management. Dynamic medicine, 6, 7. doi: 10.1186/1476-5918-6-7.
37. Orrevall, Y., Tishelman, C., Permert, J., & Lundström, S. (2013). A national observational study of the prevalence and use of enteral tube feeding, parenteral nutrition and intravenous glucose in cancer patients enrolled in specialized palliative care. Nutrients, 5, 267–282. doi: 10.3390/nu5010267.
38. Ruggeri, E., Agostini, F., Fettucciari, L., Giannantonio, M., Pironi, L., & Pannuti, F. (2013). Home artificial nutrition in advanced cancer patients. Tumori, 99(2), 218–224. doi: 10.1177/030089161309900216.
39. Fan, B. G. (2007). Parenteral nutrition prolongs the survival of patients associated with malignant gastrointestinal obstruction. Journal of Parenteral and Enteral Nutrition, 31(6), 508–510. doi: 10.1177/0148607107031006508.
40. Lowe, S. S., Watanabe, S. M., & Courneya, K. S. (2009). Physical activity as a supportive care intervention in palliative cancer patients: a systematic review. Journal of Supportive Oncology, 7(1), 27–34.
41. Oldervoll, L. M., Loge, J. H., Lydersen, S., Paltiel, H., Asp, M. B., Nygaard, U. V., … Kaasa, S. (2011). Physical exercise for cancer patients with advanced disease: a randomized controlled trial. Oncologist, 16(11), 1649–1657. doi: 10.1634/theoncologist.2011-0133.
42. Fong, D. Y., Ho, J. W., Hui, B. P., Lee, A. M., Macfarlane, D. J., Leung, S. S., … Cheng, K. K. (2012). Physical activity for cancer survivors: meta-analysis of randomised controlled trials. BMJ, 344, e70. doi: 10.1136/bmj.e70.
43. Speck, R. M., Courneya, K. S., Mâsse, L. C., Duval, S., & Schmitz, K. H. (2010). An update of controlled physical activity trials in cancer survivors: a systematic review and meta-analysis. Journal of Cancer Survivorship, 4(2), 87–100. doi: 10.1007/s11764-009-0110-5.
44. Stene, G. B., Helbostad, J. L., Balstad, T. R., Riphagen, I. I., Kaasa, S., & Oldervoll, L. M. (2013). Effect of physical exercise on muscle mass and strength in cancer patients during treatment–a systematic review. Critical Reviews in Oncology/Hematology, 88, 573–593. doi: 10.1016/j.critrevonc.2013.07.001.
45. Antoun, S., Birdsell, L., Sawyer, M. B., Venner, P., Escudier, B., & Baracos, V. E. (2010). Association of skeletal muscle wasting with treatment with sorafenib in patients with advanced renal cell carcinoma: results from a placebo-controlled study. Journal of Clinical Oncology, 28, 1054–1060. doi: 10.1200/JCO.2009.24.9730.
46. Awad, S., Tan, B. H., Cui, H., Bhalla, A., Fearon, K. C., Parsons, S. L., & Lobo, D. N. (2012). Marked changes in body composition following neoadjuvant chemotherapy for oesophagogastric cancer. Clinical Nutrition, 31(1), 74–77. doi: 10.1016/j.clnu.2011.08.008.
47. Kortebein, P., Ferrando, A., Lombeida, J., Wolfe, R., & Evans, W. J. (2007). Effect of 10 days of bed rest on skeletal muscle in healthy older adults. JAMA, 297, 1772–1774. doi: 10.1001/jama.297.16.1772-b.
48. Moertel, C. G., Schutt, A. J., Reitemeier, R. J., & Hahn, R. G. (1974). Corticosteroid therapy of preterminal gastrointestinal cancer. Cancer, 33, 1607–1609. doi: 10.1002/1097-0142(197406)33:6<1607::aid-cncr2820330620>3.0.co;2-v.
49. Maltoni, M., Nanni, O., Scarpi, E., Rossi, D., Serra, P., & Amadori, D. (2001). High-dose progestins for the treatment of cancer anorexia-cachexia syndrome: a systematic review of randomised clinical trials. Annals of Oncology, 12(3), 289–300. doi: 10.1023/a:1011156811739.
50. Ruiz Garcia, V., López-Briz, E., Carbonell Sanchis, R., Gonzalvez Perales, J. L., & Bort-Marti, S. (2013). Megestrol acetate for treatment of anorexia-cachexia syndrome. Cochrane Database of Systematic Reviews, 2013, Cd004310. doi: 10.1002/14651858.CD004310.pub3.
51. Yavuzsen, T., Davis, M. P., Walsh, D., LeGrand, S., & Lagman, R. (2005). Systematic review of the treatment of cancer-associated anorexia and weight loss. Journal of Clinical Oncology, 23, 8500–8511. doi: 10.1200/JCO.2005.01.8010.
52. Dewey, A., Baughan, C., Dean, T, Higgins, B, & Johnson, I. (2007). Eicosapentaenoic acid (EPA, an omega-3 fatty acid from fish oils) for the treatment of cancer cachexia. Cochrane Database of Systematic Reviews, 2007, Cd004597. doi: 10.1002/14651858.CD004597.pub2.
53. Colomer, R., Moreno-Nogueira, J. M., García-Luna, P. P., García-Peris, P., García-de-Lorenzo, A., Zarazaga, A., … Casimiro, C. (2007). N-3 fatty acids, cancer and cachexia: a systematic review of the literature. British Journal of Nutrition, 97, 823–831. doi: 10.1017/S000711450765795X.
54. de Aguiar Pastore Silva, J., Emilia de Souza Fabre, M., & Waitzberg, D. L. (2015). Omega-3 supplements for patients in chemotherapy and/or radiotherapy: A systematic review. Clinical Nutrition, 34, 359–366. doi: 10.1016/j.clnu.2014.11.005.
55. Ghoreishi, Z., Esfahani, A., Djazayeri, A., Djalali, M., Golestan, B., Ayromlou, H., … Darabi, M. (2012). Omega-3 fatty acids are protective against paclitaxel-induced peripheral neuropathy: a randomized double-blind placebo controlled trial. BMC Cancer, 12, 355. doi: 10.1186/1471-2407-12-355.
56. Sánchez-Lara, K., Turcott, J. G., Juárez-Hernández, E., Nuñez-Valencia, C., Villanueva, G., Guevara, P., … Arrieta, O. (2014). Effects of an oral nutritional supplement containing eicosapentaenoic acid on nutritional and clinical outcomes in patients with advanced non-small cell lung cancer: randomised trial. Clinical Nutrition, 33, 1017–1023. doi: 10.1016/j.clnu.2014.03.006.
57. Bruera, E., Strasser, F., Palmer, J. L., Willey, J., Calder, K., Amyotte, G., … Baracos, V. (2003). Effect of fish oil on appetite and other symptoms in patients with advanced cancer and anorexia/cachexia: a double-blind, placebo-controlled study. Journal of Clinical Oncology, 21, 129–134. doi: 10.1200/JCO.2003.01.101.
58. Del Fabbro, E., Hui, D., Dalal, S., Dev, R., Nooruddin, Z. I., & Bruera, E. (2011). Clinical outcomes and contributors to weight loss in a cancer cachexia clinic. Journal of Palliative Medicine, 14, 1004–1008. doi: 10.1089/jpm.2011.0098.
59. Bruera, E., Belzile, M., Neumann, C., Harsanyi, Z., Babul, N., & Darke, A. (2000). A double-blind, crossover study of controlled-release metoclopramide and placebo for the chronic nausea and dyspepsia of advanced cancer. Journal of Pain and Symptom Management, 19, 427–435. doi: 10.1016/s0885-3924(00)00138-x.
60. Bruera, E. D., Maceachern, T. J., Spachynski, K., Legatt, D. F., MacDonald, R. N., Babul, N., … Darke, A. C. (1994). Comparison of the efficacy, safety, and pharmacokinetics of controlled release and immediate release metoclopramide for the management of chronic nausea in patients with advanced cancer. Cancer, 74, 3204–3211. doi: 10.1002/1097-0142(19941215)74:12<3204::aid-cncr2820741220>3.0.co;2-g.
61. Winter, A., MacAdams, J., & Chevalier, S. (2012). Normal protein anabolic response to hyperaminoacidemia in insulin-resistant patients with lung cancer cachexia. Clinical Nutrition, 31, 765–773. doi: 10.1016/j.clnu.2012.05.003.
62. Lundholm, K., Körner, U., Gunnebo, L., Sixt-Ammilon, P., Fouladiun, M., Daneryd, P., … Bosaeus, I. (2007). Insulin treatment in cancer cachexia: effects on survival, metabolism, and physical functioning. Clinical Cancer Research, 13, 2699–2706. doi: 10.1158/1078-0432.CCR-06-2720.
63. Berk, L., James, J., Schwartz, A., Hug, E., Mahadevan, A., Samuels, M., & Kachnic, L. (2008). A randomized, double-blind, placebo-controlled trial of a beta-hydroxyl beta-methyl butyrate, glutamine, and arginine mixture for the treatment of cancer cachexia (RTOG 0122). Support Care Cancer, 16, 1179–1188. doi: 10.1007/s00520-008-0403-7.
64. Lai, V., George, J., Richey, L., Kim, H. J., Cannon, T., Shores, C., … Couch, M. (2008). Results of a pilot study of the effects of celecoxib on cancer cachexia in patients with cancer of the head, neck, and gastrointestinal tract. Head Neck, 30, 67–74. doi: 10.1002/hed.20662.
65. Madeddu, C., Dessì, M., Panzone, F., Serpe, R., Antoni, G., Cau, M. C., … Mantovani, G. (2012). Randomized phase III clinical trial of a combined treatment with carnitine + celecoxib ± megestrol acetate for patients with cancer-related anorexia/cachexia syndrome. Clinical Nutrition, 31, 176–182. doi: 10.1016/j.clnu.2011.10.005.
66. McMillan, D. C., Wigmore, S. J., Fearon, K. C., O’Gorman, P., Wright, C. E., & McArdle, C. S. (1999). A prospective randomized study of megestrol acetate and ibuprofen in gastrointestinal cancer patients with weight loss. British Journal of Cancer, 79, 495–500. doi: 10.1038/sj.bjc.6690077.
67. Reid, J., Mills, M., Cantwell, M., Cardwell, C. R., Murray, L. J., & Donnelly, M. (2012). Thalidomide for managing cancer cachexia. Cochrane Database of Systematic Reviews, 2012, Cd008664. doi: 10.1002/14651858.CD008664.pub2.
68. Solheim, T. S., Fearon, K. C., Blum, D., & Kaasa, S. (2013). Non-steroidal anti-inflammatory treatment in cancer cachexia: a systematic literature review. Acta Oncologica, 52, 6–17. doi: 10.3109/0284186X.2012.724536.
69. Strasser, F., Luftner, D., Possinger, K., Ernst, G., Ruhstaller, T., Meissner, W., … Cerny, Т. (2006). Comparison of orally administered cannabis extract and delta-9-tetrahydrocannabinol in treating patients with cancer-related anorexia-cachexia syndrome: a multicenter, phase III, randomized, double-blind, placebo-controlled clinical trial from the Cannabis-In-Cachexia-Study-Group. Journal of Clinical Oncology, 24, 3394–3400. doi: 10.1200/JCO.2005.05.1847.
70. Brisbois, T. D., de Kock, I. H., Watanabe, S. M., Mirhosseini, M., Lamoureux, D. C., Chasen, M., … Wismer, W. V. (2011). Delta-9-tetrahydrocannabinol may palliate altered chemosensory perception in cancer patients: results of a randomized, double-blind, placebo-controlled pilot trial. Annals of Oncology, 22, 2086–2093. doi: 10.1093/annonc/mdq727.
71. Burney, B. O., Hayes, T. G., Smiechowska, J., Cardwell, G., Papusha, V., Bhargava, P., … Garcia, J. M. (2012). Low testosterone levels and increased inflammatory markers in patients with cancer and relationship with cachexia. The Journal of Clinical Endocrinology and Metabolism, 97, 700–709. doi: 10.1210/jc.2011-2387.
72. Chlebowski, R. T., Herrold, J., Ali, I., Oktay, E., Chlebowski, J. S., Ponce, A. T., … Block, J. B. (1986). Influence of nandrolone decanoate on weight loss in advanced non-small cell lung cancer. Cancer, 58, 183–186. doi: 10.1002/ 1097-0142(19860701) 58:1<183::aid-cncr2820580131>3.0.co;2-3.
73. Loprinzi, C. L., Kugler, J. W., Sloan, J. A., Mailliard, J. A., Krook, J. E., Wilwerding, M. B., … Christensen, B. J. (1999). Randomized comparison of megestrol acetate versus dexamethasone versus fluoxymesterone for the treatment of cancer anorexia/cachexia. Journal of Clinical Oncology, 17, 3299–3306. doi: 10.1200/JCO.1999.17.10.3299.
74. Beattie, A. H., Prach, A. T., Baxter, J. P., & Pennington, C. R. (2000). A randomised controlled trial evaluating the use of enteral nutritional supplements postoperatively in malnourished surgical patients. Gut, 46, 813–818. doi: 10.1136/gut.46.6.813.
75. Mortensen, K., Nilsson, M., Slim, K., Schäfer, M., Mariette, C., Braga, M., … Lassen, K. (2014). Consensus guidelines for enhanced recovery after gastrectomy: Enhanced Recovery After Surgery (ERAS®) Society recommendations. British Journal of Surgery, 101, 209–229. doi: 10.1002/bjs.9582.
76. Group VATPNCS (1991). Perioperative total parenteral nutrition in surgical patients. The New England Journal of Medicine, 325, 525–532. doi: 10.1056/NEJM199108223250801.
77. Marimuthu, K., Varadhan, K. K., Ljungqvist, O., & Lobo, D. N. (2012). A meta-analysis of the effect of combinations of immune modulating nutrients on outcome in patients undergoing major open gastrointestinal surgery. Annals of Surgery, 255, 1060–1068. doi: 10.1097/SLA.0b013e318252edf8.
78. Bozzetti, F., Cozzaglio, L., Gavazzi, C., Bidoli, P., Bonfanti, G., Montalto, F., … Zucali, R. (1998). Nutritional support in patients with cancer of the esophagus: impact on nutritional status, patient compliance to therapy, and survival. Tumori, 84, 681–686. doi: 10.1177/030089169808400614.
79. Fietkau, R., Iro, H., Sailer, D., & Sauer, R. (1991). Percutaneous endoscopically guided gastrostomy in patients with head and neck cancer. Recent Results Cancer Res, 121, 269–282. doi: 10.1007/978-3-642-84138-5_31.
80. Isenring, E. A., Capra, S., & Bauer, J. D. (2004). Nutrition intervention is beneficial in oncology outpatients receiving radiotherapy to the gastrointestinal or head and neck area. British Journal of Cancer, 91, 447–452. doi: 10.1038/sj.bjc.6601962.
81. Lee, J. H., Machtay, M., Unger, L. D., Weinstein, G. S., Weber, R. S., Chalian, A. A., … Rosenthal, D. I. (1998). Prophylactic gastrostomy tubes in patients undergoing intensive irradiation for cancer of the head and neck. Аrchives of Otorhinolaryngology-Head & Neck Surgery, 124, 871–875. doi: 10.1001/archotol.124.8.871.
82. Nayel, H., el-Ghoneimy, E., & el-Haddad, S. (1992). Impact of nutritional supplementation on treatment delay and morbidity in patients with head and neck tumors treated with irradiation. Nutrition, 8, 13–18.
83. Nugent, B., Lewis, S., & O’Sullivan, J. M. (2013). Enteral feeding methods for nutritional management in patients with head and neck cancers being treated with radiotherapy and/or chemotherapy. Cochrane Database of Systematic Reviews, 2013, Cd007904. doi: 10.1002/14651858.CD007904.pub3.
84. Odelli, C., Burgess, D., Bateman, L., Hughes, A., Ackland, S., Gillies, J., … Collins, C. E. (2005). Nutrition support improves patient outcomes, treatment tolerance and admission characteristics in oesophageal cancer. Clinical Oncology, 17, 639–645. doi: 10.1016/j.clon.2005.03.015.
85. Paccagnella, A., Morello, M., Da Mosto, M. C., Baruffi, C., Marcon, M. L., Gava, A., … Marchiori, C. (2010). Early nutritional intervention improves treatment tolerance and outcomes in head and neck cancer patients undergoing concurrent chemoradiotherapy. Support Care Cancer, 18, 837–845. doi: 10.1007/s00520-009-0717-0.
86. Thiel, H. J., Fietkau, R., & Sauer, R. (1988). Malnutrition and the role of nutritional support for radiation therapy patients. Recent Results Cancer Research, 108, 205–226. doi: 10.1007/978-3-642-82932-1_27.
87. Tyldesley, S., Sheehan, F., Munk, P., Tsang, V., Skarsgard, D., Bowman, C. A., … Hobenshield, S. E. (1996). The use of radiologically placed gastrostomy tubes in head and neck cancer patients receiving radiotherapy. International Journal of Radiation Oncology — Biology — Physics, 36, 1205–1209. doi: 10.1016/s0360-3016(96)00434-8.
88. van den Berg, M. G., Rasmussen-Conrad, E. L., van Nispen, L., van Binsbergen, J. J., & Merkx, M. A. (2008). A prospective study on malnutrition and quality of life in patients with head and neck cancer. Oral Oncology, 44, 830–837. doi: 10.1016/j.oraloncology.2007.11.002.
89. van den Berg, M. G., Rasmussen-Conrad, E. L., Wei, K. H., Lintz-Luidens, H., Kaanders, J. H., & Merkx, M. A. (2010). Comparison of the effect of individual dietary counselling and of standard nutritional care on weight loss in patients with head and neck cancer undergoing radiotherapy. British Journal of Nutrition, 104, 872–877. doi: 10.1017/S0007114510001315.
90. Khalid, U., McGough, C., Hackett, C., Blake, P., Harrington, K. J., Khoo, V. S., … Andreyev, H. J. (2006). A modified inflammatory bowel disease questionnaire and the Vaizey Incontinence questionnaire are more sensitive measures of acute gastrointestinal toxicity during pelvic radiotherapy than RTOG grading. International Journal of Radiation Oncology — Biology — Physics, 64, 1432–1441. doi: 10.1016/j.ijrobp.2005.10.007.
91. Ravasco, P., Monteiro-Grillo, I., & Camilo, M. (2012). Individualized nutrition intervention is of major benefit to colorectal cancer patients: long-term follow-up of a randomized controlled trial of nutritional therapy. American Journal of Clinical Nutrition, 96, 1346–1353. doi: 10.3945/ajcn.111.018838.
92. Mekhail, T. M., Adelstein, D. J., Rybicki, L. A., Larto, M. A., Saxton, J. P., & Lavertu, P. (2001). Enteral nutrition during the treatment of head and neck carcinoma: is a percutaneous endoscopic gastrostomy tube preferable to a nasogastric tube? Cancer, 91, 1785–1790.
93. Daly, J. M., Hearne, B., Dunaj, J., LePorte, B., Vikram, B., Strong, E., … DeCosse, J. J. (1984). Nutritional rehabilitation in patients with advanced head and neck cancer receiving radiation therapy. American Journal of Surgery, 148, 514–520. doi: 10.1016/0002-9610(84)90379-9.
94. Trotti, A., Bellm, L. A., Epstein, J. B., Frame, D., Fuchs, H. J., Gwede, C. K., … Zilberberg, M. D. (2003). Mucositis incidence, severity and associated outcomes in patients with head and neck cancer receiving radiotherapy with or without chemotherapy: a systematic literature review. Radiotherapy & Oncology, 66, 253–262. doi: 10.1016/s0167-8140(02)00404-8.
95. Wang, J., Liu, M., Liu, C., Ye, Y., & Huang, G. (2014). Percutaneous endoscopic gastrostomy versus nasogastric tube feeding for patients with head and neck cancer: a systematic review. Journal of Radiation Research, 55, 559–567. doi: 10.1093/jrr/rrt144.
96. Lees, J. (1997). Nasogastric and percutaneous endoscopic gastrostomy feeding in head and neck cancer patients receiving radiotherapy treatment at a regional oncology unit: a two year study. European Journal of Cancer Care, 6, 45–49. doi: 10.1111/j.1365-2354.1997.tb00268.x.
97. Henson, C. C., Burden, S., Davidson, S. E., & Lal, S. (2013). Nutritional interventions for reducing gastrointestinal toxicity in adults undergoing radical pelvic radiotherapy. Cochrane Database of Systematic Reviews, 2013, Cd009896. doi: 10.1002/14651858.CD009896.pub2.
98. Kalaiselvan, R., Theis, V. S., Dibb, M., Teubner, A., Anderson, I. D., Shaffer, J. L., … Lal, S. (2014). Radiation enteritis leading to intestinal failure: 1994 patient-years of experience in a national referral centre. European Journal of Clinical Nutrition, 68, 166–170. doi: 10.1038/ejcn.2013.251.
99. Huang, E. Y., Leung, S. W., Wang, C. J., Chen, H. C., Sun, L. M., Fang, F. M., … Hsiung, C. Y. (2000). Oral glutamine to alleviate radiation-induced oral mucositis: a pilot randomized trial. International Journal of Radiation Oncology — Biology — Physics, 46, 535–539. doi: 10.1016/s0360-3016(99)00402-2.
100. Cerchietti, L. C., Navigante, A. H., Lutteral, M. A., Castro, M. A., Kirchuk, R., Bonomi, M., … Uchima, P. (2006). Double-blinded, placebo-controlled trial on intravenous L-alanyl-L-glutamine in the incidence of oral mucositis following chemoradiotherapy in patients with head-and-neck cancer. International Journal of Radiation Oncology — Biology — Physics, 65, 1330–1337. doi: 10.1016/j.ijrobp.2006.03.042.
101. Pytlík, R., Benes, P., Patorková, M., Chocenská, E., Gregora, E., Procházka, B., … Kozák, T. (2002). Standardized parenteral alanyl-glutamine dipeptide supplementation is not beneficial in autologous transplant patients: a randomized, double-blind, placebo controlled study. Bone Marrow Transplant, 30, 953–961. doi: 10.1038/sj.bmt.1703759.
102. Crowther, M., Avenell, A., & Culligan, D. J. (2009). Systematic review and meta-analyses of studies of glutamine supplementation in haematopoietic stem cell transplantation. Bone Marrow Transplant, 44, 413–425. doi: 10.1038/bmt.2009.41.
103. Gibson, R. J., Keefe, D. M., Lalla, R. V., Bateman, E., Blijlevens, N., Fijlstra, M., … Bowen, J. M. (2013). Systematic review of agents for the management of gastrointestinal mucositis in cancer patients. Support Care Cancer, 21, 313–326. doi: 10.1007/s00520-012-1644-z.
104. Hamad, A., Fragkos, K. C., & Forbes, A. (2013). A systematic review and meta-analysis of probiotics for the management of radiation induced bowel disease. Clinical Nutrition, 32, 353–360. doi: 10.1016/j.clnu.2013.02.004.
105. Wedlake, L. J., Shaw, C., Whelan, K., & Andreyev, H. J. (2013). Systematic review: the efficacy of nutritional interventions to counteract acute gastrointestinal toxicity during therapeutic pelvic radiotherapy. Alimentary Pharmacology & Therapeutics, 37, 1046–1056. doi: 10.1111/apt.12316.
106. Massicotte, M. H., Borget, I., Broutin, S., Baracos, V. E., Leboulleux, S., Baudin, E., … Antoun, S. (2013). Body composition variation and impact of low skeletal muscle mass in patients with advanced medullary thyroid carcinoma treated with vandetanib: results from a placebo-controlled study. The Journal of Clinical Endocrinology and Metabolism, 98, 2401–2408. doi: 10.1210/jc.2013-1115.
107. Andreyev, H., Norman, A., Oates, J., & Cunningham, D. (1998). Why do patients with weight loss have a worse outcome when undergoing chemotherapy for gastrointestinal malignancies? European Journal of Cancer, 34, 503–509.
108. Ross, P. J., Ashley, S., Norton, A., Priest, K., Waters, J. S., Eisen, T., … O’Brien, M. E. (2004). Do patients with weight loss have a worse outcome when undergoing chemotherapy for lung cancers? British Journal of Cancer, 90, 1905–1911. doi: 10.1038/sj.bjc.6601781.
109. Miyata, H., Yano, M., Yasuda, T., Hamano, R., Yamasaki, M., Hou, E., … Doki, Y. (2012). Randomized study of clinical effect of enteral nutrition support during neoadjuvant chemotherapy on chemotherapy-related toxicity in patients with esophageal cancer. Clinical Nutrition, 31, 330–336. doi: 10.1016/j.clnu.2011.11.002.
110. Li, Y., Ping, X., Yu, B., Liu, F., Ni, X., & Li, J. (2009). Clinical trial: prophylactic intravenous alanyl-glutamine reduces the severity of gastrointestinal toxicity induced by chemotherapy–a randomized crossover study. Alimentary Pharmacology & Therapeutics, 30, 452–458. doi: 10.1111/j.1365-2036.2009.04068.x.
111. Sun, J., Wang, H., & Hu, H. (2012). Glutamine for chemotherapy induced diarrhea: a meta-analysis. Asia Pacific Journal of Clinical Nutrition, 21, 380–385.
112. Sornsuvit, C., Komindr, S., Chuncharunee, S., Wanikiat, P., Archararit, N., & Santanirand, P. (2008). Pilot Study: effects of parenteral glutamine dipeptide supplementation on neutrophil functions and prevention of chemotherapy-induced side-effects in acute myeloid leukaemia patients. Journal of International Medical Research, 36, 1383–1391. doi: 10.1177/147323000803600628.
113. Sayles, C., Hickerson, S. C., Bhat, R. R., Hall, J., Garey, K. W., & Trivedi, M. V. (2016). Oral Glutamine in Preventing Treatment-Related Mucositis in Adult Patients With Cancer: A Systematic Review. Nutrition in Clinical Practice, 31, 171–179. doi: 10.1177/0884533615611857.
114. Urbain, P., Birlinger, J., Lambert, C., Finke, J., Bertz, H., & Biesalski, H. K. (2013). Longitudinal follow-up of nutritional status and its influencing factors in adults undergoing allogeneic hematopoietic cell transplantation. Bone Marrow Transplant, 48, 446–451. doi: 10.1038/bmt.2012.158.
115. Muscaritoli, M., Conversano, L., Torelli, G. F., Arcese, W., Capria, S., Cangiano, C., … Rossi Fanelli, F. (1998). Clinical and metabolic effects of different parenteral nutrition regimens in patients undergoing allogeneic bone marrow transplantation. Transplantation, 66, 610–616. doi: 10.1097/00007890-199809150-00011.
116. van Haren, I. E., Timmerman, H., Potting, C. M., Blijlevens, N. M., Staal, J. B., & Nijhuis-van der Sanden, M. W. (2013). Physical exercise for patients undergoing hematopoietic stem cell transplantation: systematic review and meta-analyses of randomized controlled trials. Physical Therapy, 93, 514–528. doi: 10.2522/ptj.20120181.
117. Wiskemann, J., Dreger, P., Schwerdtfeger, R., Bondong, A., Huber, G., Kleindienst, N., … Bohus, M. (2011). Effects of a partly self-administered exercise program before, during, and after allogeneic stem cell transplantation. Blood, 117, 2604–2613. doi: 10.1182/blood-2010-09-306308.
118. Guièze, R., Lemal, R., Cabrespine, A., Hermet, E., Tournilhac, O., Combal, C., … Masetti, R. (2014). Enteral versus parenteral nutritional support in allogeneic haematopoietic stem-cell transplantation. Clinical Nutrition, 33, 533–538. doi: 10.1016/j.jtct.2020.11.006.
119. Trifilio, S., Helenowski, I., Giel, M., Gobel, B., Pi, J., Greenberg, D., & Mehta, J. (2012). Questioning the role of a neutropenic diet following hematopoetic stem cell transplantation. Biology of Blood Marrow Transplantation, 18, 1385–1390. doi: 10.1016/j.bbmt.2012.02.015.
120. van Dalen, E. C., Mank, A., Leclercq, E., Mulder, R. L., Davies, M., Kersten, M. J., … van de Wetering, M. D. (2016). Low bacterial diet versus control diet to prevent infection in cancer patients treated with chemotherapy causing episodes of neutropenia. Cochrane Database of Systematic Reviews, 4, Cd006247. doi: 10.1002/14651858.CD006247.pub2.
121. Brown, S., Goringe, A., Fegan, C., Davies, S., Giddings, J., Whittaker, J., … Poynton, C. H. (1998). Parenteral glutamine protects hepatic function during bone marrow transplantation. Bone Marrow Transplant, 22, 281–284. doi: 10.1038/sj.bmt.1701321.
122. Uderzo, C., Rebora, P., Marrocco, E., Varotto, S., Cichello, F., Bonetti, M., … Cesaro, S. (2011). Glutamine-enriched nutrition does not reduce mucosal morbidity or complications after stem-cell transplantation for childhood malignancies: a prospective randomized study. Transplantation, 91, 1321–1325. doi: 10.1097/TP.0b013e31821ab959.
123. Knols, R. H., de Bruin, E. D., Uebelhart, D., Aufdemkampe, G., Schanz, U., Stenner-Liewen, F., … Aaronson, N. K. (2011). Effects of an outpatient physical exercise program on hematopoietic stem-cell transplantation recipients: a randomized clinical trial. Bone Marrow Transplant, 46, 1245–1255. doi: 10.1038/bmt.2010.288.
124. Midtgaard, J., Christensen, J. F., Tolver, A., Jones, L. W., Uth, J., Rasmussen, B., … Rørth, M. (2013). Efficacy of multimodal exercise-based rehabilitation on physical activity, cardiorespiratory fitness, and patient-reported outcomes in cancer survivors: a randomized, controlled trial. Annals of Oncology, 24, 267–273. doi: 10.1093/annonc/mdt185.
125. Ballard-Barbash, R., Friedenreich, C. M., Courneya, K. S., Siddiqi, S. M., McTiernan, A., & Alfano, C. M. (2012). Physical activity, biomarkers, and disease outcomes in cancer survivors: a systematic review. Journal of the National Cancer Institute, 104, 815–840. doi: 10.1093/jnci/djs207.
126. Holmes, M. D., Chen, W. Y., Feskanich, D., Kroenke, C. H., & Colditz, G. A. (2005). Physical activity and survival after breast cancer diagnosis. JAMA, 293, 2479–2486. doi: 10.1001/jama.293.20.2479.
127. Meyerhardt, J. A., Giovannucci, E. L., Holmes, M. D., Chan, A. T., Chan, J. A., Colditz, G. A., … Fuchs, C. S. (2006). Physical activity and survival after colorectal cancer diagnosis. Journal of Clinical Oncology, 24, 3527–3534. doi: 10.1200/JCO.2006.06.0855.
128. Kim, E. H., Lee, H., Chung, H., Park, J. C., Shin, S. K., Lee, S. K., … Noh, S. H. (2014). Impact of metabolic syndrome on oncologic outcome after radical gastrectomy for gastric cancer. Clinics and Research in Hepatology and Gastroenterology, 38, 372–378. doi: 10.1016/j.clinre.2013.11.009.
129. Farvid, M. S., Cho, E., Chen, W. Y., Eliassen, A. H., & Willett, W. C. (2014). Dietary protein sources in early adulthood and breast cancer incidence: prospective cohort study. BMJ, 348, g3437. doi: 10.1136/bmj.g3437.
130. Sinha, R., Cross, A. J., Graubard, B. I., Leitzmann, M. F., & Schatzkin, A. (2009). Meat intake and mortality: a prospective study of over half a million people. Archives of Internal Medicine, 169, 562–571. doi: 10.1001/archinternmed.2009.6.
131. Boffetta, P., Couto, E., Wichmann, J., Ferrari, P., Trichopoulos, D., Bueno-de-Mesquita, H. B., … Trichopoulou, A. (2010). Fruit and vegetable intake and overall cancer risk in the European Prospective Investigation into Cancer and Nutrition (EPIC). National Cancer Institute, 102, 529–537. doi: 10.1093/jnci/djq072.
132. Pierce, J. P., Stefanick, M. L., Flatt, S. W., Natarajan, L., Sternfeld, B., Madlensky, L., … Rock, C. L. (2007). Greater survival after breast cancer in physically active women with high vegetable-fruit intake regardless of obesity. Journal of Clinical Oncology, 25, 2345–2351. doi: 10.1200/JCO.2006.08.6819.
133. Tong, H., Isenring, E., & Yates, P. (2009). The prevalence of nutrition impact symptoms and their relationship to quality of life and clinical outcomes in medical oncology patients. Supportive Care in Cancer, 17, 83–90. doi: 10.1007/s00520-008-0472-7.
134. Laird, B. J., Kaasa, S., McMillan, D. C., Fallon, M. T., Hjermstad, M. J., Fayers, P., … Klepstad, P. (2013). Prognostic factors in patients with advanced cancer: a comparison of clinicopathological factors and the development of an inflammation-based prognostic system. Clinical Cancer Research, 19, 5456–5464. doi: 10.1158/1078-0432.CCR-13-1066.
135. Martin, L., Watanabe, S., Fainsinger, R., Lau, F., Ghosh, S., Quan, H., … Baracos, V. (2010). Prognostic factors in patients with advanced cancer: use of the patient-generated subjective global assessment in survival prediction. Journal of Clinical Oncology, 28, 4376–4383. doi: 10.1200/JCO.2009.27.1916.
136. Koretz, R. L. (2007). Do data support nutrition support? Part II. enteral artificial nutrition. Journal of the American Dietetic Association, 107, 1374–1380. doi: 10.1016/j.jada.2007.05.006.
137. Koretz, R. L., Lipman, T. O., & Klein, S. (2001). AGA technical review on parenteral nutrition. Gastroenterology, 121, 970–1001. doi: 10.1053/gast.2001.28031.
138. Bruera, E., Hui, D., Dalal, S., Torres-Vigil, I., Trumble, J., Roosth, J., … Tarleton, K. (2013). Parenteral hydration in patients with advanced cancer: a multicenter, double-blind, placebo-controlled randomized trial. Journal of Clinical Oncology, 31, 111–118. doi: 10.1200/JCO.2012.44.6518.
139. Raijmakers, N. J. H., van Zuylen, L., Costantini, M., Caraceni, A., Clark, J., Lundquist, G., … van der Heide, A. (2011). Artificial nutrition and hydration in the last week of life in cancer patients. A systematic literature review of practices and effects. Annals of Oncology, 22(7), 1478–1486. doi: 10.1093/annonc/mdq620.
140. McCann, R. M., Hall, W. J., & Groth-Juncker, A. (1994). Comfort care for terminally ill patients. The appropriate use of nutrition and hydration. JAMA, 272(16), 1263–1266. doi: 10.1001/jama.272.16.1263.
141. Good, P., Richard, R., Syrmis, W., Jenkins-Marsh, S., & Stephens, J. (2014). Medically assisted hydration for adult palliative care patients. Cochrane Database of Systematic Reviews, 2014(4), Cd006273. doi: 10.1002/14651858.CD006273.pub3.
142. Cerchietti, L., Navigante, A., Sauri, A., & Palazzo, F. (2000). Hypodermoclysis for control of dehydration in terminal-stage cancer. International Journal of Palliative Nursing, 6, 370–374. doi: 10.12968/ijpn.2000.6.8.9060.
Адреса для листування:
Швець Олег
02121, Київ, вул. Вербицького, 30А
Асоціація дієтологів України
E-mail: shvetsoleg@outlook.com
Сorrespondence:
Oleg Shvets
02121, Kyiv, Verbytskyi str., 30А
Association of Dietitians of Ukraine
E-mail: shvetsoleg@outlook.com














Leave a comment