Сучасні підходи до лікування пацієнтів з НДРЛ і «рідкісними» мутаціями гена EGFR та власний досвід терапії випадків з інсерцією у 20-му екзоні
Суховерша О.А., д.мед.н., доцент
Резюме. На сьогодні виявлено та вивчено більше 200 різноманітних онкогенних мутацій гена EGFR (epidermal growth factor receptor — EGFR, рецептор епідермального фактору росту), що мають значення для розвитку, прогресування та прогнозу перебігу онкологічного процесу. Упродовж тривалого часу основна увага була прикута до двох найбільш поширених онкогенних мутацій у каталітичному домені рецептора EGFR: в екзоні 19 (Del746–750) (46% випадків) та в екзоні 21 (L858R) (38%). Саме ці дослідження поклали початок таргетній терапії у пацієнтів з недрібноклітинним раком легені (НДРЛ) і успіхам у лікуванні не тільки в метастатичних, а й резектабельних випадках. Інші варіанти мутацій гена EGFR становлять 10–15% і їх традиційно відносять до «рідкісних», однак з появою удосконалених технологій секвенування відсоток «рідкісних» мутацій досяг 30–44%. Інсерція у 20-му екзоні гена EGFR є найпоширенішим типом «рідкісної» мутації, який виявляють приблизно у 10% хворих на НДРЛ з мутацією EGFR. При цьому пацієнти з інсерціями у 20-му екзоні EGFR демонструють первинну резистентність до інгібіторів тирозинкінази (ІТК) EGFR ранніх поколінь і мають незадовільні клінічні результати. Нами проведено огляд особливостей клінічного перебігу НДРЛ з інсерцією у 20-му екзоні EGFR та еволюції методів лікування таких хворих. Одним з препаратів, що демонструє ефективність щодо інсерції у 20-му екзоні EGFR, є ІТК третього покоління — осимертиніб. Його ключовою особливістю є широке терапевтичне вікно щодо мутованих форм EGFR, включно з інсерціями у 20-му екзоні, що свідчить про потенційну терапевтичну перевагу в якості таргетної терапії при пухлинах цього типу. Наведено результати досліджень ефективності осимертинібу при НДРЛ з інсерцією у 20-му екзоні EGFR, а також власний клінічний досвід лікування пацієнтів із цією мутацією.
DOI: 10.32471/clinicaloncology.2663-466X.47-3.29302
Епідеміологія Недрібноклітинного раку легені
 Рак легені (РЛ) є другим за поширеністю типом онкопатології у світі і першим за рівнем смертності. У 2020 р., за даними з 185 країн, було діагностовано більше 2,2 млн нових випадків РЛ, що становить понад 11% усіх нових випадків раку, а смертність від РЛ наближалася до 1,8 млн (18,0% онколетальності). Смертність від РЛ пов’язана з високим ступенем злоякісності та пізньою діагностикою: у більш ніж 65% випадків при першому зверненні діагностують місцево-поширені або метастатичні стадії хвороби. Також важливим є певне «помолодіння» РЛ, хоча переважна більшість пацієнтів — у віці від 55 років. Водночас збільшення кількості випадків РЛ серед жінок викликає тривогу [1].
Рак легені (РЛ) є другим за поширеністю типом онкопатології у світі і першим за рівнем смертності. У 2020 р., за даними з 185 країн, було діагностовано більше 2,2 млн нових випадків РЛ, що становить понад 11% усіх нових випадків раку, а смертність від РЛ наближалася до 1,8 млн (18,0% онколетальності). Смертність від РЛ пов’язана з високим ступенем злоякісності та пізньою діагностикою: у більш ніж 65% випадків при першому зверненні діагностують місцево-поширені або метастатичні стадії хвороби. Також важливим є певне «помолодіння» РЛ, хоча переважна більшість пацієнтів — у віці від 55 років. Водночас збільшення кількості випадків РЛ серед жінок викликає тривогу [1].
Незважаючи на те що тютюнопаління залишається основною причиною розвитку РЛ, статистика показує, що 12% осіб з таким діагнозом ніколи не палили. Цікаво, що вища частота мутацій рецептора епідермального фактора росту (epidermal growth factor receptor — EGFR) (також відомого як HER1, або ErbB1), що призводить до його гіперактивації, була генотипована у тих, хто ніколи не курив (42,5%), порівняно з тими, хто курить зараз (4,9%), або колишніми курцями (13,5%). Близько 80–85% випадків РЛ припадає на недрібноклітинний РЛ (НДРЛ), що включає такі гістологічні підтипи, як залозиста, плоскоклітинна та крупноклітинна карцинома. На сьогодні досягнуто значних успіхів у розумінні канцерогенезу РЛ, особливо його недрібноклітинного варіанту, коли драйвером розвитку онкологічного процесу виступає EGFR [1, 2].
Мутації EGFR переважно виявляють у осіб східноазійського походження. У Східній Азії у 35–38% пацієнтів з НДРЛ відмічають мутацію EGFR, а в США і Європі частота цього явища становить 10–17% [3]. Найчастіше мутації EGFR виявляють при аденокарциномі у некурців [4, 5]. В Україні поширеність EGFR-мутації серед пацієнтів з неплоскоклітинним РЛ становить 20% [6].
Мутації EGFR при НДРЛ
EGFR — це рецепторна тирозинкіназа, що експресується на поверхні клітин мезодермального та ектодермального походження та бере участь у процесах росту, проліферації та диференціації клітин у багатьох органах. EGFR належить до сімейства ErbB-рецепторних тирозинкіназ, яке також включає HER2 (ErbB2), HER3 (ErbB3) і HER4 (ErbB4) [3].
EGFR відіграє важливу роль у нормальних біологічних процесах, включаючи проліферацію та міграцію клітин, а у разі гіперактивації внаслідок мутації бере активну участь у процесах канцерогенезу [7–9].
Ген EGFR розташований у хромосомній ділянці 7p11.2 [3] і складається з 28 екзонів, з яких екзони 18–21 кодують «щілину» АТФ-зв’язувального домену тирозинкінази. Загалом EGFR складається з позаклітинного лігандзв’язувального домену, гідрофобної трансмембранної ділянки, внутрішньоклітинного домену рецепторної тирозинкінази та С-кінцевого домену. EGFR є трансмембранним рецептором, який запускає сигнальний каскад за допомогою димеризації, ініційованої лігандами, що активує тирозинкінази та множинні ефектори низхідного шляху. EGFR запускає реакції фосфорилювання, стимулюючи сигнальні каскади, які в тому числі залучені до процесів ембріогенезу та диференціювання стовбурових клітин [10–13].
EGFR зв’язує щонайменше сім лігандів з високою варіабельністю. Після стимуляції EGFR піддається комбінаторній гомо- або гетеродимеризації з одним з білків сімейства HER, таким чином активуючи розгалужену сигнальну мережу. Трансмембранний білок EGFR має великий позаклітинний компонент (з 4 доменами, 620 амінокислотами), який в основному служить сайтом зв’язування ліганду і прикріплений коротким спіральним трансмембранним доменом до внутрішньоклітинного домену тирозинкінази [3].
Мутації гена EGFR можуть призводити до ліганд-незалежної активації рецептора, внаслідок чого сигнал, який активує проліферацію клітин, передається без приєднання ліганду до рецептора. Таким чином, відбувається гіперактивація EGFR-сигнального каскаду, що реалізується у вигляді безперервного передавання сигналу через EGFR, та, відповідно, патологічної проліферації клітин і в результаті — розвитку онкологічної патології.
НДРЛ з мутацією EGFR обумовлений «активуючими» мутаціями, які групуються навколо АТФ-зв’язувальної кишені внутрішньоклітинного домену тирозинкінази і призводять до ліганд-незалежної активації рецептора EGFR. Це, у свою чергу, сприяє виживанню та запуску антиапоптотичних сигналів, опосередкованих фосфатидилінозитол 3-кіназою (PI3K)/протеїнкіназою B (AKT) і позаклітинною сигнально-регульованою кіназою (ERK)/мітоген-активованою протеїнкіназою (MAPK) [3].
У 2004 р. соматичні мутації в екзонах 18–21 гена EGFR, які спричиняли незалежну від ліганду активацію тирозинкінази EGFR, були виявлені у пухлинній тканині при НДРЛ [14, 15]. Основна увага була прикута до двох найбільш поширених онкогенних мутацій у каталітичному домені EGFR: в екзоні 19 (Del746–750) (46% випадків) та в екзоні 21 (L858R) (38%) [16, 17]. У той час як перші аналізи були мутаційно-специфічними цільовими тестами на основі полімеразної ланцюгової реакції (ПЛР), призначеними для виявлення лише класичних мутацій, у теперішній час розроблено більш складні платформи секвенування як для клінічних, так і для дослідницьких цілей [18]. На сьогодні за допомогою секвенування виявлено та вивчено >200 різних онкогенних мутацій EGFR, що мають значення для розвитку, прогресування та прогнозу перебігу онкологічного процесу. Ці мутації прийнято відносити до «рідкісних». «Рідкісні» мутації EGFR є гетерогенною групою, серед яких вирізняють мутацію G719X у 18-му екзоні; S768I у 20-му екзоні; інсерції у 20-му екзоні, мутацію L861Q у 21-му екзоні та багато інших [19, 20]. Розвиток генотипування разом з потужними дослідницькими зусиллями призвели до підвищення рівня виявлення широкого спектра активуючих мутацій EGFR, включаючи інсерції у 20-му екзоні EGFR та активаційні точкові мутації, такі як G719X, S768I, L861Q та деякі інші [18]. Сучасні дані щодо мутацій EGFR у зразках аденокарциноми з порталу даних Genomic Data Commons Національного інституту раку США (National Cancer Institute) свідчать про те, що частота «рідкісних» мутацій може бути значно вищою, ніж повідомлялося раніше, що пов’язано з удосконаленням технологій секвенування [21]. Так, згідно з опублікованими даними з 83 зразків аденокарциноми легені, які мають позитивний результат на мутацію EGFR, 28% мали мутації L858R, 28% — мутації Del19. Таким чином, частка «рідкісних» мутацій при цьому досягла 44%, що дозволяє сумніватися в правомірності терміну «рідкісні» взагалі.
У багатьох дослідженнях відмічається той факт, що найбільш поширеним варіантом (23–43%) серед «рідкісних» мутацій є інсерції у 20-му екзоні EGFR [22, 23]. Таким чином, можемо констатувати, що інсерція у 20-му екзоні EGFR є третім найпоширенішим підтипом мутації EGFR, виявленим приблизно у 10% мутованих EGFR при НДРЛ. Окрім точкових мутацій, делецій та інсерцій, нещодавно визначено більш складні мутації EGFR, які також включають дуплікації в екзонах 18–25 домену рецепторної тирозинкінази [23] та мутації, що спричиняють димеризацію EGFR, зачіпаючи N-кінець EGFR, який може взаємодіяти з різними партнерами при димеризації [24, 25]. «Рідкісні» мутації EGFR також виявлені в позаклітинному домені EGFR, кодованому екзонами 2–15 [20, 26].
Діагностика рідкісних мутацій EGFR
На сьогодні для ідентифікації молекулярних змін слід надавати перевагу технології секвенування наступного покоління (Next-generation sequencing — NGS). Розробка NGS-технології сприяла появі методів, які дозволяють проводити надглибоке секвенування для виявлення активних мутацій EGFR, мутацій резистентності de novo та мутацій, що призводять до набутої резистентності під час лікування. Натомість використання застарілого ПЛР-методу не тільки не дозволяє виявити супутні мутації, а й залишає поза полем зору так звані «рідкісні» мутації, які за умови застосування NGS-діагностики виявляються не такими вже й «рідкісними» і становлять до 35–44% EGFR-мутацій, у той час як на класичні мутації Del746–750 в екзоні 19 та L858R в екзоні 21 припадає по 28% EGFR-мутацій [21]. Ці дані, отримані саме завдяки NGS-тестуванню, спростовують попередні висновки щодо частки «класичних» мутацій на рівні 85–90%, що ґрунтувалися на результатах ПЛР-аналізу. Окрім того, існують і складні мутації. Так, «рідкісні» мутації можуть виникати не тільки ізольовано, а й разом з незалежною поширеною або рідкісною мутацією EGFR [20]. Маючи на увазі дані щодо високої частки (до 43%) інсерцій у 20-му екзоні серед «рідкісних» мутацій EGFR, стає очевидною актуальність вивчення біології та лікування саме у разі такого варіанту патології НДРЛ [19, 20].
Вчасне виявлення мутацій EGFR має вирішальне значення для адекватного та ефективного лікування пацієнтів з НДРЛ в епоху персоніфікованої таргетної терапії. У цьому контексті варто звернути увагу на важливу роль методу Liquid Biopsy під час виявлення мутацій EGFR, який забезпечує можливість детекції мутацій EGFR до початку лікування у пацієнтів з НДРЛ та мутаціями EGFR [3, 27]. Liquid Biopsy — це метод виявлення молекулярних змін у циркулюючій ДНК пухлини (ctDNA) або інших нуклеїнових кислотах у крові чи інших рідинах організму. Відсутність доступної тканини для молекулярного профілювання, ризик ускладнень біопсії та значна затримка з біопсією пухлинної тканини — усе це конвертується в потенційні переваги Liquid Biopsy. Більше того, біопсія тканини, зроблена з використанням біологічного матеріалу, взятого в одному місці, може не відображати переважні механізми розвитку резистентності у пацієнта, у результаті чого можна пропустити появу клінічно значущого клону пухлинних клітин. Це пов’язано з вираженою гетерогенністю пухлини, яку спостерігають при НДРЛ. Проспективні дослідження показали, що детекція мутацій у плазмі крові може бути предиктором відповіді на терапію так само, як і виявлення цих мутацій у матеріалі біопсії тканини. При цьому навіть виявлення дуже низьких алельних фракцій у ctDNA може бути клінічно значущим. Враховуючи переваги порівняно з біопсією тканин, Liquid Biopsy можна вважати одним зі стандартів виявлення мутацій резистентності [3].
Інсерції у 20-му екзоні EGFR
Інсерції у 20-му екзоні EGFR — це різноманітна група мутацій, яка налічує до 44 варіантів [3]. В одному з найбільших досліджень, присвячених цій темі, було проаналізовано мутації у близько 25 тис. пацієнтів з НДРЛ та мутацією EGFR. Загалом виявлено 547 випадків мутацій з інсерцією у 20-му екзоні. Далі проведено секвенування відібраних 547 випадків мутацій. Більшість інсерцій полягали у «вставлянні» 1–3 амінокислот. Найчастіше відмічали інсерції p.A767_V769dup (25,1%; n=145): p.S768_D770dup (17,6%; n=96). Спектр виявлених інсерцій та інших генетичних альтерацій налічував >10 варіантів [28].
Екзон 20 EGFR охоплює амінокислоти (AК) 762–823 і містить дві важливі ділянки: регуляторний домен C-спіралі (AК762–766) і прилеглу петлю, яка йде за ним (AК767–774). Інсерції екзона 20 при EGFR-мутованому НДРЛ включають інсерції та/або дуплікації 3–21 пари основ, які зазвичай відбуваються між AA 761–775(6–8) (рисунок), і слугують для активації рецептора ліганд-незалежним способом, штовхаючи С-спіраль у її внутрішнє положення, індукуючи активну конформацію рецептора. Таким чином, серед понад 60 унікальних активувальних інсерцій у 20-му екзоні EGFR, ідентифікованих на сьогодні, більшість складається з 1–4 вставок AК, розташованих у петлі після C-спіралі (див. рисунок) [18].
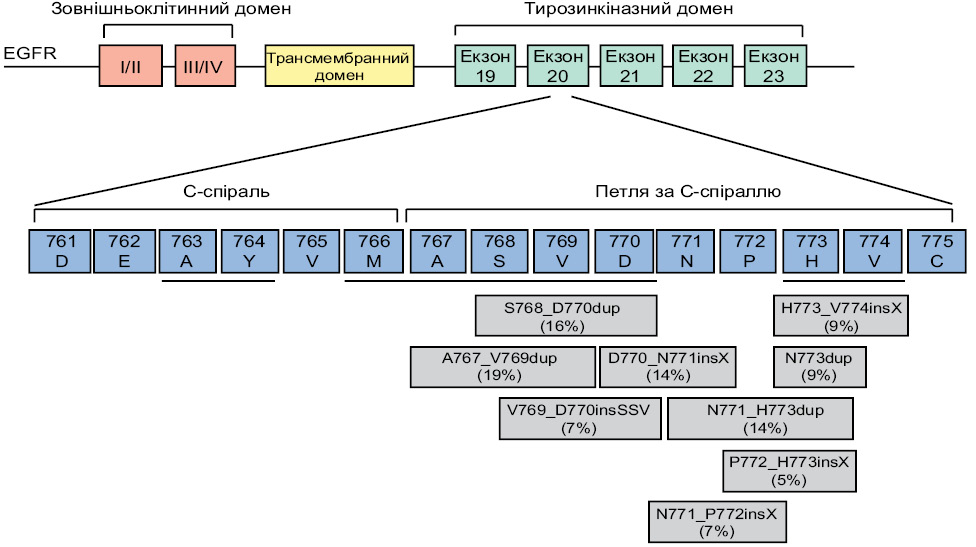
Значна гетерогенність виявлених інсерцій у 20-му екзоні разюче контрастує як з мутаціями EGFR Del746–750 в екзоні 19, які демонструють меншу варіабельність, так і з мутаціями HER2, які представляють собою інсерції у 20-му екзоні, які найчастіше представлені як A775_G776insYVMA [18].
При дослідженні in vitro інсерції у 20-му екзоні проявляють проміжну каталітичну активність, вищу, ніж EGFR дикого типу, але не таку високу, як мутація EGFR L858R. Ранні дослідження кристалічних структур показали, що найпоширеніші EGFR-інсерції у 20-му екзоні, на відміну від EGFR Del746–750 в екзоні 19 і L858R у 21-му екзоні, не впливають безпосередньо на структуру АТФ-зв’язувальної кишені EGFR. Таким чином, хоча мутації EGFR Del746–750 в 19-му екзоні і L858R у 21-му екзоні збільшують відносну спорідненість до інгібіторів тирозинкінази (ІТК) порівняно з EGFR дикого типу — молекулярна особливість, яка забезпечує велике терапевтичне вікно для інгібування ІТК мутованого рецептора — цей ефект не спостерігається у випадку з інсерцією у 20-му екзоні EGFR. Нещодавно проведене тривимірне моделювання кристалічних структур EGFR з інсерцією у 20-му екзоні D770insNPG порівняно з EGFR T790M і EGFR дикого типу показало, що EGFR з інсерцією у 20-му екзоні продемонстрував структуру, подібну до моделі EGFR T790M з точки зору позиціонування залишку гейткіпера, що підтверджує причину стійкості до ІТК І покоління. Ці аналізи також дали можливість припустити, що зсув C-спіралі, а також петлі зв’язування фосфату (P-петлі) в напрямку до кишені зв’язування ліків призводить до певних стеричних перешкод, які пригнічують зв’язування з ІТК [18].
Ці структурні відмінності пояснюють головну проблему в розробці ефективних низькомолекулярних таргетних інгібіторів, що впливають на пухлини з інсерцією у 20-му екзоні EGFR, і ще більше підкреслюють відсутність клінічної активності ІТК EGFR І та ІІ покоління щодо пухлин, які містять інсерцію у 20-му екзоні EGFR, порівняно з класичними мутаціями EGFR. Втім є дані щодо окремих випадків чутливості мутацій інсерції у 20-му екзоні, таких як H773dup, H773_V774insNPH і N771delinsKG до ІТК І покоління [18].
Хоча останнім часом було досягнуто значного прогресу, широкий спектр специфічних мутацій інсерції у 20-му екзоні EGFR обмежує систематичну характеристику структури кожної унікальної зміни та її чутливості до інгібіторів EGFR. Хоча деякі інсерції (зокрема, V769-D770 insX, D770-N771 insX, H773-V774 insX) є більш поширеними, ніж інші [18].
Таким чином, хоча в цілому існує певна гетерогенність, мутації з інсерцією у 20-му екзоні не чутливі до ІТК EGFR І покоління. У подальшому, безумовно, потрібно аналізувати залежність результату від варіанта мутації, що відкриває перспективи розвитку більш персоналізованої таргетної терапії. Разом з тим таргетні препарати з первинно закладеним широким спектром дії, зокрема осимертиніб, також можуть бути ефективними, що потребує додаткових клінічних досліджень.
Варто зауважити, що існує можливість «подвійних» мутацій у 20-му екзоні: одночасно мутації EGFR та Her-2-neu. Біологія цих мутацій є схожою, а відтак — і таргетні препарати теоретично можуть впливати одночасно на обидві ці мутації. Однак набір варіантів молекулярних мутацій для EGFR є набагато більшим, ніж для Her-2-neu, що, безумовно, позначається на ефективності терапії [29]. Це ще раз підкреслює важливість та складність напрацювання адекватних та ефективних методів терапії при пухлинах з інсерцією у 20-му екзоні EGFR, зокрема, та групи «рідкісних» мутацій EGFR у цілому.
Особливості клінічного перебігу хвороби у разі мутацій EGFR загалом та інсерції у 20-му екзоні зокрема
РЛ з мутаціями EGFR менш чутливий до поліхіміотерапії, ніж пухлини з EGFR дикого типу [30, 31]. Також спостерігається резистентність до імунотерапії у разі наявності мутації EGFR та незалежно від експресії PD-L1 [3,32]. У пацієнтів з НДРЛ та мутаціями EGFR відмічають вищий ризик розвитку метастазів у головний мозок порівняно з тими, хто має дикий тип EGFR. До ери застосування ІТК медіана часу від радіотерапії до виявлення метастазів у головному мозку становила 14 міс. Особливості перебігу онкологічного процесу та терапії у хворих похилого віку, а також пацієнтів з низьким функціональним статусом також було детально вивчено. Дослідження показали, що застосування ІТК EGFR може мати більше переваг щодо виживаності без прогресування (ВБП) у хворих літнього віку, ніж у молодших пацієнтів. Крім того, ІТК EGFR є хорошим вибором для осіб з мутацією EGFR і низьким функціональним статусом [3].
Пацієнти з мутаціями інсерції у 20-му екзоні EGFR виявляють первинну резистентність до ІТК EGFR ранніх поколінь і мають незадовільні клінічні результати. У недавньому ретроспективному дослідженні, у якому оцінювали ефективність терапії ІТК EGFR І лінії у хворих з мутаціями інсерції у 20-му екзоні EGFR, було отримано медіану загальної виживаності (ЗВ) 16,8 міс, що становить приблизно половину від ЗВ (31,6 міс) у пацієнтів з класичними мутаціями EGFR, які отримували афатиніб у дослідженні LUX-Lung 3. У зведеному аналізі досліджень LUX-Lung 2, LUX-Lung 3 і LUX-Lung 6 у пацієнтів з інсерцією у 20-му екзоні EGFR афатиніб в якості І лінії терапії забезпечив медіану ЗВ 9,2 міс та медіану ВБП 2,7 міс. У проспективному обсерваційному дослідженні також було показано, що лікування ІТК EGFR І покоління в якості терапії ІІ лінії дає такі ж незадовільні результати у пацієнтів з інсерцією у 20-му екзоні EGFR — медіана ЗВ 12,9 міс та медіана виживаності без прогресування (ВБП) 1,9 міс. В іншому дослідженні було показано, що 5-річна ЗВ становила 8 і 19% у хворих з інсерцією у 20-му екзоні EGFR та у хворих із класичними мутаціями EGFR. Однак нові таргетні препарати можуть покращити результати в цій популяції, наприклад осимертиніб. Таким чином, пацієнти з інсерцією у 20-му екзоні EGFR мають поганий прогноз і отримують незначну користь від лікування EGFR TKI І покоління [33].
Лікування пацієнтів з НДРЛ та інсерцією у 20-му екзоні EGFR
Своєрідною «візитівкою» успіхів у молекулярній терапії при НДРЛ на сьогодні є препарати для лікування пацієнтів з пухлинами з мутацією гена EGFR. У 2009 р. було вперше продемонстровано в рандомізованому контрольованому дослідженні IPASS, що ІТК EGFR перевершують хіміотерапію в якості І лінії лікування пацієнтів з мутаціями EGFR. Протягом наступних років було проведено кілька великих досліджень для підтвердження ефективності ІТК EGFR у порівнянні з хіміотерапією. Так, випробування за участю представників європеоїдної раси підтвердило ефективність гефітинібу у таких пацієнтів із сенсибілізувальними мутаціями EGFR. 13 липня 2015 р. гефітиніб було схвалено в якості терапії І лінії у пацієнтів з метастатичним НДРЛ з мутаціями EGFR [3].
Незважаючи на те що ВБП при застосуванні ІТК EGFR в середньому становить майже 12 міс, було показано, що майже у всіх пацієнтів з часом відбувається прогресування захворювання. При цьому продовження застосування гефітинібу в наступних лініях терапії є шкідливим. Було виявлено, що ця шкода пов’язана з вторинною мутацією T790M гена EGFR [3].
Інгібітори ІІ покоління афатиніб і дакомітиніб були впроваджені для лікування пацієнтів, у яких спостерігалося прогресування захворювання на фоні застосування ІТК І покоління. На відміну від інгібіторів І покоління ІТК EGFR препарати ІІ покоління зв’язуються ковалентно та незворотно. Ці препарати також, як правило, мають менш вибіркову активність, інгібуючи інші білки сімейства HER, включаючи HER2. Доклінічні дані щодо ІТК ІІ покоління були багатообіцяючими, демонструючи потужну активність на моделях РЛ, стійких до інгібіторів І покоління. Однак у ході клінічних досліджень не було досягнуто очікуваного результату — ЗВ не покращувалась. При цьому застосування як афатинібу, так і дакомітинібу характеризувалося значною токсичністю, а ризик розвитку серйозних побічних ефектів, переривання лікування через побічні реакції, а також необхідність зниження дози були достовірно вищими для ІТК ІІ покоління у порівнянні з ІТК І покоління. Після появи ІТК ІІІ покоління деякі дослідники почали називати ІТК ІІ покоління «втраченим поколінням», підкреслюючи відсутність прогресу порівняно з ІТК І покоління [3].
Розуміння механізму набутої резистентності призвело до розробки ІТК EGFR ІІІ покоління, до яких належать рокілетиніб, олмутиніб, назартиніб, авітиніб, осимертиніб та ін. Однак лише осимертиніб довів свою високу клінічну ефективність та є на сьогодні «золотим стандартом» лікування пацієнтів з EGFR-позитивним НДРЛ. Осимертиніб активний проти делецій 19-го екзону, мутацій у 21-му екзоні, а також мутації T790M у 20-му екзоні. Він є переважно селективним щодо мутованого EGFR, і тому токсичність у терапевтичних дозах є нижчою, ніж у препаратів І та ІІ покоління. Важливим є те, що осимертиніб здатний долати гематоенцефалічний бар’єр, що робить його активним проти уражень центральної нервової системи (ЦНС) [3].
Ефективність осимертинібу було підтверджено в подвійному сліпому рандомізованому контрольованому дослідженні FLAURA за участю «нелікованих» пацієнтів з НДРЛ з мутацією EGFR. Так, медіана ВБП у хворих, які отримували осимертиніб, становила 18,9 міс проти 10,3 міс для тих, хто отримував ІТК EGFR І покоління (ерлотиніб або гефітиніб). Перевага осимертинібу порівняно з TKI І покоління EGFR зберігалася для всіх підгруп, що аналізувалися. Хворі, які приймали осимертиніб, повідомили про меншу кількість побічних ефектів 3-го ступеня або вище, ніж ті, хто отримував ерлотиніб або гефітиніб. На основі даних досліджень 18 квітня 2018 р. Управління з контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA) схвалило осимертиніб як терапію І лінії для пацієнтів з метастатичним НДРЛ з мутацією EGFR [3].
Нові методи лікування пацієнтів з НДРЛ з інсерцією у 20-му екзоні EGFR
Пацієнти з пухлинами НДРЛ з мутацією у 20-му екзоні EGFR, як правило, належать до некурців. Раніше пухлини НДРЛ з мутацією у 20-му екзоні EGFR вважалися стійкими до будь-яких впливів і ця мутація була маркером резистентності і до таргетної терапії. Важливо, що клінічні результати у пацієнтів з мутацією EGFR у 20-му екзоні були подібними до НДРЛ дикого типу EGFR.
У чому причина резистентності до ІТК І покоління? Насамперед — у локалізації та структурі мутації. Тривимірне структурне моделювання демонструє, що ці мутації по-різному впливають на зв’язування з ІТК EGFR. Екзон 20 EGFR містить С-альфаспіраль, за якою йде Р-петля. Під час інсерції екзона 20 конформації С-спіралі та Р-петлі змінюються, що призводить до утворення стеричної перешкоди та звуження кармана зв’язування з ІТК. Ці структурні відмінності пояснюють головну проблему в розробці ефективних низькомолекулярних таргетних інгібіторів EGFR з мутацією у 20-му екзоні і підкреслюють відсутність клінічної активності ІТК EGFR І та ІІ покоління щодо пухлин, що містять мутацію у 20-му екзоні EGFR [18].
Незважаючи на початкові проблеми з таргетним лікуванням пацієнтів з пухлинами з мутацією у 20-му екзоні EGFR, протягом останніх 5–10 років активно проводилися клінічні дослідження нових методів терапії. У цьому контексті вивчали інгібітори білків теплового шоку 90 (Heat shock protein 90 — HSP90) ІІ покоління, такі як ганетеспіб, люмінеспіб, які, на жаль, показали обмежений ефект; ІТК EGFR, що ковалентно та незворотно інгібують EGFR та HER2, та позіотиніб, який продемонстрував помірну активність поряд з вираженими побічними ефектами, пов’язаними з інгібуванням EGFR дикого типу, та мобоцертиніб, який має покращену селективність щодо інгібування EGFR з інсерцією у 20-му екзоні й отримав статус «проривної терапії». Також з метою впливу на пухлини з інсерцією у 20-му екзоні EGFR досліджували такі моноклональні антитіла, як цетуксимаб, нецитумумаб, бевацизумаб та амівантамаб.
Нещодавно було представлено оновлення клінічного дослідження I фази CHRYSALIS, яке демонструє ефективність амівантамабу: відношення ризиків 40% із середнім періодом ВБП 8,3 міс. Переносимість лікування в цілому була задовільною: висип на шкірі був поширеним побічним ефектом у 86% пацієнтів, лише у 4% випадків висипання мали 3-й ступінь. Іншими поширеними побічними ефектами були реакції, пов’язані з інфузією (66% і лише 3% зі ступенем ≥3, переважно під час першої інфузії) та пароніхія (42%), але загалом події 3-го ступеня, пов’язані з лікуванням, спостерігалися лише у 16% хворих. Амівантамаб став першим препаратом таргетної терапії при НДРЛ з інсерцією у 20-му екзоні EGFR, якому FDA було надано перспективний статус «проривної терапії» в березні 2020 р., і першим, який було схвалено FDA в травні 2021 р., однак подальші дослідження лікарського засобу тривають [18].
Ефективність осимертинібу в якості терапії пацієнтів з НДРЛ з інсерцією у 20-му екзоні EGFR
Осимертиніб — це селективний ІТК EGFR ІІІ покоління, який проявляє активність щодо широкого спектра мутацій EGFR, включаючи del19, L858R, T790M, G719 та інші активаційні точкові мутації, і наразі схвалений FDA в якості І лінії терапії та для ад’ювантного використання для del19 і L858R, а також ІІ лінії терапії для T790M. Ключовою особливістю осимертинібу є його широке терапевтичне вікно щодо мутованих форм EGFR, включно з інсерціями у 20-му екзоні, на відміну від EGFR дикого типу, що свідчить про потенційну терапевтичну перевагу в якості таргетної терапії при пухлинах з інсерцією у 20-му екзоні EGFR. Це положення знаходить відображення в результатах досліджень T. Hirano та співавторів [33], які дали експериментальне обґрунтування виняткових можливостей осимертинібу в порівнянні з ІТК І та ІІ покоління. Аналогічні дослідження, проведені N. Floc’h та співавторами [34], визначили «чутливі» до осимертинібу варіанти молекулярних мутацій (D770_N77 та V769_D770). Таким чином, осимертиніб можна розглядати у якості одного з основних таргетних препаратів для лікування пацієнтів з пухлинами з інсерцією у 20-му екзоні.
Осимертиніб був одним з перших препаратів, які продемонстрували ефект у клінічній практиці та маломасштабних випробуваннях. Так, переваги препарату було продемонстровано в дослідженні Y. Qin та співавторів [27]. У роботі проаналізовано молекулярну структуру мутацій EGFR у близько 25 тис. пацієнтів з НДРЛ. Спектр виявлених інсерцій та інших генетичних альтерацій налічував >10 варіантів. Лікування із застосуванням ІТК EGFR отримували 65 пацієнтів, зокрема: ІТК I покоління — 51 хворий; афатиніб — 10 осіб; позіотиніб (poziotinib NOV120101, HM781–36B) — 12 хворих; осимертиніб — 22 пацієнти. Результати лікування (ВБП) оцінювали залежно від варіанту мутації та препарату, який застосовували. Найкращі результати отримано в групі пацієнтів, у яких застосовували осимертиніб. Серед 65 хворих, яких лікували за допомогою ІТК, 15 осіб отримували щонайменше 2 ІТК послідовно. Саме осимертиніб у 2-й лінії терапії продемонстрував найвищу ефективність.
В іншому дослідженні KCSG-LU15-09, у якому взяли участь 36 пацієнтів (22 чоловіки та 14 жінок), також вивчали ефективність осимертинібу при «рідкісних» мутаціях [36]. У ході секвенування зразків виявлено основні рідкісні мутації EGFR: G719X у 18-му екзоні (53%); L861Q у 21-му екзоні (25%); S768I у 20-му екзоні (22%). У якості 1-ї лінії терапії осимертиніб (80 мг) отримували 22 (61%), у якості 2-ї лінії — 11 (31%) та в якості 3-ї лінії — 3 (8%) пацієнти. Регресію пухлини після застосування осимертинібу спостерігали у 28 (78%) пацієнтів. При цьому середній показник редукції становив 44%. Найкращі показники частоти об’єктивної відповіді (ЧОВ) та медіани ВБП спостерігали для мутацій L861Q (21-й екзон) і S768I (20-й екзон). Відповідно до отриманих результатів ЧОВ становила 50% (18 з 36 пацієнтів), а медіана ВБП — 8,2 міс. Медіана тривалості відповіді на лікування становила 11,2 міс. Профіль безпеки терапії був прийнятним. Так, виявлено лише побічні ефекти 1–2-го ступеня, а саме: висипання — у 31%, свербіж — у 25%, зниження апетиту — у 25%, діарея — у 22%, задишка — у 22% пацієнтів. У цілому авторами зроблено висновок про високу ефективність та прийнятний профіль безпеки осимертинібу в лікуванні пацієнтів з рідкісними мутаціями EGFR.
Ще одне рандомізоване дослідження ІІ фази ECOG-ACRIN 5162 присвячено вивченню ефективності осимертинібу (у дозі 160 мг) при лікуванні НДРЛ з мутаціями у 20-му екзоні [37]. У дослідження включено 21 пацієнта, з них — 15 жінок, у яких вивчено субструктуру мутацій у 20-му екзоні. Відповідно до отриманих результатів у 1 пацієнта зареєстровано повну відповідь на лікування, у 4 — часткову, у 12 (60%) — стабілізацію перебігу захворювання. ЧОВ становила 25%, медіана ВБП — 9,7 міс. Токсичність терапії осимертинібом була невисокою. Так, відмічали небажані явища 1–2-го ступеня, а саме: діарею (76%), слабкість (67%), тромбоцитопенію (67%), анемію (43%), лейкопенію (43%), анорексію (43%). Серед небажаних явищ 3-го ступеня зафіксовано слабкість (10%), анемію (10%), подовження інтервалу Q–Tc (10%), анорексію (5%). Лише в 1 випадку зареєстровано небажане явище 4-го ступеня — дихальну недостатність. У цьому дослідженні досягнуто кращих результатів ВБП для осимертинібу — 9,7 міс проти 8,3 міс для амівантамабу [38] та 7,3 міс для мобоцертинібу (ТАК-788) [39]. Варто відмітити, що у нашому медичному закладі — Дніпровській міській клінічній лікарні № 4 — наразі тривають клінічні дослідження амівантамабу (PAPILLON) та мобоцертинібу (ТАК-788).
Ґрунтуючись на даних експериментальних досліджень та позитивних результатах клінічних спостережень, осимертиніб на сьогодні включений до числа основних таргетних препаратів, які досліджуються у клінічних випробуваннях щодо терапії пацієнтів з НДРЛ та мутацією EGFR у вигляді інсерції у 20-му екзоні. Так, з 11 рандомізованих досліджень 3 базуються на застосуванні осимертинібу [18].
Нещодавнє дослідження І фази нецитумумабу та осимертинібу з підвищенням дози (до 160 мг) у пацієнтів з прогресуванням НДРЛ, резистентним до ІТК EGFR, продемонструвало рівень ОВ на рівні 50% та ВБП 5,3 міс у пацієнтів з інсерцією у 20-му екзоні EGFR у невеликій когорті [40]. Учені в Китаї також вивчають моноклональне антитіло EGFR JMT101 в комбінації з ІТК EGFR (осимертинібом або афатинібом) у пацієнтів з місцево-поширеним або метастатичним НДРЛ з інсерцією у 20-му екзоні EGFR, у ході відкритого багатоцентрового клінічного дослідження Ib фази (NCT04448379).
Слід зазначити, що немає жодних клінічних даних щодо пацієнтів з EGFR у 20 пацієнтів, які прямо порівнювали б стандартну дозу осимертинібу 80 мг із вищою добовою дозою 160 мг. Однак вищі дози емпірично перевіряються при інсерції у 20-му екзоні EGFR з двох причин. По-перше, незважаючи на відоме збереження осимертинібом інгібування EGFR дикого типу, доклінічні дані свідчать про те, що для інгібування інсерції у 20-му екзоні EGFR потрібні вищі значення IC50 порівняно з канонічними мутаціями. По-друге, раніше було доведено, що осимертиніб є безпечним та ефективним у дозі 160 мг на добу у пацієнтів із захворюваннями ЦНС, у яких для досягнення адекватної відповіді потрібна більш висока концентрація препарату [18].
У контексті впливу на ЦНС привертає увагу дослідження ефективності осимертинібу у пацієнтів з НДМР, інсерцією у 20-му екзоні EGFR та метастазами в головний мозок. Так, у дослідженні B. van Veggel та співавторів з Нідерландів, в якому взяв участь 21 пацієнт, у 11 з яких виявляли метастази в головний мозок, вивчалася ефективність терапії осимертинібом (80 або 160 мг) [40]. Автори відмічають, що в ході терапії було досягнуто певних результатів. Так, зареєстровано 1 часткову відповідь, 17 випадків стабілізації перебігу захворювання та лише 3 випадки прогресування. Медіана ВБП становила 3,6 міс (95% довірчий інтервал 2,6–4,5) і не залежала від наявності комутацій. При цьому ЗВ становила 8,7 міс (95% довірчий інтервал 1,1–16,4). У 14 із 21 пацієнта (67%) відмічали зменшення розмірів пухлини.
КЛІНІЧНИЙ ВИПАДОК
Пацієнтка 1956 р.н. перебуває під спостереженням з грудня 2020 р. Їй встановлено клінічний діагноз «недрібноклітинний неплоскоклітинний рак верхньої частки правої легенi урТ2а урN2 М0 G2 IIIA ст.». 17 грудня 2020 р. було проведено радикальну операцію — верхню лобектомію справа. На основі патогістологічного висновку та імуногістохімічного дослідження встановлено діагноз «аденокарцинома помірного та низького диференціювання». У лютому–квітні 2021 р. було проведено 4 курси ад’ювантної поліхіміотерапії (пеметрексед + карбоплатин). Після цього у липні 2021 р. на мультиспіральній комп’ютерній томографії (МСКТ) органів грудної порожнини було зафіксовано прогресування захворювання з метастазами в обидві легені та внутрішньогрудні лімфовузли.
Молекулярне дослідження тканин пухлини виявило інсерцію у 20-му екзонi та делецію в 19-му екзоні гена EGFR.
9 вересня 2021 р. пацієнтці було призначено таргетну терапію ITK EGFR ІІІ покоління — осимертинібом у дозі 80 мг/добу. У результаті через 3 міс лікування було досягнуто повного регресу метастазів пухлини в легенях та внутрішньогрудних лімфовузлах, який зберігається станом на листопад 2022 р. (останній МСКТ-контроль — 23.11.2022 р.) — тобто протягом 14 міс. У пацієнтки було зафіксовано наступні небажані явища: слабкість 1-го ступеня, наявна на фоні всього лікування, діарея 1-го ступеня — з 3-го тижня, періодично. Серйозних побічних ефектів не було зареєстровано. Загальна тривалість лікування на момент оцінки становила 35 міс.
Висновки
У той час як клінічні результати пацієнтів з класичними сенсибілізувальними мутаціями EGFR при НДРЛ різко покращилися після розробки ІТК EGFR, для пацієнтів з пухлинами, що містять інсерцію у 20-му екзоні EGFR, такий ступінь клінічного прогресу лишається недоступним. Це пов’язано з обмеженими можливостями методів діагностики в минулому та великою кількістю різних варіантів інсерцій у 20-му екзоні. Такі бар’єри спочатку обмежували прогрес, однак завдяки швидкому вдосконаленню технології секвенування та ретельному ретроспективному огляду клінічних даних останнє десятиліття принесло чіткіше розуміння особливостей інсерції у 20-му екзоні EGFR як третього найпоширенішого підтипу EGFR-мутованого НДРЛ, що має унікальну біологію та вимагає спеціального підходу до розробки цільової терапії.
У цьому контексті увагу привертають дані щодо ефективності осимертинібу при різних варіантах інсерції у 20-му екзоні EGFR. Ключовою особливістю осимертинібу є його широке терапевтичне вікно щодо мутованих форм EGFR, включно з інсерціями у 20-му екзоні, на відміну від EGFR дикого типу, що надає йому певну терапевтичну перевагу в якості таргетної терапії при пухлинах цього типу. Так, отримані первинні позитивні результати при застосуванні підвищених доз (160 мг) за задовільного рівня токсичності, а також досліджено ефективність осимертинібу при метастазах у головний мозок. Таким чином, широкий спектр дії, що значно збільшує можливості щодо лікування при комплексних та/або подвійних мутаціях, а також можливість поєднання осимертинібу з іншими таргетними препаратами робить його перспективним лікарським засобом для лікування пацієнтів з НДРЛ та інсерціями у 20-му екзоні EGFR.
СПИСОК Використаної ЛІТЕРАТУРИ
1. Rodak, O., Peris-Díaz, M. D., Olbromski, M., Podhorska-Okołów, M., & Dzięgiel, P. (2021). Current landscape of non-small cell lung cancer: epidemiology, histological classification, targeted therapies, and immunotherapy. Cancers, 13(18), 4705. doi: 10.3390/cancers13184705.
2. Chen, Z., Fillmore, C. M., Hammerman, P. S., Kim, C. F., & Wong, K. K. (2014). Non-small-cell lung cancers: a heterogeneous set of diseases. Nature Reviews Cancer, 14(8), 535–546.
3. Couraud, S., Zalcman, G., Milleron, B., Morin, F., & Souquet, P. J. (2012). Lung cancer in never smokers–a review. European journal of cancer, 48(9), 1299–1311.
4. Kosaka, T., Yatabe, Y., Endoh, H., Kuwano, H., Takahashi, T., & Mitsudomi, T. (2004). Mutations of the epidermal growth factor receptor gene in lung cancer: biological and clinical implications. Cancer research, 64(24), 8919–8923.
5. Шпарик, Я. В., Пономарьова, О. В., Соколов, В. В., та співавт. (2020) Поширеність мутацій гена EGFR в українських пацієнтів з місцево-поширеним або метастатичним недрібноклітинним раком легені. Клінічна онкологія, 10 (37–38), 10–17. (In Ukr.).
6. Yarden, Y., & Sliwkowski, M. X. (2001). Untangling the ErbB signalling network. Nature reviews. Molecular cell biology, 2(2), 127–137.
7. Gschwind, A., Fischer, O. M., & Ullrich, A. (2004). The discovery of receptor tyrosine kinases: targets for cancer therapy. Nature Reviews Cancer, 4(5), 361–370. doi.org/10.1038/nrc1360.
8. Burgess, A. W. (2008). EGFR family: structure physiology signalling and therapeutic targets. Growth factors, 26(5), 263–274. doi.org/10.1080/08977190802312844.
9. Sabbah, D. A., Hajjo, R., & Sweidan, K. (2020). Review on epidermal growth factor receptor (EGFR) structure, signaling pathways, interactions, and recent updates of EGFR inhibitors. Current topics in medicinal chemistry, 20(10), 815–834. doi.org/10.2174/1568026620666200303123102.
10. Plönes, T., Engel-Riedel, W., Stoelben, E., Limmroth, C., Schildgen, O., & Schildgen, V. (2016). Molecular pathology and personalized medicine: The dawn of a new era in companion diagnostics—practical considerations about companion diagnostics for non-small-cell-lung-cancer. Journal of Personalized Medicine, 6(1), 3. doi.org/10.3390/jpm6010003.
11. Wang, D. D., Ma, L., Wong, M. P., Lee, V. H., & Yan, H. (2015). Contribution of EGFR and ErbB-3 heterodimerization to the EGFR mutation-induced gefitinib-and erlotinib-resistance in non-small-cell lung carcinoma treatments. PloS one, 10(5), e0128360. doi.org/10.1371/journal.pone.0128360.
12. Brambilla, E., & Gazdar, A. (2009). Pathogenesis of lung cancer signalling pathways: roadmap for therapies. European Respiratory Journal, 33(6), 1485–1497. doi.org/10.1183/09031936.00014009.
13. Lynch, T. J., Bell, D. W., Sordella, R., Gurubhagavatula, S., Okimoto, R. A., Brannigan, B. W., … Haber, D. A. (2004). Activating mutations in the epidermal growth factor receptor underlying responsiveness of non–small-cell lung cancer to gefitinib. New England Journal of Medicine, 350(21), 2129–2139. doi.org/10.1056/NEJMoa040938.
14. Paez, J. G., Janne, P. A., Lee, J. C., Tracy, S., Greulich, H., Gabriel, S., … Meyerson, M. (2004). EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science, 304(5676), 1497–1500. doi.org/10.1126/science.1099314.
15. Sharma, S. V., Bell, D. W., Settleman, J., & Haber, D. A. (2007). Epidermal growth factor receptor mutations in lung cancer. Nature Reviews Cancer, 7(3), 169–181. doi.org/10.1038/nrc2088.
16. Yatabe, Y., & Mitsudomi, T. (2007). Epidermal growth factor receptor mutations in lung cancers. Pathology international, 57(5), 233–244. doi.org/10.1111/j.1440–1827.2007.02098.x.
17. Meador, C. B., Sequist, L. V., & Piotrowska, Z. (2021). Targeting EGFR Exon 20 Insertions in Non–Small Cell Lung Cancer: Recent Advances and Clinical UpdatesTargeting EGFR Exon 20 Insertions in NSCLC. Cancer discovery, 11(9), 2145–2157. doi: 10.1158/2159-8290.CD-21-0226.
18. Siegelin, M. D., & Borczuk, A. C. (2014). Epidermal growth factor receptor mutations in lung adenocarcinoma. Laboratory investigation, 94(2), 129–137.
19. Masood, A., Kancha, R. K., & Subramanian, J. (2019, June). Epidermal growth factor receptor (EGFR) tyrosine kinase inhibitors in non-small cell lung cancer harboring uncommon EGFR mutations: focus on afatinib. In Seminars in oncology (Vol. 46, No. 3, pp. 271–283). WB Saunders.
20. portal.gdc.cancer.gov.
21. Kuiper, J. L., Hashemi, S. M. S., Thunnissen, E., Snijders, P. J. F., Grünberg, K., Bloemena, E., … Smit, E. F. (2016). Non-classic EGFR mutations in a cohort of Dutch EGFR-mutated NSCLC patients and outcomes following EGFR-TKI treatment. British journal of cancer, 115(12), 1504–1512.
22. Krawczyk, P., Kowalski, D. M., Ramlau, R., Kalinka‑Warzocha, E., Winiarczyk, K., Stencel, K., … Krzakowski, M. (2017). Comparison of the effectiveness of erlotinib, gefitinib, and afatinib for treatment of non‑small cell lung cancer in patients with common and rare EGFR gene mutations. Oncology letters, 13(6), 4433–4444.
23. Gallant, J. N., Sheehan, J. H., Shaver, T. M., Bailey, M., Lipson, D., Chandramohan, R., … Lovly, C. M. (2015). EGFR Kinase Domain Duplication (EGFR-KDD) Is a Novel Oncogenic Driver in Lung Cancer That Is Clinically Responsive to AfatinibEGFR-KDD as a Therapeutic Target in Lung and Other Cancers. Cancer discovery, 5(11), 1155–1163.
24. Konduri, K., Gallant, J. N., Chae, Y. K., Giles, F. J., Gitlitz, B. J., Gowen, K., … Lovly, C. M. (2016). EGFR Fusions as Novel Therapeutic Targets in Lung CancerTherapeutically Targetable EGFR Fusions in Lung Cancer. Cancer discovery, 6(6), 601–611.
25. Kohsaka, S., Nagano, M., Ueno, T., Suehara, Y., Hayashi, T., Shimada, N., … Mano, H. (2017). A method of high-throughput functional evaluation of EGFR gene variants of unknown significance in cancer. Science translational medicine, 9(416), eaan6566.
26. Ou, S. I., Nagasaka, M., & Zhu, V. W. (2018). Liquid Biopsy to Identify Actionable Genomic Alterations. American Society of Clinical Oncology educational book. American Society of Clinical Oncology. Annual Meeting, 38, 978–997. doi.org/10.1200/EDBK_199765.
27. Qin, Y., Jian, H., Tong, X., Wu, X., Wang, F., Shao, Y. W., & Zhao, X. (2020). Variability of EGFR exon 20 insertions in 24 468 Chinese lung cancer patients and their divergent responses to EGFR inhibitors. Molecular oncology, 14(8), 1695–1704.
28. Friedlaender, A., Subbiah, V., Russo, A., Banna, G. L., Malapelle, U., Rolfo, C., & Addeo, A. (2022). EGFR and HER2 exon 20 insertions in solid tumours: from biology to treatment. Nature Reviews Clinical Oncology, 19(1), 51–69. doi.org/10.1038/s41571-021-00558-1.
29. Yoshimasu, T., Oura, S., Ohta, F., Hirai, Y., Naito, K., Nakamura, R., … Okamura, Y. (2011). Epidermal growth factor receptor mutations are associated with docetaxel sensitivity in lung cancer. Journal of Thoracic Oncology, 6(10), 1658–1662. doi.org/10.1097/JTO.0b013e318221f71a.
30. Fang, S., & Wang, Z. (2014). EGFR mutations as a prognostic and predictive marker in non-small-cell lung cancer. Drug design, development and therapy, 8, 1595. doi.org/10.2147/DDDT.S69690.
31. Addeo, A., Passaro, A., Malapelle, U., Banna, G. L., Subbiah, V., & Friedlaender, A. (2021). Immunotherapy in non-small cell lung cancer harbouring driver mutations. Cancer treatment reviews, 96. doi.org/10.1016/j.ctrv.2021.102179.
32. Bazhenova, L., Minchom, A., Viteri, S., Bauml, J. M., Ou, S. H. I., Gadgeel, S. M., … Girard, N. (2021). Comparative clinical outcomes for patients with advanced NSCLC harboring EGFR exon 20 insertion mutations and common EGFR mutations. Lung Cancer, 162, 154–161.
33. Hirano, T., Yasuda, H., Tani, T., Hamamoto, J., Oashi, A., Ishioka, K., … Soejima, K. (2015). In vitro modeling to determine mutation specificity of EGFR tyrosine kinase inhibitors against clinically relevant EGFR mutants in non-small-cell lung cancer. Oncotarget, 6(36), 38789.
34. Floc’h, N., Martin, M. J., Riess, J. W., Orme, J. P., Staniszewska, A. D., Ménard, L., … Cross, D. A. (2018). Antitumor Activity of Osimertinib, an Irreversible Mutant-Selective EGFR Tyrosine Kinase Inhibitor, in NSCLC Harboring EGFR Exon 20 InsertionsOsimertinib in NSCLC Patients with EGFR Ex20Ins Mutations. Molecular cancer therapeutics, 17(5), 885–896.
35. Cho, J. H., Lim, S. H., An, H. J., Kim, K. H., Park, K. U., Kang, E. J., … Ahn, M.-Ju. (2020). Osimertinib for patients with non–small-cell lung cancer harboring uncommon EGFR mutations: a multicenter, open-label, phase II trial (KCSG-LU15–09). J. Clin. Oncol., 38(5), 488.
36. Piotrowska, Z., Wang, Y., Sequist, L. V., & Ramalingam, S. S. (2020). ECOG-ACRIN 5162: a phase II study of osimertinib 160 mg in NSCLC with EGFR exon 20 insertions. J. Clin. Oncol., 38(15), 9513–9513.
37. Sabari, J. K., Shu, C. A., Park, K., Leighl, N., Mitchell, P., Kim, S., … Cho, B. C. (2021). OA04. 04 Amivantamab in post-platinum EGFR exon 20 insertion mutant non-small cell lung cancer. Journal of Thoracic Oncology, 16(3), S108–S109.
38. Riely, G. J., Neal, J. W., Camidge, D. R., Spira, A. I., Piotrowska, Z., Costa, D. B., … Jänne, P. A. (2021). Activity and Safety of Mobocertinib (TAK-788) in Previously Treated Non-Small Cell Lung Cancer with EGFR Exon 20 Insertion Mutations from a Phase I/II Trial. Cancer discovery, 11(7), 1688–1699. doi.org/10.1158/2159-8290.CD-20-1598.
39. Riess, J. W., Groshen, S. G., Reckamp, K. L., Wakelee, H. A., Oxnard, G. R., Padda, S. K., … Gandara, D. R. (2019). Osimertinib (Osi) plus necitumumab (Neci) in EGFR-mutant NSCLC: An ETCTN California cancer consortium phase I study.
40. Van Veggel, B., Santos, J. V. M. R., Hashemi, S. M. S., Paats, M. S., Monkhorst, K., Heideman, D. A. M., … de Langen, A. J. (2020). Osimertinib treatment for patients with EGFR exon 20 mutation positive non-small cell lung cancer. Lung Cancer, 141, 9–13.














Leave a comment