Вплив пухлини та супутньої патології на морфо-функціональні зміни в нирках
Кротевич М.С.1, Трохимич С.С.1, Кошубарова М.В.1, Скорода Л.В.1, Вітрук Ю.В.1, Войленко О.А.1, Кононенко О.А.1, Стаховський О.Е.1, Семко С.Л.1, Пікуль М.В.1, Кошель Д.О.1, Вукалович П.С.1, Тимошенко А.В.1, Буйвол О.В.1, Стаховський Е.О.1, Пасічник С.М.2
Резюме. У роботі представлено ретроспективний аналіз результатів обстеження та лікування 30 хворих, яким впродовж 2015–2019 рр. в Національному інституті раку було виконано хірургічне втручання з приводу світлоклітинного нирково-клітинного раку. Критерієм включення в дослідження було повністю інтраренальне розміщення пухлини без поширення її на капсулу нирки (Т1а–Т2в стадія, будь-яке N, будь-яке М). Метою дослідження було вивчення впливу пухлини на морфо-функціональні зміни в нирках в залежності від її величини та наявності системних захворювань (цукровий діабет, гіпертонічна хвороба та ін.). Результати. Морфологічне дослідження вказувало на формування зони відмежування між пухлиною та паренхімою нирки у вигляді лімфоїдноклітинної інфільтрації та проліферації судин, які прямо пропорційно збільшувалися із збільшенням розміру пухлини (р <0,05), а наявність супутньої патології пришвидшувала та поглиблювала вираженість склеротичних змін у вигляді склерозування канальців, прогресивного збільшення відстані між ними, витончення їх епітелію (р <0,001). Висновки. Було встановлено статистично достовірну обернено пропорційну залежність прогресивного зменшення об’єму функціонуючої паренхіми нирки та зниження показника швидкості клубочкової фільтрації від збільшення розміру пухлини (р <0,04), а поєднання пухлини великих розмірів та супутньої патології призводить до значного погіршення функції ураженої пухлиною нирки (р <0,02).
Одержано 2.12.2021
Прийнято до друку 12.12.2021
DOI: 10.32471/clinicaloncology.2663-466X.43-3.28619
ВСТУП
Протягом останнього десятиліття в Україні та світі значно зросла кількість хворих нефрологічного профілю як серед дорослого, так і серед дитячого населення. Визначається значне збільшення кількості уражень нирок на тлі хвороб сечостатевої системи, онкопатології, системних захворювань та ін. [1, 2]. Епідеміологічні дослідження останніх років продемонстрували, що поширеність хронічної хвороби нирок у різних регіонах світу досягає 8–35,5% [3], загальна захворюваність — близько 5,5–6% та характеризується прогресуючим перебігом та високою летальністю [4].
Ураження нирок можуть бути обумовлені як прямим негативним впливом (наприклад інфекція, пухлина), так і захворюваннями інших органів і систем, які опосередковано впливають на їх функцію.
Одним з найпоширеніших захворювань сечостатевої системи є інфекція та рак нирки. Інфекції в нирках залежно від їх виду та локалізації ураження, можуть викликати запальні процеси у вигляді гломерулонефриту чи пієлонефриту [5]. Іншим прямим агентом, що викликає порушення функції нирки, є пухлина. Проте до цього часу відсутні чіткі морфо-функціональні дані про стан паренхіми нирки при її пухлині, а результати наявних досліджень не виявили статистичної різниці даних морфометричної оцінки паренхіми нирки у хворих на локалізований рак та здорових людей [6]. Однак автори зробили припущення, що на результати міг вплинути ряд факторів: повільний ріст пухлини та поступовий ріст псевдокапсули, конкурентне заміщення ниркової паренхіми пухлиною без зміни об’єму всередині.
Гіпертонічна хвороба, цукровий діабет, амілоїдоз, деякі форми атеросклерозу, сечокам’яна хвороба та інші захворювання також під час патогенетичного розвитку викликають порушення функції нирок [7].
Ниркова паренхіма обмежена капсулою, що має сполучно-тканинну структуру та практично немає еластичних волокон. Під час гострого запального процесу в нирці виникає набряк паренхіми, однак ниркова капсула має певну площу і не може розтягнутися, це все призводить до стиснення самої паренхіми і, як наслідок, пiдвищення тиску всерединi нирки, порушення мiкроциркуляцiї, а тривала гiпоксiя ниркової паренхiми спричиняє склеротичнi змiни. Подібний механізм може виникати при пухлині нирки [6, 8]. Прогресування цих процесів та/або їх поєднання неминуче призведе до погіршення функції нирки, наростання ознак хронічної ниркової недостатності, що може спричинити виникнення гострих серцево-судинних, неврологічних станів, призвести до інвалідизації та смерті хворих [9].
МЕТА РОБОТИ
Оцінити морфо-функціональні зміни в нирках залежно від величини пухлини та наявності системних захворювань (цукровий діабет, гіпертонічна хвороба, атеросклероз).
МАТЕРІАЛ ТА МЕТОДИ ДОСЛІДЖЕННЯ
У науково-дослідному відділенні пластичної та реконструктивної онкурології Національного інституту раку України в рамках науково-дослідної роботи «Вивчити ефективність органозберігаючої хірургічної тактики лікування раку нирки, оптимізувати показання та медичну реабілітацію хворих» було проведено ретроспективний аналіз, який мав на меті вивчити вплив пухлини на морфо-функціональні зміни в нирці. Дослідження було схвалено Локальною етичною комісією при Національному інституті раку та проводилося відповідно до Гельсінської декларації та Настанови «Лікарські засоби. Належна клінічна практика» (Good Clinical Practice — GCP).
Діагностика нирково-клітинного раку (НКР) вимагала спеціального комплексного обстеження, що передбачало: вивчення анамнестичних даних, об’єктивного статусу хворого, клініко-лабораторних, променевих та функціональних методів дослідження. До обсягу анамнестичних даних входило вивчення скарг, анамнезу життя та захворювання. Після отримання результатів лабораторного обстеження всім хворим було проведено спіральну комп’ютерну томографію, за допомогою якої чітко визначали розміри пухлини, встановлювали її локалізацію та відношення до структур нирки. Також за даними спіральної комп’ютерної томографії обов’язково визначали об’єм функціонуючої паренхіми нирки на боці ураження (RFPV) [10]. Оцінку сумарної швидкості клубочкової фільтрації (ШКФ), а також функціонального стану здорової та ураженої пухлиною нирки проводили за допомогою радіонуклідної динамічної нефросцинтиграфії.
Основним критерієм включення в дослідження було інтраренальне розміщення пухлини (Т1а–Т2в стадія, будь-яке N, будь-яке М) згідно з TNM-класифікацією [11].
Пацієнтів з двосторонніми пухлинами нирки, пухлиною єдиної нирки, супутньою онкопатологією не було включено в це дослідження.
Загалом у дослідження увійшли 29 хворих, яким упродовж 2015–2020 рр. було виконано хірургічне втручання з приводу НКР: нефректомію — у 19 (65,5%), резекцію нирки — у 10 (34,5%) випадках. Вік хворих коливався в межах 25–66 років, Me = 56 років, міжквартильний інтервал — 41,5–59,3 року. Чоловіків було 14 (48,3%), жінок — 15 (51,7%). Слід зазначити, що у 19 (65,5%) хворих відмічали супутню патологію з боку інших органів та систем, що впливало на функцію нирок у доопераційний період: гіпертонічну хворобу діагностовано у 10 (34,5%), атеросклероз — у 6 (20,7%), цукровий діабет — у 3 (10,3%) пацієнтів.
Клінічні параметри представлено в табл. 1.
Таблиця 1. Клінічні параметри пацієнтів
| Показник | Середнє значення
(n=29) |
|
| Fuhrman score | Grade 2 | 21 (72,4%) |
| Grade 3 | 8 (27,6%) | |
| Максимальний діаметр пухлини, мм | 57 (38,8—93,3) | |
| Об’єм функціонуючох паренхіми нирки, % | 73 (44,5—87) | |
| R.E.N.A.L. score | 11 (10—11,25) | |
| Сумарна ШКФ, мл/хв | 90 (81—110,5) | |
| ШКФ на боці ураження, мл/хв | 41,5±12,8 | |
| ШКФ здорової нирки, мл/хв | 52,8±8,6 | |
Слід відмітити статистично значуще (p<0,001 за критерієм Стьюдента для пов’язаних вибірок) зниження показника ШКФ на боці ураження в порівнянні зі здоровою ниркою (у середньому на 11,2 мл/хв (95% довірчий інтервал (ДІ) 6,8 мл/хв — 15,6 мл/хв)), що підтверджувало залежність погіршення функції нирки від наявності пухлини.
З метою порівняльної оцінки морфо-функціональних змін у паренхімі нирки залежно від величини пухлини, пацієнтів було розділено на три групи: до першої увійшло 9 (31%) хворих, у яких максимальний діаметр пухлини становив 4 см і менше (Т1а стадія); другу групу склали також 9 (31%) пацієнтів з діаметром пухлини більше 4, але менше 7 см (Т1в стадія); до третьої групи увійшло 11 (37,9%) хворих, у яких діаметр пухлини був 7 см і більше (Т2 стадія).
Патоморфологічне дослідження операційного матеріалу проводили у відділенні патологічної анатомії за наступною методикою: макропрепарат фіксували в 10% водному нейтральному розчині формаліну. Із різних ділянок макропрепарату вирізали шматочки розмірами до 0,5×0,5×0,5 см, які використовували для виготовлення гістологічних препаратів. Фарбування виконували за допомогою гематоксилін-еозину. Оцінювали ступінь гістопатологічної атипії ядер пухлини нирки за Фурманом [12], а також визначали морфологічні зміни в паренхімі нирки біля пухлини та на максимально віддаленій ділянці від неї, вимірюючи середній діаметр канальця, міжканальцеву відстань, товщину стінки канальця.
Статистичну обробку отриманих результатів проводили за допомогою програмного забезпечення EZR v. 1.54 (graphical user interface for R statistical software version 4.0.3, R Foundation for Statistical Computing, Vienna, Austria) [13]. Для кількісних ознак описова статистика включала обчислення середньої величини (X) та стандартне відхилення (±SD) у разі нормального закону розподілу або медіанне значення (Ме) та міжквартильний інтервал (у разі закону розподілу, відмінного від нормального).
Для проведення аналізу зв’язку ризику недосягнення ефекту з факторними ознаками було використано метод побудови однофакторних та багатофакторних моделей логістичної регресії. Якість моделей оцінювалася за площею під ROC-кривою (AUC — Area under the ROC curve), розраховувався 95% ВІ показника. Вибір оптимального порогу моделей проводився за Youden Index, для оптимального порогу наводилися показники чутливості та специфічності. Для кількісної оцінки ступеня впливу факторної ознаки розраховували показник відношення ризиків та його 95% ВІ. Під час відбору мінімального набору значущих незалежних ознак у рамках багатофакторних моделей логістичної регресії використано метод покрокового включення/виключення ознак (критичний поріг включення ознаки p <0,1 і для виключення р >0,2) [14].
При проведенні аналізу використані критерії з двосторонньою критичною областю, критичний рівень значимості прийнятий рівним 0,05.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ ТА ЇХ ОБГОВОРЕННЯ
Групи співставні за основними критеріями, що аналізувалися. Демографічні та клінічні параметри досліджуваних груп представлено в табл. 2.
Таблиця 2. Демографічні та клінічні параметри груп
| Показник | Група Т1а
n=9 (%) |
Група Т1в
n=9 (%) |
Група Т2
n=11 (%) |
Рівень значущості відмінності, p | |
| Вік, роки | 47,9±14,2 | 49,7±12,4 | 55,5±8,8 | р >0,07 | |
| Супутня патологія, n | 5 (55,5) | 5 (55,5) | 9 (81,8) | р >0,85 | |
| Fuhrman score: | Grade 2 | 7 (77,8) | 7 (77,8) | 7 (63,6) | р >0,96 |
| Grade 3 | 2 (22,2) | 2 (22,2) | 4 (36,4) | ||
| Максимальний діаметр пухлини, мм | 32,7±5,9 | 52,7±7,7 | 96±14,2 | р <0,000001 | |
| Об’єм паренхіми нирки, що функціонує, % | 91,3±5,1 | 74±8,4 | 37,5±10,5 | р <0,00001 | |
| R.E.N.A.L. score | 9,1±0,9 | 10,4±0,7 | 11,5±0,5 | р <0,002 | |
| Сумарна ШКФ, мл/хв | 109,7±16,5 | 95,1±17 | 81,3±10 | р <0,04 | |
| ШКФ на боці ураження, мл/хв | 51,9±9,8 | 42,7±10,6 | 32,4±9,7 | р <0,05 | |
| ШКФ здорової нирки, мл/хв | 57,9±7,5* | 52,4±9,9* | 49,4±6,3 | р <0,01 | |
*р >0,11
Як видно з табл. 2, статистично достовірно групи порівняння відрізнялися за максимальним діаметром пухлини, R.E.N.A.L. score, RFPV, показником сумарної ШКФ та ШКФ на боці ураження. Однак ШКФ здорової нирки статистично достовірно не відрізнялася при порівнянні першої з другою та другої з третьою групами, вказуючи на можливий вплив інших факторів на функціональний стан нирок.
Для виявлення зв’язку факторних ознак з ризиком низької ШКФ було проведено однофакторний аналіз із використанням методу побудови моделей логістичної регресії. Під час проведення аналізу низьке значення враховано при ШКФ на боці ураження <45 мл/хв (19 випадків). Аналіз однофакторних моделей логістичної регресії прогнозування ризику низької ШКФ наведено в табл. 3.
Таблиця 3. Аналіз однофакторних моделей логістичної регресії прогнозування ризику низької ШКФ
| Факторна ознака | Значення коефіцієнта моделі, b±mb | Рівень значущості відмінності коефіцієнта від 0, р | Показник відношення шансів моделі, ВР (95% ДІ) |
| Стать (чоловіки порівняно з жінками) | –0,11±0,78 | 0,892 | – |
| Вік, роки | 0,11±0,04 | 0,010 | 1,12 (1,03–1,22) |
| Супутня патологія
«Так» проти «Ні» |
1,73±0,86 | 0,044 | 5,63 (1,05–30,1) |
| Максимальний діаметр пухлини, мм | 0,088±0,037 | 0,017 | 1,09 (1,02–1,18) |
| Об’єм паренхіми нирки, що функціонує, % | 0,098±0,039 | 0,013 | 0,91 (0,84–0,98) |
| R.E.N.A.L. score, бали | 1,22±0,47 | 0,010 | 3,37 (1,34–8,52) |
| Fuhrman score, бали | 0,61±0,93 | 0,511 | – |
Таким чином, у ході проведення однофакторного аналізу виявлено зростання (р=0,010) ризику низької ШКФ з віком пацієнта, ВР = 1,12 (95% ДІ 1,03–1,22) на кожен рік пацієнта. За наявності супутньої патології ризик низької ШКФ також підвищується (р=0,044), ВР = 5,63 (95% ДІ 1,05–30,1) у порівнянні з пацієнтами без таких захворювань. Підвищується (р=0,017) ризик низької ШКФ і зі збільшенням максимального діаметра пухлини, ВР = 1,09 (95% ДІ 1,02–1,18) на кожен міліметр діаметра пухлини. У разі зростання R.E.N.A.L. score ризик низької ШКФ також підвищується (р=0,010), ВР = 3,37 (95% ДІ 1,34–8,52) на кожен бал показника. А от при зростанні RFPV ризик низької ШКФ знижується (р=0,013), ВР = 0,91 (95% ДІ 0,84–0,98) на кожен відсоток.
На рис. 1 наведено криву операційних характеристик однофакторної моделі прогнозування ризику низької ШКФ за віком. Площа під кривою операційних характеристик AUC — 0,84 (95% ДІ 0,66–0,95), що свідчить про сильний зв’язок віку з ризиком низької ШКФ.
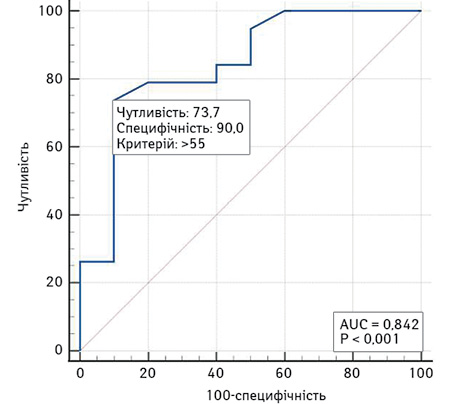
У разі вибору оптимального (за Youden Index) порогу >55 років чутливість цієї моделі становить 73,7%, специфічність — 90%.
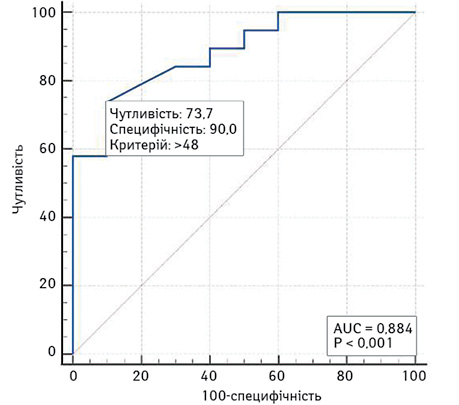
Площа під кривою операційних характеристик моделі прогнозування ризику низької ШКФ за максимальним діаметром пухлини AUC — 0,88 (95% ДІ 0,71–0,97), що свідчить також про сильний зв’язок діаметра з ризиком низького ШКФ (рис. 2). У разі вибору оптимального (за Youden Index) порогу >48 мм чутливість цієї моделі становить 73,7%, специфічність — 90%.
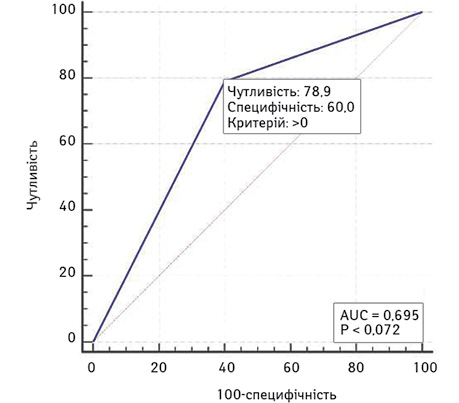
Площа під кривою операційних характеристик моделі прогнозування ризику низької ШКФ за наявністю супутньої патології AUC = 0,70 (95% ДІ 0,50–0,85), що є свідченням посереднього її зв’язку з ризиком низької ШКФ (рис. 3). У разі прогнозування ризику низької ШКФ за наявністю супутньої патології чутливість моделі становить 79%, специфічність — 60%.
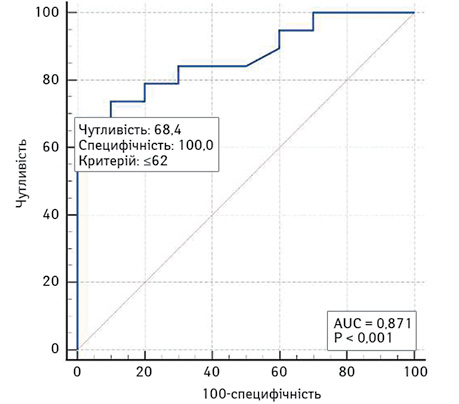
Площа під кривою операційних характеристик моделі прогнозування ризику низької ШКФ за показником об’єму функціонуючої паренхіми нирки, AUC — 0,87 (95% ДІ 0,69–0,97), що також є свідченням сильного зв’язку об’єму паренхіми нирки, яка функціонує, з ризиком низької ШКФ (рис. 4). У разі вибору оптимального (за Youden Index) порогу ≤62% чутливість цієї моделі становить 68,4%, специфічність — 100%.
Під час відбору сукупності незалежних ознак прогнозування ризику низької ШКФ в рамках багатофакторної моделі було виділено дві ознаки: вік пацієнта та максимальний діаметр пухлини. Результати аналізу двофакторної моделі логістичної регресії прогнозування ризику низької ШКФ представлено в табл. 4.
Таблиця 4. Аналіз двофакторної моделі логістичної регресії прогнозування ризику низької ШКФ
| Факторна ознака | Значення коефіцієнта моделі, b±mb | Рівень значимості відмінності коефіцієнта від 0, р | Показник відношення шансів моделі, ВШ (95% ДІ) |
| Вік, роки | 0,16±0,08 | 0,045 | 1,18 (1,00–1,39) |
| Максимальний діаметр пухлини, мм | 0,13±0,08 | 0,086 | 1,14 (0,98–1,33) |
На рис. 5 наведено криву операційних характеристик двофакторної моделі прогнозування ризику низької ШКФ. Площа під кривою операційних характеристик AUC — 0,95 (95% ДІ 0,80–1,00), що свідчить про дуже сильний зв’язок віку та максимального діаметра пухлини з ризиком низької ШКФ.
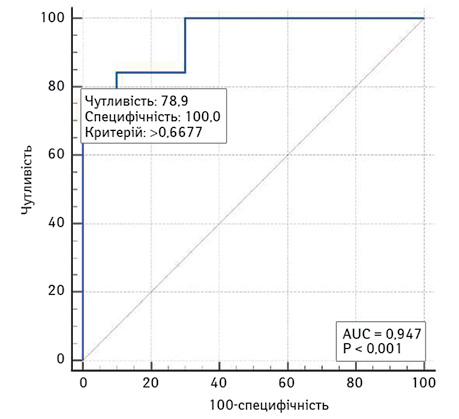
У разі вибору оптимального (за Youden Index) порогу >0,6677 чутливість двофакторної моделі прогнозування ризику низького ШКФ становить 78,9% (95% ДІ 54,4–93,9), специфічність — 100% (95% ДІ 69,2–100).
За результатами аналізу отриманих даних можна констатувати обернено пропорційну залежність низької ШКФ від віку та розміру пухлини. Наявність супутньої патології мала опосередкований вплив на ШКФ і не увійшла в модель, тому що більше має значення вік і це вже передбачає те, що у людини є вік-асоційовані супутні захворювання. Для виявлення більш тонких залежностей потрібні подальші дослідження.
Під час морфологічного дослідження операційного матеріалу в усіх хворих було діагностовано світлоклітинний НКР, ІІ ступінь ядерної атипії за Fuhrman виявлено у 21 (72,4%), ІІІ ступінь — у 8 (27,6%) випадках. Статистичної різниці в групах порівняння по ступеню атипії не було виявлено (р > 0,96).
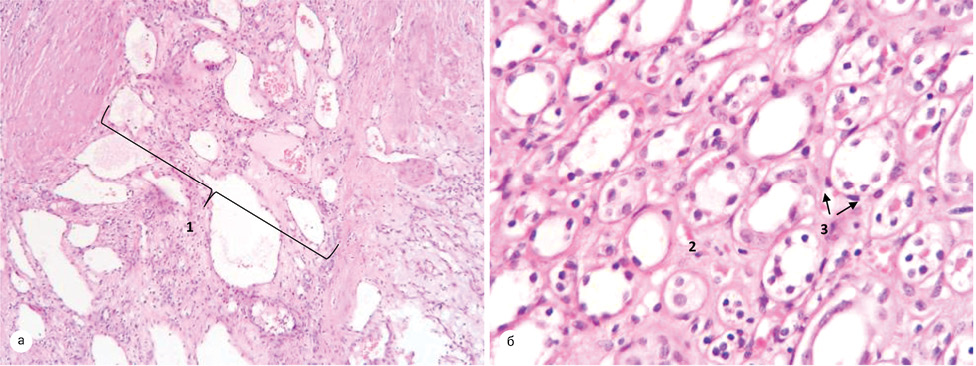
При світлооптичному дослідженні зразків паренхіми, у пацієнтів першої групи було відмічено, що пухлина відмежована від паренхіми нирки за рахунок лімфоїдноклітинної інфільтрації, серед якої визначалася незначна проліферація судин, скупчення склерозованих канальців. Поза зоною відмежування і далі — середній діаметр канальців складав у межах 40,33±6,51 мкм, середня міжканальцева відстань — 12,73±6,3 мкм, середня товщина стінки канальця — 10,17±1,88 мкм (рис. 6).
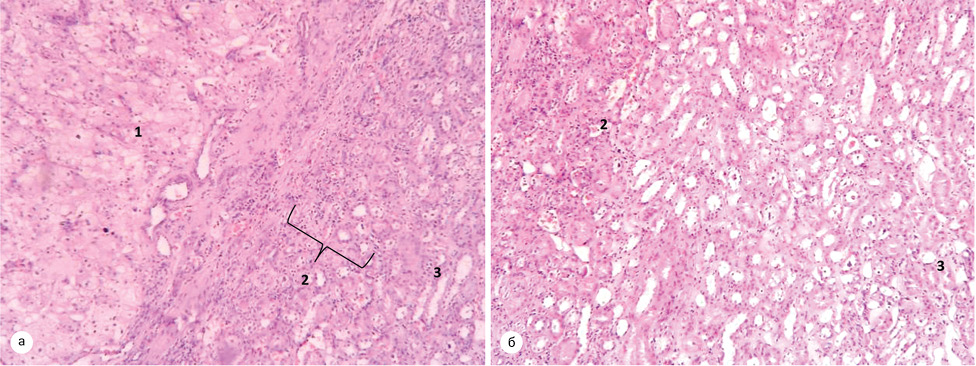
Окрім того, гістологічні зміни паренхіми нирки у хворих із супутньою патологією відповідали змінам, характерним для гіпертонічної хвороби (рис. 7), цукрового діабету (рис. 8) та атеросклерозу (рис. 9). У пацієнтів без супутньої патології — морфологічна картина відповідала нормі, що підтверджувало факт відсутності впливу малих пухлин нирки на її паренхіму.
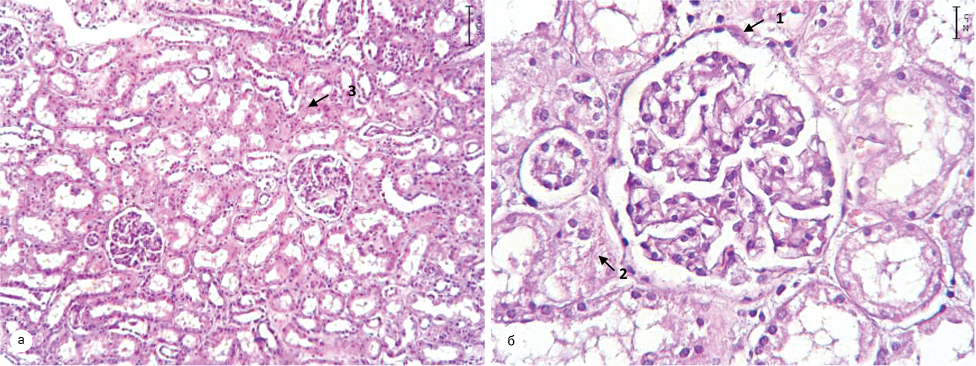
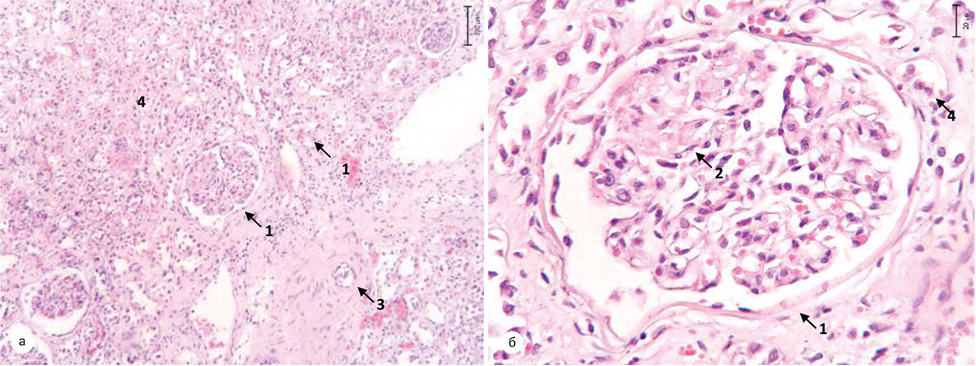
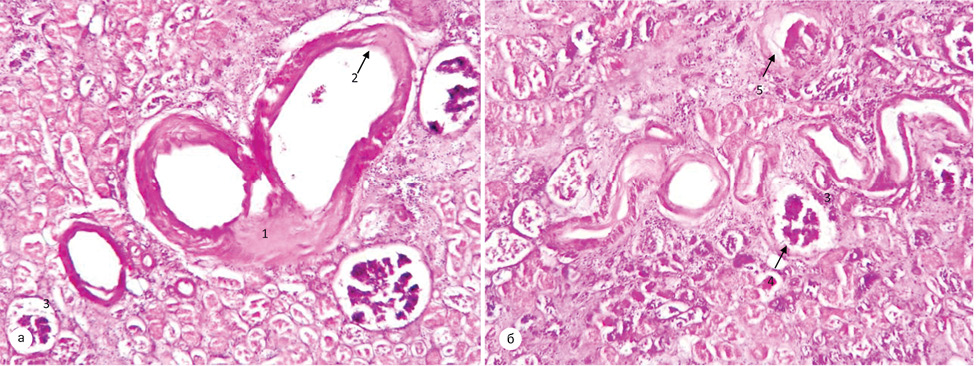
У пацієнтів другої групи — пухлина відмежована від паренхіми нирки сформованою капсулою з вираженою лімфоїдноклітинною інфільтрацією. У товщі капсули визначаються поодинокі клубочки з явищами склерозу капсули. Поза ділянкою відмежування — строма нирки з вогнищевим міксоматозом. Епітелій клубочків витончений, просвіт вогнищево заповнений колоїдним вмістом. Клубочки з явищами склерозу, повністю виповнюють Боуменівський простір. Середній діаметр канальців був у межах 45,55±10,47 мкм, середня міжканальцева відстань — 21,35±5,55 мкм, середня товщина стінки канальця — 11,68±2,29 мкм (рис. 10). Слід відмітити, що у хворих цієї групи із супутньою патологією при морфологічному дослідженні визначались ознаки наростання ішемії та склерозу.
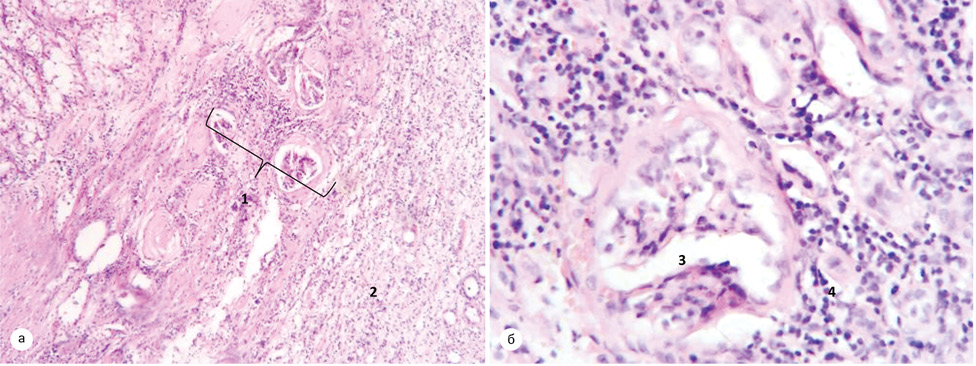
Для хворих третьої групи — межа між пухлиною та паренхімою нирки була представлена масивною ділянкою склерозу за типом капсули з вираженою проліферацією судин різного калібру. Канальці поза зоною відмежування з поширеним склерозом, епітелій канальців витончений, відстань між канальцями прогресивно збільшується залежно від вираженості склеротичних змін. Діаметр канальців становив 45±14,72 мкм, міжканальцева відстань збільшувалася до 15,6±3,12 мкм, товщина стінки канальця зменшувалася до 12,33±3,45 мкм (рис. 11).
Проведене нами дослідження вказує на прямий негативний вплив розміру пухлини, віку та супутньої патології на морфо-функціональні зміни паренхіми нирки, а подальше їх вивчення дозволить оптимізувати тактику лікування хворих на НКР.
ВИСНОВКИ
Виявлено обернено пропорційну статистично достовірну залежність прогресивного зменшення об’єму функціонуючої паренхіми нирки, та зниження показників сумарної ШКФ та ШКФ на боці ураження від збільшення розміру пухлини (р <0,04).
Інтраренальна пухлина нирки розміром 7 см і більше у хворих із супутньою патологією (гіпертонічна хвороба, цукровий діабет, атеросклероз) призводить до значного погіршення функції нирки та зменшення компенсаторних можливостей організму (р <0,02)
Морфологічне дослідження вказує на формування зони відмежування між пухлиною та паренхімою нирки у вигляді лімфоїдноклітинної інфільтрації та проліферації судин, які прямо пропорційно зростають зі збільшенням розміру пухлини (р <0,05).
Збільшення розміру пухлини нирки викликає склерозування канальців, прогресивне збільшення відстані між ними, витончення їх епітелію, а наявність супутньої патології пришвидшує та поглиблює вираженість склеротичних змін (р <0,001).
Список використаної літератури
1. Mills, K. T., Xu, Y., Zhang, W., Bundy, J. D., Chen, C. S., Kelly, T. N., … He, J. (2015). A systematic analysis of world-wide population-based data on the global burden of chronic kidney disease in 2010. Kidney International, 88(5), 950–957. doi: 10.1038/ki.2015.230.
2. Сайдакова, Н. О., Старцева, Л. М., & Кравчук Н. Г. (2019). Основні показники урологічної допомоги в Україні за 2011–2015 роки: відомче видання. Київ : Поліум, 20 с.
3. Hill, N. R., Fatoba, S. T., Oke, J. L., Hirst, J. A., O’Callaghan, C. A., Lasserson, D. S., & Hobbs, F. D. (2016). Global Prevalence of Chronic Kidney Disease — A Systematic Review and Meta-Analysis. PLoS One, 11(7), e0158765. doi: 10.1371/journal.pone.0158765.
4. Sirman, V. M., Boris, R. M., & Nykytenko, O. P. (2016). Acute kidney damage in inflammatory processes and ways of their correction 198. Journal of Education, Health and Sport, 6(1), 349–368.
5. Лоншакова, К. С., Абгалдаева, Е. А., Мондодоев, А. Г., & Убашеев, И. О. (2009). Эффективность нефрофита при лекарственных нефропатиях (морфологические исследования). Бюллетень ВСНЦ СО РАМН, 2(66), 113–115.
6. Войленко О. А. Оптимізація діагностики та хірургічного лікування локалізованого нирково-клітинного раку : дис. … доктора мед. наук : 14.01.07 / Войленко Олег Анатолійович. — Київ : НІР, 2020. 418 с.
7. Колесник, М. О., & Лапчинська, І. І. (2001). Невідкладні стани в нефрології. Лікування та діагностика, 4, 41–49.
8. Черданцева, Т. М., Бобров, И. П., Климачев, В. В., Брюханов, В. М., Лазарев, А. Ф., Авдалян, А. М., & Долгатов, А. Ю. (2013). Размер опухолевого узла и гистологическое строение перитуморозной зоны рака почки. Фундаментальные исследования, 7–1, 188–193.
9. Go, A. S., Chertow, G. M., Fan, D., McCulloch, C. E., & Hsu, C. Y. (2004). Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. The New England Journal of Medicine, 351(13), 1296–1305. doi: 10.1056/NEJMoa041031.
10. Стаховський, Е. О., Войленко, О. А., Вітрук, Ю. В., Стаховський, О. Е., & Вукалович, П. С. (2016). Вибір тактики хірургічного лікування хворих на нирково-клітинний рак: метод. Рекомендації. Київ, 28 с.
11. Sobin, L. H., Gospodarowicz, M. K., & Wittekind, С. (2009). TNM classification of malignant tumors. 7th ed. Wiley-Blackwell, 336 р.
12. Fuhrman, S. A., Lasky, L. C., & Limas, C. (1982). Prognostic significance of morphologic parameters in renal cell carcinoma. The American Journal of Surgical Pathology, 6(7), 655–663. doi: 10.1097/00000478-198210000-00007.
13. Kanda, Y. (2013). Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplantation, 48, 452–458. doi: 10.1038/bmt.2012.244.
14. Гур’янов, В. Г., Лях, Ю. Є., Парій, В. Д., Короткий, О. В., Чалий, О. В., Чалий, К. О., & Цехмістер, Я. В. (2018). Посібник з біостатистики. Аналіз результатів медичних досліджень у пакеті EZR (R–statistics): навчальний посібник. Київ : Вістка, 208 с.
Адреса:
Кротевич Михайло Станіславович
03022, м. Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: KrotevychM@gmail.com
Сorrespondence:
Krotevych Mihaylo
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
E-mail:KrotevychM@gmail.com














Leave a comment