Успішне лікування пацієнтки з множинними ускладненнями після перенесеної панкреатодуоденальної резекції
Мушенко Є.В.1, Тищенко О.М.1, Смачило Р.М.1, Старенький В.П.2, Авдосьєв Ю.В.1
- 1ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України», Харків
- 2ДУ «Інститут медичної радіології та онкології ім. С.П. Григор’єва НАМН України», Харків
Резюме. Бурхливий розвиток хірургічної панкреатології в ХХ ст. призвів до розробки цілого ряду резекційних втручань на підшлунковій залозі, які на даний час з успіхом застосовуються для лікування пухлинних та деяких непухлинних захворювань цього органу. Основні методологічні аспекти виконання панкреатодуоденальної резекції (ПДР) були описані ще в 1935 р. Allen Oldfather Whipple. Наступні 9 десятиліть ознаменувалися бурхливим розвитком анестезіології, удосконаленням хірургічної техніки, розробкою нових методів інструментального забезпечення хірургічних втручань, що призвело до значного зниження смертності після ПДР, яка в високопотокових панкреатологічних центрах не перевищує 3–5%. Однак кількість післяопераційних ускладнень, як і раніше, залишається надзвичайно високою, досягаючи 70%. Метою роботи є демонстрація ефективності мультидисциплінарного підходу при лікуванні множинних післяопераційних ускладнень після перенесеної ПДР, розвиток яких був обумовлений формуванням післяопераційної панкреатичної фістули. Наведене клінічне спостереження демонструє ефективність мультидисциплінарного підходу при лікуванні множинних важких ускладнень після перенесеної ПДР. Тільки своєчасна діагностика ускладнень, що розвиваються, а також застосування мініінвазивних методик лікування дають можливість досягти позитивного результату лікування в подібних випадках, що дозволяє припустити, що виконання резекційних операцій на підшлунковій залозі залишається прерогативою високотехнологічних спеціалізованих панкреатологічних центрів.
Одержано 21.09.2021
Прийнято до друку 18.10.2021
DOI: 10.32471/clinicaloncology.2663-466X.43-3.28270
Вступ
Панкреатодуоденальна резекція (ПДР) є основним методом лікування при злоякісних пухлинах голівки підшлункової залози та периампулярної зони, а також деяких доброякісних пухлинах і певних формах хронічного панкреатиту. Однак, за даними А.Г. Кригера та співавторів, частота післяопераційних ускладнень після виконання подібного типу втручань досягає 50–70% без істотної тенденції до зниження [1]. Найбільш тривожними ускладненнями, що зумовлюють високу ймовірність летального результату, є формування панкреатичної фістули (ПФ) та розвиток арозійної кровотечі [2]. S. Pedrazolli (2017) повідомляє, що ймовірність розвитку ПФ після ПДР становить 40–50% [3]. При цьому розвиток клінічно значущої панкреатичної фістули (класу В і С, ISGPS) є індуктором виникнення інших специфічних ускладнень, які в кінцевому наслідку можуть привести до летального результату, і тільки їх своєчасна корекція дозволяє досягти успішного результату лікування.
Метою роботи є демонстрація ефективності мультидисциплінарного підходу при лікуванні пацієнтів з множинними післяопераційними ускладненнями після перенесеної ПДР, розвиток яких було обумовлено формуванням післяопераційної ПФ.
Наводимо клінічне спостереження.
Хвора, 68 років, звернулася в клініку ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМН України» 16.12.2019 р. зі скаргами на жовтяницю, свербіж шкіри, загальну слабкість через 1 міс від початку захворювання. Була обстежена за місцем проживання. За даними комп’ютерної томографії (КТ), у хворої визначали ознаки біліарної обструкції на рівні великого дуоденального сосочка (ВДС) з рівномірним розширенням холедоха по всій довжині до 16 мм. Печінка збільшена в розмірах до 195×118 мм, однорідної структури. Внутрішньопечінкові ходи розширені. Підшлункова залоза часточкової структури 27×22×15 мм. Паренхіма однорідна, зі зниженою ехогенністю за рахунок жирової перебудови. Вірсунгова протока розширена до 5,5 мм. Регіонарні лімфовузли не збільшені, ознак віддаленого метастазування не виявлено. З особливостей: тип поділу печінкової артерії — 3 за N. Michels (1955) [4].
Стан хворої при зверненні середньої тяжкості. Виражена іктеричність склер та шкірного покриву. З особливостей: пацієнтка хворіє на цукровий діабет ІІ типу, ожиріння (індекс маси тіла — 38,6). У клініці хвору було дообстежено. У клінічних аналізах крові і сечі — без істотних відхилень від вікової норми. У біохімічному аналізі крові: загальний білок — 62,8 г/л, загальний білірубін — 302,8 мкмоль/л, прямий білірубін — 114,3 мкмоль/л, лужна фосфатаза — 955 ОД/л, аланінамінотрансфераза — 249,2 ОД/л, аспартатамінотрансфераза — 173,3 ОД/л. Хворій виконано дуоденоскопію, за даними якої визначаться об’ємне утворення ВДС — біопсія. За даними гістологічного дослідження виявлено аденокарциному ВДС. Хворій встановлений діагноз: рак ВДС T2N0M0, Ib стадія. Хронічна механічна жовтяниця. Хронічна печінкова недостатність. Цукровий діабет ІІ типу, середньої тяжкості. Ожиріння II ст.
У зв’язку з явищами механічної жовтяниці, печінкової недостатності 1-м етапом виконано зовнішньо-внутрішнє черезпечінкове черезшкірне холангіодренування. На тлі проведеної терапії зменшилися прояви печінкової недостатності, відзначена тенденція до регресу гіпербілірубінемії (загальний білірубін знизився до 126 мкмоль/л). Встановлено показання до хірургічного втручання.
26.12.2019 р. пацієнтку прооперовано: виконано лапаротомію, ПДР, дренування черевної порожнини. При ревізії в ділянці ВДС виявлено щільне пухлиноподібне утворення до 1 см в діаметрі. Холедох розширений до 1 см, в ньому визначається раніше встановлений дренаж. Уздовж гепатодуоденальної зв’язки визначаються поодинокі збільшені лімфовузли (реактивного характеру?). Підшлункова залоза звичайних розмірів, м’яка з «соковитою» паренхімою. Печінка збільшена в розмірах, пухка, бурого кольору. Після мобілізації дванадцятипалої кишки за Кохером виявлено збільшені лімфовузли аортокавального проміжку, у зв’язку із чим виконано аортокавальну лімфодисекцію. За даними експрес-гістологічного дослідження, пухлинних елементів в аортокавальних лімфовузлах не виявлено.
Мобілізований панкреатодуоденальний комплекс en bloc з жовчним міхуром та клітковиною гепатодуоденальної зв’язки. Гастродуоденальну артерію перев’язано біля вустя. Під час цього етапу ретельно контролювався хід правої печінкової артерії. Послідовно сформовані панкреатикоєюноанастомоз (за типом duct-to-mucosa з залишенням «втраченого» дренажу) та гепатикоєюноанастомоз на петлі, що була ізольована за Ру, а також гастроентероанастомоз та міжкишкове сполучення. У відвідну петлю тонкої кишки заведено зонд для харчування. Черевну порожнину дреновано з трьох точок.
Профілактика тромбоемболічних ускладнень проводилася механічним (еластичне бинтування нижніх кінцівок) та медикаментозним (низькомолекулярні гепарини в профілактичній дозі) способами. На 5-ту післяопераційну добу відзначено наявність жовчі (до 200 мл) у виділеннях по дренажу зони панкреатикоєюноанастомозу. У наступні 5 діб відмічено поступове припинення виділення жовчі по дренажу, у зв’язку із чим його було видалено. На 9-ту післяопераційну добу у хворої відзначено ознаки гастростазу (на 6-ту добу хвора самостійно видалила зонд, встановлений інтраопераційно). Хворій проводилося консервативне лікування, спрямоване на відновлення пасажу їжі зі шлунка, виконувалися стоки зі шлунка двічі на добу з деяким позитивним ефектом. Хворій призначено парентеральне харчування з розрахунком добового калоражу, проводилася корекція водно-електролітних порушень. Одночасно було рекомендовано продовжити приймати ентерально збалансовані харчові суміші, оскільки пацієнтка частково засвоювала ентеральне харчування. На 12-ту післяопераційну добу відзначено відходження великої кількості прозорих виділень по контрапертурі в правому підребер’ї (через яку раніше було виведено дренаж зони панкреатикоєюноанастомозу) з мацерацією шкіри. Було проведено реканалізацію контрапертури та встановлено трубковий дренаж, по якому почав надходити панкреатичний сік з дебітом до 100 мл/добу. Зберігалися явища гастростазу, у зв’язку із чим на 14-ту післяопераційну добу було виконано спробу ендоскопічного встановлення зонда для харчування в відвідну петлю тонкої кишки, яка, однак, була безуспішною. За даними ендоскопічного дослідження виявлено ознаки анастомозиту. Продовжено консервативне лікування. Хворій призначено протизапальну променеву терапію (3 сеанси з разовою вогнищевою дозою 0,2 Гр через 2 дні; сумарною вогнищевою дозою (СВД) 0,6 Гр). Прояви гастростазу дещо зменшилися, однак зберігалося блювання до 300 мл/добу з’їденим вмістом. З 25-ї післяопераційної доби періодично відзначалася поява геморагічної домішки у виділеннях з дренажу, встановленого до зони панкреатикоєюноанастомозу (до 50 мл/добу). Лабораторно відзначалися явища анемії (рівень гемоглобіну — 89 г/л). Хворій призначено гемостатичну терапію, трансфузію еритроцитів, свіжозамороженої плазми (СЗП). На 30-ту післяопераційну добу пацієнтка зазначила набряк і дискомфорт в правій верхній кінцівці. За даними ультразвукової діагностики (УЗД) — ознаки неоклюзуючого тромбозу правої внутрішньої яремної вени, у зв’язку із чим гемостатичну терапію було відмінено, знову призначено низькомолекулярні гепарини в профілактичній дозі (лікувальну дозу антикоагулянтів не призначали в зв’язку з епізодичними виділеннями геморагічного характеру по дренажу, які, однак, не відзначалися протягом попередніх 2 діб). Явища гастростазу практично регресували. Виконано рентген-контрастне дослідження шлунково-кишкового тракту: евакуація зі шлунка сповільнена до 3 год, в інших відділах — пасаж контрасту не порушений.
На 35-ту післяопераційну добу стан пацієнтки різко погіршився — відзначено ознаки гострої шлунково-кишкової кровотечі, яка маніфестувала у вигляді мелени. За даними ендоскопічного дослідження — ознаки геморагічного гастриту. Зберігається виділення панкреатичного соку по дренажу з дебітом до 150 мл/добу. Знову відзначено періодичну наявність геморагічного компонента у виділеннях по дренажу. Хворій повторно відмінено антикоагулянти, призначено гемостатичну терапію, трансфузію еритроцитів, СЗП. На 38-му післяопераційну добу хвора відзначила набряк та біль у ділянці лівої гомілки. За даними УЗД, виявлено ознаки неоклюзуючого тромбозу суральних вен лівої гомілки. На 45-ту післяопераційну добу хвора відзначила погіршення зору. Оглянута окулістом — ознаки часткового гемофтальму справа. Незважаючи на проведену терапію, у пацієнтки протягом наступних 10 діб відзначалися епізоди гострої шлунково-кишкової кровотечі, що маніфестувала з періодичністю 1 раз на 3 доби у вигляді мелени. При черговому ендоскопічному дослідженні джерела кровотечі у верхніх відділах шлунково-кишкового тракту не виявлено, у зв’язку з чим на 52-гу післяопераційну добу виконано ангіографію гілок черевної аорти, за даними якої виявлено псевдоаневризму правої печінкової артерії в ділянці кукси гастродуоденальної артерії. Виконано емболізацію порожнини псевдоаневризми та загальної печінкової артерії спіралями Gianturko (рисунок).
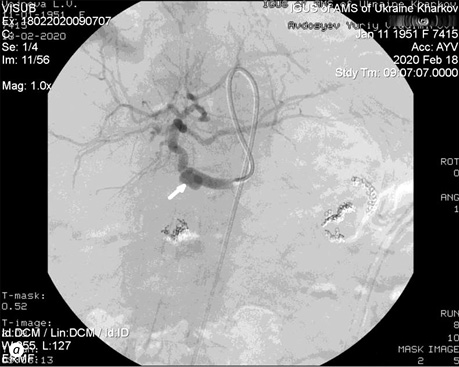
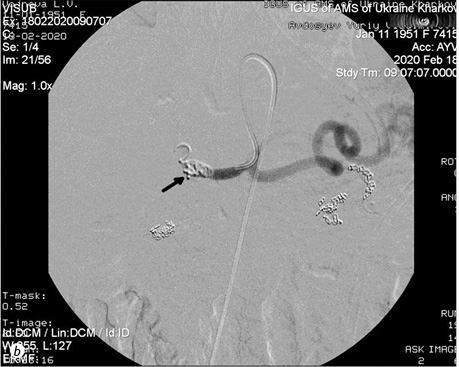
Рисунок. Ангіограми хворої, 68 років: а — псевдоаневризма правої печінкової артерії в ділянці кукси гастродуоденальної артерії (біла стрілка); b — емболізація правої печінкової артерії спіралями Gianturko (чорна стрілка)
У подальшому рецидивів гострої шлунково-кишкової кровотечі, виділення крові по дренажу не відзначено. Явища гастростазу повністю регресували на 50-ту післяопераційну добу. Відділення панкреатичного соку по дренажу спонтанно припинилося на 55-у добу після операції. Хвору виписано на 62-гу післяопераційну добу (72-гу добу після звернення).
За даними гістологічного дослідження видаленого препарату, у хворої виявлено помірно диференційовану аденокарциному дванадцятипалої кишки з вростанням в м’язовий шар стінки кишки. У регіонарних вузлах пухлинні елементи не виявлено.
Хворій встановлений остаточний діагноз: рак дванадцятипалої кишки T2N0M0, IIa стадія. Хронічна механічна жовтяниця. Хронічна печінкова недостатність. Цукровий діабет ІІ типу, середньої тяжкості. Неповна несформована зовнішньо-внутрішня панкреатична фістула, клас В (ISGPS, 2016) [5]. Псевдоаневризма загальної печінкової артерії. Пострезекційна арозійна кровотеча, клас С (ISGPS, 2007) [6]. Постгеморагічна анемія III ступеня. Післяопераційний гастростаз, клас С (ISGPS, 2007) [7]. Гострий неоклюзуючий тромбоз правої внутрішньої яремної вени. Гострий неоклюзуючий тромбоз суральних вен лівої нижньої кінцівки. Частковий гемофтальм справа.
Пацієнтка відмовилася від ад’ювантної поліхіміотерапії. Хвору оглянуто через 1,5 року після операції: скаржиться на періодичний біль, дискомфорт у верхніх відділах живота після прийому їжі. За даними КТ, ознак рецидиву захворювання не виявлено. У результаті обстеження виявлено ознаки екскреторної та інкреторної недостатності підшлункової залози, призначено відповідну корекцію. За даними УЗД вен правої верхньої та лівої нижньої кінцівок: реканалізація тромбозу правої внутрішньої яремної вени, УЗ-ознаки посттромбофлебітичного синдрому лівої нижньої кінцівки. Оглянута офтальмологом — явища гемофтальму справа повністю регресували. Пацієнтка повернулася до звичного способу життя. Продовжує спостерігатися в онколога за місцем проживання.
Обговорення
Консистенція панкреатичної кукси і діаметр головної панкреатичної протоки є загальноприйнятими факторами ризику розвитку ПФ. При цьому «соковита» консистенція підшлункової залози і діаметр вірсунгової протоки менше 3 мм істотно підвищують ризик розвитку неспроможності панкреатоєюноанастомозу. Разом з тим, на думку Д.С. Горіна та співавторів, незалежними факторами ризику формування ПФ у пацієнтів, які перенесли ПДР, за результатами одно- і мультифакторного аналізу, є КТ-ознаки «м’якої» підшлункової залози, засновані на розрахунку коефіцієнта накопичення контрастної речовини, а також частки функціонуючих ацинарних структур підшлункової залози, які визначаються за результатами термінового гістологічного дослідження видаленого препарату [2]. Спроби хірургічного вирішення проблеми ПФ призвели до розробки величезної кількості методик розташування та формування панкреатикоєюноанастомозу. Однак, висока частота формування ПФ після ПДР, яка відзначається в більшості клінік по всьому світу, у тому числі в великопотокових центрах хірургічної панкреатології, свідчить про те, що це питання ще далеке від остаточного рішення. Так само недостатньо ефективними є і методи медикаментозної профілактики ПФ. Цілком ймовірно, що існуюча думка про відмову від первинного формування панкреатикоєюноанастомозу на користь зовнішньої панкреатикостоми з відтермінованим формуванням панкреатокишкового анастомозу у пацієнтів з високим ризиком формування ПФ є єдино надійним інструментом профілактики даного ускладнення. Без сумніву, прецизійна техніка формування панкреатикоєюноанастомозу за типом duct-to-mucosa на ізольованій петлі тонкої кишки, а також застосування інгібіторів панкреатичної секреції в перед-, інтра- та післяопераційний період дозволяють знизити ризики формування ПФ у пацієнтів з помірним ризиком їх розвитку.
Сучасні дані свідчать про те, що саме формування панкреатичної нориці відповідає за розвиток інших важких, а в ряді випадків — фатальних специфічних ускладнень, у пацієнтів, які перенесли резекційні втручання на підшлунковій залозі, у тому числі післяопераційний гастростаз і пострезекційну кровотечу.
Більшість вітчизняних та зарубіжних авторів схиляються до того, що розвиток локального некрозу тканини підшлункової залози в зоні швів, а також пошкодження ацинарних панкреатичних структур під час формування співустя є причиною розвитку ПФ. Поширення запального процесу на навколишні тканини, у тому числі на зону гастроентероанастомозу, призводить до виникнення гастростазу, а безпосередній вплив панкреатичного секрету на судини може призводити до виникнення арозійної кровотечі в пізні терміни після операції (клас С, ISGPS, 2007) [6].
Розвиток клінічно значущої панкреатичної фістули (клас В і С, ISGPS, 2016) [5] вимагає тривалого дренування зони панкреатикоєюноанастомозу для відведення панкреатичного секрету, а в ряді випадків і виконання реінтервенцій, спрямованих на роз’єднання панкреатокишкового співустя, які закінчуються або формуванням зовнішньої панкреатикостоми, або екстирпацією кукси підшлункової залози (що особливо виправдано у разі розвитку арозійної кровотечі).
Розвиток гастростазу у пацієнтів з ПФ, які перенесли ПДР, цілком ймовірно, обумовлений, з одного боку, порушенням моторики верхніх відділів шлунково-кишкового тракту, а з іншого — вираженим локальним запаленням, яке в тому числі може призводити до розвитку анастомозита, що мало місце в вищеописаному випадку. При цьому дана проблема успішно вирішується тривалим назоінтестинальним зондуванням з призначенням збалансованого ентерального харчування через зонд. Однак раннє видалення зонда відповідно до критеріїв fast-track-хірургії або самостійне видалення зонда хворим (як в описаному вище спостереженні) в умовах розвитку анастомозиту не дозволяють в ряді ситуацій повторно встановити зонд для харчування в тонку кишку. У такому випадку загальноприйняті консервативні методи лікування післяопераційного гастростазу є або малоефективними, або зовсім неефективними.
Сучасні літературні дані свідчать про те, що променева терапія анастомозиту високоефективна. Механізм терапевтичної дії променевої терапії при анастомозиті полягає в усуненні спазму та набряку тканин в ділянці співустя, що призводить до відновлення прохідності його просвіту [8].
При лікуванні вогнищ запалення керуються правилом: чим гострішим і дифузнішим є перебіг процесу та чим раніше розпочато лікування, тим нижчими мають бути дози. За даними літератури, при гострих запальних процесах разова вогнищева доза становить 0,1–0,2 Гр, а СВД доводять до 0,3–0,6 Гр. Опромінення проводять кілька разів (зазвичай 3–4) з інтервалами між фракціями в стадії інфільтрації 1–2 дні, у стадії нагноєння 2–3 дні. При хронічному перебігу запалення разова вогнищева доза підвищується до 0,7–1,0 Гр з інтервалами 1–2 дні, а СВД, відповідно, до 2,5–3,0 Гр. Таким чином, тривалість курсу променевої терапії у разі анастомозиту зазвичай не перевищує 10 днів. Поле опромінення має бути значних розмірів.
Слід зазначити, що вказані дози опромінення дуже низькі в порівнянні з дозами, що застосовуються при пухлинах (в радіаційній онкології найчастіше разова доза становить 2–5 Гр, СВД 40–60 Гр), у зв’язку із цим будь-яких побічних явищ, що можуть бути спричинені променевою терапією, не відзначається.
Також необхідно зазначити, що лікування важкого гастростазу, особливо в умовах відсутності адекватного ентерального харчування, має враховувати постійну корекцію водно-електролітних порушень (проведену на базі моніторингу відповідних показників), а також збалансоване парентеральне харчування з урахуванням потреб в калоріях в умовах наявного катаболізму.
Розвиток кровотечі в ранній післяопераційний період (класи А і В, ISGPS, 2007) в більшості випадків вимагають виконання релапаротомії, оскільки є результатом зісковзування лігатури або недостатнього гемостазу під час первинного втручання. Тому в такій ситуації ендоваскулярні методи гемостазу неефективні. У той самий час при відстрочених пострезекційних кровотечах (клас С, ISGPS, 2007), які виникають внаслідок арозії судин в зоні хірургічного втручання на тлі функціонуючої ПФ, використання методик ендоваскулярного гемостазу є досить ефективним. У більшості спостережень їх застосування дозволяє домогтися остаточного гемостазу шляхом встановлення внутрішньосудинного стента або ендоваскулярної оклюзії пошкодженої судини. У разі ж масивної арозійної кровотечі використання методів рентгенендоваскулярної хірургії дозволяє знизити інтенсивність кровотечі та виграти час для виконання відкритого втручання, спрямованого на остаточний гемостаз (включаючи екстирпацію панкреатичної кукси). Також необхідно пам’ятати, що за наявності панкреатичної нориці маніфестувати кровотеча може не тільки виділенням крові по дренажу, а й у вигляді гострої шлунково-кишкової кровотечі, що мало місце в вищеописаному спостереженні. При цьому помилкова інтерпретація даних ендоскопічного дослідження призвела до затримки виконання рентгенендоваскулярного втручання у цієї пацієнтки більш ніж на 10 діб. І тільки немасивний характер кровотечі дозволив домогтися позитивного результату лікування.
Незважаючи на адекватну профілактику тромбоемболічних ускладнень у хворої з множинними факторами ризику (онкологічне захворювання, надлишкова маса тіла, цукровий діабет, тривалий період гіподинамії, гастростаз), призначення гемостатичних препаратів спричиняло розвиток тромбозів внутрішньої яремної вени та вен нижніх кінцівок. У свою чергу призначення антикоагулянтів обумовлювало рецидиви арозійної кровотечі. У такій ситуації підтримання необхідного балансу згортальної/протизгортальної системи крові є складним завданням для клініциста, рішення якої, безсумнівно, вимагає постійного контролю концентрації факторів згортання крові, що є проблематичним навіть в умовах високоспеціалізованого стаціонару.
Висновки
Таким чином, незважаючи на тривалу історію розвитку резекційної хірургії підшлункової залози, проблема ПФ так і залишилася невирішеною. Рішення про формування панкреатикоєноанастомозу має прийматися строго індивідуально з урахуванням факторів ризику. Під час формування цього співустя потрібно використовувати всі наявні в арсеналі засоби хірургічної та медикаментозної профілактики розвитку ПФ. У резекційній хірургії підшлункової залози, мабуть, як у жодній іншій галузі хірургії, з обережністю слід ставитися до принципів fast-track (особливо до раннього видалення дренажів та назоінтестінального зонда). ПФ є потенційно смертельним ускладненням, яке може індукувати розвиток інших важких специфічних ускладнень, тому потрібне ретельне спостереження за хворим з метою раннього виявлення та корекції можливих ускладнень.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів.
Список використаної літератури
1. Кригер, А. Г., Горин, Д. С., Калдаров, А. Р., Паклина, О. В., Раевская, М. Б., Берелавичус, С. В., … Смирнов, А. В. (2016). Методологические аспекты и результаты панкреатодуоденальной резекции. Онкология. Журнал им. П.А. Герцена, 5: 15–21. doi: 10.17116/onkolog20165515-21.
2. Горин, Д. С., Кригер, А. Г., Галкин, Г. В., Калинин, Д. В., Глотов, А. В., Калдаров, А. Р., … Берелавичус, С. В. (2020). Прогнозирование возникновения панкреатического свища после панкреатодуоденальной резекции. Хирургия. Журнал им. Н.И. Пирогова, 7: 61–67. doi:10.17116/hirurgia202007161.
3. Pedrazzoli, S. (2017). Pancreatoduodenectomy (PD) and postoperative pancreatic fistula (POPF): A systematic review and analysis of the POPF-related mortality rate in 60, 739 patients retrieved from the English literature published between 1990 and 2015. Medicine (Baltimore), 96(19): e6858. doi:10.1097/MD.0000000000006858.
4. Michels, N. A. (1955). Blood supply and anatomy of the upper abdominal organs with a descriptive atlas. Philadelphia : JB Lippincott Co.
5. Bassi, C., Marchegiani, G., Dervenis, C., Sarr, M., Abu Hilal, M., Adham, M., …, Buchler, M. (2017). The 2016 update of the International Study Group (ISGPS) definition and grading of postoperative pancreatic fistula: 11 Years After. Surgery, 161(3): 584–591. doi: 10.1016/j.surg.2016.11.014.
6. Wente, M. N., Veit, J. A., Bassi, C., Dervenis, C., Fingerhut, A., Gouma, D. J., Izbicki, J. R., …, Büchler, M. W. (2007). Postpancreatectomy hemorrhage (PPH): an International Study Group of Pancreatic Surgery (ISGPS) definition. Surgery, 142(1): 2–5. doi: 10.1016/j.surg.2007.02.001.
7. Wente, M. N., Bassi, C., Dervenis, C., Fingerhut, A., Gouma, D. J., Izbicki, J. R., Neoptolemos, J. P., …, Büchler, M. W. (2007). Delayed gastric emptying (DGE) after pancreatic surgery: a suggested definition by the International Study Group of Pancreatic Surgery (ISGPS). Surgery, 142(5): 761–8. doi: 10.1016/j.surg.2007.05.005.
8. Кукош, М. Ю. (2012). Роль лимфостимуляции и лучевой терапии в комплексной лечении анастомозитов. (Диссертация кандидата медицинских наук). Московский государственный медико-стоматологический университет, Москва.
Адреса:
Мушенко Євгеній Володимирович
61100, м. Харків, вул. Танкопія, 8, кв. 159
E-mail: dr.mushenko@gmail.com
Сorrespondence:
Eugene Mushenko
apt. 159, 8 Tankopia Str., Kharkiv 61100
E-mail: dr.mushenko@gmail.com














Leave a comment