Роль високодозової хіміотерапії в комплексному лікуванні дітей зі злоякісними солідними новоутвореннями
Іонкіна Н.І., Сітько В.В, Шайда Е.В., Свергун Н.М., Скачкова О.В., Ожиганов О.О. , Іжовський О.Й., Ніколаєва О.В., Стежка М.О., Білоконь О.В., Лузан Т.О. , Климнюк Г.І., Павлик С.В.
Резюме. Завдяки застосуванню високодозової хіміотерапії (ВХТ) з підтримкою аутологічними гемопоетичними стовбуровими клітинами (ГСК) відсоток виліковування при злоякісних пухлинах у дітей групи високого ризику значно збільшився. Застосування підтримки кровотворення аутологічних ГСК у дітей вже стало стандартом у багатьох лікувальних програмах, кількість аутотрансплантацій в світі постійно зростає. З 2004 по 20011 рр. у відділенні дитячої онкології Національного інституту раку проведено 39 курсів ВХТ з трансплантацією стовбурових клітин периферичної крові (СКПК) у 39 пацієнтів із солідними злоякісними новоутвореннями. Серед них 25 хворих з нейробластомою високого ризику, 10 — із саркомою Юїнга, 3 — із пухлиною Вільмса, 1 — з метастатичною формою тератобластоми. Дану методику застосовували для консолідації досягнутої ремісії у хворих, які показали хорошу відповідь на індукційний курс хіміотерапії. Результати дослідження: 24 (61,5%) пацієнти з 39, які отримували ВХТ з трансплантацією СКПК в даний час живі: 20 (51,3%) із них знаходяться в повній ремісії, а 4 (10,2% ) — продовжують лікування рецидиву. 2 (5%) хворих померли в ранні терміни після трансплантації від інфекційних ускладнень в період мієлоаплазії. Введення в стандарти лікування ВХТ з трансплантацією СКПК в 1-шу лінію терапії при лікуванні нейробластоми і саркоми Юїнга високого ризику дозволило досягти рівня 5-річної безрецидивної виживаності: при нейробластомі — 42%, а при саркомі Юїнга — 32%, що відповідає або наближається до показників передових клінік світу.

Вступ
Застосування підтримки кровотворення аутологічними гемопоетичними стовбуровими клітинами (ГСК) у дітей уже стало стандартом у багатьох лікувальних програмах, кількість аутотрансплантацій у світі постійно росте [11, 12, 15]. Завдяки застосуванню високодозової хіміотерапії (ВХТ) з підтримкою аутологічними ГСК відсоток виліковування при злоякісних пухлинах у дітей групи високого ризику значно підвищився і становить при герміногенних пухлинах 58–85%, нефробластомі — 50–60%, нейробластомі IV стадії — 40%, саркомі Юїнга — 40–50% [1, 4, 10, 16].
ВХТ із трансплантацією ГСК у дітей зі злоякісними солідними новоутвореннями можна застосовувати у таких випадках (згідно з рекомендаціями Міжнародної спілки дитячих онкологів):
- саркома Юїнга: при IV стадії захворювання, при незадовільній відповіді на лікування або при виникненні рецидиву [2, 13];
- нейробластома: при IV стадії у дітей віком старших 1 року, при будь-якій стадії захворювання за наявності n-myc ампліфікації [17, 18];
- нефробластома: при несприятливому гістологічному варіанті пухлини, при виникненні рецидиву захворювання чи прогресуванні на фоні лікування [5];
- герміногенні пухлини: при незадовільній відповіді на лікування, при виникненні рецидиву захворювання [3, 10];
- пухлини головного та спинного мозку: метастатична форма чи рецидив медулобластоми (вік до 3 років) [14];
- ретинобластома: при нерезектабельній формі захворювання, IV стадії захворювання [6].
Слід відмітити, що питання про місце ВХТ з аутологічною трансплантацією стовбурових клітин у лікуванні злоякісних солідних новоутворень у дітей все ще не визначено остаточно, однак більшість лікувальних програм застосовують цю стратегію для консолідації досягнутої ремісії у пацієнтів групи високого ризику.
Доведеним стандартом застосування ВХТ з трансплантацією стовбурових клітин периферичної крові (СКПК) у 1-й лінії є лікування нейробластоми високого ризику, саркоми Юїнга високого ризику, метастатичної форми медулобластоми/примітивної нейроектодермальної пухлини головного мозку у дітей до 4 років.
Матеріали та методи
З 2004 по 20011 рр. у відділенні дитячої онкології Національного інституту раку проведено 39 курсів ВХТ з трансплантацією СКПК у 39 пацієнтів із солідними злоякісними новоутвореннями. Серед них 25 хворих з нейробластомою високого ризику, 10 — із саркомою Юїнга, 3 — із пухлиною Вільмса, 1 — із метастатичною формою тератобластоми.
Вік пацієнтів становив від 18 міс до 19 років (медіана — 5,5 року), середня маса — 35,4 кг (9–102 кг).
Дану методику застосовували для консолідації досягнутої ремісії у хворих, що показали хорошу відповідь на індукційний курс хіміотерапії (повна ремісія чи дуже добра часткова відповідь).
Стовбурові клітини отримували шляхом апаратного лейкоцитаферезу на апараті «Fresenius AS-104», «AS-204». За сеанс проводили обробку 2–4 об’ємів циркулюючої крові пацієнта.
Після обробки заготовлені стовбурові клітини зберігали у низькотемпературному холодильнику при температурі -80 °С. В якості кріопротектора застосовували розчин диметилсульфоксиду (ДМСО). Життєздатність лейкоцитів перевіряли після кріоконсервування та безпосередньо перед введенням за методикою із трепановим синім із застосуванням світлової мікроскопії або цитофлюориметрично в прямій реакції імунофлюорисценції за протоколом ISHAGE, розробленим CD34 Haematopoietic Stem Cell Working Party для цілей трансплантації кровотворної тканини.
Основним режимом кондиціонування (ВХТ) як для пацієнтів із нейробластомою, так і з саркомою Юїнга був режим «BuMel» (бусульфан -7; -6; -5; -4; -3 у день 1 мг/кг/введення перорально кожні 6 годин 16 введень, мелфалан-2 140 мг/м у день внутрішньовенно), оскільки він, за даними літератури, показав найбільшу ефективність при цих патологіях [7, 8]. Цей режим застосовувався у 30 дітей. У 7 хворих застосовувався режим «МЕС» (мелфалан, етопозид, карбоплатина) [9]: 3 дитини з нейробластомою, 3 пацієнти з нефробластомою і 1 хворий з саркомою Юїнга. У 1 пацієнта із рецидивом саркоми Юїнга, беручи до уваги проведену раніше променеву терапію і неможливість застосувати бусульфан, було проведено режим «МЕ» (мелфалан, етопозид). У дитини із злоякісною герміногенною пухлиною було проведено ВХТ найбільш ефективним режимом для цієї нозології — карбоплатина, етопозид (таблиця).
Для попередження цитотоксичної дії цитостатика на ГСК реінфузію СКПК пацієнтам проводили через 24–48 год після закінчення курсу ВХТ. Перед введенням заготовлених клітин проводили премедикацію, що включала: гіпергідратацію тривалістю 2–3 год, седативні та десенсибілізуючі засоби у вікових дозах.
Таблиця Види ВХТ, які застосовували для кондиціонування
| Діагноз | Види хіміотерапії | |||
|---|---|---|---|---|
| «BuMel» | «МЕС» | «МЕ» | «Carbo/Etop» | |
| Нейробластома | 22 | 3 | ||
| Саркома Юїнга | 8 | 1 | 1 | |
| Нефробластома | 3 | |||
| Тератобластома | 1 | |||
| Всього | 30 | 7 | 1 | 1 |
Ведення хворих у період аплазії кісткового мозку під час приживлення трансплантату проводили згідно з рекомендаціями ЕВМТ (Европейська група з трансплантації крові і кісткового мозку).
Пацієнтам дозволялося залишати стерильний бокс після досягнення стабільного лейкоцитарного енграфту (нейтрофіли > 1×10/мл протягом 3 наступних днів) за відсутності ознак інфекційного процесу, відміни антибіотиків. Виписували зі стаціонару після досягнення стабільного тромбоцитарного енграфту (тромбоцити > 30×10/мл без переливань донорських тромбоцитів > 7 днів) та за відсутності геморагічних проявів.
Для оцінки віддалених результатів лікування використовували метод Каплан — Майєра.
Результати дослідження
24 (61,5%) пацієнти із 39, що отримували ВХТ з трансплантацією СКПК в даний час живі: 20 (51,3%) із них знаходяться у повній ремісії, а 4 (10,2%) — продовжують лікування рецидиву. 2 (5%) хворих померли у ранні терміни після трансплантації від інфекційних ускладнень у період мієлоаплазії. Термін спостереження становить 1–70 міс.
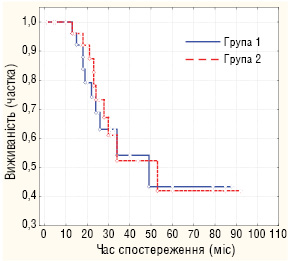
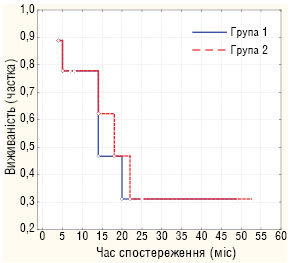
Із 25 пацієнтів з нейробластомою на даний час живі 17 (68%). У повній ремісії знаходяться 13 (52%) хворих, а 4 (16%) дитини продовжують лікування з приводу рецидиву захворювання (рис. 1). Із 10 пацієнтів із саркомою Юїнга високого ризику після трансплантації живі 4 (40%) (рис. 2). Із 3 хворих з нефробластомою, що отримували для консолідації досягнутої ремісії високодозову поліхіміотерапію, живі 2 (66,7%). Пацієнт з тератобластомою живий протягом 2,5 року після трансплантації. Тривалість спостереження становить 1–70 міс.
Висновки
Введення у стандарти лікування ВХТ з трансплантацією СКПК у першу лінію терапії при лікуванні нейробластоми та саркоми Юїнга високого ризику дозволило досягти рівня 5-річної безрецидивної виживаності при нейробластомі — 42%, а при саркомі Юїнга — 32%, що відповідає чи наближається до показників передових клінік світу.
Література
1. Румянцев А.Г., Масчан А.А. (2003) Трансплантация гемопоэтических стволовых клеток у детей: руководство для врачей. М.: Мед. информ. агентство, 657–662.
2. Aleinikova O.V., Strongin I.S., Pochetukhin K.V. (2002) High-dose chemotherapy with autologous bone marrow transplantation in children with high-risk malignant neoformations. Vopr. Onkol., 3(48): 327–330.
3. Hara I., Mijake H., Yamada Y. et al. (2006) Feasibility and usefulness of high-dose chemotherapy (high-dose ifosfamide, carboplatin and etoposide) combined with peripheral blood stem cell transplantation for male germ cell tumor: a single-institute experience. Anticancer Drags., 9(17): 1057–1066.
4. Tienghi A., Giovanis P., Rosti G. et al. (2003) High-dose busulphan-alkeran with PBSC support in relapsed Ewing’s sarcoma/PNET in young adults. Bone Marrow Transplant., 31(1): 273.
5. Kremens B., Gruhn B., Klingebiel T. et al. (2002) High-dose chemotherapy with autologous stem cell rescue in children with nephroblastoma. Bone Marrow Transplant., 12(30): 893–898.
6. Kremens B., Wieland R. et al. (2003) High-dose chemotherapy with autologous stem cell rescue in children with retinoblastoma. Bone Marrow Transplant., 31: 281–284.
7. Zaucha-Prazmo A., Drabko K., Wojcik B. et al. (2006) High-dose therapy followed by auto HSCT in children with advanced neuroblastoma in four transplant canters in Poland. Med. Wieku Rozwoj., 3(10): 775–784.
8. Tienghi A., Giovanis P., Rosti G. et al. (2003) High-dose busulphan-alkeran with PBSC support in relapsed Ewing’s sarcoma/PNET in young adults. Bone Marrow Transplant., 31(1): 273.
9. Kremens B., Gruhn B., Klingebiel T. et al. (2002) High-dose chemotherapy with autologous stem cell rescue in children with nephroblastoma. Bone Marrow Transplant., 12(30): 893–898.
10. Miki T., Mizutani Y., Akaza H. et al. (2007) Long-term results of first-line sequential high-dose carboplatin, etoposide and ifosfamide chemotherapy with peripheral blood stem cell support for patients with advanced testicular germ cell tumor. Int. J. Urol., 1(14): 54–59.
11. Lanzkowsky P. (2005) Manual of pediatric hematology and oncology, 4 ed. — Burlington, 835 p.
12. Ledenstein R., Poetschger U., Hartmann O. et al. (2004) Megatherapy/SCT activity in pediatric solid tumors in Europe. Bone Marrow Transplant., . 33(1): 285
13. Drabko K., Zawitkowska-Klaczynska J., Wojcik B. et al. (2005) Megachemotherapy followed by autologous stem cell transplantation in children with Ewing’s sarcoma. Pediat. Transplant., 5(9): 618–621.
14. Drabko K., Wisniewska-Slusarz H., Wojcik B. et al. (2005) Megachemotherapy followed by autologous stem cell transplantation in children with high-risk CNS tumors. Med. Wieku Rozwoj., 9: 439–447.
15. Pinkerton C.R., Plowman P.N. (2005) Pediatric Oncology, 4 ed. Cambridge: University Press, 799 p.
16. Caldas G., Lacerda A.F., Neto A. et al. (2004) Survival of children with high-risk neuroblastoma after conventional treatment followed by high-dose chemotherapy and autologous stem cell transplantation. Bone Marrow Transplant., 33(1): 834.
17. Topotecan combined with myeloablative doses of thiotepa and carboplatin for neuroblastoma, brain tumors, and other poor-risk solid tumors in children and young adults. (2001) Bone Marrow Transplant., 6(28): 551–556.
18. Matthay K.K., Villanca J.G., Seeger R.C. et al. (1999) Treatment of high-risk neuroblastoma with intensive chemotherapy, autologus bone marrow transplantation, and 13-cis-retinoid acid. Children’s Cancer Group. N. Engl. J. Med., 341: 1165–1173.
Роль высокодозной химиотерапии в комплексном лечении детей со злокачественными солидными новообразованиями
Национальный институт рака, Киев
Резюме. Благодаря применению ВХТ с поддержкой аутологичными ГСК процент излечения при злокачественных опухолях у детей группы высокого риска значительно увеличился. Применение поддержки кроветворения аутологичными ГСК у детей уже стало стандартом во многих лечебных программах, количество аутотрансплантаций в мире постоянно растет. С 2004 по 20011 гг. в отделении детской онкологии Национального института рака проведено 39 курсов ВХТ с трансплантацией СКПК в 39 пациентов с солидными злокачественными новообразованиями. Среди них 25 больных с нейробластомой высокого риска, 10 — с саркомой Юинга, 3 — с опухолью Вильмса, 1 — с метастатической формой тератобластомы. Данную методику применяли для консолидации достигнутой ремиссии у больных, которые показали хороший ответ на индукционный курс химиотерапии. Результаты исследования: 24 (61,5%) пациента из 39, получавших ВХТ с трансплантацией СКПК в настоящее время живы: 20 (51,3%) из них находятся в полной ремиссии, а 4 (10,2%) — продолжают лечение рецидива. 2 (5%) больных умерли в ранние сроки после трансплантации от инфекционных осложнений в период миелоапплазии. Введение в стандарты лечения ВХТ с трансплантацией СКПК в 1-ю линию терапии при лечении нейробластомы и саркомы Юинга высокого риска позволило достичь уровня 5-летней безрецидивной выживаемости: при нейробластоме — 42%, а при саркоме Юинга — 32%, что соответствует или приближается к показателям передовых клиник мира.
солидные новообразования у детей, высокодозная химиотерапия, стволовые клетки периферической крови.














Leave a comment