Первинно-множинні пухлини. Синхронна неходжкінська лімфома з клітин зони мантії та аденокарцинома шлунка. Клінічний випадок
Крячок І.А.1, Шудрак Н.А.1, Степанішина Я.А.1, Антонюк С.О.2, Шудрак Є.А.1
Резюме. Лімфома з клітин мантії — це В-клітинна лімфома, як правило, з агресивним перебігом, характеризується ураженням лімфатичних вузлів, селезінки, кісткового мозку, оболонок головного мозку і шлунково-кишкового тракту. Аденокарцинома (залозистий рак) — злоякісне новоутворення, яке розвивається із залозистих (секреторних) клітин слизової оболонки шлунка. У даній статті представлено клінічний випадок первинно-множинного, синхронного злоякісного новоутворення — В-клітинної лімфоми з клітин зони мантії з ураженням шлунка та аденокарциномою шлунка.
Одержано: 12.11.2020
Прийнято до друку: 25.11.2020
DOI: 10.32471/clinicaloncology.2663-466X.39-3.27442
Первинно-множинні новоутворення, особливо синхронне виникнення неходжкінської лімфоми з клітин зони мантії — мантійноклітинної лімфоми (МКЛ) та раку шлунка у одного пацієнта — достатньо рідкісний стан, що ще не був описаний в українській науковій літературі. Лімфома з клітин зони мантії (з мантійних клітин) — це варіант В-клітинної лімфоми, що характеризується агресивним перебігом та поганим прогнозом.
У Західній Європі, Скандинавії та США частота МКЛ варіює від 0,5 до 0,7 випадку на 100 000 населення, крім того, у людей старших за 65 років захворюваність зростає до 3,9 випадку на 100 000. Загальна виживаність хворих із цим діагнозом становить 3–5 років з моменту виявлення захворювання. МКЛ становить 2,5–7% випадків серед усіх неходжкінських лімфом і характеризується ураженням окремих лімфатичних вузлів, селезінки, кісткового мозку, оболонок головного мозку, також приблизно у 30% випадків — шлунково-кишкового тракту [1]. У зв’язку із цим до переліку обов’язкових обстежень хворих з встановленим діагнозом МКЛ перед початком спеціальної терапії входить гастроскопія та колоноскопія. Незважаючи на останні досягнення в терапії, МКЛ залишається невиліковним захворюванням, а пацієнти з групи високого ризику за Міжнародним прогностичним індексом для МКЛ мають вкрай незадовільний прогноз.
Рак шлунка є найчастішою нозологічною формою в структурі смертності після раку легені та становить 9% усіх випадків серед злоякісних захворювань в Україні [2–3]. Стратегії лікування цього захворювання різні та залежать від симптомів та об’єктивного статусу пацієнта.
Аденокарцинома шлунка (АК) становить 90% усіх злоякісних захворювань шлунка. Абсолютна кількість хворих на рак шлунка збільшується у зв’язку зі старінням населення. Постійно триває пошук нових діагностичних маркерів, які можуть допомогти діагностувати рак шлунка на ранніх стадіях, та нових терапевтичних схем, які б були більш ефективними порівняно з тими, що вже існують [4–5].
Отже, МКЛ як і АК шлунка — агресивні злоякісні захворювання, за яких підхід до лікування все ще залишається незадовільним. У подальшому необхідно докласти більше зусиль для розуміння виникнення синхронних злоякісних процесів, особливостей їх діагностики та ефективного лікування. Відносно добре відомі причини виникнення первинних новоутворень, але одночасна поява злоякісних пухлин різних гістологічних типів відмічають рідко, зокрема, синхронний прояв МКЛ та АК шлунка [6–9].
З огляду на рідкісність виникнення синхронних пухлинних процесів, а саме лімфоми з ураженням шлунка та АК аналогічної локалізації, відсутність стандартних лікувальних опцій та стратегії підходів до терапії таких станів, висвітлення даної проблеми з представленням клінічного випадку є актуальним.
Клінічний випадок
68-річному чоловіку у лютому 2019 р. було встановлено діагноз лімфоми з клітин зони мантії. Пацієнт скаржився на втрату маси тіла (>12 кг за останні 6 міс), наявність збільшених лімфатичних вузлів шиї та новоутворення в області носоглотки. Діагноз було встановлено на підставі гістологічного та імуногістохімічного досліджень (лютий 2019 р.), біопсії утворення носоглотки: пухлинні клітини були CD20- (рис. 1); BCL2- (рис. 2); CD5- (рис. 3); Cyclin D1-позитивними (рис. 4); експресія CD23 визначалася в дрібних залишках сітки фолікулярних дендритних клітин, маркер Ki-67 (рис. 5) був позитивний у 80% пухлинних клітин.
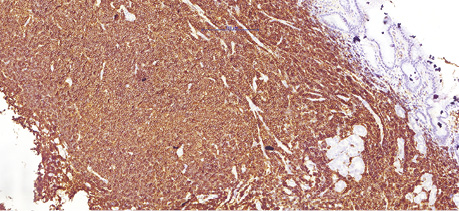
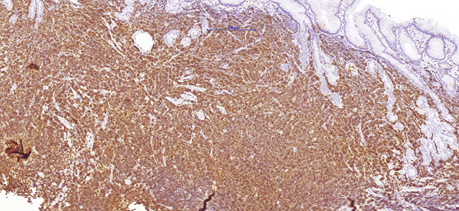
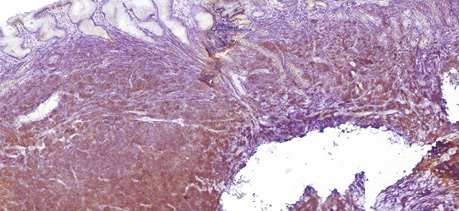
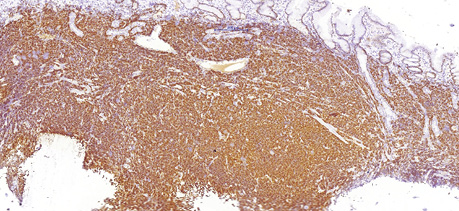
Під час дообстеження за результатами комп’ютерної томографії шиї, органів грудної клітки, органів черевної порожнини та малого таза у пацієнта виявлено множинне ураження лімфатичних вузлів шиї, середостіння, черевної порожнини та заочеревинного простору, носоглотки та ураження шлунка (потовщення стінки до 20 мм). За результатами цитологічного дослідження кісткового мозку (лютий 2019 р.) ураження не виявлено.
Важливо зазначити, що перед початком спеціальної терапії за місцем проживання пацієнту не було проведено повноцінне обстеження (не проведено езофагофіброгастродуоденоскопію (ЕФГДС) з біопсією шлунка).
Згідно з даними клініко-лабораторних досліджень значущих змін у загальному аналізі крові, сечі, біохімічних показниках і коагулограми не виявлено.
Пацієнт отримав 3 курси імунохіміотерапії за схемою RB (ритуксимаб + бендамустин) за місцем проживання. Згідно з проміжною оцінкою відповіді на лікування, за даними комп’ютерної томографії (квітень 2019 р.) досягнуто часткової морфологічної відповіді на лікування — визначалося резидуальне потовщення стінки кардіального відділу шлунка (критерії Cheson, 2008).
Однак після завершення 6-го курсу лікування виявлено позитивне накопичення фтордезоксиглюкози в шлунку та появу раніше не визначених вогнищ у печінці згідно з даними позитронно-емісійної комп’ютерної томографії (листопад 2019 р.), на підставі чого визначено прогресування захворювання. У березні 2020 р. пацієнт звернувся до Національного інституту раку з метою дообстеження та визначення подальшої тактики лікування. З огляду на статус захворювання пацієнту було рекомендовано розпочати курс поліхіміотерапії 2-ї лінії після проведення дообстеження. Під час проведення ЕФГДС у ділянці кардіального жому виявлено інфільтрацію слизової оболонки з виразкуванням, у нижній третині шлунка по великій кривизні виявлено виразковий дефект до 3 см, взято множинну біопсію утворення шлунка. Згідно з даними імуногістохімічного дослідження (березень 2020 р.) у матеріалі біопсії виявлено, що гістологічна картина та імунофенотип пухлинних клітин характерні для низькодиференційованої тубулярної АК шлунка (G3), з ураженням тіла, дистального відділу шлунка та великої кривизни (загальні цитокератини в клітинах пухлини (DACO, клон АЕ1/АЕ3) були позитивними, також позитивною була реакція в клітинах типу малих лімфоцитів, маркер Кі-67 був позитивним у 70% пухлинних клітин, відсутня експресія онкопротеїну с-erbB-2 (HER2/neu) та CD45). Згідно з даними гістологічного та імуногістохімічного дослідження біоптату ділянки кардіального жому встановлено, що імунофенотип клітин характерний для лімфоми з клітин мантійної зони (пухлинні клітини були CD20-, BCL2-, CD5-, Cyclin D1-позитивними; Ki-67-позитивними на 85% та CD23-позитивними в дрібних залишках сітки фолікулярних дендритних клітин) [5, 10]. Гістологічний матеріал було направлено в референтну лабораторію з метою перегляду гістологічного матеріалу, де було підтверджено наявність у одного пацієнта 2 варіантів злоякісних захворювань.
Під час дообстеження хворого турбувала виражена загальна слабкість, дискомфорт в епігастральній ділянці та поява випорожнень чорного кольору — клініки шлунково-кишкової кровотечі. Було проведено консервативну гемостатичну терапію, на фоні якої кровотечу було зупинено. Було рекомендовано терміново розпочати спеціальне лікування, курс поліхіміотерапії за схемою R-DHAP (ритуксимаб, дексаметазон, високодозовий цитарабін, цисплатин). Усього пацієнт отримав 2 курси спеціального лікування. Паралельно проведено біопсію новоутворення печінки з метою встановлення заключного діагнозу. Згідно з даними патогістологічного дослідження біоптату печінки (червень 2020 р.) встановлена низькодиференційована карцинома метастатичного походження. У зв’язку з цим пацієнту було розпочато монохіміотерапію капецитабіном. Враховуючи метастатичне поширення раку шлунка оперативне лікування пацієнту не було показане.
Після завершення 2-го курсу поліхіміотерапії за схемою R-DHAP було проведено повторну гастроскопію шлунку, під час якої виявлено інфільтрацію слизової оболонки, набряк та крововиливи, починаючи з верхньої третини тіла шлунка до пілоричного відділу. Також було взято біопсію (множинні фрагменти з усіх відділів шлунка). Згідно з даними імуногістохімічного дослідження в матеріалі біопсії визначається низькодиференційована АК шлунка, ознак ураження слизової оболонки шлунка лімфомою не було виявлено. За даними контрольної комп’ютерної томографії, в ділянці великої кривизни шлунка виявлено потовщену стінку (15–18 мм), у печінці виявлено множинні метастази (збільшення розмірів та кількості вогнищ у печінці).
Отже, на фоні проведеного лікування досягнуто відповідь на терапію МКЛ, проте зафіксовано прогресування АК шлунка. Пацієнта направлено до онколога з метою подальшого скринінгу та терапії АК шлунка.
Обговорення
На сьогодні опубліковано багато повідомлень про множинні карциноми шлунка, однак публікації про поєднане ураження АК та злоякісною лімфомою є досить рідкісними. Особливо вичерпною є інформація про синхронне ураження шлунка АК та МКЛ, висвітлена в Yong I and Min Young Koo (2007), де повідомлялось про випадок синхронного ураження шлунка АК та МКЛ [11]. Існують також малочисельні повідомлення у західних країнах про декілька випадків синхронної АК та МКЛ товстої кишки [12–13].
Середній вік пацієнтів, у котрих діагностують МКЛ становить 54–68 років, а співвідношення чоловіків і жінок — 2–3:1. У близько 95% пацієнтів захворювання діагностують на пізніх стадіях. У пацієнта, історію хвороби якого нами було проаналізовано, вік, стать та стадія були аналогічними до даних хворих, представлених у багатьох публікаціях. Симптоми та ознаки ураження шлунково-кишкового тракту при МКЛ неспецифічні та включають біль в животі, діарею, нудоту, блювання, втрату маси тіла та втому. Ураження шлунково-кишкового тракту можуть спостерігатися у 10–30% пацієнтів [8]. Ураження верхніх відділів шлунково-кишкового тракту відмічають частіше, ніж дистальних відділів із залученням товстої кишки. Екстранодальні ураження виявляють приблизно в 90% випадків МКЛ. Отже, під час проведення повного обстеження хворого з виконанням ЕФГДС та фіброколоноскопії частіше виявляють пізню стадію захворювання (III або IV стадія за Ann-Arbor). B-симптоми наявні менш ніж у 50% хворих на МКЛ [14].
Діагностика МКЛ може бути більш точною завдяки прогресу в технологіях імунології та молекулярної генетики. Міжнародна група з дослідження лімфом (International Lymphoma Study Group — ILSG) опублікувала Переглянуту європейсько-американську класифікацію лімфопроліферативних захворювань, що інтегрує всю морфологічну, імунологічну, генетичну та молекулярну біологічну інформацію. Таким чином, МКЛ було віднесено до одного з незалежних підтипів серед 11 периферичних В-клітинних лімфом [15]. Диференційна діагностика даного варіанту захворювання від інших лімфом лише за морфологічними ознаками є складною. МКЛ характеризується позитивною експресією CD5, CD19, CD20, CD22, CD79a та циклін-D1 та, як правило, негативною CD10 та CD23 [16–18]. Маркер CD5 особливо корисний при диференціальній діагностиці з фолікулярною лімфомою. Позитивна експресія CD5 спостерігається як при МКЛ, так і при лімфомах з малих лімфоцитів. Відсутність експресії CD5 характерна також для фолікулярної лімфоми. Найціннішим маркером для діагностики МКЛ є циклін-D1. Високий рівень експресії цикліну-D1 вказує на перегрупування гена bcl-1, чим пояснюється виникнення транслокації t (11;14) у 70% випадків [17–20].
У нашому випадку імуногістохімічне дослідження показало позитивну експресію CD5, CD20 і циклін-D1 на пухлинних клітинах.
У пацієнтів із синхронною лімфомою та карциномою 2 новоутворення зазвичай розташовані в окремих органах або структурах. Цікаво, що в нашому випадку у пацієнта новоутворення були локалізовані в різних відділах шлунка: лімфома була виявлена в ділянці кардіального жому, а АК — в ділянці тіла шлунку.
Важливими клінічними прогностичними факторами при МКЛ є статус за шкалою Східної об’єднаної онкологічної групи (Eastern Cooperative Oncology Group — ECOG), клінічна стадія, спленомегалія, анемія, ураження кісткового мозку та периферичної крові, мітотичний індекс >2,5, мутації p53, підвищений рівень лактатдегідрогенази та вік [21]. У нашому випадку були такі фактори ризику, як пізня клінічна стадія та підвищений рівень лактатдегідрогенази. Однак прогноз для пацієнтів із синхронною АК шлунка та МКЛ ще не з’ясований у зв’язку з відсутністю значної кількості спостережень.
Аналізуючи наведений клінічний випадок, важливо підкреслити необхідність проведення біопсії місць ураження шлунка до призначення спеціальної терапії з приводу МКЛ, з метою встановлення типу ураження даного органа, а також виявлення синхронного процесу. Зважаючи на те, що даному пацієнту не було проведено біопсію шлунка вчасно, на момент виявлення синхронного процесу призначення радикального лікування щодо АК не було доцільним у зв’язку з наявністю метастазів у печінці.
Синхронний розвиток двох злоякісних процесів є однією з найскладніших проблем діагностики та лікування в онкології. Оскільки як для МКЛ, так і для АК шлунка типові ендоскопічні знахідки відсутні, карцинома може неправильно трактуватися, наприклад, як мультифокальна лімфома, враховуючи їх макроскопічну схожість. Тому пацієнтів слід ретельно обстежувати з виконанням ендоскопії та біопсії уражених ділянок.
Результати лікування синхронних пухлин все ще залишаються незадовільними, тому необхідні подальші дослідження та розробка нової стратегії обстеження та лікування для поліпшення результатів терапії у разі таких процесів.
Список використаної літератури
1. Inamdar, A. A., Goy, A., Ayoub, N. M., Attia, C., Oton, L., Taruvai, V., … Suh, S. K. (2016). Mantle cell lymphoma in the era of precision medicine-diagnosis, biomarkers and therapeutic agents. Oncotarget, 7(30), 48692–48731. doi: 10.18632/oncotarget.8961.
2. Статистика онкологічних захворювань в Україні. Retrieved from: https://uozter.gov.ua/ua/news-1-0-223.
3. Федоренко, З. П., Гулак, Л. О., Михайлович, Ю. Й., Горох, Є. Л., Рижов, А. Ю., Сумкіна, О. В., & Куценко, Л. Б. (2020). Рак в Україні, 2018–2019. Захворюваність, смертність, показники діяльності онкологічної служби /гол. ред. О.О. Колеснік. Бюлетень Національного канцер-реєстру України, 21, 101.
4. Ellison-Loschmann, L., Sporle, A., Corbin, M., Cheng, S., Harawira, P., Gray, M., … Pearce, N. (2017). Risk of stomach cancer in Aotearoa/New Zealand: A Māori population based case-control study. Journal Plose One, 12(7), e0181581. doi: 10.1371/journal.pone.0181581.
5. Diakos, C. I., Charles, K. A., McMillan, D. C., & Clarke, S. J. (2014). Cancerrelated inflammation and treatment effectiveness. Lancet Oncology. 15, e493-503. doi: 10.1016/S1470-2045(14)70263-3.
6. Campo, E., Raffeld, M., & Jaffe, E. S. (1999). Mantle-cell lymphoma. Seminars in Hematology, 36(2),115-127.
7. Meusers, P., Hense., J, & Brittinger, G. (1997). Mantle cell lymphoma: diagnostic criteria, clinical aspects and therapeutic problems. Leukemia, 11(2), 60–64.
8. Romaguera, J. E., Medeiros, L. J., Hagemeister, F. B., Fayad, L. E., Rodriguez, M. A., Pro, B., … Cabanillas, F. (2003). Frequency of gastrointestinal involvement and its clinical significance in mantle cell lymphoma. Cancer, 97(3), 586–591. doi: 10.1002/cncr.11096.
9. Bertoni, F., Zucca, E., & Cotter, F. E. (2004). Molecular basis of mantle cell lymphoma. British Journal of Haematology, 124, 130–140. doi: 10.1182/blood-2010-04-189977.
10. Gao, J., Peterson, L., Nelson, B., Goolsby, C., & Chen, Y.H. (2009). Immunophenotypic variations in mantle cell lymphoma. American Journal of Clinical Pathology, 132, 699–706. doi: 10.1309/AJCPV8LN5ENMZOVY.
11. Yong, I. & Min, Young, Koo (2007). Synchronous Adenocarcinoma and Mantle Cell Lymphoma of the Stomach. Yonsei Medical Journal, 48(6), 1061–1065. doi: 10.3349/ymj.2007.48.6.1061.
12. Kanehira, K., Braylan, R. C., & Lauwers, G. Y. (2001). Early phase of intestinal mantle cell lymphoma: a report of two cases associated with advanced colonic adenocarcinoma. Journal of Medical Case Reports, 14(8), 811–817. doi: 10.1038/modpathol.3880395.
13. Padmanabhan, V., & Trainer, T. D. (2003). Synchronous adenocarcinoma and mantle cell lymphoma of the colon. Archives of Pathology & Laboratory Medicine, 127(2), E64-66. doi: 10.1043/0003-9985(2003)127<e64:SAAMCL>2.0.CO;2.
14. Majlis, A., Pugh, W. C., Rodriguez, M. A., Benedict, W. F., & Cabanillas, F. (2016). Mantle cell lymphoma: correlation of clinical outcome and biologic features with three histologic variants. Journal of Clinical Oncology, 15(4), 1664–1671. doi: 10.1200/JCO.1997.15.4.1664
15. Chan, J. K., Banks, P. M., Cleary, M. L., Delsol, G., De Wolf-Peeters, C., Falini, B., … Isaacson, P. G. (1994). A revised European-American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood, 84, 1361–1392. doi: 10.1093/ajcp/103.5.543.
16. Lee, S. Y., Kim, J. J., Lee, J. H., Kim, Y. H., Rhee, P. L., Paik, S. W., … Ko, Y. H. (2005). Synchronous adenocarcinoma and mucosa-associated lymphoid tissue (MALT) lymphoma in a single stomach. Japanese Journal of Clinical Oncology, 35, 591–594. doi: 10.1093/jjco/hyi164.
17. Kumar, S., Krenacs, L., Otsuki, T., Kumar, D., Harris, C. A., Wellmann, A., Raffeld, M. (1996). bcl-1 rearrangement and cyclin D1 protein expression in multiple lymphomatous polyposis. American Journal of Clinical Pathology, 105, 737–743. doi: 10.1093/ajcp/105.6.737.
18. Bertoni, F., Zucca, E., & Cotter, F. E. (2003). Molecular basis of mantle cell lymphoma. British Journal of Haematology, 124(2), 130–140. doi: 10.1046/j.1365-2141.2003.04761.x.
19. Herrero-Vicent, C., Machado, I., Illueca, C., Avaria, A., Salazar, C., Hernandez, A., … Lavernia, J. (2016). Diagnostic and therapeutic update of mantle cell lymphoma (MCL): analysis of seven cases treated in a centre in one year. Ecancermedicalscience, 10: 627. doi: 10.3332/ecancer.2016.627.
20. Parry-Jones, N., Matutes, E., Morilla, R., Brito-Babapulle, V., Wotherspoon, A., Swansbury, G. J., Catovsky, D. (2007). Cytogenetic abnormalities additional to t(11;14) correlate with clinical features in leukemic presentation of mantle cell lymphoma, and may influence prognosis: a study of 60 cases by FISH. British Journal of Haematology, 137(2), 117–124. doi: 10.1111/j.1365-2141.2007.06526.x.
21. Yu, Wang, & Shuangge, Ma (2014). Risk Factors for Etiology and Prognosis of Mantle Cell Lymphoma. Expert Review of Hematology, 7(2), 233–243. doi: 10.1586/17474086.2014.889561.
Первично-множественные опухоли. Синхронная неходжкинская лимфома из клеток зоны мантии и аденокарцинома желудка. Клинический случай
1Национальный институт рака, Киев
2Медицинская лаборатория CSD, Киев
Резюме. Лимфома из клеток мантии — это В-клеточная лимфома, как правило, с агрессивным течением, характеризуется поражением лимфатических узлов, селезенки, костного мозга, оболочек головного мозга и желудочно-кишечного тракта. Аденокарцинома (железистый рак) — злокачественное новообразование, которое развивается из железистых (секреторных) клеток слизистой оболочки желудка. В данной статье представлен клинический случай первично-множественного синхронного злокачественного новообразования — В-клеточной лимфомы из клеток зоны мантии с поражением желудка и аденокарциномой желудка.
Ключевые слова: В-клеточная лимфома из клеток зоны мантии; аденокарцинома желудка; первично-множественное злокачественное новообразование; езофагофибродуаденоскопия; колоноскопия; позитронно-эмиссионная компьютерная томография.
Адреса:
Шудрак Наталія Андріївна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: shudraknatalia@ukr.net
Correspondence:
Burlaka Anton
33/43 Lomonosova Str., Kyiv 03022
National Cancer Institute
E-mail: shudraknatalia@ukr.net














Leave a comment