Можливості електротермічної резекції печінки з приводу метастазів колоректального раку
Бондарь Г.В., Седаков И.Е., Ищенко Р.В., Борота А.В., Павлов Р.В. , Ласачко П.С.
Резюме. У Донецькому обласному протипухлинному центрі виконано 33 резекції печінки і 26 крайові біопсії печінки з використанням генератора електрозварювання м’яких тканин ЕК-300М1, розробленого співробітниками Інституту електрозварювання ім. Є.О. Патона. Із них виконано: правобічних гемігепатектомій — 15, лівобічних гемігепатектомій — 6, трисегментектомій — 8, бісегментектомій — 4. Дослідження застосування електрозварювання показали зменшення крововтрати під час операції більш ніж в 1,5 раза (524±98 мл порівняно з біполярною коагуляцією (844±79 мл)). Час дисекції паренхіми скоротився на 21±4 хв. Ускладнень, пов’язаних із використанням генератора електрозварювання, не спостерігали. Середній період ремісії після резекцій за описаною методикою становив 1,3 року (15,6 міс). Середня тривалість життя хворих після резекцій печінки становила 1,47±0,17 року (17,64 міс). При цьому 1-річна виживаність становила 60,6%, 3-річна — 18,1%. Використання генератора електрозварювання м’яких тканин є надійною і безпечною процедурою для резекції печінки з приводу метастазів колоректального раку. Розроблений спосіб спрощує техніку операції, скорочує крововтрату та дозволяє відмовитися від застосування гемостатичної губки і гемостатических пластин.
Резюме. В Донецком областном противоопухолевом центре произведено 33 резекции печени и 26 краевых биопсий печени с использованием генератора электросварки мягких тканей ЭК-300М1, разработанного сотрудниками Института электросварки им. Е.О. Патона. Из них выполнено: правосторонних гемигепатэктомий — 15, левосторонних гемигепатэктомий — 6, трисегментэктомий — 8, бисегментэктомий — 4. Исследования применения электросварки показали уменьшение кровопотери во время операции более чем в 1,5 раза (524±98 мл в сравнении с биполярной коагуляцией (844±79 мл)). Время диссекции паренхимы сократилось на 21±4 мин. Осложнений, связанных с использованием генератора электросварки, не наблюдали. Средний период ремиссии после резекций по описанной методике составил 1,3 года (15,6 мес). Средняя продолжительность жизни больных после резекций печени составила 1,47±0,17 года (17,64 мес). При этом 1-годичная выживаемость составила 60,6%, 3-летняя — 18,1%. Использование генератора электросварки мягких тканей является надежной и безопасной процедурой для резекции печени по поводу метастазов колоректального рака. Разработанный способ упрощает технику операции, сокращает кровопотерю и позволяет отказаться от применения гемостатической губки и гемостатических пластин.
Актуальность

В настоящее время одной из актуальных проблем современной онкологии является лечение злокачественных новообразований печени. Хирургическая гепатология — быстроразвивающееся направление в онкологии. Еще в 70–80-е годы ХХ века резекции печени по поводу злокачественных опухолей производили крайне редко, а послеоперационная летальность приближалась к 50% [6, 8, 10]. Операции сопровождались большой кровопотерей. На рубеже веков представления о возможностях лечения первичных и метастатических опухолей печени коренным образом изменились.
Среди злокачественных новообразований печени метастатическое поражение ее встречается в клинической практике достаточно часто. Установлено, что примерно у каждого третьего онкологического больного, независимо от локализации первичной опухоли, встречаются метастазы в печени, а при локализации опухоли в зонах, дренируемых воротной веной, частота метастазирования возрастает до 50% [1, 5, 12]. Гепатоцеллюлярный рак занимает 5-е место у мужчин и 8-е место у женщин среди всех злокачественных новообразований в мире [2, 10].
Первые работы о резекциях печени при хирургическом лечении метастазов колоректального рака появились в 80-х годах прошлого века. К 1993 году в мировой литературе опубликованы данные всего о 62 повторных резекциях печени [11]. К настоящему времени количество работ по этой проблеме свыше 50. Интерес к данной проблеме связан с тем, что частота рецидивов после резекции печени по поводу метастазов колоректального рака довольно высокая. По сводным данным H. Wanebo и соавторов (1996), примерно у 65–85% больных после резекции печени возникает рецидив заболевания, причем у 50% пациентов имеет место повторное поражение печени, а у 20–30% это поражение ограничено только печенью, 10–25% могут являться кандидатами для повторных резекций печени. Подобную распространенность повторного поражения печени подтверждают и работы последних лет [12]. Учитывая высокую и все возрастающую частоту рака толстой кишки во всем мире, количество больных, нуждающихся как в первичной, так и повторной резекции печени, довольно велико.
Не все перечисленные способы профилактики кровотечения равноценны: некоторые из них представляют лишь исторический интерес (наложение блоковидных кетгутовых швов), некоторые сложны и требуют дополнительного оборудования (шунтирование нижней полой вены). Наиболее простым, эффективным, а поэтому и наиболее часто употребляемым методом является Pringle-маневр. Его широко пропагандируют ведущие хирурги-гепатологи (В.А. Вишневский, Э.И. Гальперин, В.А. Журавлев и др.) [3, 4, 12].
Xирургическое лечение является «золотым стандартом» у больных как с первичным, так и с метастатическим поражением печени [7, 9], но резекция возможна менее чем у 40% пациентов (В.Д. Федоров и соавт., 2003).
Наилучшие показатели выживаемости у больных с изолированным метастатическим поражением печени, подвергшимся резекциям различного объема, были получены при выполнении сегментэктомий и экономных атипичных резекций (по данным хирургического отделения опухолей печени и поджелудочной железы Российского Онкологического Научного Центра им. Н.Н. Блохина Российской Академии Медицинских Наук (Ю.И. Патютко, И.В. Сагайдак, 2003). Совершенствование методов лечения злокачественных опухолей печени является одной из наиболее актуальных проблем современной клинической медицины, что обусловлено, с одной стороны, высокой частотой этой патологии, с другой — трудностями терапии развившихся или поздних стадий заболевания (В.Н. Бордуновский и соавт., 1994; В.А. Журавлев, В.И. Агалаков, 1996; Д.В. Комов и соавт., 1986; А.И. Хазанов, 1999).
Продолжительность жизни больных после установления диагноза метастатического поражения печени при отсутствии лечения составляет, как правило, не более 6 мес. Поэтому исследования, направленные на улучшение выживаемости этой группы пациентов, представляются весьма актуальными.
Цель
Улучшить оперативную технику и снизить интраоперационную кровопотерю при резекции печени по поводу метастазов колоректального рака.
Материалы и методы
В хирургическом отделении Донецкого областного противоопухолевого центра (ДОПЦ) произведено 33 резекции печени и 26 краевых биопсий печени с использованием генератора электросварки мягких тканей ЭК-300М1, разработанного сотрудниками Института электросварки им. Е.О. Патона. Из них выполнено: правосторонних гемигепатэктомий — 15, левосторонних гемигепатэктомий — 6, трисегментэктомий — 8, бисегментэктомий — 4.
Настоящее исследование проведено на основе сведений из историй болезни, амбулаторных карт, контрольных карт диспансерного наблюдения о 59 больных с первично-операбельным Т1-4 N0-2 М1 колоректальным раком, комплексное лечение которым было проведено в ДОПЦ за период с 2007 по 2009 гг.
Отбор больных в исследование осуществлялся с соблюдением принципов рандомизированной выборочной совокупности. Все отобранные пациенты были детально ознакомлены с задачами исследования, программой лечебно-диагностических мероприятий и дали свое письменное информированное согласие на лечение.
В зависимости от объема поражения и произведенных оперативных вмешательств, все больные, включенные в протокол настоящего исследования, были распределены на 2 группы.
В исследуемую группу включены 33 больных, метастатическое поражение печени которых ограничивалось 1 долей, в связи с чем выполнены обширные резекции печени.
Контрольную группу составили 26 пациентов с билобарным поражением, у которых производилась широкая биопсия, сопоставимых по категориям TNM с исследуемой группой. Больные контрольной группы получали комплексное лечение в условиях ДОПЦ, включающее одномоментную катетеризацию печеночной артерии и последующую полихимиотерапию в паллиативном режиме.
Изучение особенностей локализации метастазов у всех пациентов выявило, что наиболее часто процесс локализовался в V сегменте (18 (30,5%) наблюдений), а также на границе верхних квадрантов VII и VIII сегментов (по 14 (23,7%) случаев). Наиболеее редко встречалась локализация опухоли в III (у 1 (1,7%) пациентки) и II сегментах (2 (3,4%) больных).
У 21 (63,6%) из 33 пациентов исследуемой группы наблюдали поражение правой доли печени, у 12 (36,3%) больных выявлено поражение левой доли печени.
 Анализ возрастного состава пациентов исследуемой группы выявил, что средний возраст составил 54,4±1,3 года, при этом наибольшее количество больных было представлено в возрастных группах 40–49 лет (61,0%) и 50–59 лет (37,3%), в то время как наименьшее количество больных было представлено в возрастной группе 20–29 лет (1,7%).
Анализ возрастного состава пациентов исследуемой группы выявил, что средний возраст составил 54,4±1,3 года, при этом наибольшее количество больных было представлено в возрастных группах 40–49 лет (61,0%) и 50–59 лет (37,3%), в то время как наименьшее количество больных было представлено в возрастной группе 20–29 лет (1,7%).
Несмотря на диспансеризацию по поводу злокачественного процесса кишечника у пациентов обеих групп в настоящем исследовании, подавляющее их большинство (71,9%) было взято под наблюдение после 12 мес с момента обнаружения первых симптомов заболевания. Давность заболевания менее 1 года отмечена у 24,7% больных. В сроки развития заболевания до 1 мес за оказанием специализированной медицинской помощи обратились лишь 3,4% больных.
Размеры опухоли печени на момент первичного осмотра в исследуемой группе до 3 см в наибольшем размере обнаружены у 6 (10,2%) пациентов, от 3 до 5 см — у 15 (25,4%) больных и свыше 5 см — в 38 (64,4%) наблюдениях.
Наблюдавшиеся пациенты не имели принципиальных различий по возрастно-половому составу, общему состоянию, качеству жизни, локализации и распространенности первичного и метастатического процесса, характеру лечения первичного очага, концентрации онкомаркеров СА-19-9 и РЭА в крови и т.д.
Способ заключался в предварительной сосудистой изоляции удаляемой части печени путем последовательной перевязки воротных структур и печеночных вен, после чего производилась диссекция паренхимы генератором электросварки мягких тканей ЭК-300М1.
Из особенностей следует отметить, что при обработке значительных участков паренхимы имеющимися инструментами электросварочного комплекса, происходит обработка относительно большой толщи ткани органа, вследствие чего наблюдается неравномерное «проваривание» паренхимы и сосудистых структур, что при обширных резекциях печени приводит к капиллярной кровоточивости и требует дополнительных мер профилактики кровотечения (наложение швов паренхимы печени, использование фибриновых пластин и др.).
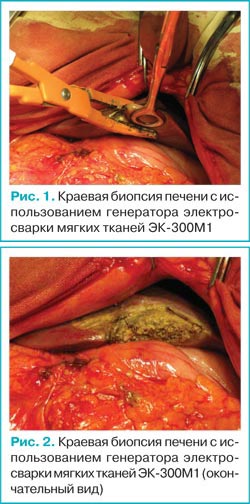
При краевых биопсиях печени (см. рис. 1, 2) в зону обработки попадает небольшая толща тканей, и обработка паренхимы происходит адекватно, из чего следует что рабочая поверхность инструментов для обработки паренхимы печени должна быть не более 3 см в длину.
Результаты
Использование данной методики позволило сократить интраоперационную кровопотерю в среднем на 320±55 мл. Время диссекции паренхимы сократилось на 21±4 мин.
Применение электросварочной технологии позволяет обеспечить надежный первичный гемостаз с первой аппликации инструмента на сосуд или на прядь тканей. Данная манипуляция практически невозможна при использовании монополярной электрокоагуляции. В этом случае чрезмерный нагрев тканей приводит к их карбонизации, что в свою очередь объясняет потерю эластичности, и разрушению целостности оболочек обрабатываемых сосудов. Клинически это проявляется несостоятельностью гемостаза, кровопотерей, необходимостью повторных аппликаций, и, как следствие, пролонгацией времени операции. Наши наблюдения (в ходе проводимых оперативных вмешательств) нашли логическое подтверждение в морфологической части работы при изучении патогистологических изменений стенки сосудов различного диаметра.
Исследования применения электросварки показали уменьшение кровопотери во время операции более чем в 1,5 раза. Так, при использовании электросварочного комплекса кровопотеря в течение операции составила 524±98 мл, в отличие от биполярной коагуляции, которая была ощутимо больше 844±79 мл. Различия статистически значимы (p<0,001).
Осложнений, связанных с использованием генератора электросварки, не наблюдали.
Средний период ремиссии после резекций по описанной методике составил 1,3 года (15,6 мес). Следует особо отметить, что при солитарных метастазах длительность этого периода составила 2,41 года (28,92 мес).
Средняя продолжительность жизни больных после резекций печени составила 1,47±0,17 года (17,64 месяцев), что несколько превосходит статистические данные отечественных и зарубежных авторов у данной категории больных. При этом 1-годичная выживаемость составила 60,6%, 3-летняя — 18,1%.
Выводы
Использование генератора электросварки мягких тканей является надежной и безопасной процедурой для резекции печени по поводу метастазов колоректального рака. Разработанный способ упрощает технику операции, сокращает кровопотерю и позволяет отказаться от применения гемостатической губки и гемостатических пластин.
Литература
1. Альперович Б.И. (1997) Хирургия печени и желчных путей, Томск. 608 с.
2. Булынин В.И., Глухов А.А., Сомляров В.В. (1995) Новый способ резекции печени с применением «струйного скальпеля ОС-1». Новые технологии в хирург. гепатол., С-Петербург, 97–98.
3. Вишневский В.А., Кубышкин В.А., Чжао А.В., Икрамов Р.З. (2003) Операции на печени. М: Миклош, 155 с.
4. Гальперин Э.И., Дедерер Ю.М. (1987) Нестандартные ситуации при операциях на печени и желчных путях. М., Медицина, 336 с.
5. Гарин А.М., Базин И.С. (2003) Злокачественные опухоли пищеварительной системы. Москва, 256 с.
6. Готье С.В., Цирюльникова О.М., Филин А.В. и др. (1997) Радикальные резекции при обширных очаговых поражениях печени. Вестн. Рос. Акад. Мед. Наук., 9: 8–13.
7. Гранов А.М., Борисов А. Е. (2003) Эндоваскулярная хирургия печени. Л., Медицина, 222 с.
8. Журавлев В.А. (2007) Пути снижения риска длительных окклюзий печеночно-двенадцатиперстной связки. Анн. хир. гепат., Т. 2 приложен., 38 с.
9. Lerut J., Gruwes J., Blumgart L. (2010) Resection of the caudate lobe of the liver. S.G.O., 171:160–162.
10. Mark S., Rosen C., Nagarney D., Taswell H. et al. (2002) Perioperative blood transfusion and determinants of survival after liver resection for metastatic colorectal carcinoma. Ann. Surg., 216: 493–505.
11. Okuda K., Nakashima T., Kojiro M. et al. (2009) Hepatocellular carcinoma without cirrhosis in Japanese patients. Gastroenter., 97: 140–6.
12. Ozawa K. (2002) Nonconventional approaches to advanced liver cancer. In liver surgery approached through the mitochondria, Tokyo, Medical Tribune, 117–65.














Leave a comment