Місце лімфаденектомії під час цистектомії при місцево-поширеному та метастатичному раку сечового міхура
Стаховський О.Е., Войленко О.А., Семко С.Л., Пікуль М.В., Кононенко О.А., Вітрук Ю.В., Стаховський Е.О.
Резюме. Лімфаденектомія є частиною стандартної цистектомії при інвазивних формах раку сечового міхура (РСМ), хоча її вплив на зменшення вираженості симптомів є абсолютно невідомим. Нашою метою було вивчення ефективності лімфаденектомії при хірургічному лікуванні хворих на місцево-поширений та метастатичний РСМ. Об’єкт і методи. Проспективне дослідження за участю 36 хворих на місцево-поширений та метастатичний РСМ. Пацієнтів розділено на 2 групи з урахуванням проведення стандартної тазової лімфаденектомії. При аналізі 2 груп не було статистичної різниці за основними показниками, такими як: вік, співвідношення чоловіків і жінок, стан ECOG та розподіл за стадіями TNM між групами. Результати. Не було статистично значущої різниці між групами в показниках післяопераційного перебування в стаціонарі, частоти переливання крові та періопераційних ускладнень. Аналіз виживаності не показав відмінностей у загальній виживаності через 2 і 3 роки: 58% проти 59% і 49% проти 49% відповідно для обох груп. Висновок. Дослідження показало, що у хворих на місцево-поширений і метастатичний РСМ із вираженою симптоматикою може бути проведена цистектомія без стандартної лімфаденектомії. Такий підхід може поліпшити результати лікування, зменшуючи загальний операційний час й інтраопераційні ускладнення, пов’язані з лімфаденектомією, без впливу на загальну виживаність.
Одержано 22.02.2019
Прийнято до друку 18.03.2019
DOI: 10.32471/clinicaloncology.2663-466X.38.22375
Вступ
Радикальна цистектомія залишається стандартом лікування пацієнтів із м’язово-інвазивними формами локалізованого раку сечового міхура (РСМ) останні 20 років [1]. Це оперативне втручання, окрім видалення сечового міхура, включає тазову лімфаденектомію. При місцево-поширених формах РСМ розширена тазова лімфаденектомія показала безпосередню кореляцію з безрецидивною виживаністю такої групи пацієнтів [2]. Виживаність хворих через 5 років після операції становить 50–60% при локалізованих Т1–Т2 стадіях захворювання [3]. Із підвищенням стадії виживаність знижується, сягаючи 26–44% у пацієнтів з pT3b–4N0 стадією. Залучення регіонарних лімфатичних вузлів в онкологічний процес при уротеліальній карциномі сечового міхура (N1–3) знижує показник виживаності до 13–29%, за даними різних авторів [4].
Місцево-поширені пухлини сечового міхура дуже часто проявляються виснажливою для пацієнта симптоматикою — кровотечею, болем, дизурією та обструкцією сечовивідних шляхів, що, на жаль, призводить до порушення соціального життя та психологічного здоров’я пацієнта [5]. Досліджень якості життя пацієнтів із місцево-поширеними формами РСМ наразі не дуже багато, й наявна лише обмежена інформація щодо цього питання [6]. Існує декілька робіт, в яких автори розглядають питання якості життя пацієнта під час проведення паліативного хірургічного лікування [4], променевої терапії [7] та/або хіміотерапії [8]. З урахуванням вищесказаного, з одного боку, існує раціональність проведення цистектомії навіть за умови поширення карциноми на суміжні органи малого таза, але такий підхід має бути частиною мультимодальної лікувальної тактики. З іншого боку, обсяг циторедукції та кількість періопераційних ускладнень безпосередньо корелюють з якістю життя та його тривалістю після проведення операції [9].
Якщо взяти до уваги, що тривалість життя пацієнтів з місцево-поширеними та метастатичними формами РСМ відносно невелика, основним завданням нашої роботи стало вивчення значення етапу лімфодисекції в межах операції циторедуктивної цистектомії. Метою цього дослідження стало визначення ефективності проведення лімфаденектомії у пацієнтів з місцево-поширеними формами РСМ.
Об’єкт і методи дослідження
Проведено проспективне рандомізоване дослідження, в яке було залучено 36 пацієнтів з віддаленим метастатичним ураженням (М1) та/або поширенням метастазів РСМ на регіонарні лімфатичні вузли групи загальної здухвинної вени (N3). Усіх пацієнтів розділено на 2 групи по 18 хворих, яким було проведено циторедуктивну цистектомію. У першу групу рандомізовано пацієнтів, у яких в обсяг оперативного втручання включали стандартну лімфаденектомію; у другу групу увійшли пацієнти, яким видалення лімфатичних вузлів під час операції не проводили. Дизайн дослідження був заздалегідь узгоджений відповідно до правил локальної етичної комісії Національного інституту раку.
Усі пацієнти дали свою письмову згоду на участь у цьому дослідженні. У роботі, окрім вивчення анамнестичних показників, клініко-лабораторних параметрів, проведено аналіз інтра- та післяопераційних ускладнень у групах порівняння. Вивчено загальну виживаність таких пацієнтів із дослідженням їх якості життя. Середній вік загальної групи хворих становив 61,9±8,8 (37–78) року. Пацієнтам основної групи проводили стандартну лімфодисекцію під час радикальної цистектомії, що полягала у видаленні внутрішніх, зовнішніх здухвинних та обтураторних лімфатичних вузлів. У контрольній групі виконували лише видалення сечового міхура (цистектомія) без тазової лімфаденектомії. Основні параметри пацієнтів, які увійшли до груп порівняння, зазначено в табл. 1.
| Параметр | Група 1 (n=18) |
Група 2 (n=18) |
Достовірність | |
| Вік, роки M±SD (95% довірчий інтервал) |
61,8±9,3 (37–78) |
62±8,6 (48–76) |
t-test; р=0,97 | |
| Стать | Чоловіки, n=33 (%) | 16 (88,9) | 17 (94,4) | χ=0,36; р=0,55 |
| Жінки, n=3 (%) | 2 (11,1) | 1 (5,6) | ||
| ECOG, балів Me [25%, 75%] |
1 [1, 2] | 2 [1, 2] | Mann — Whitney U test; р=0,12 | |
| T | 3, n (%) | 12 (66,7) | 10 (55,6) | χ=0,47; р=0,49 |
| 4, n (%) | 6 (33,3) | 8 (44,4) | ||
| N | 0–2, n (%) | 2 (11,1) | 4 (22,2) | χ=0,8; р=0,37 |
| 3, n (%) | 16 (88,9) | 14 (77,8) | ||
| М | 0, n (%) | 12 (66,7) | 9 (50,0) | χ=1,02; р=0,31 |
| 1, n (%) | 6 (33,3) | 9 (50,0) | ||
| УГН | Відсутній, n (%) | 8 (44,4) | 7 (38,9) | χ=0,58; р=0,37 |
| Наявний, n (%) | 10 (55,6) | 11 (61,1) | ||
УГН — уретерогідронефроз.
Як свідчать дані табл. 1, більшість пацієнтів становили чоловіки працездатного віку. За основними параметрами при порівнянні групи були зіставними: за віком, статтю, загальним станом за ECOG статусом, стадією захворювання за TNM, кількістю випадків уретерогідронефрозу, що розвинувся внаслідок поширення захворювання.
Порівняльний аналіз досліджуваних параметрів у групах виконували за методом «χ». Зіставлення проведено в групах за періопераційними показниками, рівнем післяопераційних ускладнень, тривалістю перебування в стаціонарі, інтенсивністю больових проявів за 5-бальною візуально-аналоговою шкалою, кількістю повторних госпіталізацій в період до 30 днів після операції. Проведено аналіз виживаності пацієнтів та побудовано криві Каплана — Мейєра для більш наочного порівняння відповідного показника.
Результати
Вивчивши основну симптоматику досліджуваних, науковці виявили у хворих низку симптомів, вираженість яких була більшою при локалізованих формах РСМ. Основні симптоми для груп порівняння перелічені в табл. 2.
| Скарги | Група 1 (n=18) |
Група 2 (n=18) |
Достовірність |
| Макрогематурія, n (%) | 17 (94,0) | 17 (94,0) | χ=0; р=1 |
| Загальна слабкість, n (%) | 17 (94,0) | 16 (88,8) | χ=0, 36; р=0,55 |
| Дизурія, n (%) | 14 (77,7) | 15 (83,3) | χ=0,18; р=0,67 |
| Больові прояви, n (%) | 10 (55,6) | 13 (72,2) | χ=1,08; р=0,3 |
| Спрага, n (%) | 12 (66,7) | 9 (50,0) | χ=1,03; р=0,31 |
| Підвищення t тіла, n (%) | 10 (55,6) | 9 (50,0) | χ=0,11; р=0,74 |
Як видно з табл. 2, основним симптомом у хворих на РСМ із проведеною цистектомією була макрогематурія, яка в більшості випадків супроводжувалася відходженням кров’яних згустків та пухлинного детриту. У 7 (38,9%) пацієнтів першої групи та 9 (50,0%) представників групи порівняння профузна гематурія призвела до вираженої анемії. Дизуричні прояви загалом відмічали до 83% пацієнтів, що проявлялися у вигляді частих потягів до сечовипускання, ніктурії, болю та різі по ходу сечівника при акті сечовипускання. Формування мікроциста, що було частіше за все зумовлено зморщуванням сечового міхура після неодноразових нерадикальних резекцій або променевої терапії, застосовували в 3 (16,7%) та 5 (27,8%) випадках відповідно в групах порівняння. Больові прояви у хворих на РСМ мають певний поліморфізм та різний ступінь вираженості (див. табл. 3). Біль у надлонній ділянці супроводжувався дизуричними проявами та гематурією. Водночас у 8 (22%) хворих головним симптомом захворювання був саме біль над лоном, у промежині та в паху (5 балів) внаслідок місцевого поширення захворювання та залучення в пухлинний процес судинно-нервових стовбурів. Цей біль не піддавався корекції ненаркотичними анальгетиками.
| Інтенсивність больового синдрому | Кількість хворих, n | Відсоток, % |
| 1 бал | 7 | 19,5 |
| 2 бали | 9 | 25,0 |
| 3 бали | 8 | 22,2 |
| 4 бали | 4 | 11,1 |
| 5 балів | 8 | 22,2 |
| Усього | 36 | 100 |
До інших скарг слід віднести постійну спрагу та сухість шкірних покривів, які відмічав 21 (58,3%) пацієнт. Ще 19 (52,8%) скаржилися на періодичне підвищення температури тіла з субфебрильних до гектичних значень. Такі прояви були зумовлені явищами хронічної ниркової недостатності та запальними процесами верхніх сечовивідних шляхів, що були наслідком перебігу онкологічного процесу сечового міхура, звуженням вічок сечоводів та розвитком уретерогідронефрозу.
Аналізуючи дані оперативних втручань, інформацію було узагальнено, вивчено в групах порівняння і наведено в табл. 4.
| Показник | Група 1 (n=18) |
Група 2 (n=18) |
Достовірність |
| Тривалість операції, хв | 154±27 (120–210) |
132±23 (100–180) |
t-test; р<0,01 |
| Об’єм крововтрати, мл Me [25%, 75%] |
400 [300, 500] |
375 [300, 500] |
Mann — Whitney U test; р=0,49 |
| Періопераційні ускладнення, n (%) | 5 (27,8) | 2 (11,1) | χ=1,6; р=0,21 |
| Необхідність переливання крові, n (%) | 2 (11,1) | 3 (16,7) | χ=0,23; р=0,6 |
| Післяопераційний ліжко-день M±SD (95% довірчий інтервал) |
9,9±3,4 (4–16) |
8,9±3,1 (5–15) |
t-test; р=0,36 |
З табл. 4 бачимо, що тривалість втручання була достовірно меншою в контрольній групі, що легко пояснити відсутністю цілого етапу з видалення груп лімфатичних вузлів (р<0,01). За об’ємом інтраопераційної крововтрати не відмічено значних відмінностей між групами порівняння. Загальна кількість періопераційних ускладнень була на низькому рівні та статистично не відрізнялася. Єдине інтраопераційне ускладнення, окрім крововтрати, було відмічено в першій групі, де під час проведення лімфодисекції лівої здухвинної зони було травмовано зовнішню здухвинну вену, що потребувало її реконструкції. Інтраопераційна гемотрансфузія не може стати допоміжним фактором оцінки ефективності проведеного лікування, оскільки вихідні дані пацієнтів обох груп з позиції анемії і гемоглобінемії були різними. Лише в 2 (11,0%) та 3 (16,6%) випадках відповідно для досліджуваних груп відмічено крововтрату більше ніж 500 мл, що потребувало переливання еритроцитарної маси інтраопераційно. Тривалість перебування в стаціонарі не була більшою в досліджуваній групі, де проводилося видалення лімфатичних вузлів. У середньому післяопераційний ліжко-день становив 9,9±3,4 (4–16) та 8,9±3,1 (5–15) доби для досліджуваних груп відповідно.
Віддалені результати лікування узагальнені для груп порівняння в табл. 5.
| Показник | Група 1 (n=18) |
Група 2 (n=18) |
Достовірність |
| Післяопераційні ускладнення (до 30 днів після операції), n (%) | 3 (16,7) | 2 (11,1) | χ=0,23; р=0,6 |
| Повторні втручання впродовж 30 днів після операції, n (%) | 1 (5,6) | 1 (5,6) | χ=0; р=1 |
| Загальна 2-річна виживаність, % | 23 | 19 | Log-Rank test р=0,71 |
| Медіана виживаності, міс | 10,2 | 8,1 | Log-Rank test р=0,71 |
З післяопераційних ускладнень у перший місяць після операції відмічено нагноєння післяопераційної рани в обох групах пацієнтів (по одному випадку у кожній) та загострення пієлонефриту (2 випадки в основній групі та 1 — у контрольній). Такі ускладнення результували в більш тривалу (10 днів) антибіотикотерапію. Оперативні втручання, які проводилися в післяопераційний період: амбулаторна перкутанна пункція лімфоцеле, що нагноїлося, та ревізія уростоми. Необхідність ревізії уростоми виникла в одного пацієнта контрольної групи та імовірно була зумовлена вираженим ожирінням і недостатнім кровопостачанням дистального відділу кондуїта — проведено інтраопераційну ревізію уростоми та перекладення нашкірної стоми з резекцією нежиттєздатної кишки.
Аналіз загальної виживаності пацієнтів проведено через 2 роки (рисунок).
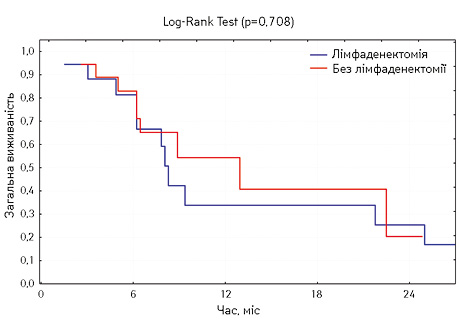
Як видно з кривих Каплана — Мейєра, 2-річна загальна виживаність у групах становила 23 та 19% відповідно для пацієнтів з лімфаденектомією та без неї, при цьому медіана виживаності сягала 10,2 та 8,1 міс відповідно (різниця статистично недостовірна; р=0,708). Враховуючи вищесказане, можна зробити висновок, що у пацієнтів з місцево-поширеними та метастатичними формами РСМ за наявності метастатичного ураження вісцеральних органів видалення лімфовузлів загальної здухвинної групи не є доцільним в аспекті виживаності цих хворих. Циторедуктивна цистектомія зумовлює значне зменшення вираженості основних симптомів захворювання. Лімфаденектомія, в свою чергу, призводить до подовження часу операції, простежується тенденція до статистично недостовірного збільшення кількості інтраопераційних ускладнень.
Дискусія
Останнім часом в онкології все частіше піддається сумніву необхідність ретельної лімфодисекції в різних напрямках. Так, на останньому конгресі Європейської асоціації урологів (European Association of Urology) дослідник К. Тужер доповідав результати ще не опублікованого рандомізованого дослідження ролі розширеної лімфаденектомії в порівнянні з лімітованою лімфаденектомією у пацієнтів з локалізованим раком передміхурової залози. Ця робота, проведена в Меморіальному онкологічному центрі Слоана — Кеттерінга (Memorial Sloan Kettering Cancer Center), не показала переваг розширеної лімфаденектомії для такої групи пацієнтів, хоча у попередніх дослідженнях вважалося виправданим виконання розширеної процедури у пацієнтів високого ризику, незважаючи на збільшення кількості періопераційних ускладнень. Онкогінекологи цього року опублікували дослідження, яке поставило під сумнів раціональність проведення видалення лімфатичних вузлів при поширених пухлинах яєчника. У рандомізованому дослідженні не відмічено переваги в групі класичного видалення лімфатичних вузлів, а тривалість життя пацієнток була навіть більшою в групі без виконання лімфаденектомії [10, 11].
Радикальна цистектомія залишається складною, травматичною операцією з високим ризиком періопераційних ускладнень до 40% і смертністю менш ніж 3% [12]. Також до уваги треба взяти і фактори, пов’язані з післяопераційними змінами, що залежать від виду деривації сечі, та психологічні питання, які можуть вплинути на стан пацієнта: загальний вигляд тіла при зовнішній деривації сечі (наявність стоми), негативний психологічний настрій пацієнтів та вартість лікування. Звичайно, розвиток хірургічної техніки та впровадження континентних видів деривації сечі дещо покращують ситуацію, але місцево-поширені та метастатичні форми РСМ, як правило, не є кандидатами для ілеоцистонеопластики.
Розширена лімфаденектомія дозволяє хірургу встановити правильний патологічний діагноз, що дає можливість отримати дані для прогнозу та планування ад’ювантної терапії. Багато досліджень показують, що розширена лімфаденектомія покращує виживаність пацієнтів без ознак захворювання [13], але всі вони стосуються хворих з локалізованим інвазивним РСМ. Рандомізованих робіт з вивчення поширених форм не було, але можна взяти до уваги приклад наших колег-онкогінекологів та відсутність переваги для пацієнток у проведенні лімфаденектомії при поширених пухлинах яєчника. Отже, залишається відкритим питання доцільності виконання лімфаденектомії в лікуванні пацієнтів з РСМ. Крім того, до сьогодні відсутні рандомізовані дослідження такого підходу лікування, і тому питання виконання розширеної лімфаденектомії та її доцільності залишається відкритим.
Залишається багато питань щодо категорії пацієнтів, яким необхідно проводити розширену лімфаденектомію, і одним з ключових, вже науково обґрунтованих та доведених фактів є те, що такі оперативні втручання повинні проводитися виключно в експертних центрах з досвідом виконання великої кількості цистектомій на рік (більше 15 на рік).
Які альтернативи хірургічному лікуванню у пацієнтів з місцево-поширеним та метастатичним РСМ? Сьогодні основним напрямом буде системна хіміотерапія. Вона, хоч і є ефективним методом для зниження стадії захворювання та може сприяти повній відповіді у незначного відсотка пацієнтів, все ж має дуже високу частоту неефективних результатів з прогресією захворювання та рецидивуванням. Променева терапія може використовуватися лише як паліативна допомога для зменшення кровоточивості пухлини; вираженого зниження больового синдрому при променевій терапії не відмічено [7].
Отже, місце для циторедуктивної цистектомії при місцево-поширеному процесі існує, але потребує подальшого дослідження. Беручи до уваги результати нашого рандомізованого дослідження, стає зрозумілим, що тактика проведення циторедуктивної цистектомії у пацієнтів із вираженою симптоматикою та анемією є доцільним хірургічним підходом, який потрібно вивчати й надалі. Результати роботи свідчать, що проведенням лімфодисекції у пацієнтів з місцево-поширеними та метастатичними формами РСМ можна знехтувати, оскільки не відмічено статистично достовірної переваги у виживаності пацієнтів з лімфаденектомією, включеною в обсяг оперативного втручання.
Список використаної літератури
- Alfred Witjes J., Lebret T., Compérat E.M. et al. (2017) Updated 2016 EAU Guidelines on Muscle-invasive and Metastatic Bladder Cancer. Eur. Urol., 71(3): 462–475. doi: 10.1016/j.eururo.2016.06.020
- Nielsen M.E., Mallin K., Weaver M.A. et al. (2014) Association of hospital volume with conditional 90-day mortality after cystectomy: ananalysis of the National Cancer DataBase. BJU Int., 114(1): 46–55. doi: 10.1111/bju.12566
- Stein J.P., Lieskovsky G., Cote R. et al. (2001) Radical cystectomy in the treatment of invasive bladder cancer: Long term results in 1,054 patients. J. Clin. Oncol., 19(3): 666–675. doi: 10.1200/JCO.2001.19.3.666
- Frank I., Cheville J.C., Blute M.L. et al. (2003) Transitional cell carcinoma of urinary bladder with regional node involvement treated by cystectomy: clinicopathologic features associated with outcome. Cancer, 97(10): 2425–2431. doi: 10.1002/cncr.11370.
- Fosså S.D., Aaronson N., Calaisda Silva F. et al. (1989) Quality of life in patients with muscle-infiltrating bladder cancer and hormone-resistant prostatic cancer. Eur. Urol., 16(5): 335–339.
- Mommsen S., Jakobsen A., Sell A. (1989) Quality of life in patients with advanced bladder cancer. A randomized study comparing cystectomy and irradiation — the Danish Bladder Cancer Study Group (DAVECA protocol 8201). Scand. J. Urol. Nephrol., 125: 115.
- Fokdal L., Høyer M., von der Maase H. (2006) Radical radiotherapy for urinary bladder cancer: treatment outcomes. Expert. Rev. Anticancer Ther., 6: 269.
- Rodel C., Weiss C., Sauer R. (2005) Organ preservation by combined modality treatment in bladder cancer: the European perspective. Semin. Radiat. Oncol., 15: 28.
- Nagele U., Anastasiadis A.G., Merseburger A.S. et al. (2007) The rationale for radical cystectomy as primary therapy for T4 bladder cancer. World J. Urol., 25(4): 401–405.
- Harter P., Sehouli J., Lorusso D. et al. (2019) A randomized trial of lymphadenectomy in patients with advanced ovarian neoplasms. N. Engl. J. Med., 380(9): 822–832. doi: 10.1056/ NEJM oa1808424.
- Soulie M., Straub M., Game X. et al. (2002) A multicenter study of the morbidity of radical cystectomy in select elderly patients with bladder cancer. J. Urol., 167: 1325–1328.
- Herr H., Lee C., Chang S., Lerner S. (2004) Bladder Cancer Collaborative Group. Standardization of radical cystectomy and pelvic node dissection for bladder cancer: A collaborative group report. J. Urol., 171: 1823–1828. doi: 10.1097/01.ju.0000120289.78049.0e
- Nielsen M.E., Mallin K., Weaver M.A. et al. (2014) Association of hospital volume with conditional 90-day mortality after cystectomy: ananalysis of the National Cancer Data Base. BJU Int., 114: 46. doi:10.1111/bju.12566
Место лимфаденэктомии во время цистэктомии при местно-распространенном и метастатическом раке мочевого пузыря
Национальный институт рака, Киев
Резюме. Введение. Лимфаденэктомия является частью стандартной цистэктомии при инвазивных формах рака мочевого пузыря (РМП), хотя ее влияние на уменьшение выраженности симптомов является абсолютно неизвестным. Нашей целью было изучение эффективности лимфаденэктомии при хирургическом лечении больных местно-распространенным и метастатическим РМП. Объект и методы. Проспективное исследование с участием 36 больных местно-распространенным и метастатическим РМП. Пациенты разделены на 2 группы с учетом проведения стандартной тазовой лимфаденэктомии. При анализе 2 групп не было статистической разницы по основным показателям, такими как: возраст, соотношение мужчин и женщин, состояние ECOG и распределение стадий TNM между группами. Результаты. Не было статистически значимой разницы между группами в показателях послеоперационного пребывания в стационаре, частоты переливания крови и периоперационных осложнений. Анализ выживаемости не показал различий в общей выживаемости через 2 и 3 года: 58% против 59% и 49% против 49% соответственно для обеих групп. Вывод. Исследование показало, что у больных местно-распространенным и метастатическим РМП с выраженной симптоматикой может быть проведена цистэктомия без стандартной лимфаденэктомии. Такой подход может улучшить результаты лечения, уменьшая общее операционное время и интраоперационные осложнения, связанные с лимфаденэктомией, без влияния на общую выживаемость.
рак мочевого пузыря; местно-распространенный и метастатический рак мочевого пузыря; тазовая лимфаденэктомия.
Адреса:
Стаховський Олександр Едуардович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: stakhovsky9@gmail.com
Correspondence:
Stakhovskyi Oleksandr
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
E-mail: stakhovsky9@gmail.com














Leave a comment