Використання надключичного клаптя для реконструкції післяопераційних дефектів при пухлинах голови та шиї
Фёдоров Д.Ю.1, Русин А.В.2, Болдижар П.А.2
- 1Закарпатский областной клинический онкологический диспансер, Ужгород
- 2Ужгородский национальный университет
Резюме. Для відновлення післяопераційних дефектів м’яких тканин голови та шиї використовують різні способи із застосуванням регіонарних і реваскуляризованих вільних клаптів. Мета нашого дослідження — вивчення можливостей використання надключичного клаптя для реконструкції післяопераційних дефектів м’яких тканин при пухлинах голови та шиї. Об’єкт і методи. Проведено аналіз результатів використання надключичного клаптя у 15 пацієнтів з пухлинами голови та шиї для реконструкції різних післяопераційних дефектів. Результати. У 1 хворого розвинувся частковий некроз шкірної площадки надключичного клаптя, що призвело до утворення нориці порожнини рота, загоєння якої було досягнуто шляхом місцевого консервативного лікування. У 3 пацієнтів виникло часткове розходження країв шкіри донорської рани. У всіх випадках отримано загоєння вторинним натягом після місцевого консервативного лікування. Висновки. Надключичний клапоть є універсальним трансплантатом для реконструкції післяопераційних дефектів м’яких тканин голови та шиї, що поєднує в собі переваги і регіонарних, і вільних клаптів. Раніше проведена променева терапія не впливає на життєздатність надключичного клаптя. Використання надключичного клаптя є основним методом відновлення післяопераційних дефектів м’яких тканин порожнини рота, ротоглотки, гортаноглотки, шийного відділу трахеї та стравоходу.
Резюме. Для восстановления послеоперационных дефектов мягких тканей головы и шеи используются различные способы с применением регионарных и реваскуляризированных свободных лоскутов. Цель нашего исследования — изучение возможностей использования надключичного лоскута для реконструкции послеоперационных дефектов мягких тканей при опухолях головы и шеи. Объект и методы. Проведен анализ результатов использования надключичного лоскута у 15 пациентов с опухолями головы и шеи для реконструкции различных послеоперационных дефектов. Результаты. У 1 больного развился частичный некроз кожной площадки надключичного лоскута, что привело к образованию свища полости рта, заживление которого достигнуто путем местного консервативного лечения. У 3 пациентов возникло частичное расхождение краев кожи донорской раны. Во всех случаях получено заживление вторичным натяжением после местного консервативного лечения. Выводы. Надключичный лоскут является универсальным трансплантатом для реконструкции послеоперационных дефектов мягких тканей головы и шеи, сочетающим в себе преимущества и регионарных, и свободных лоскутов. Ранее проведенная лучевая терапия не влияет на жизнеспособность надключичного лоскута. Использование надключичного лоскута является основным методом восстановления послеоперационных дефектов мягких тканей полости рта, ротоглотки, гортаноглотки, шейного отдела трахеи и пищевода.
Получено 22.10.2018
Принято в печать 04.12.2018
ВВЕДЕНИЕ
Хирургическое лечение опухолей головы и шеи нередко приводит к образованию послеоперационных дефектов, требующих реконструкции с целью улучшения функциональных и косметических результатов, а следовательно, и повышения качества жизни пациентов.
Для восстановления послеоперационных дефектов мягких тканей головы и шеи используются различные способы с применением регионарных и реваскуляризированных свободных лоскутов. Среди регионарных наиболее популярны лоскуты большой грудной мышцы, подкожной мышцы шеи, грудино-ключично-сосцевидной мышцы, мышечно-слизистый на лицевой артерии, подподбородочный, подподъязычный и др. Использование регионарных лоскутов технически является более простым, однако большинство из них имеют недостатки: большая толщина, недостаточная пластичность и мобильность, расположение в зоне предшествующего облучения и др. Кроме того, забор регионарных лоскутов нередко приводит к нежелательным последствиям со стороны донорской зоны. Наиболее востребованными свободными лоскутами являются лучевой и переднелатеральный бедра. Свободные реваскуляризированные лоскуты более универсальны и значительно расширяют возможности реконструкции, но их применение требует навыков микрососудистой хирургии, наличия специального оборудования, интенсивного послеоперационного мониторинга, а также увеличивает продолжительность операции [13].
В связи с вышесказанным является актуальным поиск более универсального трансплантата, сочетающего в себе преимущества и регионарных, и свободных лоскутов.
Цель нашего исследования — изучение возможностей использования надключичного лоскута для реконструкции послеоперационных дефектов мягких тканей при опухолях головы и шеи.
Надключичный лоскут — это кожно-фасциальный лоскут, кровоснабжаемый надключичной артерией, забор которого производится в надключичной и дельтовидной области.
Впервые лоскут, подобный надключичному, был описан T.D. Mütter в 1842 г. как «плечевой лоскут» [цит. по 2, 17, 19]. В 1903 г. C. Toldt впервые описал «поверхностную артерию шеи», берущую начало от щитошейного ствола и выходящую между трапециевидной и грудино-ключично-сосцевидной мышцами [цит. по 7, 9, 16]. В последующие годы в литературе встречались несистемные сообщения об использовании «плечевого», «акромиального», «шейно-плечевого» лоскутов, но эти методики не были эффективными в связи с отсутствием понимания анатомии трансплантата и, следовательно, большим количеством осложнений. В 1979 г. B.G. Lamberty в своей публикации «The supraclavicular axial patterned flap» впервые детально описал надключичный лоскут и питающую его артерию, положив начало данному способу реконструкции в том виде, в котором мы знаем его сегодня [цит. по 2, 4, 18, 19]. Однако, несмотря на это, лоскут не получил широкого распространения, и только в 1997 г. N. Pallua и соавторы представили результаты лечения ожоговых контрактур шеи с использованием надключичного лоскута [цит. по 13, 14]. А в 2000 г. N. Pallua и соавторы впервые опубликовали данные о применении надключичного лоскута для восстановления послеоперационных дефектов у больных онкологического профиля [цит. по 2, 11]. После этого указанный лоскут стал приобретать популярность.
В настоящее время в литературе имеются сообщения об использовании надключичного лоскута для реконструкции послеоперационных дефектов височной кости, заднебокового основания черепа, кожи верхней части передней грудной стенки, лица, шеи, области околоушной слюнной железы и ушной раковины, слизистой оболочки и мягких тканей полости рта, ротоглотки, гортаноглотки, трахеи, шейного отдела пищевода и др., что свидетельствует о широком спектре применения трансплантата.
N. Kokot и соавторы в 2013 г. представили результаты применения надключичного лоскута у 45 пациентов для реконструкции различных дефектов головы и шеи: полости рта — 13 случаев, кожи головы и шеи — 10, гортаноглотки — 8, ротоглотки — 7, височной кости — 5, пищевода — 1 случай и трахеи — 1 случай. Из 45 пациентов 15 (33%) до операции получали лучевую терапию. У 31 (68%) больного была выполнена диссекция шеи, включающая IV или IV и V уровень. Средние размеры лоскута в данной группе: ширина — 6,1 см, длина — 21,4 см. Возникли следующие осложнения: слюнные свищи — 7 (16%), частичное расхождение краев раны в области кожной площадки лоскута — 11 (24%), частичный некроз кожной площадки — 8 (18%), полный некроз кожной площадки — 2 (4%). Повторная реконструктивная операция потребовалась 4 пациентам (9%) [13].
Та же группа исследователей сообщила об использовании надключичного лоскута у 22 пациентов для закрытия дефектов кожи головы и шеи (кожа шеи — 10 случаев, кожа лица — 7, кожа височной области и области ушной раковины — 4, кожа околоушной области — 1 случай). Из 22 пациентов 8 (36%) до операции получали лучевую терапию. У 9 (41%) была выполнена диссекция шеи, включающая IV или IV и V уровень. Средняя ширина лоскута составила 6,1 см, а длина — 21,8 см. Осложнения, возникшие в данной группе пациентов: частичное расхождение краев раны в области кожной площадки лоскута — 2 (9%), частичный некроз кожной площадки — 2 (9%), полный некроз кожной площадки — 1 (4,5%) [14].
J.W. Granzow и соавторы в 2013 г. опубликовали данные о 18 случаях восстановления дефектов кожи и мягких тканей головы и шеи с помощью надключичного лоскута. Ширина лоскута составила в среднем 7,0 см, длина — 24,0 см. Осложнения: дистальный некроз лоскута — 1, слюнной свищ — 1 и пищеводный свищ — 1 случай. Повторная реконструктивная операция потребовалась 1 пациенту [9].
В исследовании A. Shenoy и соавторов надключичный лоскут был применен в 11 эпизодах, а именно: реконструкция дефекта твердого неба выполнена у 1 пациента, дна полости рта — у 1, слизистой оболочки щеки — у 1, реконструкция дефекта гортаноглотки после ларингэктомии — у 2 больных, циркулярного дефекта глотки — у 2, дефектов кожи щеки и околоушной области — у 4 пациентов. Один из пациентов до операции получал лучевую терапию. Средние размеры лоскута в данном исследовании: ширина — 7,0 см, длина — 20,0 см. В послеоперационный период отмечали следующие осложнения: глоточные свищи — 2 случая, частичный некроз лоскута — 1, полный некроз лоскута — 1 случай. Повторная реконструкция была проведена 1 пациенту [18].
M.W. Chu и соавторы выполнили с помощью надключичного лоскута реконструкцию дефекта области трахеостомы у 5 пациентов (4 пациента оперированы по поводу парастомального рецидива рака гортани, 1 — по поводу рецидива рака щитовидной железы). Трое пациентов ранее получали лучевую терапию, двое — лучевую и химиотерапию. Размеры лоскута в среднем: ширина — 6,6 см, длина — 16,0 см. Осложнений получено не было [6].
E. Chiu и соавторы в 2010 г. описали опыт использования надключичного лоскута для замещения циркулярных глоточно-пищеводных дефектов у 20 пациентов. В 6 случаях в послеоперационный период образовались глоточные свищи, в 2 — стриктуры анастомозов. Повторные операции не потребовались [5].
M.W. Herr и соавторы в 2014 г. сообщили о применении надключичного лоскута у 24 пациентов для реконструкции послеоперационных дефектов головы и шеи (глотки — 5 случаев, полости рта — 4, заднебокового отдела основания черепа — 6, кожи — 7, области трахеостомы — 2 случая). У 13 (54%) была проведена лучевая терапия до операции. Из осложнений авторы описали 2 случая частичного некроза кожной площадки лоскута, 2 глоточных свища и 1 свищ полости рта. Одному из пациентов потребовалась повторная реконструктивная операция [11].
S. Kadakia и соавторы в 2016 г. опубликовали результаты исследования, включавшего 63 пациента, которым было проведено хирургическое лечение по поводу опухолей головы и шеи с использованием надключичного лоскута. В 38 случаях производилось закрытие дефектов кожи, в 25 — дефектов слизистой оболочки (гортаноглотка — 9 пациентов, глоточный свищ — 3, дно полости рта — 7, ротоглотка — 3, щека — 3 больных). При реконструкции дефектов слизистой оболочки описаны следующие осложнения: полный некроз лоскута — 4 случая, частичный некроз лоскута — 7 и глоточный свищ — 3 [12].
В 2016 г. L. Giordano и соавторы представили результаты применения надключичного лоскута у 14 пациентов. Восстановление дефектов гортаноглотки выполнено в 6 случаях, ротоглотки — в 2, полости рта — в 2, кожи головы и шеи — в 4 случаях. При этом частичный некроз лоскута развился у двух больных. Лучевую терапию до операции получали 2 пациента [8].
В отечественной литературе мы встретили только одно сообщение об использовании надключичного лоскута для замещения послеоперационных дефектов мягких тканей при опухолях головы и шеи [1].
Полный некроз надключичного лоскута при реконструкции дефектов слизистой оболочки (полость рта, глотка, пищевод, трахея), по данным различных авторов, встречается с частотой 0–16% случаев, а частичный некроз — 4,2–28% случаев [6, 11–13]. При реконструкции дефектов кожи частота этих осложнений несколько ниже и составляет 0–4,5% в случае полного некроза и 9–10,5% — в случае частичного некроза лоскута [12, 14]. Свищи глотки и полости рта при использовании надключичного лоскута встречаются от 6,4% до 24–30% случаев [5, 13]. Локализация дефекта, замещаемого лоскутом, не влияет на частоту осложнений [13].
По данным литературы, корреляции между проведенной до операции лучевой терапией и осложнениями в виде частичного или полного некроза лоскута не установлено [11–14]. Почти во всех сообщениях отмечено отсутствие клинически значимых последствий со стороны донорской раны при заборе надключичного лоскута [6, 11, 13, 14, 18]. В отдельных случаях имели место использование свободного кожного лоскута или частичное расхождение краев донорской раны [11, 13]. Среднее время забора надключичного лоскута составило примерно 60 мин [9, 11–14].
По мнению большинства авторов, возможно одномоментное выполнение диссекции шеи, включающей уровень IV, V с забором надключичного лоскута, при условии сохранения сосудов, питающих лоскут [13, 14, 18]. Ранее выполненная диссекция шеи, включающая уровень IV, V, при отсутствии данных о сохраненной надключичной артерии является противопоказанием к забору надключичного лоскута [6, 9, 13].
Несколько групп исследователей провели сравнение применения надключичного лоскута и свободных кожно-фасциальных трансплантатов (лучевого лоскута и переднелатерального лоскута бедра) для восстановления послеоперационных дефектов при опухолях головы и шеи [10, 15, 20]. Во всех случаях результаты реконструкций и количество осложнений были примерно одинаковыми для обеих групп, при этом время операции и срок пребывания в стационаре были меньше для группы надключичного лоскута. Кроме того, донорская рана в случае использования надключичного лоскута в большинстве случаев заживает первичным натяжением и не требует пересадки кожи.
В связи с относительно простой методикой забора надключичного лоскута, его надежностью, пластичностью, широким спектром применения многие авторы считают, что данный трансплантат может стать «методом первого выбора» или «золотым стандартом» в реконструкции послеоперационных дефектов мягких тканей при опухолях головы и шеи [9, 10, 18].
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
С марта 2017 г. по октябрь 2018 г. в Закарпатском областном клиническом онкологическом диспансере у 15 пациентов с опухолями головы и шеи был использован надключичный лоскут для реконструкции различных послеоперационных дефектов (таблица).
| № | Диагноз | TNM, стадия |
Локализация дефекта |
Пол | Возраст, лет | Гистологический тип опухоли | Предшествующее лечение | Диссекция шеи, уровень | Осложнения | Лечение осложнений |
| 1 | Рак слизистой оболочки ретромолярной области | рT2N0M0, II стадия |
Ретромолярная область | М | 55 | Рак плоскоклеточный | ЛТ 70 Гр | I–III | – | – |
| 2 | Рак языка | рT3N0M0, III стадия |
Боковая поверхность языка, боковой отдел дна полости рта | М | 45 | Рак плоскоклеточный | ХЛТ (ЛТ 66 Гр) | I–III | – | – |
| 3 | Рак слизистой оболочки полости рта | рT3N0M0, III стадия |
Боковой отдел дна полости рта, щека | М | 70 | Рак плоскоклеточный | ХЛТ (ЛТ 70 Гр) | I–III | – | – |
| 4 | Рак слизистой оболочки полости рта | рT4N1M0 IV стадия |
Боковой и фронтальный отдел дна полости рта, щека | М | 43 | Рак плоскоклеточный | ХЛТ (ЛТ 68 Гр) | I–III | Частичное расхождение краев донорской раны | Консервативное |
| 5 | Рак ротоглотки | рT2N2M0, IV стадия |
Боковая стенка ротоглотки, ретромолярная область | М | 66 | Рак плоскоклеточный | ХЛТ (ЛТ 70 Гр), ПХТ | I–III | Частичный некроз кожной площадки лоскута | Консервативное |
| 6 | Рак слизистой оболочки полости рта | рT3N1M0, III стадия |
Боковая поверхность языка, боковой отдел дна полости рта | М | 64 | Рак плоскоклеточный | ХЛТ (ЛТ 66 Гр) | I–III | Частичное расхождение краев донорской раны | Консервативное |
| 7 | Рак слизистой оболочки полости рта | T4N0M0, IV стадия |
Щека, нижняя губа, переднебоковой отдел дна полости рта | Ж | 73 | Рак плоскоклеточный | ХЛТ (ЛТ 68 Гр) | I–III | – | – |
| 8 | Рак ротоглотки | рT3N0M0, III стадия |
Боковая стенка ротоглотки, ретромолярная область | М | 63 | Рак плоскоклеточный | ХЛТ (ЛТ 68 Гр) | I–III | – | – |
| 9 | Рак слизистой оболочки ретромолярной области | рT3N0M0, III стадия |
Щека, область альвеолярного отростка верхней челюсти | М | 78 | Цистаденоидный рак | ЛТ 68 Гр | I–III | – | – |
| 10 | Рак гортани | рT4N0M0, IV стадия |
Циркулярный дефект гортаноглотки, шейного отдела пищевода | М | 58 | Рак плоскоклеточный | Ларингэктомия, ХЛТ (ЛТ 40 Гр) | – | Частичное расхождение краев донорской раны | Консервативное |
| 11 | Рак гортани | рT4N1M0,IV стадия | Шейный отдел трахеи, кожа и мягкие ткани передней области шеи | Ж | 61 | Рак плоскоклеточный | Ларингэктомия, ХЛТ (ЛТ 44 Гр) | – | – | – |
| 12 | Рак слизистой оболочки дна полости рта | рT3N1M0, III стадия |
Фронтальный отдел дна полости рта, передняя треть языка | М | 58 | Рак плоскоклеточный | ХЛТ (ЛТ 68 Гр), ПХТ | I–III | – | – |
| 13 | Рак гортани | рT4N1M0, IV стадия |
Гортаноглотка | М | 67 | Рак плоскоклеточный | ХЛТ (ЛТ 70 Гр) | II–IV | – | – |
| 14 | Рак языка | рT3N0M0, III стадия |
Субтотальный дефект дна полости рта, языка | Ж | 67 | Рак плоскоклеточный | ХЛТ (ЛТ 40 Гр) | I–III | – | – |
| 15 | Рак слизистой оболочки полости рта | рT4N1M0, IV стадия |
Сквозной дефект щеки | М | 44 | Рак плоскоклеточный | ХЛТ (ЛТ 68 Гр) | – | – | – |
ХЛТ — химиолучевая терапия; ЛТ — лучевая терапия; ПХТ — полихимиотерапия.
Анатомия и техника забора надключичного лоскута. Надключичный лоскут — это регионарный кожно-фасциальный лоскут, забор которого производится в надключичной и дельтовидной области (рис. 1). Кровоснабжение лоскута осуществляется надключичной артерией, отходящей от поперечной артерии шеи, которая, в свою очередь, является ветвью щитошейного ствола. Венозный отток от лоскута происходит по двум сопровождающим надключичную артерию венам, одна из которых впадает в поперечную вену шеи, вторая — в наружную яремную вену. Иннервация лоскута обеспечивается чувствительными поверхностными ветвями шейного сплетения.
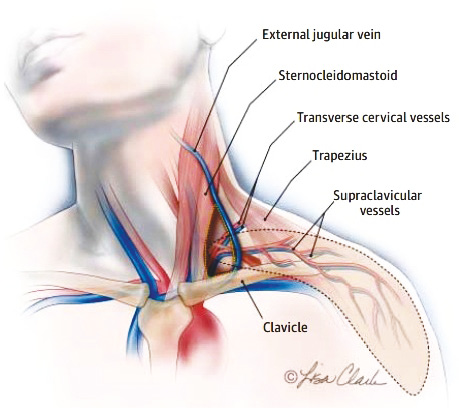
Данные литературы об источнике надключичной артерии несколько отличаются. Согласно результатам исследований B.G. Lamberty надключичная артерия является ветвью поперечной артерии шеи в 93% случаев, а ветвью надлопаточной артерии — в 7% случаев [цит. по 4, 13], в то время как N. Pallua и соавторы обнаружили отхождение надключичной артерии от поперечной артерии шеи в 100% случаев [цит. по 13, 19]. Анатомическое исследование V. Tayfur и соавторов показало, что в 62,9% случаев надключичная артерия является ветвью поперечной артерии шеи, а в 37,1% — надлопаточной артерии [19].
Проекция места отхождения надключичной артерии находится в треугольнике, ограниченном спереди задним краем грудино-ключично-сосцевидной мышцы, сзади — наружной яремной веной, снизу — медиальной третью ключицы; на расстоянии примерно 7,0–8,0 см от вырезки грудины и на 2,0–3,0 см выше верхнего края ключицы [4, 9]. Диаметр начального отдела артерии, питающей лоскут, в среднем составляет 1,0–1,5 мм [4, 13, 19]. Надключичная артерия следует параллельно заднему краю ключицы и далее над дельтовидной мышцей по направлению от акромиона к олекранону [9]. Размеры надключичного лоскута, по данным разных авторов, могут варьировать: ширина — от 4 до 16 см, а длина — от 16 до 41 см [9, 13]. Дуга ротации надключичного лоскута составляет примерно 120–180о [9, 18].
Для определения местоположения надключичной артерии большинство авторов использовали аудиодопплер [2, 9, 13], а некоторые — компьютерную томографию с внутривенным введением контраста [8].
Техника забора стандартного надключичного лоскута детально описана в литературе (рис. 2). Выкраивание лоскута обычно начинается с дистальной части. Кожа, подкожная жировая клетчатка, фасция рассекаются до дельтовидной мышцы, и лоскут поднимается вдоль нее. Далее диссекция продолжается вдоль ключицы и поверхности трапециевидной мышцы. Выполняется мобилизация надключичной клетчатки вокруг сосудистой ножки лоскута. «Скелетизировать» сосудистую ножку не обязательно. При необходимости, для увеличения длины трансплантата, может быть пересечена поперечная артерия шеи дистальнее места отхождения надключичной артерии. Кожная площадка лоскута формируется с учетом формы, размера и локализации дефекта, закрытие которого планируется. Перемещение лоскута на область дефекта чаще проводится через подкожный тоннель, в этом случае выполняется деэпидермизация части трансплантата, которая находится под кожей.
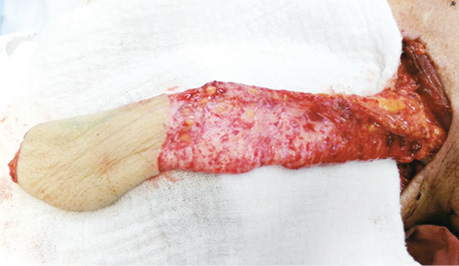
Донорская рана, в большинстве случаев, может быть ушита первично. Однако при большой ширине надключичного лоскута (более 6–7 см) для закрытия донорской раны может потребоваться расщепленный свободный кожный трансплантат.
В нашем исследовании хирургическое лечение было проведено по поводу рака слизистой оболочки полости рта различных локализаций в 10 случаях, по поводу рака ротоглотки — в 2 случаях и рака гортани — в 3 случаях. Локальная распространенность процесса соответствовала рТ2 у 2 пациентов, рТ3 — у 7 и рТ4 — у 6 больных. Метастазы в регионарных лимфатических узлах были обнаружены у 7 пациентов и соответствовали категориям N1 (6 случаев) и N2 (1 случай). В исследование были включены больные в возрасте от 43 до 78 лет, 12 мужчин и 3 женщины. Плоскоклеточный рак был диагностирован в 14, а цистаденоидный рак — в 1 случае. Все пациенты ранее получили химиолучевую терапию (13) или лучевую терапию (2). У 12 больных выполнена диссекция шеи: у 11 — I–III уровень, у 1 — II–IV уровень (в последнем случае надключичный лоскут был взят на контралатеральной стороне). У всех больных с раком слизистой оболочки полости рта и ротоглотки выполнена резекция нижней челюсти: сегментарная — у 10 (в 2 случаях субтотальная), краевая — у 2 пациентов.
Во всех случаях забор трансплантата был произведен по стандартной вышеописанной методике, среднее время процедуры (включая деэпидермизацию) составило 75 мин. Размеры лоскута варьировали: длина — от 18,0 до 28,0 см, ширина — от 5,0 до 8,0 см. Донорская рана ушита первично у 14 пациентов, у одного — с использованием расщепленного свободного кожного трансплантата.
Размеры дефектов варьировали от 4,5×3,5 см (дефект ретромолярной области) до 8,0×8,0 см (циркулярный дефект гортаноглотки, шейного отдела пищевода). Во всех случаях лоскут к области дефекта был проведен через подкожный тоннель.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Основная цель реконструкции послеоперационных дефектов — максимальное сохранение исходной формы и функции при минимальных последствиях со стороны донорской зоны [17].
В современной литературе большинство авторов характеризуют надключичный лоскут как безопасный, универсальный, надежный и простой в заборе [6, 9, 11, 13, 18]. Также отмечается большая дуга ротации, расширяющая спектр применения лоскута, и отсутствие роста волос в области кожной площадки [17]. Кроме того, во многих публикациях сообщается о небольшом количестве осложнений при использовании данного трансплантата [9].
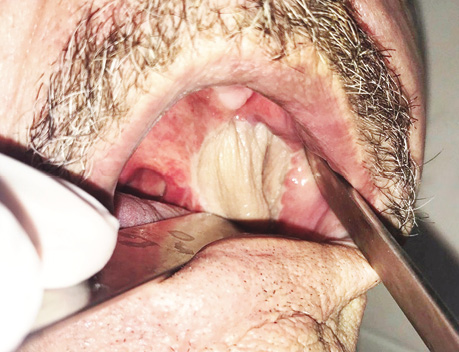
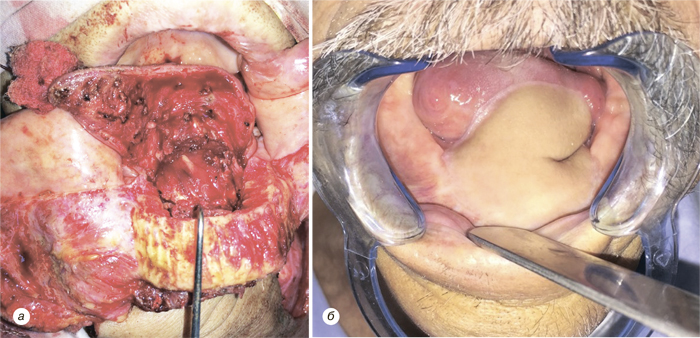
Надключичный лоскут мы использовали для реконструкции послеоперационных дефектов ретромолярной области (рис. 3), боковой поверхности языка, бокового и фронтального отдела дна полости рта (рис. 4), в том числе субтотального дефекта бокового и фронтального отдела дна полости рта (рис. 5), дефектов щеки (рис. 6), в том числе сквозного дефекта щеки (рис. 7), боковой стенки ротоглотки, нижней губы, гортаноглотки, шейного отдела пищевода (рис. 8), шейного отдела трахеи, кожи и мягких тканей передней области шеи (рис. 9).
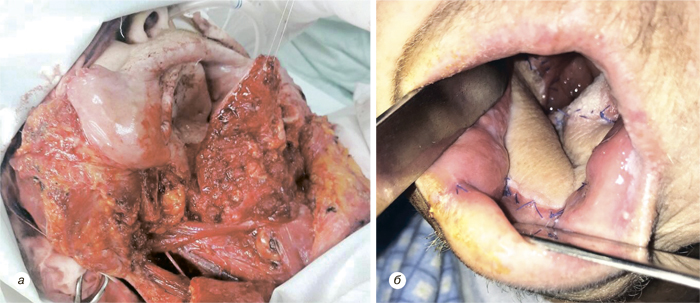
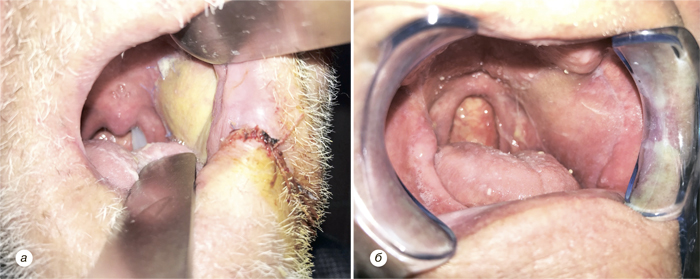
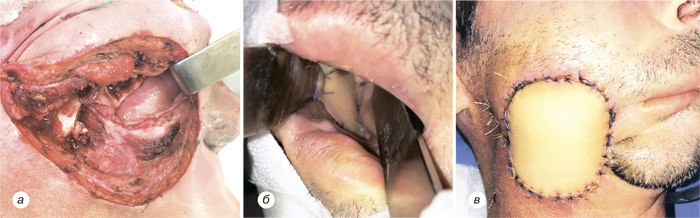
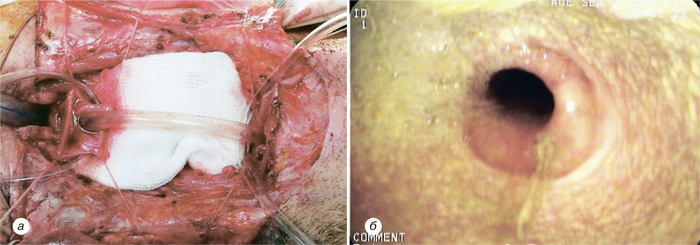
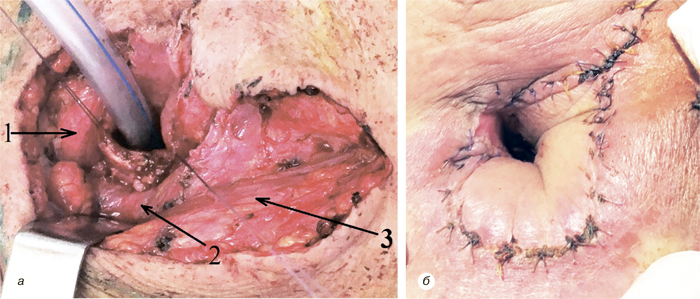
У 1 больного развился частичный некроз кожной площадки надключичного лоскута, что привело к образованию свища полости рта, заживление которого достигнуто путем местного консервативного лечения, повторная операция не потребовалась. У 3 пациентов возникло частичное расхождение краев кожи донорской раны. Во всех случаях получено заживление вторичным натяжением после местного консервативного лечения. Осложнения со стороны донорской раны мы расцениваем как клинически незначимые. В целом количество и виды осложнений, зафиксированных у наших пациентов, соответствуют данным литературы и даже являются несколько меньшими, чем в некоторых исследованиях.
Все наши больные получали до операции химиолучевую или лучевую терапию. В 12 случаях доза лучевой терапии составила 66–70 Гр, а в 3 случаях — 40–44 Гр. При этом количество осложнений минимально, это может свидетельствовать о том, что лучевая терапия существенно не влияет на жизнеспособность надключичного лоскута.
В нашей серии среднее время забора трансплантата (включая деэпидермизацию) составило 75 мин. Это на 15 мин больше, чем аналогичный показатель, указанный в литературе. Мы считаем, что имеющаяся разница обусловлена небольшим опытом работы с надключичным лоскутом.
В 2016 г. L. Giordano и соавторы провели анализ всех опубликованных на тот момент в англоязычной литературе эпизодов использования надключичного лоскута [8]. Согласно представленным данным для реконструкции различных послеоперационных дефектов при опухолях головы и шеи (в том числе дефектов кожи), данный трансплантат был применен в 417 случаях (включая 14 собственных наблюдений авторов). В итоге выполненного анализа, включающего локализацию дефекта, виды и количество осложнений, авторы оценили результаты использования надключичного лоскута при реконструкции дефектов полости рта, гортаноглотки, ротоглотки как превосходные («excellent results») и сравнимые с результатами применения свободных реваскуляризированных трансплантатов.
По мнению ряда исследователей, надключичный лоскут является альтернативой лоскуту большой грудной мышцы (одному из самых надежных и часто используемых лоскутов) в связи с лучшими функциональными и косметическими результатами [2, 4, 7]. Наш опыт применения лоскута большой грудной мышцы и небольшой опыт использования надключичного лоскута также свидетельствуют о том, что последний не менее надежен и более универсален.
Некоторые авторы считают надключичный лоскут таким же тонким и гибким, как лучевой лоскут [13]. В других публикациях сообщается, что надключичный лоскут является прекрасной и надежной альтернативой свободным реваскуляризированным трансплантатам [11, 14, 16, 20].
Мы согласны с данными литературы, о том, что надключичный лоскут во многих случаях может стать «методом первого выбора» или «золотым стандартом» в реконструкции послеоперационных дефектов мягких тканей при опухолях головы и шеи [9, 10, 14, 17, 18].
Большинство авторов сходятся во мнении, что надключичный лоскут может быть использован максимально эффективно и надежно для реконструкции послеоперационных дефектов полости рта, ротоглотки, гортаноглотки, шейного отдела трахеи и пищевода, кожи головы и шеи [8, 13, 17]. Такие дефекты мы получаем при хирургическом лечении пациентов с раком слизистой оболочки полости рта, ротоглотки, гортаноглотки, гортани.
По данным Национального канцер-регистра Украины, в 2017 г. заболеваемость раком слизистой оболочки полости рта составила 5,8 на 100 тыс. населения, глотки — 5,9 на 100 тыс. населения, гортани — 4,9 на 100 тыс. населения [3]. Следовательно, именно эти локализации занимают львиную долю всех злокачественных новообразований головы и шеи. Соответственно, именно с дефектами полости рта, глотки, шейного отдела трахеи и пищевода наиболее часто встречаются специалисты по опухолям головы и шеи в своей повседневной практике.
ВЫВОДЫ
Надключичный лоскут является универсальным трансплантатом для реконструкции послеоперационных дефектов мягких тканей головы и шеи, сочетающим в себе преимущества и регионарных, и свободных лоскутов.
Использование надключичного лоскута является основным методом восстановления послеоперационных дефектов мягких тканей полости рта, ротоглотки, гортаноглотки, шейного отдела трахеи и пищевода, что обусловлено свойствами указанного трансплантата и относительной простотой его забора.
Ранее проведенная лучевая терапия (в дозе 40–70 Гр) не влияет на жизнеспособность надключичного лоскута.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Галич С.П., Гиндич О.А., Процык В.С. и др. (2016) Хирургическое лечение полнослойных дефектов щечной области. Пластична, реконструктивна і естетична хірургія, 3–4, 6–13. https://uapras.org/pro-zhurnal
2. Саприна О.А., Азизян Р.И., Ломая М.В. (2017) Надключичный лоскут в реконструкции дефектов головы и шеи (обзор литературы). Опухоли головы и шеи, 7, 46–49. doi: 10.17650/2222-1468-2017-7-1-46-49
3. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2018) Рак в Україні, 2016–2017. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 19: 18–21, 34–35. http://www.ncru.inf.ua
4. Atallah S., Guth A., Chabolle F., Bach C.A. (2015) Supraclavicular artery island flap in head and neck reconstruction. Eur. Ann. Otorhinolaryngol. Head Neck Dis., 132(5): 291–294. doi: 10.1016/j.anorl.2015.08.021
5. Chiu E.S., Liu P.H., Baratelli R., Lee M.Y. et al. (2010) Circumferential pharyngoesophageal reconstruction with a supraclavicular artery island flap. Plast. Reconstr. Surg., 125(1): 161–166. doi: 10.1097/PRS.0b013e3181c4951e
6. Chu M.W., Levy J.M., Friedlande P.L., Chiu E.S. (2015) Tracheostoma reconstruction with the supraclavicular artery island flap. Ann. Plast. Surg., 74(6), 677–679. doi: 10.1097/SAP.0b013e3182a9e9bd
7. Emerick K.S., Herr M.A., Deschler D.G. (2014) Supraclavicular flap reconstruction following total laryngectomy. Laryngoscope, 124(8): 1777–1782. doi: 10.1002/lary.24530
8. Giordano L., Di Santo D., Occhini A. et al. (2016) Supraclavicular artery island flap (SCAIF): a rising opportunity for head and neck reconstruction. Eur. Arch. Otorhinolaryngol., 273(12): 4403–4412. doi: 10.1007/s00405-016-4092-4
9. Granzow J.W., Suliman A., Roostaeian J. et al. (2013) The supraclavicular artery island flap (SCAIF) for head and neck reconstruction: surgical technique and refinements. Otolaryngol. Head Neck Surg., 148(6): 933–940. doi: 10.1177/0194599813484288
10. Granzow J.W., Suliman A., Roostaeian J. et al. (2013) Supraclavicular artery island flap (SCAIF) vs free fasciocutaneous flaps for head and neck reconstruction. Otolaryngol. Head Neck Surg., 148(6): 941–948. doi: 10.1177/0194599813476670
11. Herr M.W., Emerick K.S., Deschler D.G. (2014) The supraclavicular artery flap for head and neck reconstruction. JAMA Facial. Plast. Surg., 16(2): 127–132. doi: 10.1001/jamafacial.2013.2170
12. Kadakia S., Agarwal J., Mourad M. et al. (2017) Supraclavicular flap reconstruction of cutaneous defects has lower complication rate than mucosal defects. J. Reconstr. Microsurg., 33(4): 275–280. doi: 10.1055/s-0036-1597718
13. Kokot N., Mazhar K., Reder L.S. et al. (2013) The supraclavicular artery island flap in head and neck reconstruction applications and limitations. JAMA Otolaryngol. Head Neck Surg., 139(11): 1247–1255. doi: 10.1001/jamaoto.2013.5057
14. Kokot N., Mazhar K., Reder L.S. et al. (2014) Use of the Supraclavicular artery island flap for reconstruction of cervicofacial defects. Otolaryngol. Head Neck Surg., 150(2): 222-228. doi: 10.1177/0194599813514205
15. Kozin E.D., Sethi R.K., Herr M. et al. (2016) Comparison of perioperative outcomes between the supraclavicular artery island flap and fasciocutaneous free flap. Otolaryngol. Head Neck Surg., 154(1): 66–72. doi: 10.1177/0194599815607345
16. Pabiszczak M., Banaszewski J., Pastusiak T., Szyfter W. (2015) Supraclavicular artery pedicled flap in reconstruction of pharyngocutaneous fistulas after total laryngectomy. Otolaryngol. Pol., 69(2): 9–13. doi: 10.5604/00306657.1147032
17. Patel U.A., Hartig G.K., Hanasono M.M. et al. (2017) Locoregional flaps for oral cavity reconstruction: a review of modern options. Otolaryngol. Head Neck Surg., 157(2): 201–209. doi: 10.1177/0194599817700582
18. Shenoy A., Patil V.S., Prithvi B.S. et al. (2013) Supraclavicular artery flap for head and neck oncologic reconstruction: an emerging alternative. Int. J. Surg. Oncol., 2013: 658989. doi: 10.1155/2013/658989
19. Tayfur V., Magden O., Edizer M., Menderes A. (2010) Supraclavicular artery flap. J. Craniofac. Surg., 21(6): 1938–1940. doi: 10.1097/SCS.0b013e3181f4ee38
20. Welz C., Canis M., Schwenk-Zieger S. et al. (2017) Oral Cancer reconstruction using the supraclavicular artery island flap: comparison to free radial forearm flap. J. Oral. Maxillofac. Surg., 75(10): 2261–2269. doi: 10.1016/j.joms.2017.02.017
Фёдоров Денис Юрьевич
88014, Ужгород, ул. Бродлаковича, 2
Закарпатский областной клинический онкологический диспансер
E-mail: fedorov.denis.13@rambler.ru
Correspondence:
Fedorov Denis
2 Brodlakovicha str., Uzhhorod 88014
Transcarpathian Regional Clinical Oncologic Dispensary
E-mail: fedorov.denis.13@rambler.ru














Leave a comment