Патогенетичні концепції і лікування серозного раку яєчника початкових стадій на сучасному етапі
Резюме. Існує два сигнальні шляхи розвитку серозного раку яєчника. Згідно з молекулярно-біологічною дуалістичною концепцією Курмана низькозлоякісний серозний рак яєчника (І типу) розвивається з пограничних серозних пухлин, а високозлоякісний серозний рак яєчника (ІІ типу) — з прихованих інтраепітеліальних карцином фімбріального відділу маткової труби — «серозної тубарної інтраепітеліальної карциноми» з вторинним залученням яєчника у пухлинний процес або з малігнізованої кортикальної інклюзійної кісти, яка утворюється з нормального фімбріального епітелію, що імплантується на оголеній поверхні яєчника під час овуляції. Більшість випадків серозного раку яєчника ранніх стадій представлена пухлинами І типу. Хірургія з виконанням адекватного стадіювання є основним методом лікування серозного раку яєчника ранніх стадій. Стандартно хірургічне лікування включає повну абдомінальну гістеректомію, двобічну сальпінгоофоректомію, оментектомію, виконання перитонеальних змивів, біопсію очеревини, ревізію черевної порожнини і заочеревинного простору для оцінки стану тазових і парааортальних лімфовузлів. Можлива консервативна операція в обсязі однобічної аднексектомії з проведенням адекватного стадіювання на основі консиліуму для молодих пацієнток з Іа стадією захворювання. Хірургічна лапароскопія може застосовуватися в лікуванні серозного раку яєчника І–ІІа стадії з великою обережністю за умови ретельного відбору пацієнток на діагностичному етапі. Ад’ювантна хіміотерапія із застосуванням таксанів/карбоплатину або карбоплатину в монорежимі протягом 3–6 курсів проводиться у пацієнток з проміжним або високим ризиком розвитку рецидиву захворювання або у разі неадекватно виконаного стадіювання.
Одержано 11.09.2018
Прийнято до друку 27.09.2018
Епітеліальний рак яєчника є найбільш частою причиною смерті від гінекологічних злоякісних пухлин у розвинених країнах світу [9]. Найпоширенішим підтипом епітеліального раку яєчника є серозний рак, що становить, за даними різних авторів, 42–85% випадків серед інших морфологічних форм цього захворювання [1, 4, 5, 7, 11, 12].
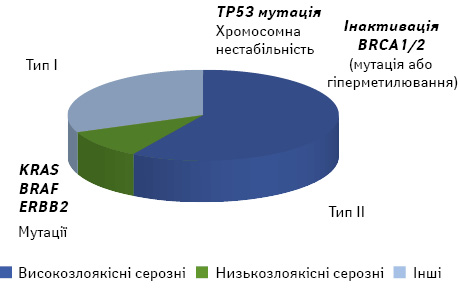
Згідно з теорією R.J. Kurman та M. Le Shih (2011), існує два сигнальні шляхи розвитку серозного раку яєчника. Так, відповідно до сучасної молекулярно-біологічної дуалістичної концепції виділяють рак яєчника І та ІІ типу [5, 7, 9, 11, 12]. За даними R.J. Kurman (2013), є помітні відмінності між низькозлоякісними (low grade) і високозлоякісними (high grade) серозними пухлинами. Якщо коротко, то перші є повільно прогресуючими, часто виявляються у I стадії (пухлина, обмежена яєчником) і розвиваються з добре організованих попередників, так званих атипових проліферативних (пограничних) пухлин, які характеризуються певними мутаціями, включаючи KRAS, BRAF і ERBB2; вони відносно генетично стабільні. І навпаки, високозлоякісні серозні карциноми агресивні, виявляються у поширених стадіях і розвиваються з інтраепітеліальних карцином у фаллопієвій трубі. Вони містять мутації TP53 у більш ніж 95% випадків і рідко мають мутації, виявлені в низькозлоякісних серозних пухлинах. На момент діагнозу вони демонструють виражені хромосомні аберації, але у процесі розвитку хвороби ці зміни залишаються відносно стабільними (рис. 1, 2). Згідно з результатами недавніх досліджень безпосереднім попередником високозлоякісної серозної карциноми яєчника є прихована інтраепітеліальна карцинома фімбріального відділу маткової труби, позначена авторами як «серозна тубарна інтраепітеліальна карцинома» , а яєчник залучається у процес вторинно (рис. 3). Іншим можливим механізмом розвитку «оваріальної» високозлоякісної серозної карциноми є імплантація нормального фімбріального епітелію на оголеній поверхні яєчника в місці розриву при овуляції. Передбачається, що цей трубний епітелій може призвести до утворення кортикальної інклюзійної кісти, яка в подальшому може зазнати злоякісної трансформації (рис. 4).
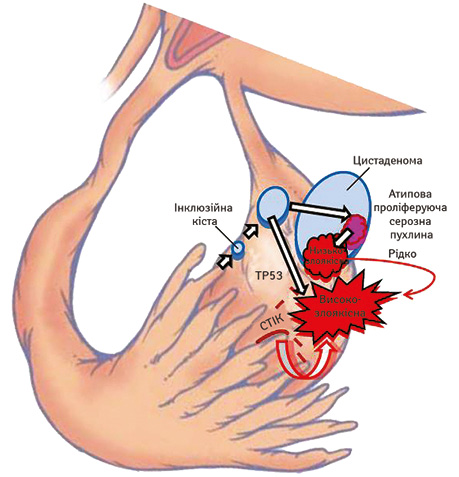
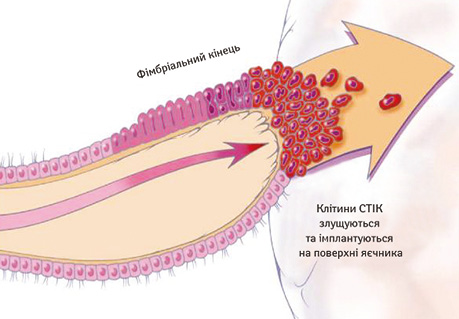
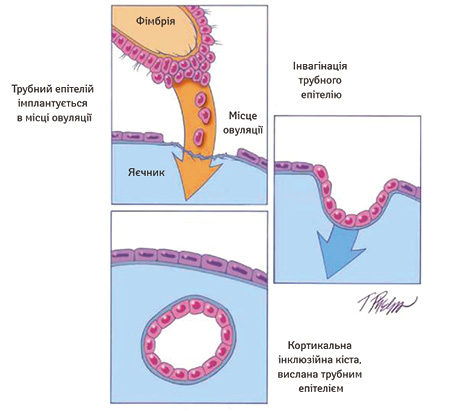
Таким чином, теорія розвитку серозних пухлин яєчника з інклюзійних кіст не відкидається, а набуває нової спрямованості: інклюзійні кісти яєчника розвиваються шляхом імплантації тубарної (мюллерівського типу) тканини, а не шляхом метаплазії з покривного епітелію яєчника, як це було прийнято раніше [11, 12].
Хірургічний компонент є одним із найважливіших аспектів у комплексі всіх лікувальних заходів, спрямованих на боротьбу з раком яєчника. Хірургічне лікування повинно виконуватися лікарем, який має онкогінекологічну підготовку і володіє всіма методами хірургічних втручань у хворих на розповсюджений рак яєчника. Бажано, щоб це лікування проводилося в спеціалізованому онкологічному стаціонарі, що істотно підвищує загальну виживаність хворих згідно з даними багатьох досліджень [16, 17].
Важлива роль у виборі тактики подальшого ведення пацієнток, особливо при виконанні органозберігаючого лікування, відводиться хірургічному стадіюванню, що включає в себе ретельний огляд черевної порожнини після виконання серединної лапаротомії або діагностичної лапароскопії, абдомінальну гістеректомію, білатеральну сальпінгоофоректомію, виконання множинних біопсій очеревини діафрагмальної поверхні, латеральних каналів, малого таза, тазову і парааортальну лімфаденектомію, видалення великого сальника, взяття асцитичної рідини, перитонеальних змивів або мазків-відбитків для проведення цитологічного і морфологічного дослідження [1, 6, 16, 18]. Значимість стадіювання підкреслює той факт, що у 22% хворих із первинно діагностованою І стадією захворювання мікроскопічне дослідження виявляє поширений процес, що в подальшому вимагає розширення спектра лікувальних заходів [5].
У науково-дослідному відділенні онкогінекології Національного інституту раку розроблено форму обов’язкового додатка до протоколу операції хворої із пухлинним утворенням яєчника, що включає стандартизований перелік усіх етапів хірургічного стадіювання, яка рекомендується до широкого впровадження для лікарів акушерів-гінекологів, гінекологів-онкологів, хірургів при виконанні оперативного лікування з приводу оваріального новоутворення (табл. 1).
Стандартно хірургічне лікування при ранніх стадіях раку яєчника (І–ІІа за FIGO) включає повну абдомінальну гістеректомію, двобічну сальпінгоофоректомію, оментектомію, виконання перитонеальних змивів, біопсію очеревини, ревізію черевної порожнини і заочеревинного простору для оцінки стану тазових і парааортальних лімфовузлів [18]. Для молодих пацієнток, зацікавлених у збереженні репродуктивної функції, в Іа стадії можлива консервативна операція в обсязі однобічної аднексектомії з проведенням адекватного стадіювання на основі консиліуму [1, 5].
У літературі широко обговорюється використання малоінвазивних хірургічних методик для лікування при початкових стадіях раку яєчника [2, 8, 10, 18]. Вперше про успішне проведення лапароскопічного стадіювання при раку яєчника І стадії було повідомлено в роботі Н. Reich та співавторів у 1990 р., а в 1994 р. D. Querleu і E. LeBlanc виконали операції лапароскопічним доступом в 9 випадках раку яєчника і маткової труби та оцінили можливість проведення лапароскопічної парааортальної лімфаденектомії [14, 15]. Після цього з’явилося багато доповідей про можливості та ефективність лапароскопічної хірургії в лікуванні при початкових стадіях раку яєчника [8]. Із безперечних плюсів лапароскопічних операцій у такому разі можна виділити малу травматичність, швидку реабілітацію хворих у післяопераційний період, а також істотний економічний ефект, що стосується скорочення часу перебування пацієнтки в стаціонарі [3, 8, 18]. Серед недоліків методу в лікуванні хворих із ранніми стадіями раку яєчника слід виділити наявність сумнівів у проведенні хірургічного стадіювання належним чином порівняно з відкритим доступом, існування ризику появи метастазів у місці хірургічних портів, а також більш високі показники розриву кістозної пухлини під час лапароскопії [8]. У 2014 р. у дослідженні Y.J. Koo та співавторів, в якому показано в цілому низку переваг у лікуванні пацієнтів із раком яєчника початкових стадій лапароскопічним доступом порівняно з лапаротомним, виділено одне істотне обмеження, безпосередньо пов’язане з проведенням адекватного хірургічного стадіювання, а саме обмежений доступ (візуалізація) до таких важливих ділянок, як гепатодіафрагмальна зв’язка, сальникова сумка, ворота печінки, селезінково-діафрагмальна зв’язка, а також приховані простори брижі кишечнику [10]. Із вищезазначеної причини хірургічну лапароскопію в лікуванні хворих на рак яєчника І–ІІа стадії слід застосовувати з великою обережністю, ретельно виконуючи відбір відповідних пацієнток на доопераційному діагностичному етапі.
Незважаючи на той факт, що лапароскопічне втручання з приводу доброякісних пухлин яєчника є золотим стандартом у загальній гінекологічній практиці, необхідний ретельний відбір пацієнток для подібних втручань. Професійна оцінка УЗД-критеріїв пухлин яєчника з виявленням багатокамерних солідних пухлин, папілярних розростань зовні та в середині капсули, рівня васкуляризації за критеріями допплер-дослідження є протипоказанням до хірургічного втручання без термінового морфологічного дослідження; необхідні уточнюючі методи обстеження, консультація хворих онкогінекологом. Інтраопераційне гістологічне дослідження видаленої пухлини, стандартне хірургічне стадіювання є обов’язковими компонентами будь-якої операції з приводу пухлини яєчника з метою визначення тактики та обсягу оперативного втручання. Ретельне обстеження органів черевної порожнини під час оперативного втручання, виконання всіх елементів хірургічного стадіювання, що має бути відображеним у протоколі операції (див. табл. 1), дасть змогу встановити стадію хвороби та спланувати лікування, запобігти повторним хірургічним втручанням [2].
Ад’ювантна хіміотерапія при ранніх стадіях раку яєчника рекомендована до призначення в усіх випадках, окрім Іа стадії при високому ступені диференціювання пухлини (G1). Так, метааналіз п’ятирічних даних із трьох досліджень показав, що жінки з I–IIa стадіями раку яєчника, які отримали ад’ювантну хіміотерапію на основі платини, мали кращу загальну виживаність, ніж ті, у кого такого лікування не проведено (відношення ризиків (HR) 0,71; 95% довірчий інтервал (ДІ) 0,53–0,93; 1008 жінок, 3 дослідження). Аналогічним чином метааналіз п’ятирічних даних із чотирьох досліджень показав, що жінки, які отримали ад’ювантну хіміотерапію, мали кращу виживаність без прогресування, ніж ті, хто її не одержав (HR 0,67; 95% ДІ 0,53–0,84; 1170 жінок, 4 дослідження) [13]. У дослідженні ACTION і ICON1 у пацієнток з ранніми стадіями раку яєчника показано, що ступінь диференціювання є найпотужнішим прогностичним показником безрецидивної виживаності. Також прогностичними факторами виявилися розрив пухлини під час операції, двобічне ураження яєчників і вік хворих [6].
Автори [1, 5, 6] виділяють групи з високим, проміжним і низьким ризиком розвитку рецидивів захворювання (табл. 2).
Тож ад’ювантна хіміотерапія рекомендована пацієнткам з проміжним і високим ризиком рецидиву захворювання, а також при неадекватно проведеному стадіюванні хвороби. У цих випадках застосовується ад’ювантне лікування з використанням таксанів/карбоплатину або карбоплатину в монорежимі протягом 3–6 курсів хіміотерапії [5, 6].
ВИСНОВКИ
1. Хірургічне стадіювання та інтраопераційне гістологічне дослідження видаленої пухлини є обов’язковим компонентом будь-якої операції з приводу пухлини яєчника з метою визначення обсягу оперативного втручання і тактики подальшого лікування.
2. Пацієнткам з серозним раком яєчника ранніх стадій з проміжним або високим ризиком рецидиву та при неадекватно проведеному стадіюванні рекомендовано 3–6 курсів ад’ювантної хіміотерапії.
Список використаної літератури
1. Венедиктова М.Г., Доброхотова Ю.Э. (2015) Онкогинекология в практике гинеколога. М.: ГЭОТАР-Медиа, 288 с.
2. Воробйова Л.І., Болгова Л.С., Свінціцький В.С. та ін. (2011) Хірургічне стадіювання при пухлинних новоутвореннях яєчника. Київ, 4 с.
3. Єгоров О.О. (2012) Лапароскопічне органозберігаюче лікування пограничних пухлин і ранньої онкологічної патології яєчників. Таврический медико-биологический вестник, 2(58): 115–117.
4. Карташов С.М. (2012) Рак яичников. Одеський мед. журнал, 6: 22–24.
5. Воробьева Л.И. (2012) Практическая онкогинекология. Київ, 228 с.
6. Переводчикова Н.И., Горбунова В.А. (2017) Руководство по химиотерапии опухолевых заболеваний. 4-е изд., расширенное и дополненное. М.: Практическая медицина, 688 с.
7. Чайка К.В., Жихарський Р.В., Камінський А.В., Сербенюк А.В. (2015) Сучасні погляди на канцерогенез епітеліального раку яєчників. Здоровье женщины, 4(100): 52–56.
8. Daisuke A. (2014) Laparoscopic surgery for early ovarian cancer. J. Gynecol. Oncol., 25(3): 168–169.
9. Dong A., Lu Y., Lu B. (2016) Genomic/epigenomic alterations in ovarian carcinoma: translational insight into clinical practice. J. Cancer, 7(11): 1441–1451.
10. Koo Y.J., Kim J.E., Kim Y.H. et al. (2014) Comparison of laparoscopy and laparotomy for the management of early-stage ovarian cancer: surgical and oncological outcomes. J. Gynecol. Oncol., 25: 111–117.
11. Kurman R.J. (2013) Origin and molecular pathogenesis of ovarian high-grade serous carcinoma. Ann. Oncol., 24(Suppl. 10): x16–21.
12. Kurman R.J., Shih Le M. (2011) Molecular pathogenesis and extraovarian origin of epithelial ovarian cancers-shifting the paradigm. Hum. Pathol., 42(7): 918–931.
13. Lawrie T.A., Winter-Roach B.A., Heus P., Kitchener H.C. (2015) Adjuvant (post-surgery) chemotherapy for early stage epithelial ovarian cancer. Cochrane Database Syst Rev., 12: CD004706.
14. Querleu D., LeBlanc E. (1994) Laparoscopic infrarenal paraaortic lymph node dissection for restaging of carcinoma of the ovary or fallopian tube. Cancer, 73: 1467–1471.
15. Reich H., McGlynn F., Wilkie W. (1990) Laparoscopic management of stage I ovarian cancer: a case report. J. Reprod. Med., 35: 601–604.
16. Sun Hee Rim, Shawn Hirsch, Cheryll C. Thomas et al. (2016) Gynecologic oncologists involvement on ovarian cancer standard of care receipt and survival. World J. Obstet. Gynecol., 5(2): 187–196.
17. Vernooij F., Heintz A.P., Coebergh J.W. et al. (2009) Specialized and high-volume care leads to better outcomes of ovarian cancer treatment in the Netherlands. Gynecol. Oncol., 112(3): 455–461.
18. Ying Zhang, Shuying Fan, Yang Xiang et al. (2015) Comparison of the prognosis and recurrence of apparent early-stage ovarian tumors treated with laparoscopy and laparotomy: a meta-analysis of clinical studies. BMC Cancer, 15: 597.
Патогенетические концепции и лечение серозного рака яичника начальных стадий на современном этапе
Национальный институт рака, Киев
Резюме. Существует два сигнальных пути развития серозного рака яичника. Согласно молекулярно-биологической дуалистической концепции Курмана низкозлокачественный серозный рак яичника (I типа) развивается из пограничных серозных опухолей, а высокозлокачественный серозный рак яичника (II типа) — из скрытых интраэпителиальных карцином фимбриального отдела маточной трубы — «серозной тубарной интраэпителиальной карциномы» со вторичным вовлечением яичника в опухолевый процесс или малигнизированной кортикальной инклюзионной кисты, которая образуется из нормального фимбриального эпителия, имплантирующегося на обнаженной поверхности яичника во время овуляции. Большинство случаев серозного рака яичника ранних стадий представлена опухолями I типа. Хирургия с выполнением адекватного стадирования является основным методом лечения серозного рака яичника ранних стадий. Стандартно хирургическое лечение включает полную абдоминальную гистерэктомию, двустороннюю сальпингоофорэктомию, оментэктомию, выполнение перитонеальных смывов, биопсию брюшины, ревизию брюшной полости и забрюшинного пространства для оценки состояния тазовых и парааортальных лимфоузлов. Возможна консервативная операция в объеме односторонней аднексэктомии с проведением адекватного стадирования на основе консилиума для молодых пациенток с Іа стадией заболевания. Хирургическая лапароскопия может применяться в лечении серозного рака яичника I–IIa стадии с большой осторожностью при условии тщательного отбора пациенток на диагностическом этапе. Адъювантная химиотерапия с применением таксанов/карбоплатина или карбоплатина в монорежиме в течение 3–6 курсов проводится у пациенток с промежуточным или высоким риском рецидива заболевания или в случае неадекватно выполненного стадирования.
патогенетические концепции; серозный рак яичника; хирургическое лечение; адъювантная химиотерапия.
Єгоров Михайло Юрійович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: yegorovmichael@gmail.com
Yegorov Mykhailo
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
E-mail: yegorovmichael@gmail.com
















Leave a comment