Врахування анатомії борозни Рув’є в хірургії печінки у хворих на метастатичний колоректальний рак
Бурлака А.А.1, Лісний І.І.1, Рудюк Т.О.2, Хворостовський Р.Р.1, Колеснік О.О.1
- 1Національний інститут раку, Київ
- 2Національний медичний університет ім. О.О. Богомольця МОЗ України, Київ
Резюме. Борозна Рув’є (БР) — важливий анатомічний орієнтир в хірургії печінки. Ідентифікація БР може запобігти пошкодженню структур воріт печінки при виконанні анатомічних резекцій в проекції правої частки та забезпечити вибірковий контроль судин глісоновим методом, включно з селективним маневром Прінгла у хворих на метастатичний колоректальний рак (мКРР). Мета. Визначити варіантну анатомію БР у хворих на мКРР. Результати. БР була присутня у 82% випадків, із них у 72% ідентифікована в печінці як відкрита. Сплавлений тип виявлено у 12% випадків, проте 18% печінки борозни не мали. Протяжність відкритої БР становила 28±2,3 мм (24–32 мм), її глибина — 6±2 мм (діапазон 4–8 мм). Праву задню секційну ніжку виявлено у 70% випадків, а у 25% — гілку портальної вени до VI сегмента. Висновки. Знання аспектів варіантної анатомії БР робить більш безпечними оперативні втручання на правій частці печінки при мКРР.
Одержано 01.08.2018
Прийнято до друку 21.08.2018
ВСТУП
Щорічно у світі Всесвітня організація охорони здоров’я реєструє понад 940 тис. нових випадків захворювання на колоректальний рак і близько 500 тис. смертей від нього [13]. Найчастіше органами-мішенями метастатичної хвороби при колоректальному раку (метастатичного колоректального раку — мКРР) є печінка і легені [16]. Резекція печінки з приводу її метастатичного ураження — беззаперечний стандарт протягом останніх трьох декад, оскільки забезпечує статистично достовірне покращення віддалених результатів лікування цієї когорти хворих [16].
Дисекція структур гепатодуоденальної зв’язки (портальна вена, печінкова артерія, жовчні протоки) застосовується при стандартних гемігепатектоміях. Після скелетизації зазначених структур стає можливим позапечінкова транссекція іпсилатеральної гілки портальної вени та печінкової артерії з метою створення зон демаркації та визначення анатомічних орієнтирів транссекції паренхіми печінки. В окремих випадках (анатомічно складна локалізація метастазу) доцільніше застосовувати перетискання портальної тріади в межах гепатодуоденальної зв’язки — маневр Прінгла, що дозволяє зменшити крововтрату під час виконання транссекції паренхіми печінки [12]. Проте класичний маневр Прінгла має обмеження через ефект тотальної теплової ішемії печінки та ішемії/реперфузії, який продемонстрував негативний онкологічний результат in vivo та in vitro [9]. З метою зменшення крововтрати, уникнення технічно складної дисекції воріт печінки та скорочення тривалості оперативного втручання було розроблено глісоновий метод [8, 9].
За останнє десятиліття розвитку хірургії печінки багато уваги було приділено алгоритмам та стратегіям, а також пошуку анатомічних маркерів, які б допомогли уникати ускладнень та спростити складні операції на правій частці печінки.
У 1938 р. Henri Rouvière зробив вагомий внесок, виконавши опис анатомії борозни у воротах печінки, який рекомендував використовувати як орієнтир для початку безпечної резекції паренхіми печінки. Однак відсутність глибоких знань анатомії та розуміння принципів безпечної хірургії печінки на той час призвели до нерозуміння важливості зробленого відкриття. У посиланнях на анатомічну літературу інформації щодо борозни Рув’є (БР) практично немає, її частота не є чітко визначеною, а морфологія точно не описана. М. Zubair та співавтори описали борозну та запропонували її класифікацію (відкритий/закритий тип) залежно від того, чи була візуалізована глісонова ніжка в борозні [16]. M. Singh та співавтори запропонували класифікацію БР залежно від її довжини, ширини і глибини. Відмічався також напрямок борозни у всіх трьох її формах («рубець», щілина або глибока борозна) як горизонтальний, косий або вертикальний. Знання анатомії БР та її варіантів є вагомим аспектом успішного виконання анатомічних резекцій в межах правої частки печінки, тому метою нашого дослідження було визначити варіантну анатомію БР у хворих на мКРР.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Проведено аналіз даних літератури в Україні та світі за останні 10 років за базами PubMed, Cochrane Library та Національного інституту раку. Також виконано аналіз хворих на мКРР із метахронним метастатичним ураженням печінки (n=62), яким виконували резекцію печінки із грудня 2016 по липень 2018 р. в умовах клініки Національного інституту раку.
У кожному клінічному випадку був застосований мультидисциплінарний розбір, участь у якому брали хірурги, онкологи, хіміотерапевти та радіологи. Діагноз метастатичного ураження печінки підтверджено цито-/гістологічними методами в результаті тонкоголкової біопсії патологічних вогнищ печінки, крім того, рутинно застосовували комп’ютерну томографію грудної, черевної порожнин та малого таза із внутрішньовенним контрастуванням і магнітно-резонансну томографію із внутрішньовенним контрастуванням. Позитронно-емісійну томографію використовували при плануванні складних резекцій та у випадках підозри на наявність метастатичного ураження інших органів/сайтів.
Хірургічна техніка передбачала виконання радикальної резекції із максимально можливим збереженням паренхіми та забезпеченням адекватного відступу від краю пухлини (4–10 мм). Кожна операція супроводжувалася інтраопераційним ультразвуковим дослідженням з метою розмітки вогнищ відносно магістральних печінкових вен та структур глісонового дерева, а також можливого виявлення нових дрібних метастазів. До великих резекцій печінки відносили видалення трьох та більше сегментів печінки (класифікація Couinaud). Техніка ішемії передбачала застосування селективного маневру Прінгла (частка/секція/сегмент). Також застосовували позапечінковий та внутрішньопечінковий глісонові методи мобілізації [12]. Транссекцію паренхіми здійснювали за допомогою методу «сrash clamp», при технічно складних операціях застосовували ультразвуковий кавітатор-аспіратор Söring Ultrasonic Generator Sonoca 300. Гемостаз резектованої паренхіми здійснювали з допомогою біполярного пінцета, кліпування LT 200, LT 300 та прошивання prolene 4.0, 5.0.
Статистичний аналіз даних проводили за пакетом STATISTICA 8.0. Нормальність розподілу змінних перевіряли тестом Шапіро — Вілка. За критичний рівень значущості під час перевірки статистичних гіпотез приймали p=0,05.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Характеристика хворих. Серед 62 пацієнтів, включених в дослідження, чоловіків було 34 (54,8%), жінок — 28 (45,2%). Середній вік контингенту становив 55±0,43 року та коливався в діапазоні від 34 до 76 років. У більшості пацієнтів первинні пухлини інфільтрували субсерозну оболонку стінки кишечнику без інвазії у суміжні органи чи структури (Т3) — 39 (62,9%). Ураження регіонарних лімфатичних вузлів (pN1 та pN2) було зареєстровано відповідно у 24 (38,7%) та 6 (9,5%) пацієнтів.
У ході оцінки раннього післяопераційного періоду до уваги бралися ускладнення та інші клініко-патологічні дані, які могли вплинути чи охарактеризувати його перебіг та допомогти оцінити переваги і недоліки досліджуваної хірургічної тактики. Зокрема, до уваги брали такі показники, як об’єм інтраопераційної крововтрати, тривалість оперативних втручань, ліжко-день, загальний рівень післяопераційних ускладнень та рівень післяопераційної смертності (табл. 1).
| Види резекцій | n (%) |
| Правобічна гемігепатектомія | 6 (9,6) |
| Лівобічна гемігепатектомія | 3 (4,8) |
| Інші трисегментектомії | 16 (25,8) |
| Резекція лівої латеральної секції (Sg II–III) | 12 (19,4) |
| Резекція передньої секції (Sg V/VIII) | 1 (1,6) |
| Резекція задньої секції (Sg VI/VII) | 6 (9,6) |
| Інші бісегментектомії | 6 (9,6) |
| Анатомічна резекція одного сегмента печінки | 6 (9,6) |
| Атипова резекція (≥4/<4 метастазів) | 5/1 (9,6) |
| Усього | 62 (100,0) |
| Періопераційні результати | |
| Інтраопераційна крововтрата, мл | 382±221 |
| Тривалість резекції, хв | 254±63,7 |
| Періопераційна гемотрансфузія, мл | 380±120 |
| Теплова ішемія (селективний маневр Прінгла), хв | 25,1±13,6 |
| Види глісонового методу: | |
| • позапечінковий | 54 (87,1) |
| • внутрішньопечінковий | 8 (12,9) |
| Безпосередні результати* | |
| Перебування в стаціонарі (ліжко-день) | 12,5±6,1 |
| Хірургічні ускладнення ≥ІІІ ступеня за Clavien — Dindo** |
5 (8,06) |
| Ексудативний плеврит | 4 (6,4) |
| Інфекція рани | 2 (3,2) |
| Гостра печінкова недостатність, grade A | 2 (3,2) |
| Гостра печінкова недостатність, grade B | 1 (1,6) |
| Білома | 2 (3,2) |
| Пневмонія | 3 (4,8) |
| Інше | 1 (1,6) |
| Усього ускладнень | 15 (24,2) |
| Післяопераційна смертність | – |
Безперервні змінні представлені як середнє значення ± стандартна похибка.
*Враховувалися результати впродовж перших 30 діб з моменту оперативного лікування.
**Враховувалися ускладнення ≥ІІІ ступеня тяжкості відповідно до класифікації Clavien — Dindo.
Аналіз типу резекцій продемонстрував, що в 25 (40,3%) випадках виконано великі резекції, зокрема гемігепатектомії — 9 (14,5%), інші трисегментектомії — 16 (25,8%). Анатомічні резекції секцій печінки зареєстрували в 12 (19,4%), 1 (1,6) та 6 (9,6%) хворих, відповідно для лівої латеральної, передньої та правої задньої секції печінки, резекції двох анатомічних сегментів виконали в 6 (9,6%) випадках. Також серед видів оперативного втручання були анатомічна сегментектомія та атипові резекції — по 6 (9,6%) випадків.
Інтраопераційна крововтрата становила 382±221 мл, тривалість резекції — 254±63,7 хв, періопераційна гемотрансфузія — 380±120 мл, а теплова ішемія (селективний маневр Прінгла) — 25,1±13,6 хв. Власні результати демонструють, що у більшості випадків застосовували позапечінковий метод виконання глісонової мобілізації — 54 (87,1%). Хірургічні ускладнення згідно з класифікацією Clavien — Dindo ≥ІІІ ступеня зареєстровано в 5 (8,06%) хворих, летальних випадків не було.
Серед усіх хірургічних ускладнень у 4 (6,4%) випадках зафіксовано ексудативний плеврит, в 3 (4,8%) — пневмонію, інфекцію післяопераційної рани, білому та прояви гострої печінкової недостатності — відповідно по 2 (3,2%) клінічні випадки. Загалом ускладнення виявлено у 15 (24,2%) хворих.
Інтраопераційний аналіз анатомії БР продемонстрував варіантну анатомію борозни та її вмісту у хворих на мКРР (табл. 2).
| Змінні | n (%) |
| Типи БР: | |
| • відкритий | 51 (82,3) |
| • сплавлений | 7 (11,3) |
| • закритий | 4 (6,4) |
| Характеристики БР: | |
| • довжина (середнє значення ± стандартна похибка), мм | 28±4 |
| • глибина (середнє значення ± стандартна похибка), мм | 6±2 |
| Вміст БР: | |
| • глісонова одиниця до задньої секції печінки (Seg VI/VII) | 43 (69,4) |
| • глісонова одиниця до VI сегмента печінки (Seg VI) | 4 (6,5) |
| • інші структури | 15 (24,1) |
Відповідно до раніше описаної класифікації БР ми розрізняли 3 типи: відкритий зареєстровано у 51 (82,3%), сплавлений — 7 (11,3%), закритий тип, або ж рубець у проекції борозни, виявлено у 4 (6,4%) хворих. Середня протяжність БР в оперованих хворих становила 28±4 мм, тоді як її глибина — 6±2 мм. У більшості випадків у проекції БР знаходилася глісонова одиниця до задньої секції печінки (Seg VI/VII) — 43 (69,4%), у 4 клінічних випадках візуалізована окрема глісонова одиниця до VI сегмента печінки (Seg VI) — 4 (6,5%), також у 15 (24,1%) вміст БР являв собою інші анатомічні структури.
Анатомічні особливості розгалуження ніжок глісонового дерева дозволяють умовно розділити печінку на 3 секції (ліву, серединну та праву), що дає можливість високоселективно контролювати останні, переважно без застосування інтраопераційної ультрасонографічної чи холангіографічної навігації [1]. Виділення та перетискання загальної правої чи лівої ніжки глісонового дерева (секцій/сегментів) є необхідними маневрами до початку транссекції паренхіми печінки. На відміну від класичного маневру Прінгла, селективне перетискання портальної тріади глісоновим методом дозволяє уникнути системного патологічного ефекту ішемії/реперфузії в майбутній культі печінки і тим самим запобігти можливим негативним онкологічним наслідкам для оперованого хворого (неконтрольоване пухлинне прогресування). Глісоновий метод мобілізації воріт печінки здобув свою популярність за останню декаду завдяки відносній простоті. Мінімалізація тривалості ішемізації всієї печінки та/чи частки в результаті застосування глісонового підходу та знання анатомічних орієнтирів, у тому числі БР, дозволяють покращити якість хірургії у хворих на мКРР (рис. 1).
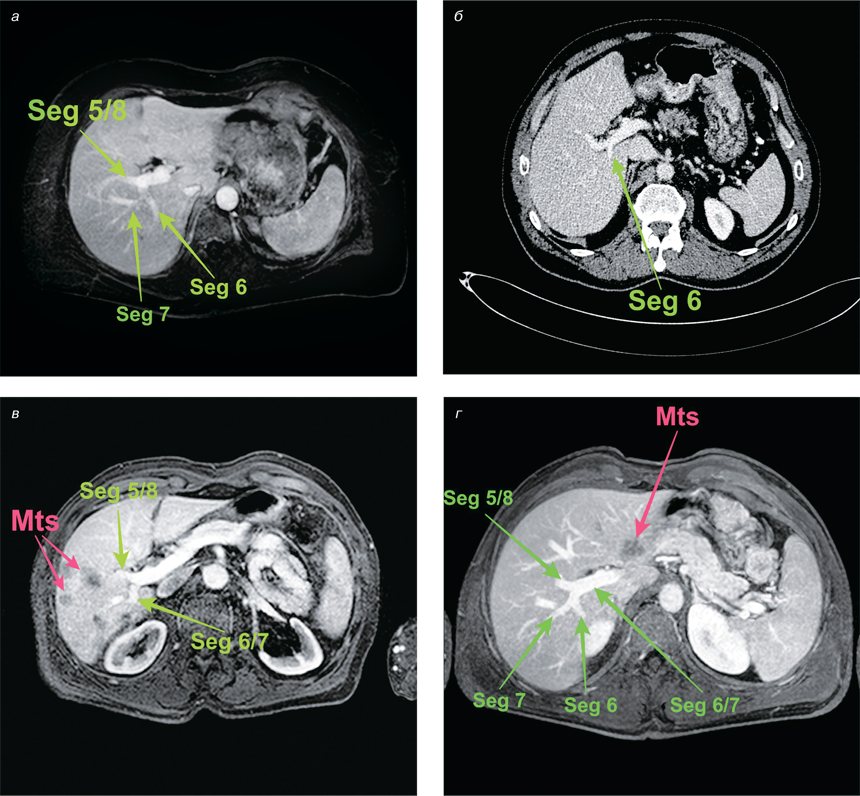
Знання анатомії печінки та досягнення технології обробки зображень полегшують оперативну процедуру, зменшуючи інтраопераційну кровотечу та забезпечуючи низький рівень післяопераційних ускладнень. Анатомічні варіації та помилкова ідентифікація нормальних анатомічних структур є основними причинами хірургічного травмування при оперативному лікуванні хворих на мКРР. БР — один з вагомих анатомічних орієнтирів, який точно вказує на площину загальної жовчної протоки (рис. 2).
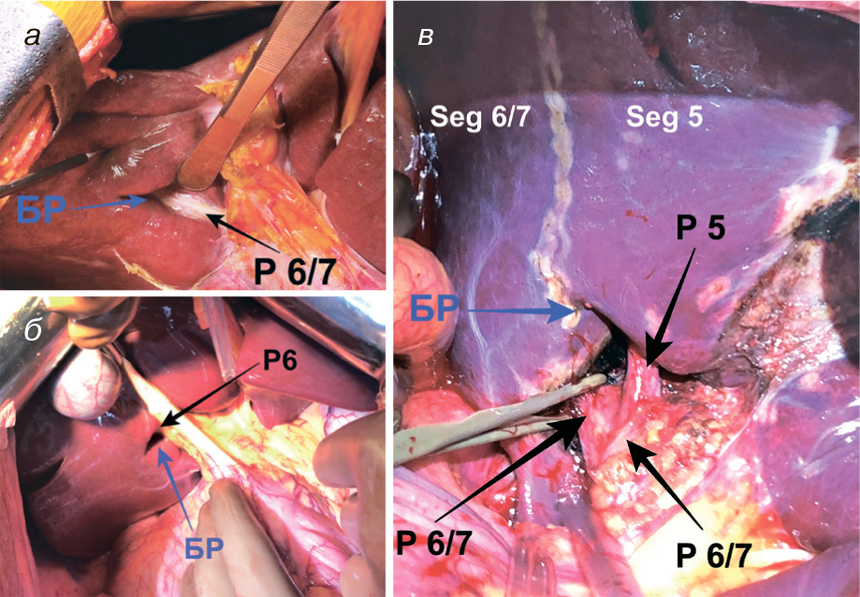
Найважливіша перевага ідентифікації БР полягає у простоті та точності визначення структур глісонового дерева до задньої секції печінки. Ідентифікація БР полегшує встановлення глісонових одиниць до задньої секції (Seg VI/VII) та/чи до Seg VI печінки, що убезпечує анатомічні та паренхімозберігаючі резекції печінки.
ВИСНОВОК
Знання варіантної анатомії БР та селективного глісонового підходу дозволяє покращити якість хірургії у хворих на мКРР. У більшості випадків у проекції БР знаходилася глісонова одиниця до задньої секції печінки — 43 (69,4%). Відкритий тип БР зареєстровано у 51 (82,3%), сплавлений — у 7 (11,3%), закритий тип, або ж рубець у проекції борозни, виявлено у 4 (6,4%) хворих.
СПИСОК ВИКОРИСТАНОЇ ТА РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ
1. Bignell M., Chave H., Branagan G. et al. (2018) Outcome of surgery for recurrent anal cancer — results from a tertiary referral centre. Colorectal Dis. doi: 10.1111/codi.14098
2. Chen X.P., Qiu F.Z. (2008) A simple technique ligating the corresponding inflow and outflow vessels during anatomical left hepatectomy. Langenbeck’s Archives of Surgery, 393(2), 227–230; discussion 31–4. doi: 10.1007/s00423-007-0224-z
3. Galperin E.I., Karagiulian S.R. (1989) A new simplified method of selective exposure of hepatic pedicles for controlled hepatectomies. HPB Surgery, 1: 19–30. doi: 10.1155/1989/28161
4. Hu J.X., Dai W.D., Miao X.Y. et al. (2009) Anatomic resection of segment VIII of liver for hepatocellular carcinoma in cirrhotic patients based on an intrahepatic Glissonian approach. Surgery, 146(5): 854–860. doi: 10.1016/j.surg.2009.06.008
5. Hugh T.B. (2002) New strategies to prevent laparoscopic bile duct injury — surgeons can learn from pilots. Surgery, 132(5): 826–835. doi: 10.1067/msy.2002.127681
6. Ichimura K. (1993) Can Rouvière’s lymph nodes in non-malignant subjects be identified with MRI? Auris Nasus Larynx, 20(2): 117−123. doi: https://doi.org/10.1016/S0385-8146(12)80238-0
7. Launois B. (1997) Hepatectomy: the posterior intrahepatic approach. Br. J. Surg., 84: 291–292. doi: https://doi.org/10.1046/j.1365-2168.1997.02705.x
8. Launois B., Jamieson G.G. (1992) The posterior intrahepatic approach for hepatectomy or removal of segments of the liver. Surg. Gynecol. Obstet., 174: 55–58.
9. Machado M.A., Herman P., Machado M.C. (2003) А standardized technique for segmental right liver resections. Arch. Surg., 138(8): 918–920. doi: 10.1001/archsurg.138.8.918
10. Machado M.A., Herman P., Machado M.C. (2004) Anatomical resection of left liver segments. Arch. Surg., 139(12): 1346–1349. doi: 10.1001/archsurg.139.12.1346
11. Machado M.A., Makdissi F.F., Galvão F.H., Machado M.C. (2008) Intrahepatic Glissonian approach for laparoscopic right segmental liver resections. Am. J. Surg., 196(4): e38–e42. doi: 10.1016/j.amjsurg.2007.10.027
12. Nakai T., Koh K., Funai S. et al. (1999) Comparison of controlled and Glisson’s pedicle transections of hepatic hilum occlusion for hepatic resection. J. Am. Coll. Surg., 189(3): 300–304. doi: https://doi.org/10.1016/S1072-7515(99)00127-1
13. Peti N., Moser M.A.J. (2012) Graphic reminder of Rouviere’s sulcus: a useful landmark in cholecystectomy. ANZ J. Surg., 82(5): 367–368. doi: 10.1111
j.1445-2197.2012.06032.x
14. Tohme S., Kameneva M.V., Yazdani H.O. et al. (2017) Drag reducing polymers decrease hepatic injury and metastases after liver ischemia-reperfusion. Oncotarget, 8(35): 59854–59866. doi: 10.18632/oncotarget.18322
15. Yamamoto M., Takasaki K., Ohtsubo T. et al. (2001) Effectiveness of systematized hepatectomy with Glisson’s pedicle transection at the hepatic hilus for small nodular hepatocellular carcinoma: retrospective analysis. Surgery, 130(3): 443–448. doi: 10.1067/msy.2001.116406
16. Zubair M., Habib L., Memon F. (2009) Rouviere’s sulcus: A guide to safe dissection in laparoscopic cholecystectomy. Pakistan J. Surg., 25: 119–121.
Учет анатомии борозды Рувье в хирургии печени у больных метастатическим колоректальным раком
Национальный институт рака, Киев
Национальный медицинский университет им. А.А. Богомольца, Киев
Резюме. Борозда Рувье (БР) — важный анатомический ориентир в хирургии печени. Идентификация БР может предотвратить повреждение структур ворот печени при выполнении анатомических резекций в проекции правой доли и обеспечить выборочный контроль сосудов глиссоновым методом, включая селективный маневр Прингла у больных метастатическим колоректальным раком (мКРР). Цель. Целью нашего исследования было определить вариантную анатомию БР у больных мКРР. Результаты. БР присутствовала в 82% случаев, из них у 72% идентифицирована в печени как открытая. Сплавленный тип выявлен в 12% случаев, однако 18% печени борозды не имели. Протяженность открытой БР составляла 28±2,3 мм (24–32 мм) и ее глубина — 6±2 мм (диапазон 4–8 мм). Правая задняя секционная ножка выявлена в 70% случаев, а в 25% — ветвь портальной вены до VI сегмента. Выводы. Знание аспектов вариантной анатомии БР делает более безопасными оперативные вмешательства на правой доле печени при мКРР.
борозда Рувье; метастатический колоректальный рак; резекция печени.
Бурлака Антон Анатолійович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: nir.burlaka@gmail.com
Correspondence:
Burlaka Anton
33/43 Lomonosov Str., Kyiv 03022
National Cancer Institute
E-mail: nir.burlaka@gmail.com














Leave a comment