Цитологічна об’єктивізована диференційна діагностика мезотеліоми та реактивного серозиту
Мариненко С.В.1, Болгова Л.С.1, Мариненко Н.І.2, Махортова М.Г.1, Гур’янов В.Г. 3
- 1Національний інститут раку, Київ
- 2Приватний вищий навчальний заклад «Київський медичний унiверситет», Київ
- 3Національний медичний університет імені Богомольця, Київ
Резюме. Мезотеліома — рідкісна злоякісна первинна хвороба серозних оболонок. Цитологічний діагноз встановлюють переважно за матеріалами ексудату, але диференційна діагностика мезотеліоми і реактивних плевритів часто викликає труднощі. Для визначення біологічних характеристик зміненого мезотелію використані додаткові методи дослідження — цитогенетичний та імуноцитохімічний. При цитогенетичному визначенні морфофункціональних типів ядерцеутворюючих регіонів хромосом установлено ймовірні відмінності клітин мезотеліоми, для яких характерне збільшення вмісту компактних 0,29±0,03 (11,90±1,20%) і перехідно-нуклеолонемних типів 1,07±0,09 (40,30±2,00%), при порівнянні з реактивним мезотелієм, відповідно 0,03±0,01 (0,84±0,14%) і 0,29±0,03 (8,70±0,70%) (р<0,05). Імуноцитохімічним методом доведено, що для клітин мезотеліоми характерна позитивна реакція при виявленні панцитокератинів (CK AE1/AE3) (94%), калретиніну (62%), віментину (56%), цитокератину 5/6 (44%), а в клітинах реактивного мезотелію — віментину (75%) і калретиніну (75%), що дозволяє визначити гістогенез вивчених клітин. Доведено, що цитогенетичний метод дозволяє проводити диференційну діагностику мезотеліоми та реактивного серозиту з високою вірогідністю: чутливість тесту — 80% (95% ДІ 52–96%), специфічність — 93% (95% ДІ 68–100%).
Одержано 23.04.2018
Прийнято до друку 29.05.2018
ВСТУП
Первинне ушкодження серозних оболонок — мезотеліому — виявляють рідко. Перш за усе уражується плевра. Частота виникнення мезотеліоми порівняно з раком легені має співвідношення 1:100 та 1:200. Характерне однобічне ураження і частіше — справа [6].
Виділяють доброякісний та злоякісний варіанти мезотеліоми. До доброякісного відносять аденоматоїдну пухлину статевих органів та фіброзну мезотеліому. При фіброзній мезотеліомі тільки в культурі тканини можливо довести походження клітин пухлини з мезотелію. Усі інші види мезотеліом злоякісні [4].
Макроскопічно злоякісна мезотеліома має форму щільного інфільтрату у вигляді значного стовщення серозної оболонки на обмеженій ділянці чи розповсюдження на увесь парієтальний чи вісцеральний листок і може оточувати орган у вигляді панцира [8].
Характерною клінічною ознакою мезотеліоми є швидке накопичення великої кількості рідини, інколи навіть протягом одного дня, незважаючи на систематичну її евакуацію. При цьому випіт має серозний чи геморагічний вигляд, може бути в’язким та мати тягучу консистенцію [5].
Виділяють три морфологічні типи злоякісної мезотеліоми плеври: епітеліоподібний, саркоматоїдний і біфазний. Прогностично більш сприятливим вважається епітеліоподібний тип пухлини, який становить 70% всіх випадків злоякісної мезотеліоми плеври. Саркоматоїдну мезотеліому виявляють у близько 10%, біфазну — 20%. Відомо, що при біфазній мезотеліомі веретеноклітинний компонент в препаратах має становити не менше 10%. За даними багатьох авторів, діагноз злоякісної мезотеліоми може встановлюватися лише при біфазному типі мезотеліоми [2, 18, 19, 21].
Цитологічна діагностика серозних рідин при мезотеліомі часто викликає значні труднощі у зв’язку з тим, що ознаки атипії не завжди виражені в пухлинних клітинах. Крім того, при реактивних серозитах мезотеліальні клітини можуть набувати різко виражених ознак проліферації з атипією, що значно ускладнює їх морфологічну діагностику. Враховуючи сказане, коли при цитологічному дослідженні виявлено клітини мезотелію з ознаками проліферації та нерізко вираженої атипії, провести диференційну діагностику мезотеліоми і реактивного серозиту важко, а часом і неможливо.
Очевидні складнощі цитологічної диференційної діагностики мезотеліоми та клітин реактивного серозиту потребують додаткових методів дослідження, такими можуть бути цитогенетичний та імуноцитохімічний (ІЦХ) методи.
Так, цитогенетичний метод використовується для визначення біологічного характеру росту. За його допомогою можна встановити структурні особливості ядерцеутворюючих регіонів (ЯУР) хромосом, які є досить варіабельними залежно від наявності рибонуклеопротеїдів. На основі вивчення аргентумпозитивних гранул, їх кількості, розміру та взаєморозміщення визначають морфофункціональний тип ЯУР хромосом, які є морфологічним відображенням транскрипції рибосомних генів у клітині і дозволяють оцінити ступінь проліферації клітин та наявність малігнізації [3, 7, 9–15, 24, 27].
Застосування цього методу спрямовано на більш об’єктивну оцінку рівня проліферативних процесів у різних популяціях клітин і виявленні ознак їх малігнізації.
Другим методом, який допомагає в низці випадків провести цитологічну диференційну діагностику мезотеліоми та реактивного серозиту, є ІЦХ, заснований на високоспецифічній реакції антиген — антитіло. ІЦХ дослідження дозволяє встановити локалізацію у клітинах різноманітних молекулярних структур і з’ясувати генез клітинних елементів [17, 20, 22, 23, 25, 26].
Таким чином, складнощі, які виникають при традиційній цитологічній диференційній діагностиці мезотеліоми та реактивного серозиту, можна подолати завдяки комплексному використанню традиційно пофарбованих препаратів, цитогенетичного та ІЦХ методів. Тому за допомогою високоспецифічної методики сріблення можна виявити і об’єктивно оцінити ступінь активності ЯУР хромосом, які є опосередкованим відображенням функціонального та проліферативного стану клітин, а ІЦХ метод дозволяє установити гістогенез пухлинних клітин, які містяться в серозній рідині, тобто визначити первинне чи вторинне ураження мезотелію.
Мета — підвищити ефективність цитологічної диференційної діагностики мезотеліоми і реактивних серозитів.
Об’єкт і методи дослідження
Проведено цитологічні дослідження осадів з ексудатів черевної та грудної порожнин у 56 пацієнтів. З матеріалу центрифугату готували цитологічні препарати та після підсушування на повітрі фарбували за методом Паппенгейма. Для цитогенетичного дослідження відбирали препарати з цитоморфологічними ознаками атипії та вираженої проліферації клітин мезотелію, що викликало складнощі при їх цитологічній оцінці за пофарбованими препаратами.
Проводили забарвлення за методом W.M. Howell, D.A. Black [1]. При мікроскопічному дослідженні у кожного хворого визначали основні морфофункціональні типи ЯУР хромосом в 100 ядрах клітин реактивного мезотелію (n=35) та мезотеліоми (n=21) за класифікацією П.В. Челідзе і О.В. Зацепіної в модифікації Л.С. Болгової та співавторів [14].
Серед 56 хворих виділено диференційно-діагностичну групу пацієнтів (n=30), у яких за цитологічними ознаками складно було провести диференційну діагностику мезотеліоми та реактивного серозиту. Крім цитогенетичного дослідження, у всіх хворих застосовували ІЦХ метод з використанням моноклональних антитіл (мкАТ) до епітеліального антигену (Ber-EP4), панцитокератину (AE 1/3), віментину, калретиніну, моноклонального раково-ембріонального антигену (mCEA), цитокератину 5/6 (СК 5/6), епітеліального мембранного антигену (ЕМА). Непрямий, двошаровий ІЦХ метод застосовували прицільно на групи атипових клітин, які були відзначені нами в забарвлених препаратах.
Матеріал 46 хворих верифікований гістологічно, а у 10 (9 — з реактивними серозитами, 1 — мезотеліомою) пацієнтів цитологічний діагноз підтверджений ймовірними клініко-рентгенологічними даними.
Вивчення цитоморфологічних, ІЦХ та цитогенетичних особливостей здійснювали за допомогою світлової мікроскопії на мікроскопі OLYMPUS CX 41 при збільшеннях: ×200, ×400, ×1000.
Аналіз результатів дослідження проводили згідно зі статистичним пакетом MedCalc v. 18.5 (MedCalc Software, Belgium, 1993–2018).
Для визначення статистичних даних розраховували середнє значення показника (M) та його стандартну похибку (m). Для порівняння значень показників у двох групах хворих використовували критерій W-Вілкоксона.
Порівняння точності диференційної діагностики мезотеліоми та реактивного серозиту за різними методами досліджень проводили шляхом побудови кривих операційних характеристик (ROC-кривих) тестів. При порівнянні отриманих даних розраховували площу під ROC-кривими та її 95% довірчий інтервал (95% ДІ). Оцінку прогностичних характеристик тестів визначали за їх чутливістю та специфічністю, проводили оцінку 95% ДІ цих параметрів.
Критичний рівень значущості у всіх статистичних тестах прийнятий при p<0,05.
Результати
При вивченні фарбованих за методом Паппенгейма (рис. 1) цитологічних препаратів, виготовлених з осаду ексудатів, виявлено значну кількість мезотеліальних клітин з вираженими ознаками проліферації, частина яких мала атипію, що зумовлювало складність проведення диференційної діагностики мезотеліоми та реактивного серозиту.
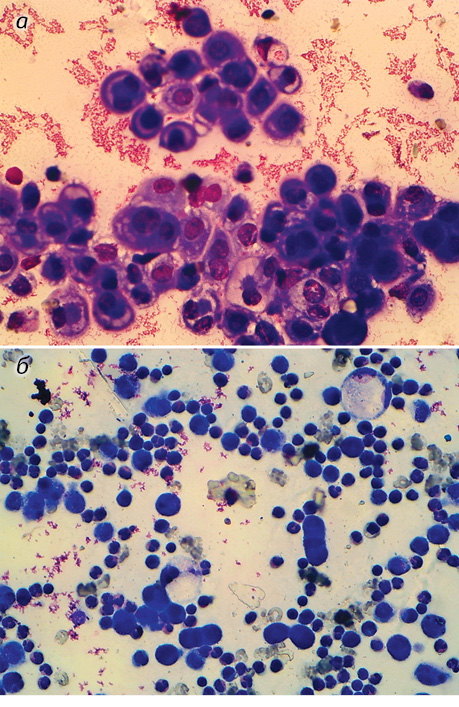
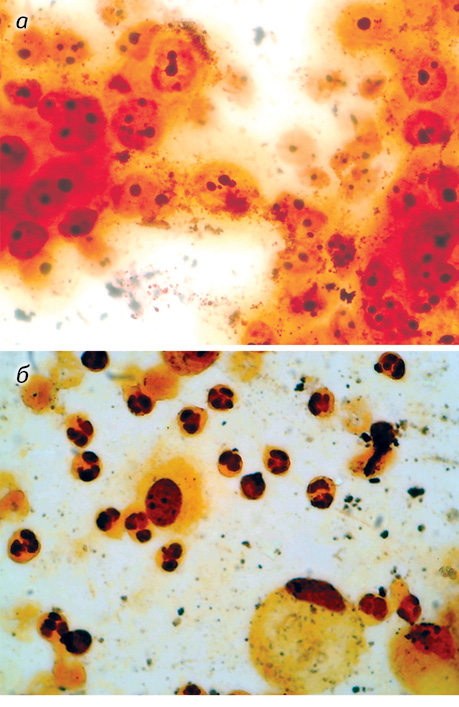
При цитогенетичному дослідженні експресії ядерець у пухлинних клітинах мезотеліоми визначено за відомою класифікацією [13] такі основні морфофункціональні типи ядерець, які можна виявити в імерсійній мікроскопічній системі: компактні, нуклеолонемні, кільцеподібні і мікроядерця (рис. 2). При цьому їх кількість на одне ядро відповідно становила 0,28±0,03, 1,41±0,12, 0,47±0,05 і 0,48±0,04, а загальний вміст ядерець на одне ядро — 2,65±0,16 (табл. 1). За отриманими цитогенетичними показниками встановлено перевагу нуклеолонемних серед усіх визначених типів ядерець.
| № з/п | Морфофункціональні типи ядерець | Мезотеліома (N=21) | Реактивні зміни клітин мезотелію (N=35) | Рівень значимості відмінності, p |
| 1 | Компактні ядерця | 0,29±0,03 | 0,03±0,01 | <0,001 |
| 11,9±1,2 | 0,84±0,14 | <0,001 | ||
| 2 | Нуклеолонемні ядерця | 1,41±0,12 | 0,96±0,06 | 0,001 |
| 52,9±2,4 | 27,9±1,1 | <0,001 | ||
| 2.1 | Власне нуклеолонемні | 0,34±0,04 | 0,67±0,04 | <0,001 |
| 12,6±1,0 | 20,0±0,6 | <0,001 | ||
| 2.2 | Перехідні нуклеолонемно-компактні | 1,07±0,09 | 0,29±0,03 | <0,001 |
| 40,3±2,0 | 8,7±0,7 | <0,001 | ||
| 3 | Кільцеподібні | 0,47±0,05 | 0,95±0,05 | <0,001 |
| 17,3±1,4 | 28,4±1,0 | <0,001 | ||
| 4 | Мікроядерця | 0,48±0,04 | 1,4±0,06 | <0,001 |
| 17,9±1,1 | 42,0±1,1 | <0,001 | ||
| 5 | Всього ядерець на 1 ядро | 2,65±0,16 | 3,3±0,14 | 0,01 |
*М — абсолютні значення, m — відсоток. При проведенні порівняння використано критерій W-Вілкоксона.
Вивчено відсотковий вміст кожного типу ядерець на 100 досліджених ядер у клітинах мезотеліоми. Кількість компактних ядерець коливалася від 0,21 до 0,69, що в середньому становило 0,29±0,03 (11,90±1,20%).
Досліджено вміст нуклеолонемних ядерець на 100 пухлинних ядер клітин мезотеліоми. Серед нуклеолонемних ядерець визначено вміст власне нуклеолонемних — 0,34±0,04 (12,60±1,00%) в інтервалі від 0,11 до 0,68 і перехідно-нуклеолонемних форм — 1,07±0,09 (40,30±2,00%) при коливанні від 0,51 до 1,83.
Експресія кільцеподібних ядерець у пухлинних клітинах мезотеліоми визначалася в діапазоні від 0,11 до 0,88, становлячи в середньому 0,47±0,05 (17,30±1,40%). Значення вмісту мікроядерець в ядрах клітин мезотеліоми зростали від 0,15 до 0,69, у середньому сягаючи 0,48±0,04 (17,90±1,10%).
При вивченні вмісту кожного типу ядерець на 100 досліджених ядер клітин реактивного мезотелію виявлено, що амплітуда коливань значень компактних ядерець становила 0,0–0,20 при середньому значенні 0,03±0,01 (0,84±0,14%). Кількість власне нуклеолонемних ядерець у клітинах реактивного мезотелію більша, ніж перехідно-нуклеолонемних, і становила 0,35–1,56, середнє значення — 0,67±0,04 (20,00±0,60%). Перехідно-нуклеолонемні ядерця виявлялися в межах 0,05–0,78, становлячи в середньому 0,29±0,03 (8,70±0,70%). Показники кільцеподібних типів ядерець в ядрах клітин мезотелію з ознаками проліферації коливалися в межах від 0,50 до 1,65, при середньому показнику 0,95±0,05 (28,40±1,00%). Експресія мікроядерець у клітинах реактивного мезотелію визначалася в інтервалі від 0,53 до 2,13, що в середньому сягало 1,40±0,06 (42,00±1,10%).
За всіма показниками відмінність між групами статистично значуща (p<0,05) (див. табл. 1).
Використовуючи мкАТ, у 15 (50%) пацієнтів встановлено мезотеліому. При цьому для клітин мезотеліоми характерна експресія панцитокератину (СК AE1/AE3) — 14/15 (94%), калретиніну — 10/15 (62%), віментину — 9/15 (56%), цитокератину 5/6 — 7/15 (44%), тоді як експресія епітеліального антигену (Ber-EP4) взагалі не виявлена — 0/15 (0%), а інших епітеліальних маркерів — слабовиражена. Так, ЕМА позитивний у 3/15 (19%) пацієнтів, раково-ембріональний антиген — в 1 (6%) з них (табл. 2, рис. 3).
| мкАТ до: | Мезотеліома (N=15) | Реактивний серозит (N=15) | ||
| ІЦХ реакція, n/N (%) | ||||
| + | – | + | – | |
| епітеліального антигену (Ber-EP4) |
0/15(0) | 15/15(100) | 1/15(6) | 14/15(94) |
| раково-ембріонального антигену | 1/15(6) | 14/15(94) | 1/15(6) | 14/15(94) |
| ЕМА | 3/15(19) | 13/15(81) | 1/15(6) | 14/15(94) |
| панцитокератинів (CК AE1/AE3) | 14/15(94) | 1/15(6) | 4/15(25) | 12/15(75) |
| цитокератину 5/6 | 7/15(44) | 9/15(66) | 1/15(6) | 15/15(94) |
| калретиніну | 10/15(62) | 6/15(38) | 12/15(75) | 4/15(25) |
| віментину | 9/15(56) | 7/15(44) | 12/15(75) | 4/15(25) |
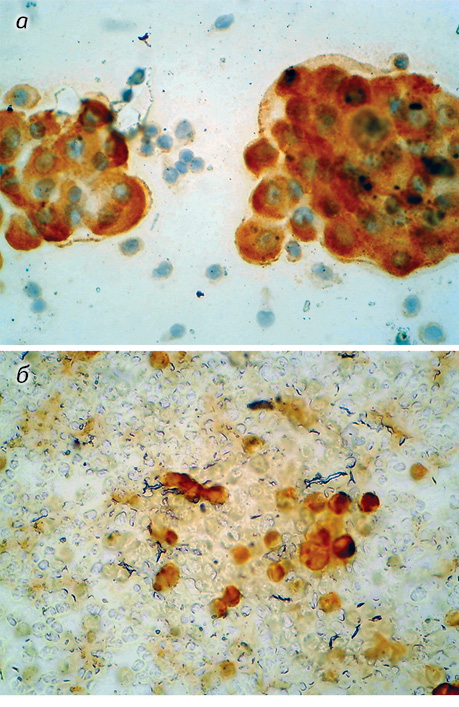
У 15 (50%) пацієнтів із 30 встановлено реактивні серозити. При цьому в клітинах реактивного мезотелію виявлено віментин і калретинін по 12 з 15, що становило по 75%. У цій групі хворих проведені ІЦХ реакції до епітеліальних антигенів були негативні, що підтверджує їх мезотеліальну природу.
Порівняння прогностичних характеристик методів діагностики проводили шляхом побудови кривих операційних характеристик, що зображено ROC-кривими на рис. 4.
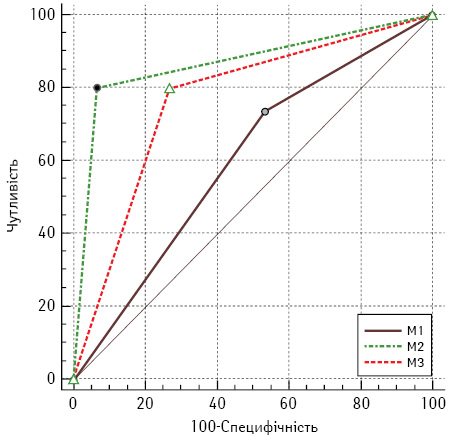
У табл. 3 наведено прогностичні характеристики тестів.
| Метод |
Площа під кривою (95% ДІ) |
Чутливість, % (95% ДІ) | Специфічність % (95% ДІ) | Рівень значущості відмінності між методами, p |
| M1 | 0,60 (0,41–0,77) | 73 (45–92) | 47 (21–73) | <0,05 |
| M2 | 0,87 (0,69–0,96) | 80 (52–96) | 93 (68–100) | |
| M3 | 0,77 (0,58–0,90) | 80 (52–96) | 73 (45–92) |
При проведенні порівняння якості діагностики мезотеліоми та реактивного серозиту за результатами трьох тестів виявлено їх статистично значущу (p<0,05) відмінність (див. табл. 3). При цьому об’єктивні характеристики мав цитогенетичний метод, для якого площа під кривою операційних характеристик становила 0,87 (95% ДІ 0,69–0,96), чутливість цього тесту — 80% (95% ДІ 52–96%), специфічність — 93% (95% ДІ 68–100%).
Таким чином, для визначення характеру ураження мезотеліальних клітин використано цитогенетичний метод виявлення морфофункціональних типів ядерцевих організаторів хромосом, який дозволяє ймовірно диференціювати клітини мезотеліоми, для яких характерне збільшення вмісту компактних і нуклеолонемних ядерець морфофункціональних типів при порівнянні з реактивним мезотелієм. Крім того, комплекс застосованих сучасних цитоморфологічного, цитогенетичного та ІЦХ методів дозволяє виявити певні параметри та порівняти їх для диференційно-діагностичної групи мезотеліоми і клітин реактивного мезотелію.
Висновки
Біологічний характер росту ураження мезотеліальних клітин, визначений цитогенетичним методом при виявленні морфофункціональних типів ядерцевих організаторів хромосом, який дозволяє ймовірно диференціювати клітини мезотеліоми із вмістом компактних ядерець 0,29±0,03 (11,90±1,20%) і перехідно-нуклеолонемних типів 1,07±0,09 (40,30±2,00%) порівняно з реактивним мезотелієм, відповідно 0,03±0,01 (0,84±0,14%) і 0,67±0,04 (20,00±0,60%) (p<0,001).
Для клітин мезотеліоми характерна позитивна ІЦХ реакція при виявленні панцитокератинів (CК AE1/AE3) (94%), калретиніну (62%), віментину (56%), цитокератину 5/6 (44%), негативна реакція — Ber-EP4 (100%), СЕА (94%), ЕМА (81%).
У клітинах реактивного мезотелію виявлено віментин (75%) і калретинін (75%), що дозволяє об’єктивно оцінити гістогенетичну належність вивчених клітин.
Цитогенетичний метод дозволяє проводити диференційну діагностику мезотеліоми та реактивного серозиту з високою точністю: чутливість тесту — 80% (95% ДІ 52–96%), специфічність — 93% (95% ДІ 68–100%).
Список використаної літератури
1. Болгова Л.С., Туганова Т.Н., Кузина И.С. (2001) Модификация окраски по Howell W., Black D. на выявление ядрышкообразующих регионов хромосом при лимфопролиферативных заболеваниях. Рукопись депонирована в ГЦНМБ (Россия), N Д-26735: 20.04.01.
2. Григорук О.Г., Лазарев А.Ф., Богатырёв В.Н. (2012) Дифференциальная цитологическая диагностика плевритов. Барнаул: 173–180 с.
3. Дубенская Л.И., Баженов С.М. (1992) Белки, ассоциированные с зонами ядрышкового организатора: практическое применение в онкоморфологии и связь с биологическими особенностями опухоли. Архив патологии, 54(4): 40–43.
4. Варивончик Д.В. (2012) Епидемиология злокачественной мезотелиомы в Украине (2001–2011 гг.). Український журнал з проблем медицини і праці, 4 (33): 56–69.
5. Клюкина Л.Б., Ерохина О.А., Гапанович Е.А. и др. (2012) Цитологический метод исследования выпотных жидкостей. Онкологический журнал, 6 (1): 79–84.
6. Лазарев А.Ф., Григорук О.Г., Базулина Л.М. и др. (2013) Мезотелиома плевры: этиология, заболеваемость, диагностика, лечения, выживаемость. Российский онкологический журнал, 5: 15–18.
7. Лазарев А.Ф., Климачев В.П., Бобров И.П., Лубенников В.А. (2002) Характеристика ядрышкового аппарата опухолевых клеток при раке желудка. Архив патологии, 64(6): 30–32.
8. Музалевский П.Н., Шойхет Я.Н., Лазарев А.Ф., Григорук О.Г. (2007) Мезотелиома: распространенность и модифицирующие факторы (литературный обзор). Сибирский онкологический журнал, 2(22): 77–83.
9. Райхлин Н.Т., Букаева И.А., Пробатова Н.А., Смирнова Е.А. (2006) Аргирофильные белки областей ядрышковых организаторов — маркеры скорости клеточной пролиферации. Архив патологии, 3: 47–51.
10. Туганова Т.Н., Болгова Л.С., Алексеенко О.И. и др. (2007) Ретроспективный пересмотр цитогистологических расхождений в определении степени дисплазии эпителия шейки матки и цервикального канала. Репродуктивное здоровье женщины, 3(32), часть 1: 234–235.
11. Туганова Т.Н., Болгова Л.С., Алексеенко О.И. и др. (2008) Ложноотрицательный результат при цитологической диагностике поражений цервикального канала. Новости клинической цитологии России, 12(3–4): 11–12.
12. Туганова Т.Н., Болгова Л.С., Алексеенко О.И., Лигирда Н.Ф. (2009) Причины цитогистологических расхождений в определении степени дисплазии эпителия шейки матки. Клин. лаб. диагностики, 2: 46–50.
13. Туганова Т.Н., Болгова Л.С., Махортова М.Г., Алексеенко О.И. (2004) Морфофункциональные типы ядрышек в цитологической диагностике фиброаденом и рака молочной железы. Новости клинической цитологии России, 8(1–2): 27–30.
14. Челидзе П.В., Зацепина О.В. (1988) Морфофункциональная классификация ядрышек. Успехи современной биологии, 105(2): 252–268.
15. Alarcon-Romero Ldel C., Illades-Aguiar B., Flores-Alfaro E. et al. (2009) AgNOR polymorphism association with squamous intraepithelial lesions and invasive carcinoma with HPV infection. Salud. Publica. Mex., 51(2): 134–140.
16. Derenzini M., Trere D. (2001) Silver-stained nucleolar organizer regions (AgNOR). Pathologica, 93(2): 99–105.
17. Hasteh F., Lin G.Y., Weidner N., Michael C.W. (2010) The use of immunohistochemistry to distinguish reactive mesothelial cells from malignant mesothelioma in cytologic effusions. Cancer Cytopathol., 118: 90–96.
18. Hjerpe A., Ascoli V., Bedrossian C.W.M. et al. (2015) Guidelines for the cytopathologic diagnosis of epithelioid and mixed-type malignant mesothelioma. Acta Cytologica, 59: 2–6.
19. Husain A.N., Colby T., Ordonez N. et al: (2013) Guidelines for pathologic diagnosis of malignant mesothelioma: 2012 update of the consensus statement from the International Mesothelioma Interest Group. Arch. Pathol. Lab. Med., 137: 647–667.
20. Husain A.N., Mirza M.K., Gibbs A. et al. (2014) How useful is GLUT-1 in differentiating mesothelial hyperplasia and fibrosing pleuritis from epithelioid and sarcomatoid mesotheliomas? An international collaborative study. Lung Cancer, 83: 324–328.
21. Matsumoto S., Nabeshima K., Kamei T. et al. (2013) Morphology of 9p21 homozygous deletion-positive pleural mesothelioma cells analyzed using fluorescence in situ hybridization and virtual microscope system in effusion cytology. Cancer Cytopathol., 121: 415–422.
22. Michael C.W., Bedrossian C.C. (2014) The implementation of liquid-based cytology for lung and pleural-based diseases. Acta. Cytol., 58: 563–573.
23. Minato H., Kurose N., Fukushima M. et al. (2014) Comparative immunohistochemical analysis of IMP3, GLUT1, EMA, CD146, and desmin for distinguishing malignant mesothelioma from reactive mesothelial cells. Am. J. Clin. Pathol., 141: 85–93.
24. Misra J.S., Das V., Srivastava A. et al. (2005) AgNOR counts in cervical smears under normal and other cytopathologic conditions. Anal. Quant. Cytol. Histol., 27(6): 337–340.
25. Ordonez N.G., Sahin A.A. (2014) Diagnostic utility of immunohistochemistry in distinguishing between epithelioid pleural mesotheliomas and breast carcinomas: a comparative study. Hum. Pathol., 45: 1529–1540.
26. Sato A., Torii I., Okamura Y. et al. (2010) Immunocytochemistry of CD146 is useful to discriminate between malignant pleural mesothelioma and reactive mesothelium. Mod. Pathol., 23: 1458–1466.
27. Singha M., Prasada S., Karlaa N. et al. (2006) Silver-stained nucleolar organizer regions in normal and dysplastic cervical lesions: correlation with DNA ploidy and S-phase fraction by flow cytometry. Oncology, 71(5–6): 411–416.
Цитологическая объективизированная дифференциальная диагностика мезотелиомы и реактивного серозита
Национальный институт рака, Киев
Частное высшее учебное заведение «Киевский медицинский университет», Киев
Национальный медицинский университет им. А.А. Богомольца, Киев
Резюме. Мезотелиома — редкая злокачественная первичная болезнь серозных оболочек. Цитологический диагноз устанавливается преимущественно по материалам экссудата, но дифференциальная диагностика мезотелиомы и реактивных плевритов часто вызывает трудности. Для определения биологических характеристик измененного мезотелия использованы дополнительные методы исследования — цитогенетический и иммуноцитохимический. При цитогенетическом определении морфофункциональных типов ядрышкообразующих регионов хромосом установлены вероятные отличия клеток мезотелиомы, для которых характерно увеличение содержимого компактных 0,29±0,03 (11,9±0,03%) и переходно-нуклеолонемных типов 1,07±0,09 (40,3±2,00%), при сравнении с реактивным мезотелием, соответственно 0,03±0,01 (0,84±0,14%) и 0,29±0,03 (8,7±0,7%) (р<0,05). Иммуноцитохимическим методом доказано, что для клеток мезотелиомы характерна позитивная реакция при выявлении панцитокератина (CК AE1/AE3) (94%), калретинина (62%), виментина (56%), цитокератина 5/6 (44%), а в клетках реактивного мезотелия — виментина (75%) и калретинина (75%), что позволяет определить гистогенез изученных клеток. Статистически доказано, что цитогенетический метод предоставляет возможность проводить дифференциальную диагностику мезотелиомы и реактивного серозита с высокой достоверностью: чувствительность теста — 80% (95% ДИ 52–96%), специфичность — 93% (95% ДИ 68–100%).
мезотелиома; реактивный серозит; цитогенетический (ядрышковые организаторы) и иммуноцитохимический методы.
Мариненко Світлана Вячеславівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: labrida@ukr.net
Correspondence:
Marynenko Svitlana
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
E-mail: labrida@ukr.net














Leave a comment