Можливості імунотерапії метастазів меланоми В16 у мишей C57Bl/6 фактором переносу
Фильчаков Ф.В.1, Лён А.Д.1, Шумилина Е.С.1, Кукушкина С.Н.1, Гриневич Ю.А. 1, Николаенко А.Н.2
Резюме. У статті представлено експериментальні дані імунотерапії меланоми із застосуванням фактора переносу ксеногенного походження, отриманого шляхом тиражування його активності на курячих ембріонах. На моделі пасивного метастазування меланоми В16 у мишей С57Bl/6 встановлено, що отриманий в системі «миші C57Bl/6 — нелінійні щури — курячі ембріони» фактор переносу при його профілактичному і терапевтичному застосуванні проявляє антиметастатичний ефект, який більш виражений у неспецифічного зразка, ніж у меланомаспецифічного. Імунотерапія фактором переносу, незалежно від специфічності, істотно збільшує середню тривалість життя дослідних тварин порівняно з контрольною групою. Отримані результати роблять перспективною розробку на цій основі методів і засобів ефективної імунопрофілактики метастазування меланоми шкіри.
Резюме. В статье представлены экспериментальные данные иммунотерапии меланомы с применением фактора переноса ксеногенного происхождения, полученного путем тиражирования его активности на куриных эмбрионах. На модели пассивного метастазирования меланомы В16 у мышей линии С57Bl/6 установлено, что полученный в системе «мыши C57Bl/6 — нелинейные крысы — куриные эмбрионы» фактор переноса при его профилактическом и терапевтическом применении проявляет антиметастатический эффект, который более выражен у неспецифического образца, чем у меланомаспецифического. Иммунотерапия фактором переноса, независимо от специфичности, существенно увеличивает среднюю продолжительность жизни опытных животных по сравнению с контрольной группой. Полученные результаты делают перспективной разработку на этой основе методов и средств эффективной иммунопрофилактики метастазирования меланомы кожи.
Получено 04.04.2018
Принято в печать 03.05.2018
Введение
Меланома кожи характеризуется ранним метастазированием, быстрым прогрессированием опухолевого процесса и химиорезистентностью. В Украине среди впервые заболевших в течение года умирают около 11% больных [1]. Медиана выживаемости пациентов с отдаленными метастазами составляет 6–9 мес, а 5-летняя выживаемость не превышает 5% [2]. В лечении больных меланомой кожи хирургический метод является основным, однако отдаленные результаты у пациентов с толщиной первичной опухоли по Breslow >2 мм, с изъязвлением первичной опухоли или метастазами в регионарных лимфатических узлах (стадия IIА–IIIС) остаются неудовлетворительными — 50–80% таких больных умирают в течение 5 лет вследствие прогрессирования опухолевого процесса [3–5]. В связи с этим предотвращение развития метастазов меланомы является главной и нерешенной проблемой клинической онкологии.
В качестве адъювантного лечения больных меланомой кожи используется цитокино-, вакцино-, таргетная терапия и адоптивная иммунотерапия [6]. Опыт применения интерферона у больных меланомой кожи насчитывает более 30 лет, однако целесообразность такой терапии остается предметом дискуссий, поскольку ее адъювантное применение, согласно ряду рандомизированных контролируемых исследований, улучшает только безрецидивную выживаемость больных [7, 8]. Среди других цитокинов наиболее изученным является интерлейкин-2, который оказывает активирующее действие на Т-клетки и натуральные киллеры [9, 10]. Его применение у больных меланомой кожи с отдаленными метастазами эффективно в 16% случаев [11]. Использование интерлейкина-2 в высоких дозах ограничено выраженной токсичностью [12] и ассоциируется с увеличением количества регуляторных Т-клеток [10]. Специфическая активная иммунотерапия на основе антигенов, ассоциированных с меланомой (MAGE-1, -3, MART-1, тирозиназа, gp100), позволяет достичь полного объективного ответа не более чем у 4% пациентов [2, 4, 13]. По-видимому, применение противоопухолевых вакцин не позволяет устранить глубокие изменения в иммунной системе, препятствующие развитию противоопухолевого иммунного ответа организма. К тому же развитие иммунного ответа на определенные антигены опухоли может давать селективные преимущества для роста тех опухолевых клеток, которые их не экспрессируют.
Таргетная терапия, основанная на блокаде иммуносупрессивных механизмов, в настоящее время интенсивно изучается в качестве потенциального подхода в лечении больных меланомой кожи. При использовании моноклональных антител против CTLA-4 у больных генерализованной меланомой кожи объективный ответ отмечен у 11,9% пациентов. При этом развивались аутоиммунные осложнения (витилиго, колит, гепатит, тиреоидит), которые в 14,5% случаев приобретали тяжелое течение [3, 14]. Такие иммунопатологические явления могут быть обусловлены, в частности, элиминацией регуляторных Т-лимфоцитов, что требует детального изучения для принятия решения по использованию такого вида терапии [15]. Применение моноклональных антител против PD-1 у больных генерализованной формой способствовало объективному ответу у 33% пациентов со значительно меньшим количеством побочных явлений [14, 16]. При применении ингибитора BRAF V600E-мутации у больных генерализованной меланомой кожи отмечен быстрый объективный ответ у 48% пациентов, но при этом в 38% случаев потребовался пересмотр схемы лечения из-за развития побочных эффектов (артралгия, сыпь, усталость, облысение, кератоакантома, плоскоклеточная карцинома, фотосенсибилизация, тошнота, диарея) [17].
Перспективные возможности связывают с применением у этой категории больных адоптивной иммунотерапии, которая основывается на переносе пациенту активированных in vitro линий и клонов опухолеспецифических лимфоцитов [18]. Убедительные результаты получены при переносе меланомаспецифических цитотоксических Т-лимфоцитов, выделенных из популяции лимфоцитов, инфильтрирующих опухоль [19]. Использование этого подхода позволило достичь объективной регрессии опухоли у 40–72% больных генерализованной меланомой кожи с отсутствием прогрессирования у 40% пациентов в течение 3–7 лет [20]. Однако следует отметить, что получение опухолеспецифических лимфоцитов іn vіtro с оптимальными характеристиками требует выполнения сложных технических условий и является дорогостоящим, что препятствует широкому внедрению данного метода иммунотерапии в клиническую практику.
Поэтому поиск эффективных адъювантных методов лечения больных меланомой кожи продолжает оставаться актуальным. Повышение противоопухолевой иммунореактивности организма при помощи субклеточных компонентов, выделенных из сенсибилизированных лимфоцитов, в частности фактора переноса (ФП), является одним из перспективных направлений адоптивной иммунотерапии и одним из путей повышения эффективности основного лечения больных меланомой кожи. Активным компонентом ФП являются низкомолекулярные (3–12 кДа) полипептиды Т-клеточного происхождения, способные инициировать развитие клеточно-опосредованного ответа иммунной системы организма на антиген и восстанавливать регуляторные и эффекторные функции Т-лимфоцитов [21–23]. Необходимо отметить, что ФП регулирует продукцию иммунокомпетентными клетками провоспалительных факторов, препятствующих развитию иммунопатологических состояний [24, 25]. Кроме того, формирование антигенспецифической иммунореактивности с помощью ФП не ограничено молекулами главного комплекса гистосовместимости [26], поэтому такая биотерапия может использоваться как в алло-, так и в ксеногенной системах. По данным клинических и экспериментальных исследований, ФП способствует торможению процесса метастазирования опухоли и улучшению выживаемости [27, 28]. Однако технология получения ФП с активностью, направленной против антигенов конкретной опухоли, не стандартизирована, а целесообразность его применения у больных меланомой кожи недостаточно изучена [29–31].
Вышеизложенное послужило обоснованием для поиска и разработки нового подхода в технологии получения меланомаспецифического ФП (ФПС) на модели иммунотерапии мышей С57Bl/6 с меланомой В16.
Объект и методы исследования
Эксперименты проведены на 20 нелинейных крысах-самцах массой тела 100–120 г стадного разведения вивария Национального института рака; 150 мышах линии C57Bl/6 массой тела 18–20 г, полученных из вивария Института молекулярной биологии и генетики НАН Украины; 30 куриных эмбрионах, полученных из «Биотест-лаборатории» (Украина). Содержание животных и работа с ними осуществлялись согласно общепринятым международным правилам проведения исследований на экспериментальных животных. Штамм меланомы В16 получен из Банка клеточных линий (руководитель — доктор биологических наук, профессор Ю.И. Кудрявец) Института экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины.
Данное исследование было одобрено локальной этической комиссией Национального института рака.
Образцы ксеногенного ФП получали по оригинальной технологии в экспериментальной системе «мыши C57Bl/6 — нелинейные крысы — куриные эмбрионы» [32]. Для этого были выделены низкомолекулярные (25 кДа) экстракты из лимфоцитов селезенки 10 интактных крыс и из лимфоцитов селезенки 10 крыс на 14-е сутки после внутрибрюшинной иммунизации клетками мышиной меланомы В16 (в количестве 2 • 10 клеток на животное в 0,2 мл забуференного физиологического раствора (ЗФР)) согласно методу [33]. Затем для получения образца неспецифического ФП (ФПН) в аллантоисный мешок 15 куриных яиц с 9-дневными эмбрионами было введено 100 пг низкомолекулярного экстракта лимфоцитов селезенки интактных крыс в 100 мкл ЗФР. Выбор данного срока был обусловлен тем, что максимальную иммунологическую активность эмбриональных тканей отмечают именно в этот период [34]. С целью получения образца ФПС в аллантоисный мешок аналогичным способом введено 100 пг низкомолекулярного экстракта лимфоцитов селезенки крыс, иммунизированных клетками меланомы В16. На 15-е сутки развития куриных эмбрионов получены образцы ФП, как описано [32]. Во всех образцах ФП исследовали концентрацию белка по методу Бредфорда [35], их замораживали и хранили при –20 °С.
Иммунотропные свойства образцов ФП (в конечной концентрации 1 и 5 нг/мл) исследовали в тестах пролиферации и цитотоксичности лимфоцитов селезенки мышей C57Bl/6 в смешанной культуре с клетками меланомы В16 іn vіtro. В системе іn vіvo иммунологические тесты оценивали на 7-е сутки после однократного внутрибрюшинного введения мышам С57Bl/6 образцов ФП в дозе 200 пг в 0,2 мл ЗФР.
Пролиферативную активность (по фазам клеточного цикла) и уровень апоптоза лимфоцитов селезенки в ответ на клетки меланомы В16 (в соотношении 50:1) оценивали в 120-часовом тесте цитофлуориметрическим методом, основанном на определении содержания ДНК в клетках с помощью пропидия йодида [36, 37]. Цитотоксическую активность лимфоцитов селезенки против клеток меланомы В16 (в соотношении 50:1) определяли в 4-часовом тесте цитофлуориметрическим методом, как описано [37], и выражали цитотоксическим индексом (%) [38]. Анализ проб проводили на проточном цитофлуориметре FACScan («Becton Dіckіnson», США) с использованием программ «Cell Quest» и «Моd FIT LT 2.0».
Антиметастатическую активность образцов ФП исследовали при разных схемах применения на модели пассивного метастазирования меланомы В16 у мышей C57Bl/6. Данная модель воспроизводит гематогенное метастазирование опухолевых клеток в условиях эксперимента.
На первом этапе изучали протективные эффекты ФП при его профилактическом применении. Для этого интактным мышам С57Bl/6 опытных групп вводили однократно внутрибрюшинно соответствующий образец ФП в дозе 200 пг в 0,2 мл ЗФР, мышам контрольной группы — 0,2 мл ЗФР. Через 3 сут всем мышам были перевиты внутривенно клетки меланомы В16 (в количестве 0,3 • 10 клеток на животное в 0,1 мл ЗФР). На 26-е сутки после введения опухолевых клеток исследовали антиметастатический эффект по следующим показателям: частота метастазирования, количество и объем метастазов в легких, индекс торможения метастазирования (ИТМ), а также цитотоксичность, уровень пролиферации и апоптоза лимфоцитов селезенки в присутствии клеток меланомы В16 in vitro. ИТМ рассчитывали по формуле:
ИТМ = (Vк — Vо) / Vк • 100%,
где Vк и Vо — средний объем метастазов у мышей контрольной и опытной групп соответственно.
В следующей серии экспериментов изучали влияние на метастазирование и выживаемость мышей C57Bl/6 образцов ФП в режиме метрономного введения (через определенные промежутки времени в низких дозах [39]). Животным опытных групп ФП вводили внутрибрюшинно в дозе 200 пг в 0,2 мл ЗФР на 2-е сутки после внутривенной перевивки меланомы В16 (0,5 • 10 клеток на животное в 50 мкл ЗФР) и затем 1 раз в неделю (всего 3 инъекции); мышам контрольной группы — 0,2 мл ЗФР. На 20-е сутки после введения опухолевых клеток оценивали антиметастатический эффект ФП по вышеописанным показателям. По аналогичной схеме исследовали влияние иммунотерапии ФП (всего 9 инъекций) на выживаемость мышей C57Bl/6 с меланомой В16 с определением средней продолжительности жизни. Контрольная и опытная группы при оценке антиметастатического эффекта включали по 10 мышей, при исследовании выживаемости — по 15 мышей.
Статистическую обработку результатов проводили с использованием программ Excel (MS Offіce 2003, XP) и STATІSTІCA 6,0 (StatSoft Іnc., США). Результаты исследования были проверены на нормальность распределения с помощью критерия Шапиро — Уилка. Для определения статистической значимости различий (р) между показателями в исследуемых группах при нормальном распределении значений применяли t-критерий Стьюдента; для значений, распределение которых отличалось от нормального, использовали непараметрический критерий Манна — Уитни [40]. Результаты исследования представляли как M±m, где M — среднее арифметическое значение, m — его стандартная ошибка. Различия оценивали как значимые при р<0,05.
Результаты и их обсуждение
Изучение иммунотропных свойств образцов ФПН и ФПС, полученных из эмбрионов кур, показало их однотипное влияние на цитотоксичность, пролиферацию и апоптоз лимфоцитов интактных мышей С57Вl/6 іn vіtro (рис. 1).
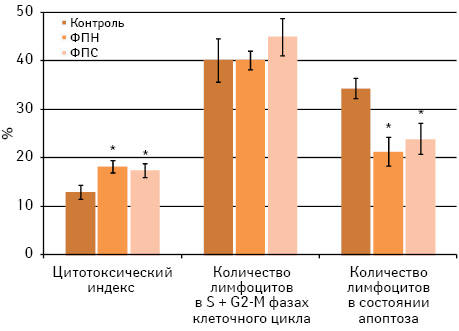
Как видно из данных, представленных на рис. 1, оба образца ФП существенно (р<0,05) повышают цитотоксичность несенсибилизированных (к антигенам меланомы В16) лимфоцитов мышей in vitro. Внесение ФП в смешанную культуру лимфоцитов и клеток меланомы В16, независимо от специфичности образца, статистически значимо снижает интенсивность апоптоза лимфоцитов при неизменном количестве пролиферирующих лимфоцитов (число клеток в S и G2-M фазах клеточного цикла).
Эти данные демонстрируют способность исследуемых образцов ФП, независимо от их специфичности, усиливать іn vіtro цитотоксичность лимфоцитов интактных мышей C57Bl/6 против клеток сингенной меланомы. Можно предположить, что в данной системе генерации de novo опухолеспецифических клеток-эффекторов не происходит, а наблюдается неспецифическая стимуляция цитотоксической активности лимфоцитов. Это, в частности, подтверждается отсутствием пролиферации лимфоцитов в ответ на клетки меланомы В16 при внесении в тест-систему ФПС.
Известно, что в организме ФП действует главным образом на эффекторные механизмы клеточно-опосредованного иммунитета, индуцируя продукцию цитокинов, опосредующих развитие иммунного ответа по Th1-сценарию [21, 22, 41]. Благодаря этому восстанавливается популяционный состав и функциональная активность Т-лимфоцитов и активируются клетки врожденного иммунитета. Учитывая, что в системе іn vіtro не удается воспроизвести сложные механизмы прямого и опосредованного влияния ФП на иммунную систему, изучена способность исследуемых образцов ФП индуцировать иммунореактивность на антигены меланомы В16 при их введении несенсибилизированному реципиенту in vivo. Для этого на 7-е сутки после введения интактным мышам С57Bl/6 исследуемых образцов ФП изучали эффективность формирования клеточно-опосредованных иммунных реакций на антигены меланомы В16 в тестах in vitro (рис. 2).
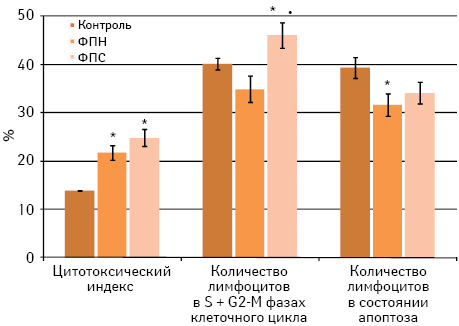
Как видно из представленных на рис. 2 данных, однократное введение мышам ФП сопровождается усилением цитотоксической активности лимфоцитов против клеток сингенной меланомы (р<0,05). При этом образцы ФП по-разному влияют на апоптоз и клеточный цикл лимфоцитов мышей С57Вl/6 в присутствии клеток меланомы В16 in vitro. После введения ФПН интактным животным проявляется эффект, аналогичный таковому в тестах іn vіtro: интенсивность апоптоза лимфоцитов в присутствии клеток меланомы В16 существенно (р<0,05) снижается на фоне неизмененного количества пролиферирующих лимфоцитов. В отличие от этого, введение ФПС увеличивает долю клеток в активных фазах клеточного цикла в ответ на антигены меланомы В16 (р<0,05). Причем в эти сроки усиление пролиферации лимфоцитов не сопровождается повышением интенсивности апоптоза.
Следовательно, исследуемые образцы ФП, независимо от способа их получения, при однократном введении in vivo усиливают цитотоксичность лимфоцитов интактных мышей С57Вl/6 против клеток сингенной меланомы, что подтверждает известные адъювантные свойства ФП [26]. С другой стороны, выраженное усиление пролиферации лимфоцитов под влиянием ФПС в присутствии клеток меланомы В16 может свидетельствовать о переносе іn vіvo иммунореактивности на ее антигены несенсибилизированному реципиенту. Последствия такого переноса мы изучили на модели пассивного метастазирования меланомы В16 у мышей С57Вl/6 при внутривенной перевивке опухолевых клеток.
В первой серии экспериментов изучены протективные эффекты образцов ФП при их профилактическом однократном применении за 3 сут до внутривенной перевивки меланомы В16 (рис. 3).
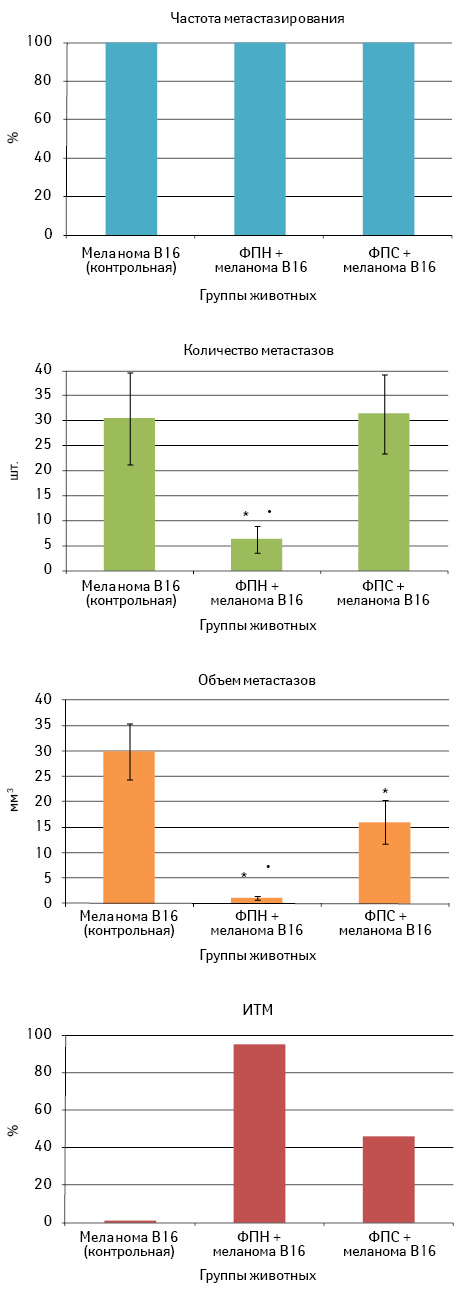
Как видно из представленных на рис. 3 данных, предварительное введение ФП не влияет на частоту метастазирования опухоли в исследуемых группах: у всех животных на 26-е сутки после внутривенной перевивки опухолевых клеток развились легочные метастазы. Однако их количество отличалось в условиях применения разных образцов ФП: в группе с ФПН количество метастазов составило 6,3±2,8 шт., что существенно меньше показателя в контроле — 30,4±9,1 шт. и в группе с ФПС — 31,4±7,9 шт. (р<0,05). Кроме того, после применения ФПН и ФПС объем метастазов, который составил соответственно 1,1±0,4 и 16,0±4,3 мм3, в обоих случаях был меньше контрольного значения 29,9±5,5 мм3 (р<0,05). Обобщая эти данные, можно утверждать, что однократное профилактическое введение ФПН оказывает более выраженное антиметастатическое действие по сравнению с таковым ФПС, о чем свидетельствует значение ИТМ (соответственно 95 и 46%).
В контексте обсуждения полученных результатов может представлять интерес состояние иммунореактивности у животных исследуемых групп, изученное нами в эти сроки (рис. 4).
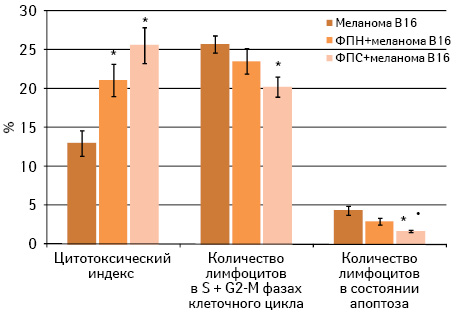
Как видно из данных, представленных на рис. 4, введение ФПН мышам C57Bl/6 до перевивки меланомы В16 не влияет на пролиферацию и апоптоз лимфоцитов в смешанной культуре in vitro. Напротив, предварительное введение ФПС приводит к существенному уменьшению количества как пролиферирующих лимфоцитов, так и лимфоцитов в состоянии апоптоза по сравнению с показателем в контрольной группе, а также в случае с числом клеток, вступивших в апоптоз, и с показателем в группе животных, получавших ФПН (р<0,05). При этом существенных отличий в цитотоксической активности лимфоцитов на фоне предварительного введения образцов ФП не выявлено. Цитотоксический индекс при применении ФПН составляет 21,1±2,1%, ФПС — 25,6±2,3% против 13,0±1,6% у мышей контрольной группы (р<0,05).
Во второй серии экспериментов исследовали влияние ФП при метрономном режиме введения (1 раз в неделю, 9 инъекций) на выживаемость мышей С57Bl/6 с меланомой В16 (рис. 5).
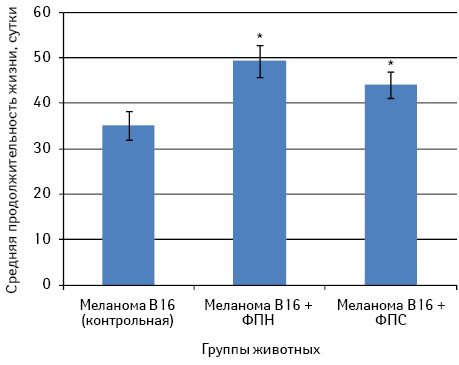
Как свидетельствуют представленные на рис. 5 данные, средняя продолжительность жизни животных после внутривенной перевивки меланомы В16 составила 35,1±3,1 сут. Введение как ФПН, так ФПС способствует существенному увеличению продолжительности жизни животных (соответственно 49,3±3,5 и 44,1±2,9 сут; р<0,05).
Механизмы, лежащие в основе такого действия ФП, были изучены на 20-е сутки после внутривенной перевивки меланомы В16 на фоне трехкратного введения (1 инъекция в неделю) соответствующего образца ФП (рис. 6).
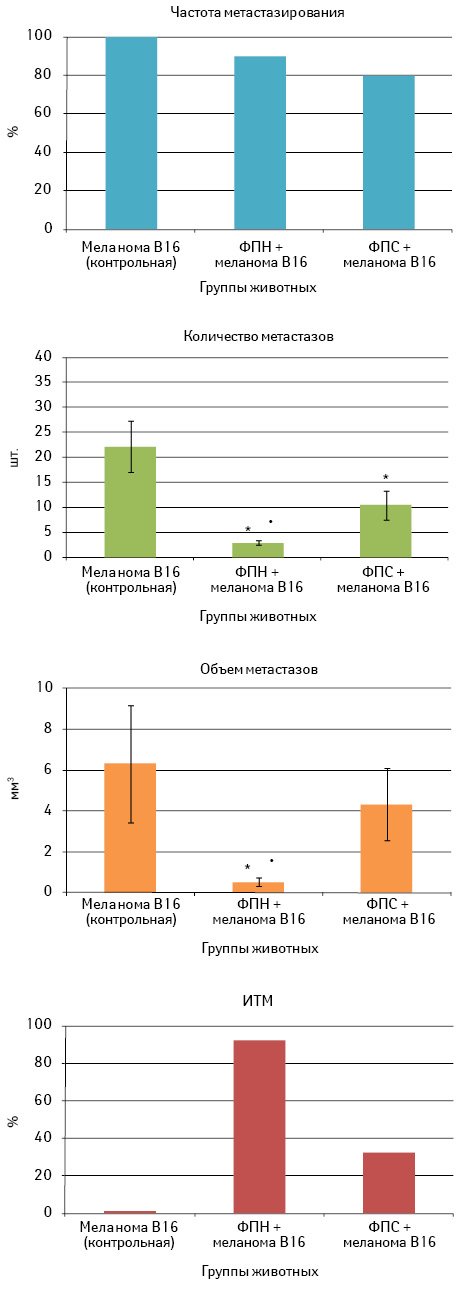
Как видно, у всех животных контрольной группы в легких выявлены метастатические очаги, среднее количество которых составило 22,0±5,1 шт. У мышей опытных групп частота метастазирования была несколько ниже, чем в контроле: в группе с ФПН — 90%, в группе с ФПС — 80%. Количество метастазов составило соответственно 2,9±0,4 и 10,3±2,9 шт., что в обоих случаях значительно (р<0,05) меньше аналогичного показателя в контрольной группе. При этом ФПН более эффективно подавляет развитие метастазов в легких мышей по сравнению с действием ФПС (р<0,05). Об этом свидетельствует и меньший объем метастазов у мышей, получавших ФПН, по сравнению с показателем в контрольной группе и в группе ФПС (соответственно 0,5±0,2 мм3 против 6,3±2,9 и 4,3±1,8 мм3; р<0,05). ИТМ в группе с ФПС составил 32%, с ФПН — 92%, что подтверждает более высокую терапевтическую эффективность последнего.
Следовательно, ФПН обладает более выраженным антиметастатическим действием при регулярном введении мышам С57Bl/6 с меланомой В16, о чем свидетельствуют угнетение роста легочных метастазов на 92% и увеличение продолжительности жизни животных на 40%.
Подводя итоги, можно заключить, что результаты, полученные на модели пассивного метастазирования меланомы В16, свидетельствуют о возможности формирования протективной иммунной защиты организма при однократном профилактическом введении ФП. Предварительное введение ФПН оказывает более выраженное терапевтическое действие по сравнению с действием ФПС. ФПН инициирует формирование противоопухолевого иммунного ответа организма, в основе которого лежат механизмы активации лимфоцитов с последующей пролиферацией специфических цитотоксических Т-лимфоцитов на фоне восстановления их пула в циркуляции [34] и повышения цитотоксической активности натуральных киллеров. Кроме иммуноопосредованных механизмов, нельзя исключать антиангиогенные эффекты ФП, обусловленные угнетением продукции фактора роста эндотелия сосудов [42]. ФПС в данной экспериментальной системе уменьшает количество лимфоцитов пролиферативного пула, а также замедляет их переход в апоптоз, что может быть обусловлено особенностями иммуносупрессорного компонента опухолеспецифического ФП [26]. Ранее нами в эксперименте были показаны преимущества карциномаспецифического ФП алло- и ксеногенного происхождения по сравнению с ФПН (аналогичного происхождения), полученными из лимфоцитов селезенки животных [28, 38, 41]. В настоящем исследовании противоопухолевые эффекты ФПН оказались более выраженными, чем меланомаспецифического образца, что может быть связано как с природой исследуемых образцов ФП (получены из эмбриональной ткани), так и с биологическими особенностями (иммуногенность) самой опухоли. Эти обстоятельства требуют дополнительного изучения в будущем. Вместе с тем полученные результаты определяют перспективу получения ФП из куриных эмбрионов и применения их в иммунотерапии пациентов для профилактики метастазирования меланомы, что может стать одним из путей повышения эффективности основного лечения этой категории больных.
Выводы
1. Предложен стандартизированный подход для получения опухолеспецифического ФП, включающий тиражирование на куриных эмбрионах активности, свойственной исходному ксеногенному образцу ФП, специфичному к антигенам мышиной меланомы В16.
2. Экспериментально обосновано применение полученных образцов ФП для предупреждения развития метастазов меланомы В16 у мышей С57Bl/6: в опытных группах животных по сравнению с контролем увеличивается продолжительность жизни, уменьшается среднее количество легочных метастазов и их объем.
3. Полученные результаты делают перспективной разработку на этой основе методов и средств эффективной иммунопрофилактики метастазирования меланомы кожи.
Список использованной литературы
1. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2017) Рак в Україні, 2015–2016. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 18: 124 с.
2. Erdei E., Torres S.M. (2010) A new understanding in the epidemiology of melanoma. Expert Rev. Anticancer Ther., 10(11): 1811–1823.
3. Кукушкина М.Н., Коровин С.И., Паливец А.Ю. (2012) Меланома кожи: современный взгляд на скрининг, диагностику и лечение (по материалам 8-го Конгресса Европейской ассоциации дерматоонкологов и 6-го Всемирного заседания междисциплинарных центров по лечению меланомы и рака кожи). Клин. онкология, 8(4): 24–27.
4. Eggermont A.M., Gore M. (2007) Randomized adjuvant therapy trials in melanoma: surgical and systemic. Semin. Oncol., 34(6): 509–515.
5. Grob J.J., Jouary T., Dréno B. et al. (2013) Adjuvant therapy with pegylated interferon alfa-2b (36 months) versus low-dose interferon alfa-2b (18 months) in melanoma patients without macrometastatic nodes: an open-label, randomised, phase 3 European Association for Dermato-Oncology (EADO) study. Eur. J. Cancer, 49(1): 166–174.
6. Galluzzi L., Vaccelli E., Dravo-San Pedro J.-M. et al. (2014) Classification of current anticancer immunotherapies. Oncotarget, 5(24): 12472–12508.
7. Eggermont A.M., Suciu S., Testori A. et al. (2012) Ulceration and stage are predictive of interferon efficacy in melanoma: results of the phase III adjuvant trials EORTC 18952 and EORTC 18991. Eur. J. Cancer, 48(2): 218–225.
8. Ives N.J., Suciu S., Eggermont A.M.M. et al. (2017) Adjuvant interferon-α for the treatment of high-risk melanoma: an individual patient data meta-analysis. Eur. J. Cancer., 82: 171–183.
9. Agarwala S.S. (2009) Current systemic therapy for metastatic melanoma. Expert Rev. Anticancer Ther., 9(5): 587–595.
10. Lee S., Margolin K. (2011) Cytokines in cancer immunotherapy. Cancers (Basel), 3(4): 3856–3893.
11. Atkins M.B., Kunkel L., Sznol M. et al. (2000) High-dose recombinant interleukin-2 therapy in patients with metastatic melanoma: long-term survival update. Cancer J. Sci. Am., 6(Suppl. 1): 11–14.
12. Davies M.A., Samuels Y. (2010) Analysis of the genome to personalize therapy for melanoma. Oncogene, 29(41): 5545–5555.
13. Rosenberg S.A., Yang J.C., Restifo N.P. (2004) Cancer immunotherapy: moving beyond current vaccines. Nat. Med., 10: 909–915.
14. Robert C., Schachter J., Long G.V. et al. (2015) Pembrolizumab versus Ipilimumab in advanced melanoma. N. Engl. J. Med., 372(26): 2521–2532.
15. Hodi F.S., Butler M., Oble D.A. et al. (2008) Immunologic and clinical effects of antibody blockade of cytotoxic T-lymphocyte-associated antigen 4 in previously vaccinated cancer patients. Proc. Natl. Acad. Sci. USA, 105(8): 3005–3010.
16. Robert C., Ribas A., Wolchok J.D. et al. (2014) Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet, 384(9948): 1109–1117.
17. Chapman P.B., Hauschild A., Robert C. et al. (2011) Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N. Engl. J. Med., 364(26): 2507–2516.
18. Rosenberg S.A., Restifo N.P. (2015) Adoptive cell transfer as personalized immunotherapy for human cancer. Science, 348(6230): 62–68.
19. Prieto P.A., Durflinger K.H., Wunderlich J.R. et al. (2010) Enrichment of CD8+ cells from melanoma tumor-infiltrating lymphocyte cultures reveals tumor reactivity for use in adoptive cell therapy. J. Immunother., 33(5): 547–556.
20. Phan G.Q., Rosenberg S.A. (2013) Adoptive cell transfer for patients with metastatic melanoma: the potential and promise of cancer immunotherapy. Cancer Control, 20(4): 289–297.
21. Kirkpatrick C.H. (1993) Structural nature and functions of transfer factors. Ann. N. Y. Acad., 685: 362–368.
22. Alvarez-Thull L., Kirkpatrick C.H. (1996) Profiles of cytokine production in recipients of transfer factors. Biotherapy, 9(1–3): 55–59.
23. Kirkpatrick C.H. (2000) Transfer factors: identification of concerved sequences in transfer factor molecules. Mol. Med., 6(4): 332–341.
24. Ojeda M.O., van’t Veer C., Fernández Ortega C.B. et al. (2005) Dialyzable leukocyte extract differentially regulates the production of TNFalpha, IL-6, and IL-8 in bacterial component-activated leukocytes and endothelial cells. Inflamm. Res., 54(2): 74–81.
25. Franco-Molina M.A., Mendoza-Gamboa E., Castillo-León L.J. et al. (2005) Bovine dialyzable leukocyte extract modulates the nitric oxide and pro-inflammatory cytokine production in lipopolysaccharide-stimulated murine peritoneal macrophages in vitro. Med. Food, 8(1): 20–26.
26. Lawrence H.S., Borkowsky W. (1996) Transfer factor — current status and future prospects. Biotherapy, 9(1–3): 1–5.
27. Levine P.H., Pizza G., Ajmera K. et al. (2011) Transfer factor in virus-associated malignancies: an underestimated weapon in prevention and treatment of cancer. Advances in Tumor Virology, 2: 7–20.
28. Гриневич Ю.А., Фильчаков Ф.В., Шумилина Е.С. и др. (2014) Фактор переноса и проблема иммунопрофилактики метастазов злокачественных новообразований (обзор литературы и собственных исследований). Наук. журн. МОЗ України, 1(5): 118–127.
29. Blume M.R., Rosenbaum E.H., Cohen R.J. et al. (1981) Adjuvant immunotherapy of high risk stage I melanoma with transfer factor. Cancer, 47(5): 882–888.
30. Miller L.L., Spitler L.E., Allen R.E. et al. (1988) A randomized, double-blind, placebo-controlled trial of transfer factor as adjuvant therapy for malignant melanoma. Cancer, 61(8): 1543–1549.
31. Фильчаков Ф.В., Коровин С.И., Лён А.Д. и др. (2014) Коррекция иммунологических нарушений у больных генерализованной формой меланомы кожи в процессе химиотерапии. Онкология, 16(2): 122–129.
32. Пат. № 88026, UA, МПК G 01 N 33/53. Спосіб отримання трансферфакторних поліпептидів з певною специфічністю / Фільчаков Ф.В., Шуміліна К.С., Льон Г.Д., Кукушкіна С.М.; заявник та патентовласник Нац. ін-т раку. — 3. № u201311945; заявл. 11.10.2013; опубл. 25.02.2014. — Бюл. № 4.
33. Пат. № 16938, UA, МПК А 61 К 35/28. Спосіб отримання пухлиноспецифічного фактора переносу / Фільчаков Ф.В., Бобро Л.І., Шуміліна К.С., Гріневич Ю.Я.; заявник та патентовласник Ін-т онкології АМН України. — З. № 200504315; заявл. 06.05.2005; опубл. 15.09.2006. — Бюл. № 9.
34. Кузнецова В.Г., Жегунов Г.Ф. (2008) Действие экстрактов из эмбриональных тканей кур на мышей с экспериментальной лейкопенией. Проблемы криобиологии, 18(3): 328–331.
35. Практическая химия белка: Пер. с англ./ Под ред. А. Дарбре. Мир, Москва, 1989. 623 с.
36. Nicoletti I., Migliorati G., Pagliacci M.C. et al. (1991) A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J. Immunol. Methods, 139: 271–279.
37. Пинегин Б.В., Ярилин А.А., Симонова А.В. и др. (2001) Применение проточной цитометрии для оценки функциональной активности иммунной системы человека. Пособие для врачей-лаборантов. Москва, 53 с.
38. Фільчаков Ф.В., Льон Г.Д., Шуміліна К.С. та ін. (2014) Імуноопосередковані механізми антиметастатичної дії карцинома-специфічного фактора переносу в умовах росту експериментальних пухлин у мишей С57ВL/6. Клин. онкология, 2(14): 53–57.
39. Sheng Sow H., Mattarollo S.R. (2013) Combining low-dose or metronomic chemotherapy with anticancer vaccines: A therapeutic opportunity for lymphomas. Oncoimmunology, 2(12): e27058.
40. Лапач С.Н., Чубенко А.В., Бабич П.Н. (2001) Статистические методы в медико-биологических исследованиях с использованием Excel. Морион, Киев, 408 с.
41. Гриневич Ю.А., Фильчаков Ф.В., Шумилина Е.С. и др. (2008) Фактор переноса: получение, биологическая характеристика, влияние на противоопухолевую резистентность организма. Специфічна імунотерапія в онкології; за ред. Ю.Я. Гріневича. Здоров’я, Київ: 293–328.
42. Franco-Molina M.A., Mendoza-Gamboa E., Zapata-Benavides P. et al. (2010) Antiangiogenic and antitumor effects of IMMUNEPOTENT CRP in murine melanoma. Immunopharmacol. Immunotoxicol., 32(4): 637–646.
Фильчаков Феодосий Викторович
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака
Тел.: (044) 259-01-84
E-mail: labklimmun@i.ua
Fil’chakov Feodosiy
33/43 Lomonosova Str., Kyiv 03022
National Cancer Institute
Tel.: (044) 259-01-84
E-mail: labklimmun@i.ua














Leave a comment