Роль мутацій гена ESR1 у розвитку резистентності до гормонотерапії у хворих із люмінальними підтипами раку грудної залози
Сивак Л.А., Тарасенко Т.Є., Лялькін С.А., Верьовкіна Н.О.
Резюме. Гормонотерапія (ГТ) — основа медикаментозного лікування при люмінальних підтипах раку грудної залози за рахунок високої ефективності та низької токсичності. Однак у частини пацієнтів відбувається прогресування захворювання під час прийому гормонопрепаратів унаслідок розвитку резистентності. Так, прогресування патологічного процесу очікується у половини пацієнток на тлі першої лінії ГТ тамоксифеном і в третини пацієнток — за використання групи інгібіторів ароматази. У розвитку резистентності до ГТ важливе визначення первинного чи вторинного (набутого) її характеру. В обох випадках зниження чутливості до гормонопрепаратів може бути зумовлене як порушенням балансу між білками-активаторами, супресорами рецепторів естрогенів (ER) і стимуляцією естрогеннезалежних сигнальних шляхів росту, так і за рахунок мутаційних змін гена ESR1, що безпосередньо кодує експресію ER. Останнім часом активно обговорюється роль мутацій гена ESR1 як раннього маркера прогнозування розвитку нечутливості до стандартних режимів ГТ (особливо за неможливості виконання повторних біопсій).
Одержано 12.02.2017
Прийнято до друку 02.03.2017
Раку грудної залози (РГЗ) властива висока гетерогенність, зумовлена передусім молекулярно-генетичними особливостями як тканини первинної пухлини, так і її метастатичних осередків. Дослідження експресії генів з визначенням їх варіантів мутацій призводить до зміни загальноприйнятих постулатів протипухлинної терапії та вибору індивідуалізованого лікування. Першою мішенню таргетної терапії РГЗ і дотепер залишаються рецептори естрогенів (ER). Майже 75% усіх випадків РГЗ є ER-позитивними [1, 2]. Дія естрогенів у клітинах реалізується завдяки їх зв’язуванню з одним з двох специфічних рецепторів — α чи β, які є лігандзалежними транскрипційними факторами і належать до суперродини ядерних рецепторів. Ці рецептори синтезуються відповідно генами ESR1 та ESR2. ESR1 локалізується на 6-й хромосомі [32]. Поєднана експресія ER-α і ER-β визначається у більшості пухлин РГЗ, проте тільки підвищення експресії ER-α сприяє збільшенню чутливості до гормонотерапії (ГТ) антиестрогенами та інгібіторами ароматази (ІА) [3, 4]. Вважають, що обидва рецептори на пухлинних клітинах РГЗ знаходяться в антагоністичних відносинах: ER-α переважно стимулюють клітинну проліферацію, а ER-β належать до супресорів клітинного поділу, і втрата експресії ER-β корелює з прогресуванням естрогеннезалежного РГЗ [5, 6]. Водночас [7] підвищення експресії ER-α при РГЗ клінічно асоційоване з невеликими розмірами пухлини, повільним ростом та низьким рівнем злоякісності.
Враховуючи біологічні особливості пухлини, імуногістохімічно РГЗ розподіляють на 2 групи пухлин з позитивним статусом ER, що належать до люмінальних підтипів А і В. Для люмінального А РГЗ характерні високоекспресуючі рецептори естрогенів/прогестеронів та низький індекс мітотичної активності пухлинних клітин, що виражається експресією білка Ki-67 не більш ніж у 20% досліджуваних пухлинних клітин. Гормонозалежні пухлини з показником Ki-67 вище порогового рівня та/або з гіперекспресією рецептора епідермального фактора росту (Her2/neu) у пухлині відносять до люмінального В підтипу РГЗ, що має агресивніший перебіг та гірший прогноз, ніж люмінальний А підтип.
Уже відомо, що лише 40% пацієнток з люмінальними підтипами РГЗ позитивно реагують на антиестрогенну терапію, в інших — на етапі ГТ розвивається резистентність. Залежно від термінів розвитку резистентність буває первинною та вторинною (набутою) [9]. Так, рецидив хвороби, що виник упродовж перших двох років після проведення ад’ювантної ГТ, визначається як первинна ендокринна резистентність, а вторинна (набута) гормонорезистентність — рецидив після 24 міс ад’ювантної ГТ чи рецидив протягом 12 міс після її завершення. У разі первинного метастатичного процесу РГЗ первинну резистентність визначають за прогресування захворювання упродовж перших 6 міс від початку першої лінії ГТ, а вторинну (набуту) — за наявності ознак прогресування після 6 міс проведення ГТ [8, 9].
Розвиток резистентності РГЗ до ГТ може бути зумовлений зменшенням вмісту ER, порушенням балансу між білками-активаторами і супресорами ER, ліганднезалежною активацією ER, стимуляцією сигнальних шляхів EGFR, PI3K, NF-kB, що ідуть в обхід естрогенових рецепторів, розповсюдженням гормонорезистентності паракринним шляхом чи через власне міжклітинні контакти [10–14].
У вивченні причин розвитку гормонорезистентності у хворих на РГЗ особливої уваги надають дослідженню гена ESR1, що переважно зустрічається в ER-α1 лігандзв’язуючому домені. На сьогодні залишається остаточно нез’ясованим зв’язок між поліморфізмом гена ESR1 та його функціональними властивостями.
Так, поліморфізм гена ESR1 відмічають тільки в 3% випадків первинних злоякісних пухлин грудної залози [15–18]. Проте його виявляють у 55% пацієнтів з гормоночутливим метастатичним РГЗ, які вже отримували лікування антиестрогенами. За даними досліджень in vitro, такі зразки пухлинних клітин з наявними мутаціями менш чутливі до подальшої терапії антиестрогенами, ніж ER-позитивні пухлинні клітини дикого типу [17, 21].
Встановлено 5 основних мутацій, асоційованих з ESR1 (D538G, E380Q та Y537S/N/C) при ER-позитивному метастатичному РГЗ після ГТ (табл. 1).
| Тип мутації | Частота варіантів мутацій гена ESR1, % |
| S463P [19] | 5 |
| S463P [19] | 3 |
| P535H [19] | 3 |
| L536Q [20] | 3 |
| L536R [19] | 3 |
| Y537C [19, 21] | 5 |
| Y537S [17, 19, 20] | 28 |
| Y537N [19, 21] | 13 |
| D538G [19, 20] | 36 |
Збільшення мутаційного навантаження в метастатичних осередках порівняно з первинним РГЗ представлено в роботах [19, 20]. Усі пацієнтки з визначеним ESR1-позитивним мутаційним статусом (переважно D538G та Y537S) у метастатичних тканинах, згідно з аналізом дослідження W. Toy та співавторів, отримували лікування гормонопрепаратами групи ІА [19, 20].
D. Robinson та співавтори (2013–2015 рр.) виявили мутації гена ESR1 у 6 з 11 біопсійних зразків метастатичних осередків ER-позитивного РГЗ та обґрунтували гіпотезу про ключову роль мутацій гена ESR1 щодо розвитку механізмів набутої гормонорезистентності після прийому ІА [20–22].
D. Guttery та співавтори (2015 р.), оцінюючи точність виявлення мутацій гена ESR1 у плазмі крові 48 хворих із метастатичним ER-позитивним РГЗ, визначили пріоритетною методикою вибору проведення технологію digital PCR (dPCR) порівняно із секвенуванням NGS (next-generation sequencing). Так, застосування dPCR дозволило визначити D538G мутації ESR1 додатково у 15% пацієнток, на відміну від аналізу cfDNA на основі секвенування NGS — у 6% (3/48). Цікавим є в цьому дослідженні аналіз попереднього лікування пацієнток з ESR1-мутаціями. Поява мутаційних змін гена ESR1 відбулася на фоні, окрім використання традиційної ГТ, ще в однієї пацієнтки за 3 міс лише хіміотерапевтичного лікування із застосуванням комбінації доцетаксел/вінорельбін [20–23].
У дослідженні T. Takeshita та співавторів (2015 р.) за допомогою dPCR були визначені мутації гена ESR1 в 11 із 55 випадків метастатичного РГЗ, із них у 36% (4/11) — поліклональні варіанти. Лікування цих пацієнток проводили ІА, у 4 з 11 пацієнток обмежилися лише прийомом тамоксифену, а дві пацієнтки з виявленими ESR1-мутаціями лікування не отримували [24–26].
G. Schiavon та співавтори (2015 р.) обстежили 128 жінок з метастатичним РГЗ та прогресуванням на тлі ГТ [23]. Мутації ESR1 визначили у 18 (14%) пацієнток, у 56% з них переважав мутантний варіант D538G. Поліклональність ESR1 мутацій виявили у 21% досліджуваних. Усі пацієнтки з мутантним ESR1 отримували попереднє лікування ІА, переважно на етапі метастатичного процесу (36%). В ад’ювантному режимі попередня терапія ІА супроводжувалася мутацією ESR1 лише у 4%. За отриманими результатами, дослідники припускають потенційну роль впливу терапії ІА на виникнення варіантів мутацій гена ESR1 саме при первинно-розповсюдженому РГЗ, хоча і зважають на наявність вже існуючих субклонів ESR1-мутацій у первинній пухлині, навантаження якими зростає у разі метастатичного процесу [21].
Розподіл найчастіших варіантів поліморфізму гена ESR1 за даними біопсійного матеріалу пацієнток з метастатичним РГЗ представлено у табл. 2.
| Загальна кількість пацієнтів y дослідженні |
Кількість пацієнтів з мутаціями гена ESR1, n (%) |
Мутації гена ESR1, n (%) | ||||
| D538G | Y537S | Y537N | Y537C | Інші | ||
| 48 пацієнток під час ГТ [22] | 9/48 (19) | 9/48 (19) | н/д | н/д | н/д | н/д |
| 128 пацієнток з прогресуванням на фоні ГТ [23] | 18/128 (14) | 14/128 (11) | 3/128 (2) | 4/128 (3) | 2/128 (2) | 2/128 (2), L536R |
| 29 пацієнток з метастазами РГЗ [21] | 7/29 (24) | 6/29 (21) | 2/29 (7) | − | 1/29(3) | − |
| 161 пацієнтка з попередньою чутливістю до нестероїдних ІА (SoFEA) [28] | 63/161 (39) | 29/161 (18) | 16/161 (10) | 23/161 (14) | 3/161 (2) | 6/161 (4), E380Q; 6/161 (4), S463P; 2/161 (1), L536R |
| 360 пацієнток з прогресуванням на фоні ГТ (PALOMA3) [29] | 91/360 (25) | 51/360 (14) | 23/360 (6) | 14/360 (4) | 5/360 (1) | 22/360 (6), E380Q; 4/360 (1), S463P; 1/360 (1), L536R |
| 153 пацієнтки, які отримували попередню ГТ ІА (FERGI) [30] | 57/153 (37) | 31/153 (20) | 19/153 (12) | 10/143 (7) | 6/143 (4) | 15/153 (26), E380Q; 5/143 (3), S463P; 7/143 (5) L536P |
| 541 пацієнтка з прогресуванням після нестероїдних ІА (BOLERO-2) [31] | 156/541 (29) | 113/541 (21) | 72/541 (13) | − | − | − |
н/д — не досліджували.
Спроби подолання гормонорезистентності відображені в низці рандомізованих та мультицентрових досліджень, але лише в деяких оцінювали роль мутацій гена ESR1 [21, 27–29].
У дослідження SoFEA було залучено 723 пацієнтки з метастатичним РГЗ, ER-позитивних в постменопаузі, які продемонстрували попередню чутливість до ІА. Хворих було розподілено на 2 групи: перша група отримувала фулвестрант (500 мг внутрішньом’язово в 1-й день, надалі 250 мг на 15-й та 29-й день з подальшим введенням кожних 28 днів) з одночасним прийомом анастрозолу щоденно 1 мг чи фулвестранту з плацебо; друга група одержувала лише екземестан 25 мг щоденно у монорежимі. За результатами дослідження, зі 161 пацієнтки з РГЗ мутації гена ESR1 виявили у 39,1% (63/161). Автори оцінили вплив мутацій ESR1 на результати лікування пацієнток, які отримали фулвестрантвмісну терапію (n=104) або лише екземестан (n=57). У пацієнток групи екземестану з мутаціями гена ESR1 медіана безрецидивної виживаності (БРВ) становила 2,6 міс (95% довірчий інтервал (ДІ) 2,4–6,2) проти 5,7 міс (95% ДІ 3,0–8,5) — у хворих, які лікувалися фулвестрантом (рис. 1).
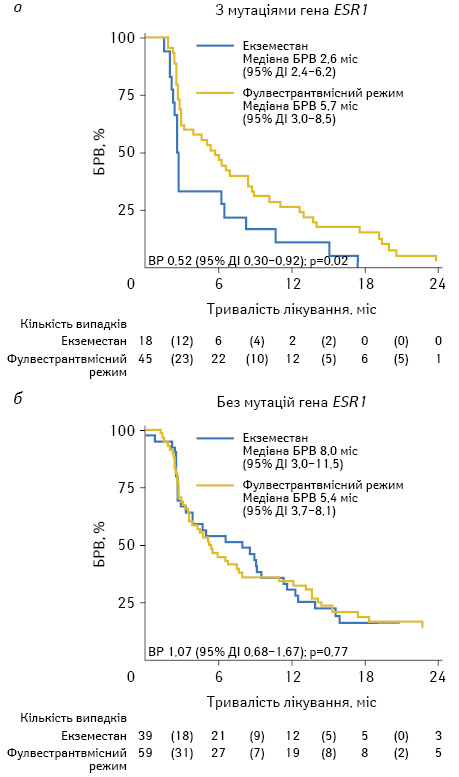
За відсутності мутацій гена ESR1 пріоритет терапії має протилежний напрям: БРВ в групі екземестану становила з wild-type ESR1 — 8 міс (95% ДІ 3,0–11,5) і лише 5,4 міс (95% ДІ 3,7–8,1) — при фулвестрантвмісних схемах.
Таким чином, статус ESR1 — важливий як для вибору тактики, так і для прогнозування віддалених результатів лікування хворих на РГЗ.
У мультицентровому рандомізованому дослідженні PALOMA3 оцінювали ефективність застосування інгібітору циклінзалежних кіназ CDK 4/6 — палбоциклібу з фулвестрантом у жінок пре- та постменопаузального віку з метастатичним, ER-позитивним РГЗ, у яких зареєстровано прогресування під час ГТ препаратами першої лінії. Усього було залучено 521 пацієнтку з розподілом за варіантами терапії 2:1 відповідно палбоциклібом (125 мг протягом 3 тиж із подальшою перервою 1 тиж) з фулвестрантом (500 мг внутрішньом’язово кожні 14 днів протягом перших 3 ін’єкцій з подальшим введенням 500 мг кожних 28 днів) чи фулвестрантом з плацебо. Жінки пременопаузального віку отримували паралельно гозерелін впродовж всього курсу лікування. Для визначення ESR1-статусу проаналізовано 360 зразків плазми крові, ESR1-мутації виявили у 25,3% пацієнток (91/360). У пацієнток з комбінованим режимом (палбоцикліб і фулвестрант) медіана БРВ становила 9,4 міс (95% ДІ 5,3–11,1) порівняно з 3,6 міс (95% ДІ 2,0–5,5) при терапії фулвестрантом у монорежимі (рис. 2).
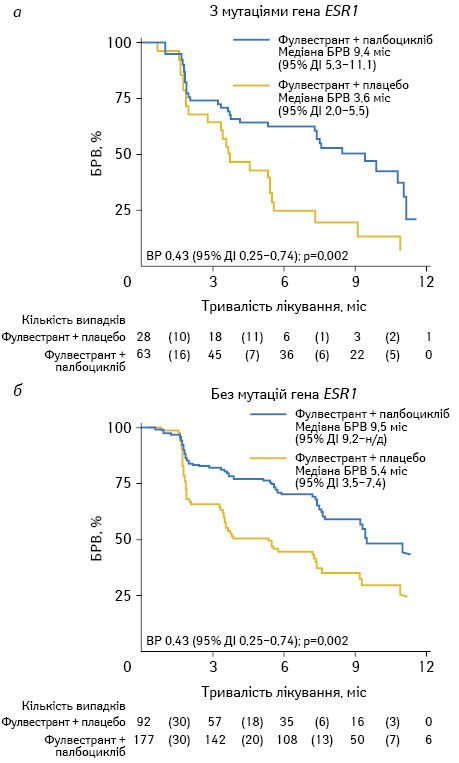
За відсутності мутацій БРВ становила 9,5 міс (95% ДІ 9,2–не досягнуто) у групі із застосуванням палбоциклібу та 5,4 міс (95% ДІ 3,5–7,4) — у групі пацієнток з фулвестрантом у монорежимі. Перевага включення палбоциклібу до терапії у випадках гормонорезистентного метастатичного РГЗ зазначена незалежно від ESR1-статусу, хоча негативний вплив мутантного ESR1 на віддалені результати лікування фулвестрантом та палбоциклібом не виключається.
Враховуючи вищесказане, можна резюмувати, що точний механізм мутаційного ESR1 збагачення при прогресуванні ініціально гормоночутливих пухлин досі невідомий, хоча клінічна значимість мутацій ESR1, присутніх в cfDNA, стає очевидною.
Отже, дослідження гена ESR1 сприяють вдосконаленню лікування гормонорезистентного РГЗ. Визначення поліморфізму гена ESR1 може слугувати додатковим прогностичним фактором для індивідуалізації лікування пацієнток вже з наявною резистентністю до ГТ чи прогнозування ризику її розвитку.
Список використаної літератури
1. Nadji M., Gomez-Fernandez C., Ganjei-Azar P., Morales A.R. (2005) Immunohistochemistry of estrogen and progesterone receptors reconsidered: experience with 5993 breast cancers. Am. J. Clin. Pathol., 123(1): 21–27.
2. Rhodes A., Jasani B., Balaton A.J. et al. (2000) Frequency of estrogen and progesterone receptor positivity by immunohistochemical analysis in 7016 breast carcinomas: correlation with patient age, assay sensitivity, threshold value, and mammographic screening. J. Clin. Pathol., 53(9): 688–696.
3. Gross J., Yee D. (2002) How does the estrogen receptor work? Breast Cancer Res., 4: 62–64.
4. Levin E. (2005) Integration of the extranuclear and nuclear actions of estrogen. Mol. Endocrinol., 19: 1951–1959.
5. Mosselman S., Polman J., Dijkema R. (1996) ER beta: identification and characterization of a novel human estrogen receptor. FEBS Letters, 392(1): 49–53.
6. Murphy L., Watson P.H. (2006) Is oestrogen receptor-beta a predictor of endocrine therapy responsiveness in human breast cancer? Endocr. Relat. Cancer, 13(2): 327–334.
7. Красильников М.А., Щербаков А.М. (2014) Сигнальные пути, регулируемые эстрогенами, и их роль в опухолевой прогрессии: новые факты и направления поиска. Успехи молекулярной онкологии, 1: 18–26.
8. Pankaj T., Maglic D., Kai F. et al. (2010) Classical and novel prognostic markers for breast cancer and their clinical significance. Clin. Med. Insights Oncol., 15–34.
9. Cardoso F., Costa A., Senkus E. et al. (2017) 3rd ESO-ESMO International Consensus Guiedlines for Advanced Breast Cancer (ABC3). Ann. Oncol., 28: 16–33.
10. Blanco G., Holli K., Heikkinen M. et al. (1990) Prognostic factors in recurrent breast cancer: relationships to site of recurrence, disease-free interval, female sex steroid receptors, ploidy and histological malignancy grading. Br. J. Cancer, 62: 142–146.
11. Hutcheson I., Knowlden J.M., Madden T.A. et al. (2003) Estrogen receptor-mediated modulation of the EGFR/MAPK pathway in tamoxifen-resistant MCF-7 cells. Breast Cancer Res. Treat., 81: 81–93.
12. Kahlert S., Nuedling S., van Eickels M. et al. (2000) Estrogen receptor alpha rapidly activates the IGF-1 receptor pathway. J. Biol. Chem., 275: 18447–18453.
13. Kato S., Endoh H., Masuhiro Y. et al. (1995) Activation of the estrogen receptor through phosphorylation by mitogen activated protein kinase. Science, 270: 1491–1494.
14. Roop R., Ma C.X. (2012) Endocrine resistance in breast cancer: molecular pathways and rational development of targeted therapies. Future Oncol., 8(3): 273–292.
15. Karnic P., Kulkarni S., Liu X.P. et al. (1994) Estrogen receptor mutations in tamoxifen-resistant breast cancer. Cancer Res., 54: 349–353.
16. Roodi N., Bailey L.R., Kao W.Y. et al. (1995) Estrogen receptor gene analysis in estrogen receptor-positive and receptor-negative primary breast cancer. J. Natl. Cancer Inst., 87: 446–451.
17. Jeselsohn R., Buchwalter G., De Angelis C. et al. (2015) ESR1 mutations as a mechanism for acquired endocrine resistance in breast cancer. Nat. Rev. Clin. Oncol., 12(10): 573–583.
18. Сomprehensive molecular portraits of human breast tumours (2012) Cancer Genome Atlas Network. Nature, 490: 61–70.
19. Toy W., Shen Y., Won H. et al. (2013) ESR1 ligand-binding domain mutations in hormone-resistant breast cancer. Nat Genet., 45: 1439–1445.
20. Robinson D., Wu Y.M., Vats P. et al. (2013) Activating ESR1 mutations in hormone-resistant metastatic breast cancer. Nat. Genet., 45: 1446–1451.
21. Jeselsohn R., Yelensky R., Buchwalter G. et al. (2014) Emergence of constitutively active estrogen receptor-α mutations in pretreated advanced estrogen receptor-positive breast cancer. Clin. Cancer Res., 20: 1757–1767.
22. Guttery D., Page K., Hills A. et al. (2015) Noninvasive detection of activating estrogen receptor 1 (ESR1) mutations in estrogen receptor-positive metastatic breast cancer. Clin. Chem., 61(7): 974–982.
23. Schiavon G., Hrebien S., Garcia-Murillas I. et al. (2015) Analysis of ESR1 mutation in circulating tumor DNA demonstrates evolution during therapy for metastatic breast cancer. Sci. Tranci. Med., 7: 313ra182.
24. Dawson S., Tsui D.W., Murtaza M. et al. (2013) Analysis of circulating tumor DNA to monitor metastatic breast cancer. N. Engl. J. Med., 368: 1199–1209.
25. Angus L., Beije N., Jager A. et al. (2017) ESR1 mutations: Moving towards guiding treatment decision-making in metastatic breast cancer patients. Cancer Treat. Rev., 52: 33–40.
26. Takeshita T., Yamamoto Y., Yamamoto-Ibusuki M. et al. (2015) Droplet digital polymerase chain reaction assay for screening of ESR1 mutations in 325 breast cancer specimens. Trans. Res., 166: е2.
27. Wang P., Bahreini A., Gyanchandani R. et al. (2016) Sensitive detection of mono- and polyclonal ers1 mutations in primary tumors, metastatic lesions, and cell-free DNA of breast cancer patients. Clin. Cancer Res., 22: 1130–1137.
28. Fribbens C., O’Leary B., Kilburn L. et al. (2016) Plasma ESR1 mutations and the treatment of estrogen receptor-positive advanced breast cancer. J. Clin. Oncol., 34: 2961–2968.
29. Turner N., Jiang Y., O’Leary B. et al. (2016) Efficacy of palbociclib plus fulvestrant (P+F) in patients (pts) with metastatic breast cancer (MBC) and ESR1 mutations (mus) in circulating tumor DNA (ctDNA). J. Clin. Oncol., 34 (suppl.): abstr 512.
30. Spoerke J., Gendreau S., Walter K. et al. (2016) Heterogeneity and clinical significance of ESR1 mutations in ER-positive metastatic breast cancer patients receiving fulvestrant. Nat. Commun., 7: 11579.
31. Hortobagyi G.N., Chen D., Piccart M. et al. (2016) Correlative analysis of genetic alterations and everolimus benefit in hormone receptor-positive, human epidermal growth factor receptor 2–negative advanced breast cancer: results from BOLERO-2. J. Clin. Oncol., 34(5): 419–426.
32. Gosden J., Middleton P., Rout D. (1986) Localization of the human oestrogen receptor gene to chromosome 6q24–q27 by in situ hybridization. Cytogenet. Cell Genet., 43: 218–220.
Роль мутаций гена ESR1 в развитии резистентности к гормонотерапии у больных с люминальными подтипами рака грудной железы
Национальный институт рака, Киев
Резюме. Гормонотерапия (ГТ) — основа медикаментозного лечения при люминальных подтипах рака грудной железы, что обусловлено высокой эффективностью и низкой токсичностью. Однако у части пациентов происходит прогрессирование заболевания на фоне проведения ГТ, что объясняется развитием резистентности. Так, прогрессирование патологического процесса отмечается у половины пациенток на фоне первой линии ГТ тамоксифеном и у трети пациенток — с использованием группы ингибиторов ароматазы. В развитии резистентности к эндокринной терапии важно определение первичного или вторичного (приобретенного) ее характера. В обоих случаях снижение чувствительности к гормонопрепаратам может быть обусловлено как нарушением баланса между белками-активаторами, супрессорами рецепторов эстрогенов (ER) и стимуляцией эстрогеннезависимых сигнальных путей роста, так и за счет мутационных изменений гена ESR1, непосредственно кодирующего экспрессию ER. В последнее время активно обсуждается роль мутаций гена ESR1 в качестве раннего маркера прогнозирования развития резистентности к стандартным режимам ГТ (особенно при невозможности повторных биопсий).
рак грудной железы; гормонотерапия; резистентность; ген ESR1.
Адреса:
Тарасенко Тетяна Євгенівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 257-93-64
E-mail: tarasenko28te@gmail.com
Correspondence:
Tarasenko Tetiana
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
Теl.: (044) 257-93-64
E-mail: tarasenko28te@gmail.com














Leave a comment