Хіміотерапія солідних пухлин, її ускладнення та терапія супроводу
Нудота, блювання в практиці онколога
О.П. Андрусенко, О.В. Вдовенко
Волинський обласний онкодиспансер
Нудота — неприємне суб’єктивне відчуття наближення блювання. Блювання — рефлекс форсованого випорожненя вмісту шлунка через рот. Наслідки вимотуючі та втомлюючі: відчуття нудоти — нездатність утримувати тверду або рідку їжу, кислий і гіркий смак у роті. Патофізіологія: Нудота — це суб’єктивне відчуття, коли відбувається стимуляція слизової оболонки шлунка і кишки, хеморецепторної тригерної зони довгастого мозку (ХТЗ), вестибулярного апарату, кори великих півкуль головного мозку. Блювання (неприємний запах блювотної маси) має нейромускульний рефлекс.
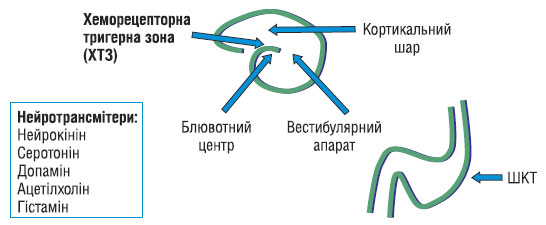
Причини: метастази, подразнення менінгеальних оболонок, рух, лікарські засоби, подразнення слизової оболонки, механічна обструкція, моторика, обмін речовин, мікроби. Нудота, пов’язана з хіміотерапією: гостра — виникає до 24 год — з хеморецепторної тригерної зони відбувається викид серотоніну в ШКТ; відстрочена — виникає через 24 год (навіть через кілька днів).
Еметогенність хіміотерапії
Лікування: антагоністи допаміну, антагоністи гістаміну (антигістамінні засоби), антагоністи ацетилхоліну (антихолінергики), антагоністи серотоніну, антагоністи нейрокінітинових рецепторів 1 типу, прокінетична засоби/агенти, інші препарати: Медрол, 32 мг на добу per os; Лоразепам 0,5–2 мг кожні 4–6 год per os; Октреотид 10 мкг/год, вводиться в/в або п/к, або 100 мкг вводиться підшкірно 8 год при кишковій непрохідності.
Проведення комплексної оцінки на основі патофізіологічних характеристик терапії з метою лікування як основної причини, так і поліпшення загального стану онкологічних хворих.
Вивчення впливу локалізації метастатичних вогнищ на показники загальної і безрецидивної виживаності у хворих, що отримували гормонотерапію з приводу люмінального А типу метастатичного раку молочної залози в менопаузі
О.І. Асєєв, І.М. Бондаренко, В.Ф. Завізіон
Дніпропетровська державна медична академія
Проблема раку молочної залози (РМЗ) є актуальною, незважаючи на успіхи в її діагностиці і лікуванні. РМЗ супроводжується високою летальністю внаслідок значної кількості метастатичних форм. З іншого боку, загальна (ЗВ) та безрецидивна виживаність (БВ) у хворих із різною локалізацією метастатичних вогнищ суттєво різняться.
Метою роботи було вивчення ефективності лікування інгібіторами ароматази метастатичного РМЗ (МРМЗ) з позитивним статусом рецепторів естрогенів (ЕР) і прогестерону (ПР) та негативним статусом рецепторів 2-го типу епідермального фактора росту людини (HER2/neu) у хворих в менопаузі залежно від локалізації пухлинних вогнищ. В дослідження включені 77 жінок, що проходили гормонотерапію на базі багатопрофільної клінічної лікарні № 4 Дніпропетровська. Всі хворі були в менопаузі більше 2 років, мали гістологічне підтвердження РМЗ, імуногістохімічне дослідження ЕР, ПР, HER2/neu. Відповідь пухлини оцінювалася на підставі комп’ютерної томографії (КТ) згідно з критеріями RECIST 1.0. Проаналізовані показники ЗВ, БВ і частоти розвитку прогресії протягом 3 років залежно від локалізації маркерних вогнищ (МВ).
Сумарний діаметр МВ відзначається багатьма авторами як незалежний достовірний чинник прогнозу МРМЗ. Нами встановлено достовірні відмінності показників ЗВ і БВ у групах із сумарним діаметром МВ за даними КТ: до 50 мм — найкращі результати лікування, від 50 до 100 мм, 100 мм і більше.
У досліджуваних нами найгірші показники в ЗВ і БВ були обумовлені присутністю вісцеральних метастазів. Останні найчастіше діагностувалися в легенях (n=37) і печінці (n=7). Медіана ЗВ у хворих із метастазами в печінці становила 5,64 міс, БВ — 2,7 міс, що в декілька разів менше, ніж загальні групові. Ризик розвитку прогресування за наявності метастазів в декількох органах підвищується у 1,86 раза. Медіана БВ становила 8,30 міс проти 19,37 при залученні у процес тільки однієї системи або органу, медіана ЗВ — 20,27 міс проти 34,85, відповідно. Показники ЗВ, БВ і частоти розвитку прогресування протягом 3 років у хворих достовірно різнилися залежно від локалізації МВ.
Применение цитофлавина в комплексном лечении онкологических больных для коррекции метаболических нарушений вызванных обширными оперативными вмешательствами
В.П. Баштан, И.А. Бахтала, Е.Г. Заскоченко, В.Н. Яровой
ВГУЗУ Украинская медицинская стоматологическая академия
Полтавский клинический онкологический диспансер
Эффективным путем профилактики и интенсивной терапии гипоксических (ишемических) повреждений вследствие обширных операций в онкологических клиниках представляется применение антигипоксантов.
Целью работы было изучение клинической эффективности цитофлавина у 3500 онкобольных во время и после хирургических вмешательств, чтобы уменьшить длительность проведения искусственной вентиляции легких, во время и после операции, снизить частоту развития вторичных легочных осложнений.
Цитофлавин применяли у 3500 онкологических больных, которым проводили хирургическое лечение Препарат вводили внутривенно капельно по 10 мл в конце наркоза. Обращаем ваше внимание на один из препаратов 2-й группы антигипоксантов — цитофлавин. Этот препарат используется в отделении реанимации и интенсивной терапии на протяжении 3 лет и успешно зарекомендовал себя. В диспансере коек в год выполняется более 3 тысяч операций. В течение года через отделение интенсивной терапии проходят около 1400 больных, которым выполнены операции на легких, органах брюшной полости, гениталиях. Активно применяя этот препарат, осложнений в нашей клинике практически не отмечалось. Поэтому мы рекомендуем цитофлавин для широкого применения при обширных операциях в онкологических клиниках. Препаратом выбора для коррекции нарушений метаболизма в послеоперационный период у онкологических больных является комплексный субстратный антигипоксант цитофлавин.
Применение цитофлавина в интенсивной терапии онкологических больных после операций позволяет уменьшить длительность проведения искусственной вентиляции легких, снизить частоту развития вторичных легочных осложнений, сократить сроки пребывания в критическом состоянии.
Вплив адьювантної імунотерапії імунофаном на стан імунологічної реактивності у хворих на рак яєчників
В.І. Бойко, Т.В. Шевченко, О.С. Шкурко
Медичний інститут Сумського державного університету
Сумський обласний онкологічний диспансер
Агресивні методи лікування (хірургічний, хіміотерапія, опромінення) сприяють поглибленню імунодепресії, що визначається у хворих на рак яєчників (РЯ) до початку лікування. Оскільки переважні імунологічні порушення визначаються в Т-клітинній ланці імунітету зрозумілі спроби використовувати з метою імунокорекції саме препарати тімуса. З 80-х років ХХ ст. для імунокорекції використовувалися імуномодулятори, отримані на основі екстракту тканин тімуса (тимозин, Т-активін і тималін). Але всі вони мали один недолік: являли собою нерозділену суміш біологічно активних пептидів і їх досить важко було стандартизувати. В останні роки показав високу ефективність в онкології імунофан: синтетичний біологічно активний фрагмент одного із гормонів тімуса — тімопоетина.
Метою роботи було вивчення впливу імунотерапії імунофаном (ІМІ) на стан імунологічної реактивності хворих на РЯ.
Обстежено 48 хворих на РЯ, які отримували комплексне лікування. Середній вік — 52,6 р. Імунологічний статус оцінювали за загальною кількістю Т-лімфоцитів (CD3) і їх субпопуляцій CD4, CD8, CD16, і B-лімфоцитів (CD22), показників фагоцитарної активності нейтрофілів (ФАН), НСТ спонтанного і стимульованого тестів. Імунологічні дослідження проводилися на початку і після проведення комплексного лікування. Хворі рандомізовані на 2 групи, 20 хворих отримували стандартну програму лікування, у 28 вона доповнена ІМІ, який вводили по 1мл в/м через день протягом 20 діб.
У хворих обох груп при госпіталізації визначалося зменшення загального пула Т-лімфоцитів (CD3) до 36%, Т-хелперів (CD4) — до 28%, порушення імунорегуляторного індексу Тх/Тс (ІІ) — до 1,2, пригнічення ФАН, зниження показників НСТ спонтанного і стимульованого тестів. Після лікування у хворих І групи кількість CD3 зменшилася до 28%, пул CD4 — до 20%, ІІ знизився до 0,8, суттєво знизилися показники неспецифічної реактивності. У пацієнток, які отримували ІМІ, імунодепресивний вплив протипухлинних методів лікування був менш виражений. Кількість CD3 зменшилася до 32%, CD4 — до 28%, ІІ дорівнював 1,1. Показники ФАН, НСТ спонтанного і стимульованого тестів не відрізнялися від їх значень на початку лікування. Таким чином, використання ІМІ позитивно впливало на стан імунологічної реактивності, сприяло підвищенню ефективності лікування хворих на РЯ.
Стан фероксидазної та аміноксидазної активності церулоплазміну в плазмі крові хворих на рак шлунка
І.В. Бойчук1, А.О. Коваль1, Д.О. Розумій2, Т.В. П’ятчаніна1, О.Р. Мельников1
1Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
2Національний інститут раку, Київ
Застосування наркозу і проведення хірургічного втручання супроводжується винесенням у загальний кровоток і судинні басейни внутрішніх органів токсичних продуктів, окиснювальні властивості яких реалізуються при взаємодії з елементами крові, таких як церулоплазмін (ЦП) і Fe(III)-трансферин (холо-ТФ). Метою роботи було дослідження фероксидазну (ФА) та аміноксидазної (АА) активність ЦП, а також визначення коефіцієнта кореляції (r) між ними в плазмі крові хворих на рак шлунка (РШ) на різних етапах хірургічного лікування.
Об’єктом дослідження була плазма крові 24 хворих на РШ ІІІ і ІV стадії, які проходили лікування у відділі пухлин черевної порожнини та заочеревинного простору Національного інституту раку. В якості контролю була використана плазма крові 7 донорів. ФА та АА ЦП в плазмі крові визначали за зміною абсорбції при λ=460 і λ=540 нм, відповідно, на спектрофотометрі СФ-26 в 1 см кварцовій кюветі при t=30 ˚С.
Згідно з отриманими даним, вміст холо-ТФ в плазмі крові хворих на РШ до операції в 2,2 рази нижчий, ніж в контролі (р <0,01) при зниженні ФА в 1,8 раза (р <0,05). АА ЦП була в 1,3 раза більша (р <0,05) порівняно з контролем. Коефіцієнт кореляції між ними становив r=0,51. В плазмі крові донорів r між ФА та АА ЦП становив 0,72. Після реанімації вміст холо-ТФ, ФА, АА ЦП та r між ними в плазмі крові хворих суттєво не змінювалися відносно вихідного значення. Ці дані дають можливість вважати, що після операції та тижневого курсу медикаментозної терапії у хворих має місце залізодефіцитна анемія, що клінічно проявляється як анемічна гіпоксія.
Зниження коефіцієнта кореляції між фероксидазною та аміноксидазною активностями ЦП в плазмі крові хворих відносно норми може бути тестом на наявність залізодефіцитної анемії і враховуватися при використанні препаратів супроводу.
Вплив антиоксидантного комплексу на гепатотоксичність та протипухлинний ефект циклофосфаміду
Б.А. Болюх, О.Я. Какарькін, О.М. Печевистий, Л.І. Какарькіна
Вінницький національний медичний університет ім М.І. Пирогова
Погребищенський медичний коледж
При терапії циклофосфамідом (ЦФ) гепатотоксичність відзначається у 23% пацієнтів і супроводжується зниженням активності мікросомальних ферментів, підвищенням рівня білірубіна, нерідко розвитком жовтяниці і оклюзії печінкових вен. Гепатопротекторний ефект вітамінних антиоксидантів відомий давно, але вплив їх на протипухлинну дію цитостатиків залишається маловивченим.
Метою дослідження було вивчення захисної дії вітамінного антиоксидантного комплексу (АОК) на гепатотоксичність і протипухлинну дію ЦФ у щурів з карциномою Герена.
Досліди проведено на 48 щурах Вістар з перевитою пухлиною Герена, яким вводили ЦФ, в дозі 100 мг/кг двічі, на 9-й та 15-й день після перевивки пухлини. Частина щурів отримувала АОК (вітаміни: А — 1000 МО/кг; С — 12 мг/кг; Е — 6 МО/кг; цинк — 8 мг/кг; селен — 8 мкг/кг, мідь — 0,4 мг/кг). На 16-й день вивчали склад гомогенату печінки, рівень метаболітів ЦФ в сироватці крові і патоморфоз пухлини Герена.
В терапевтичній дозі ЦФ проявляє високу антибластомну активність (гальмує ріст пухлин на 97,0%), але викликає пошкодження печінки, що проявляється підвищенням у гомогенаті рівня МДА в 2,3 раза, зниженням рівня фосфоліпідів на 9,2%, а також активності мікросомальних ферментів (глюкозо-6-фосфатази, NADH та NADPH-редуктаз дихлорфеноліндофенолу, арілестерази) на 42,6–76,5%. АОК у значній мірі протистоїть індукованому ЦФ пошкодженню печінки, знижуючи рівень МДА на 88,3%, відновлюючи активність ферментів на 27,5–43%. АОК не впливає на концентрацію в плазмі активних метаболітів ЦФ і навіть посилює гальмування росту пухлини до 99,4%, що пояснюється зростанням активності метаболізуючих ЦФ ферментів. АОК захищає печінку від пошкоджувальної дії ЦФ, проявляє мембраностабілізуючий вплив на мікросомальний комплекс, посилює протипухлинний ефект ЦФ.
Локальная гипертермия как сенсибилизатор регионарной химиотерапии в комплексном лечении больных местно-распространенным раком молочной железы
Г.В. Бондарь, И.Е. Седаков, С.К. Кульков, Р.В. Старушко
Донецкий областной противоопухолевый центр
Неуклонный рост заболеваемости раком молочной железы, а также увеличение количества его местно-распространенных форм заставляют искать новые методы терапии. Впервые ВЧ-гипертермия в онкологии применена в 1975 г. немецким ученным von Ardenne.M. С середины прошлого века появились первые упоминания о методике внутриартериальный химиотерапии, и в начале 70-х годов ХХ в. эта методика получила применение в лечении РМЖ. В 90-х годах ХХ в. на базе ДОПЦ разработан и внедрен в практику метод катетеризации внутренней грудной артерии, через верхнюю надчревную артерию. Идея сочетания регионарной химиотерапии с локальной гипертермией легла в основу данного исследования.
В исследование включены 23 пациентки с гистологически подтвержденной местно-распространенной формой рака молочной железы (T4N0–2M0–1). Всем пациенткам выполнена катетеризация внутренней грудной артерии по методике клиники. В настоящее время на первом этапе комплексного лечения проводятся курсы неоадьювантной селективной полихимиотерапии по схеме CMF, в течение 9 дней. Суммарная доза препаратов за 1 курс: циклофосфан — 500 мг/м2, метотрексат — 40 мг/м2, 5-фторурацил — 600 мг/м2. Введение химиопрепаратов осуществляется дозатором лекарственных веществ со скоростью 20 мл/ч одномоментно с сеансом локальной гипертермии, которая проводится установкой «Магнитерм» компании «Радмир» в течении 30мин с частотой излучения 27 МГц и мощностью 65 Вт.
Данный метод лечения показал хорошую эффективность по критериям RECIST. Уже после первого курса лечения частичный ответ получен у всех пациенток. Количество осложнений у пациенток, получивших регионарную химиотерапию на фоне локальной гипертермии, составило 6,5%, количество осложнений у пациенток, получавших регионарную ПХТ без гипертермии, составило 6,3%. В структуре осложнений ведущее место занимали: дерматит — 4,0 %, лейкопения — 2,2 %, прочие — 0,3 %. Осложнения, возникшие в процессе селективной ПХТ на фоне локальной гипертермии, носили нетяжелый характер и не требовали прерывания лечения.
Разработанный метод лечения местно-распространеного рака молочной железы показал высокие ближайшие результаты при низком уровне побочных явлений, в связи с чем может рассматриваться как перспективный.
Внутриартериальная полихимиотерапия в комплексном лечении локорегионарных рецидивов и метастазов рака молочной железы
Г.В. Бондарь, В.Н. Смирнов, А.И. Фефелов, С.О. Алиева, М.Н. Шепляков
Донецкий областной противоопухолевый центр
Несмотря на рост заболеваемости значительных успехов в лечении удается достичь благодаря выявлению заболевания на ранних стадиях и применению комплексного подхода к лечению. Однако все же следует отметить тот факт, что в 10–48% случаев к моменту лечения имеют местно-распространенный процесс, отдаленные результаты лечения которого оставляют желать лучшего. Более 40% пролеченных больных возвращаются в лечебные учреждения с рецидивами и метастазами первичной опухоли.
В Донецком областном противоопухолевом центре с 1990 по 2006 г. пролечено 217 пациенток с рецидивами в кожу и метастазами в мягкие ткани грудной стенки и 121 пациентка с ограниченным вовлечением регионарных лимфатических узлов, как на стороне первичной опухоли, так и в надключичные, медиастинальные и ипсилатеральные.
Проанализированы 2 группы больных, получавших системную (n=188) и внутриартериальную (n=151) полихимиотерапию на фоне гормонотерапии. Лечение дополняли операцией или лучевой терапией в показанных случаях. Полная и частичная регрессия опухоли отмечены у 74%, прогрессирование процесса — у 7% пациенток, получавших селективную внутриартериальную полихимиотерапию, в подгруппе больных, получавших системное лечение, эти показатели составили 54% и 29%, соответственно. Стабилизации состояния опухолевого процесса в обеих подгруппах не отличались — 19% и 15%. Разработанный метод селективной внутриартериальной полихимиотерапии эффективен при рецидивах и метастазах в мягких тканях грудной стенки на стороне первичного процесса и ограниченных вовлечениях регионарных лимфатических узлов.
Отдаленные результаты РПХТ составили: 5-ти летняя выживаемость в группе больных с поражением лимфатических узлов шеи и средостения — 21,3%, а в группе больных с поражением кожи грудной стенки и послеоперационного рубца — 35,9%. Регионарная химиотерапия — одна из новых возможностей эффективного лечения локорегионарных рецидивов. Результаты проведенного исследования обосновывают перспективность внедрения технологии внутриартериальной селективной доставки химиопрепаратов в паллиативном комплексном лечении больных с локорегионарными рецидивами.
Радіотермометричне дослідження як метод контролю добових біоритмів у лікуванні злоякісної пухлини молочної залози
О.М. Воробйов¹, А.І. Шевченко², О.В. Шмикова¹, М.О. Воробйов²
¹Запорізький обласний клінічний онкологічний диспансер
²Запорізький державний медичний університет
Рак молочної залози — найпоширеніше онкологічне захворювання у жінок. Метод радіотермометрії (РТМ) дозволяє неінвазивно визначати теплову активність пухлини молочної залози, контролювати динаміку захворювання та оптимізувати тактику лікування.
Мета роботи — за допомогою РТМ вивчити добові біоритми пухлин у хворих на місцево-розповсюджений рак молочної залози та покращити результати лікування. Дослідження базується на результатах лікування 215 хворих на місцево-розповсюджений рак молочної залози, які пройшли поліхіміотерапію (ПХТ) з урахуванням біоритмів пухлин. РТМ молочних залоз виконувалася за допомогою радіотермометра РТМ-01-РЕС виробництва ООО «Фирма РЕС», Москва (сертифікат відповідності серія ВВ № 001153).
До досліджуваної групи увійшли 107 хворих на місцево-розповсюджений рак молочної залози ІІІА та ІІІВ стадії (T1–4N1–2M0). До контрольної групи увійшли 108 хворих порівнюваних стадій та віку. ПХТ проводилася у групах за схемою FАС та СМF, у досліджуваній групі — відповідно до добових біоритмів температури пухлини. РТМ виконувалася перед початком курсу ПХТ і після його проведення 4 рази на добу. Це давало змогу виявити пік підвищення температури в ураженій ділянці, завдяки чому введення хіміопрепаратів призначалося саме на цю годину. Зниження сумарної термоасиметрії відображало ефективність лікування.
Показник тривалості життя хворих — 3 роки і більше — становив у досліджуваній групі 48,6%, а в контрольній групі — 33,3%. РТМ молочних залоз є безпечним неінвазивним методом визначення добових біоритмів пухлинних клітин для планування хронохіміотерапії. Хронохіміотерапія дозволяє значно поліпшити віддалені результати лікування хворих на рак молочної залози. Отримані результати використання хронохіміотерапії є обнадійливими і потребують подальшого вивчення.
Использование фазлодекса во 2-й линии гормонотерапии метастатического рака молочной железы.
К.В. Гаевой*, А.В. Чернобай**, В.А. Ковтун*
Полтавский областной клинический онкологический диспансер*
Украинская медицинская стоматологическая академия**
Рак молочной железы в Украине прочно занимает 1-е место по заболеваемости женского населения с тенденцией к ее приросту до 2%. У 50% больных РМЖ возникают отдаленные метастазы. Медиана выживаемости больных метастатическим РМЖ составляет 24–36 мес, при этом около 15% больных живут более 5 лет. Сегодня повышенную продукцию эстрогенов считают основной причиной развития рака молочной железы. Поэтому среди лекарственных методов лечения данной патологии гормонотерапия занимает одно из важных мест. Достижения современной иммуногистохимии позволило выделить довольно обширную группу пациентов, позитивных по экспрессии рецепторов стероидных гормонов, что является фактором чувствительности к гормонотерапии РМЖ.
Цель работы — изучить эффективность фулвестранта (Фазлодекс®, «АстраЗенека») во 2-й линии терапии метастатического рака молочной железы.
В доклинических исследованиях показано преимущество фазлодекса перед тамоксифеном в том числе и по противоопухолевой активности. В отделении химиотерапии Полтавского клинического онкологического диспансера проводили гормонотерапию фазлодексом у 8 пациенток, у которых имелся метастатический РМЖ с преимущественной локализацией очагов в костной системе, легких, печени. Ранее у всех больных применялись повторные курсы ПХТ 1–2-й линии и тамоксифен. Иммуногистохимически пациентки имели люминальный фенотип А и В РМЖ. Лечение проводили в течении 6 мес в принятом дозовом режиме 1 раз в 28 дней.
На фоне приема препарата у 62,5% пациенток достигнут общий клинический эффект, период до прогрессирования в этой группе составил от 6,5 до 12,7 мес (медиана — 8,2 мес). Все пациентки после регистрации прогрессирования получали куративную ПХТ 2–3-й линии и живы на сегодня.4 больных умерли, из них 3 — от прогрессирования в головной мозг в сроки от 4,2 до 7,1 мес, таким образом медиана выживаемости составила 7 мес. Применение фазлодекса во 2-й линии гормонотерапии показывает лучшие результаты у пациенток с люминальным А фенотипом процесса, при этом период проведения гормонотерапии при достижении стабилизации должен длиться более продолжительный период.
Визначення рівня експресії репаративного ензиму АГТ у пухлинах головного мозку людини з метою подальшої оптимізації комбінованого лікування (хіміотерапії)
О.Я. Главацький, І.Г. Васильєва, О.В. Маркова, Л.Л. Лукаш, Л.А. Шапошник, О.О. Півень, І.М. Шуба, В.В. Лило
ДУ «Інститут нейрохірургії імені акад. А.П. Ромоданова» НАМН України, Київ
Хіміотерапія хворих на пухлини головного мозку є важливою складовою комбінованого лікування. Для хіміотерапії деяких форм пухлин широко використовують алкілувальні агенти, але їх застосування не завжди є ефективним. Однією з причин низької ефективності такого лікування може бути високий рівень експресії ферменту метилтрансферази. Мета дослідження — визначити особливості експресії гену репаративного ферменту О6-метилгуанін-ДНКметилтрансферази (MGMT) у пухлинах головного мозку для оптимізації результатів хіміотерапії хворих.
Під час оперативних втручань отримано біоптати пухлин 10 хворих на гліоми супратенторіальної локалізації (гліобластоми — 8, анапластичні астроцитоми — 2 випадки). Фрагменти біоптатів зберігали у рідкому азоті і при –70 °С. За допомогою Вестерн-блот-аналізу в біоптичному матеріалі визначали наявність та рівень експресії О6-метілгуанін-ДНК метилтрансферази. Крім того, з фрагментів біопсії вилучали клітини гліом та визначали ЦД50 при короткостроковому культивуванні (24–48 год) за наявності різних концентрацій фотемустину за допомогою вітального барвника.
При Вестерн-блот-аналізі в біоптичних зразках гліом у 9 з 10 пацієнтів був виявлений репаративний ензим О6-метілгуанин-ДНК-метил-трансфераза. Рівень його експресії різнився у пацієнтів. ЦД50 фотемустину (за даними морфологічного тесту з використанням вітального барвника) визначено у межах 3,0–15,0 µМ хіміопрепарату у 4 з 7 пацієнтів. У 3 з 10 випадків ЦД50 фотемустину (за даними морфологічного тесту з використанням вітального барвника) не вдалося визначити (рубцева тканина, відсутність життєздатних клітин внаслідок попередньої хіміотерапії).
Отримані попередні результати дослідження наявності репаративного ензиму О6-метилгуанін-ДНКметилтрансферази у пухлинах головного мозку хворих на злоякісні гліоми. Оскільки наявність MGMT супроводжується чутливістю клітин гліом до цитотоксичної дії фотемустину, плануються подальші дослідження.
Использование наночастиц в качестве активированных носителей противоопухолевых препаратов
Н.П. Дикий1, Е.П. Медведева1, Н.В. Красносельский2, С.Н. Балака2
1Институт физики высоких энергий и ядерной физики ННЦ ХФТИ, Харьков
2Харьковский национальный медицинский университет
Уникальность физических и химических свойств наноструктурных материалов открывает множество вариантов их применения в медицине. Целью данной работы явилось изучение влияния активированных наночастиц (НЧ) и противоопухолевых препаратов на жизнеспособность опухолевых клеток Эрлиха.
В качестве объекта исследования были выбраны НЧ магнетита Fe3O4 (<50 нм, Alta Aesar) и оксида ZnO (<40 нм, Sigma), которые были подвергнуты облучению тормозным g-излучением на линейном ускорителе электронов. С помощью методов гамма- и ИК-спектрометрии, а также рентгеноструктурного анализа показаны отсутствие примесей, высокая кристалличность структуры и характер решеточных колебаний исходных и активированных НЧ. Для предотвращения агрегации и седиментации образцы были подвергнуты сонификации и длительному встряхиванию. Для улучшения биосовместимости НЧ были помещены в растворы гелофузина, липина и липофундина и проинкубированы с асцитными клетками Эрлиха (1,8·106 кл/мл). После инкубации (37 0С) опухолевых клеток с НЧ Fe3O4 в присутствии доксорубицина и НЧ ZnO были проведены суправитальное окрашивание и подсчет жизнеспособности опухолевых клеток.
Процент гибели опухолевых клеток после взаимодействия с активированными НЧ Fe3O4 в присутствии доксорубицина и НЧ ZnO составил 86 и 73% соответственно. Высокий процент гибели опухолевых клеток вызван эффектом синергизма действия Оже-электронов 53Fe и 65Zn с развитием оксидативного стресса и магнитоконтролируемого транспорта доксорубицина.
Наночастицы магнетита Fe3O4 и оксида ZnO являются высокоэффективными средствами доставки противоопухолевых препаратов в ткань опухоли.
Визначення оптимальної тривалості хіміотерапії у хворих на метастатичний рак молочної залози
К.О. Дмитренко, В.С. Кислицина, В.А. Коссе, В.Е. Машталер, А.С. Скляр
Дніпропетровська державна медична академія
Підвищення ефективності лікування метастатичного раку молочної залози є актуальною проблемою клінічної онкології. Протягом багатьох років хіміотерапія є основним методом лікування метастатичного раку молочної залози. На сьогодні з’являється дедалі більше препаратів, лікування якими проводиться без обмеження терміну. Обґрунтованість такого лікувального підходу залишається дискутабельною, попередні результати вкрай обнадійливі, а віддалені результати ще невідомі. Мета — покращити результати лікування хворих на метастатичний рак молочної залози шляхом розроблення алгоритму прийняття рішення про термін лікування.
В основу роботи покладений аналіз результатів лікування за таким показником, як термін лікування. Дослідження проводили у двох групах хворих. Перша група включала 61 пацієнтку з МРМЗ, яким виконували лікування впродовж 24 тиж паклітакселом 80 мг/м2. Друга група — 67 пацієнтів, лікування яким проводили 1 раз на тиждень в тій же дозі, але без обмеження терміну лікування.
Рішення про продовження хіміотерапії має бути диференційним і його доцільно приймати на підставі такого алгоритму: при стабілізації захворювання на 24 тиж у хворих з метастазами в легені та лімфатичні вузли лікування слід припинити; при частковій відповіді — продовжити його до 32 тиж; при збереженні зростання часткової відповіді на 32-му тижні — лікування може бути продовжене максимально до 40-го тижня і припинене; за відсутності зростання часткової відповіді термін 32 тиж достатній. У хворих на МРМЗ з локалізацією метастазів у печінці або печінці та легенях за наявності об’єктивної відповіді на лікування його рекомендується продовжувати по можливості до 48 тижв. Після 48 тиж тільки в разі збереження зростання часткової відповіді за останній контрольний проміжок часу безперервне лікування може мати користь.
Наявність метастазів в печінку, збереження часткової відповіді пухлини на лікування та її зростання за останній контрольований проміжок часу є показанням до продовження лікування. В інших випадках рішення можна приймати на основі розробленого алгоритму, що враховує фактори впливу на загальну та безрецидивну виживаність хворих.
Современные методы профилактики сердечной недостаточности, способствующие улучшению качества жизни, при проведении химиотерапии препаратами антрациклинового ряда
Н.А. Добровольский, Е.Н. Бестанчук, Н.В. Марцинковская, С.В. Любарская
Одесский областной онкологический диспансер
Проблема профилактики сердечной недостаточности при проведении химиотерапии (ХТ) препаратами антрациклинового ряда (доксорубицин, энирубицин и др) становится все более актуальной в связи с ростом заболеваемости онкологической патологией как во всем мире, так и у нас в стране.
Нами на базе отделения полихимиотерапии Одесского онкологического диспансера за период 2010–2011 гг. набрано 32 пациента с различной онкопатологией в возрасте 40–60 лет без признаков ХСН. Всем больным проводили клиническое-лабораторное обследование: лабораторные (ОАК, биохимическое исследование крови, электролиты, коагулограмма) и инструментальные (ЭКГ, ЭхоКС) исследования. На фоне курсов ПХТ с антрациклинами, с целью уменьшения кардиотоксичности, назначали карведилол в дозе 6,25мг/сут, с последующим повышением дозы до 12,5мг/сут под контролем показателей гемодинамики в виде базовой кардиотропной терапии, на весь период проведения химиотерапии. Контрольный осмотр пациентов проводился перед введением ХТ антрациклинами, через 1 и 6 мес с проведением инструментального исследования в динамике. При проведении химиотерапии, на фоне приема карведилола, у 26 больных выявлена положительная динамика: отсутствие тенденции к снижению ФВ, сохранялась толерантность к физической нагрузке, отсутствовали объективные признаки сердечной недостаточности (одышка, отеки нижних конечностей, тахикардия, нарастающая слабость), нарушения ритма.
На фоне кардиотропной терапии карведилолом отсутствовали клинические проявления прогрессирования СН (по данным клинического обследования, ЭКГ, ЭхоКС).
Применение карведилола как кардиопротектора в виде базовой терапии у онкобольных, получающих курсы химиотерапии антрациклинами, в перерывах между химиотерапиями в дозе 12,5мг/сут, снижает риск развития сердечной недостаточности в отдаленный период, предупреждает формирование дилатационной кардиомиопатии, нарушений ритма и прогрессирующей систолической дисфункции левого желудочка.
Etopozid и Cisplatin в лечении метастатического плоскоклеточного рака шейки матки.
Л.А. Дударева-Истру, А.В. Забунов, С.В. Сидорова, А.Г. Мунтяну, Д.П. Болун.
Институт онкологии, Молдова
В последние годы изучаются новые возможности цитостатиков, позволяющие получить хороший результат в лечении плоскоклеточного рака шейки матки и его метастазов, резистентного к лучевой терапии и полихимиотерапии стандартными схемами (CF, AFP). Изучали схемы EP в лечении метастатического плоскоклеточного рака шейки матки в качестве II линии.
Под нашим наблюдением находились 21 пациентка с метастатическим плоскоклеточным раком шейки матки (3 — плоскоклеточный рак с ороговением, 18 — плоскоклеточный неороговевающий рак), получившие ранее курс лучевой терапии и полихимиотерапии без эффекта. У 10 пациенток отмечено местное прогрессирование процесса, у 8 — метастазы в парааортальные и повздошные лимфоузлы, 2 — в кости, у 1 в легкие. Возраст больных колебался от 28 до 62 лет. Общее состояние по ECOG от 0 до 3 баллов. Лечение проводили по схеме EP, в режиме: Cisplatin 75 мг/м2 в/в капельно в 1-й день Etopozid 120 мг/м2 в/в капельно 1-й, 3-й и 5-й дни. Количество курсов 2–4, интервал между курсами составлял 21 день. Токсичность режима была умеренная.
Предварительные результаты использованной схемы EP в лечении метастатического плоскоклеточного рака шейки матки были следующие: всего ПР была достигнута у 9 (42,85%) пациенток, у 4 пациенток с местным прогрессированием была достигнута полная регрессия (19,05%), у 5 с метастазами в повздошные и парааортальные лимфоузлы — ПР (23,8%), у 9 пациенток — стабилизация процесса (42,85%), у 3 пациенток отмечали прогрессиирование процесса (14,28%).
Предварительное изучение схемы Etopozid + Cisplatin позволило получить высокий процент ремиссии в лечении метастатического плоскоклеточного рака шейки матки, резистентного к проводимой ранее лучевой и химиотерапии.
Селективная внутриартериальная полихимиотерапия в комплексном лечении распространенного синхоронного билатерального рака молочной железы
Ю.В. Думанский, И.Е. Седаков, Д.В. Трухин, А.А. Борота, Н.Г. Куква
Донецкий областной противоопухолевый центр
Рак молочной железы (РМЖ) в Украине занимает 1-е место в структуре женской онкологической заболеваемости и смертности. Показатели заболеваемости РМЖ неуклонно растут во всех странах мира, включая Украину. Данные о частоте выявления двусторонних поражений молочных желез у разных авторов противоречивы, и составляют от 0,8 до 19,6%. До сих пор не существует единых стандартов и тактик лечения пациенток с данной патологией.
За период 1980–2010 гг. в Донецком областном противоопухолевом центре пролечено 106 пациенток с синхронным билатеральным РМЖ. В исследование включена 41 пациентка с распространенным синхронным билатеральным РМЖ IIIB–IV стадий, в комплексном лечении которых, начиная с 1998 г., применяли селективную внутриартериальная полихимиотерапию (СВПХТ) по разработанной в клинике методике. У 21 (51,2%) пациентки на момент установления первичного диагноза имелись отдаленные метастазы. В 31 (75,6%) случае в обеих молочных железах распространённость опухолевого процесса соответствовала критерию Т4, а в 10 (24,4%) случаях — Т4 с одной стороны и Т1–3 — с контрлатеральной. С целью проведения СВПХТ в неоадъювантном и паллиативном режимах, в 35 (85,4%) случаях — двусторонней катетеризации a. thoracica interna через a. epigastrica superior. Пациентки получали курсы СВПХТ по схеме CMF. У 26 (63,4%) пациенток проведен курс лучевой терапии.
В 17 (41,5%) случаях было выполнено радикальное оперативное вмешательство с двух сторон. У пациенток этой группы средняя продолжительность жизни составила 3,44 года, 5-летняя выживаемость — 42,7%. В 24 (58,5%) случаях проведено консервативное комплексное лечение. Средняя продолжительность жизни у данной группы пациенток составила 2,17 года, 5-летняя выживаемость — 30,1%.
Применение селективной внутриартериальной полихимиотерапии в неоадъювантном и паллиативном режимах в комплексном лечении билатерального синхронного рака молочной железы в значительном количестве случаев повышает возможность выполнения последующего радикального оперативного лечения, улучшает выживаемость пациенток с данной патологией.
Об эффективности неоадъювантной химиотерапии при железистых и плоскоклеточных раках
В.М. Ефетов, Т.С. Ефетова
Крымский государственный медицинский университет им. С.И. Георгиевского, Симферополь
На эффективность химиотерапии (ХТ) оказывают влияние две основные особенности опухолевого роста: толерантность опухолевых клеток в определенных фазах клеточного цикла и их биохимический полиморфизм. Если первое препятствие для эффективности ХТ может быть частично устранено многократными курсами, то второе препятствие даже при помощи комбинации химиопрепаратов и их замены в большинстве случаев неустранимо. Даже при эффективной ХТ, приводящей к уменьшению объема опухолевого узла, остаются клоны толерантных клеток, продолжающие размножаться и метастазировать в процессе проведения курсов ХТ. С этих позиций стабилизацию опухолевого процесса следует рассматривать как динамическое равновесие между гибелью чувствительных клеток и пролиферацией толерантных. Только полное, гистологически доказанное отсутствие опухолевых элементов может свидетельствовать о полной эффективности ХТ.
На примере рака молочной железы (РМЖ) определяли эффективность неоадъювантной полихимиотерапии (НАПХТ) по сравнению с крупнофракционной гамматерапией (КФГТ). Проведено рандомизированное исследование выживаемости 473 больных РМЖ. Т1–4N0–2M0, из которых 281 получали 3 курса НАПХТ по схеме CMF или АС и 192 КФГТ по 5,4 Гр. На МЖ — суммарная очаговая доза (СОД) 27 Гр. и по 4,6 Гр. на лимфоузлы СОД 23 Гр. в течение 5 дней с последующей мастэктомией по Пейти.
Трехлетняя выживаемость после НАПХТ составила 75,8±3,4%, 5-летняя — 67,6±4,6%, 8-летняя — 33,3±7,8%. После КФГТ соответственно 91,7±2,4%; 86,0±3,5% и 68,1±9,9% (р<0,001; р<0,001; р<0,05). Возникшие после лечения отдаленные метастазы выявляли после НАПХТ у 26,9±2,2% больных, после КФГТ — у 13,0±3,4%.
При железистом и плоскоклеточном раке органов, где полная эффективность ХТ не превышает 5–10% и когда имеется надежда на радикальное хирургическое лечение, неоадъювантную ХТ применять не следует, так как она затягивает сроки операции на 3–4 мес, не предотвращая прогрессии опухоли и ее метастазирования, что фатально для больного. ХТ следует проводить в адъювантном режиме.
Преимущества применение вазоната в условиях химиотерапии антрациклиновыми антибиотиками
В.Ф. Завизион, М.Б. Завизион, М.В. Артёменко
Днепропетровская государственная медицинская академия
Антрациклиновые антибиотики (АА) относятся к наиболее эффективным и часто применяемым препаратам в онкологии. Кардиотоксичность — существенный побочный эффект антрациклинов. Поиск путей снижения кардиотоксичности при лечении АА остается актуальной проблемой. Цель работы: определить возможности применения вазоната («Олайнфарм», Латвия) в качестве кардиопротектора при химиотерапии (ХТ) АА по поводу рака молочной железы (РМЖ).
43 больных РМЖ в возрасте 34–65 лет, которым с неоадъювантной, адъювантной или паллиативной целью проводили ХТ антрациклинсодержащими схемами (АC, FАC). Основным критерием отбора больных было отсутствие у них выраженной сердечной патологии. 22 больных (исследуемая группа) применяли вазонат в дозе 250 мг 4 раза в сутки внутрь в течение всего периода лечения. Остальным больным кардиопротекторы не назначали. Средний возраст больных в исследуемой группе 52 лет, в контрольной — 55 лет. До начала лечения поводили электрокардиографию (ЭКГ), эхокардиографию (эхоКГ), лабораторные исследования. Контрольные исследования проводились по окончании третьего курса и после завершения ХТ.
Всем больным исследуемой группы проведено 6 курсов ХТ. Клинически значимых проявлений кардиотоксичности, в том числе субъективных, физикально определяемых и регистрируемых на ЭКГ и эхоКГ, в указанной группе не было. В контрольной группе 2 больных в связи с проявлениями кардиотоксичности в виде дискомфортных ощущений в области сердца по типу длительно давящей малоинтенсивной боли, снижения вольта ЭКГ и общегипоксических синдромов после 3 и 4 курсов ХТ антрациклинсодержащими схемами переведены на схему CMF. После смены режима ХТ показатели функции сердечно-сосудистой системы были стабильно удовлетворительными.
Анализ результатов исследования подтверждает целесообразность использования вазоната в качестве препарата сопровождения при лечении антрациклиновыми антибиотиками в адекватных дозах.
Паклитаксел в комбинированной химиотерапии диссеминированного рака шейки матки
А.В. Забунов, Л.А. Дударева-Истру, А.Г. Мунтяну, С.В. Сидорова
Институт онкологии, Молдова
Химиотерапия традиционно применяется у больных с рецидивами и метастазами рака шейки матки (РШМ), после проведенного ранее радикального лечения. Эффективность химиотерапии не превышает 30%, а большинство больных умирает в течение 6–8 мес с момента развития прогрессирования заболевания. Ранее (GOG 169) было показано, что добавление паклитаксела к цисплатине увеличивает частоту объективного эффекта (36% против 19%) и продолжительность времени до прогрессирования (4,8 против 2,8 мес). Оценивали эффективность и побочные эффекты комбинации паклитаксел + цисплатин у больных диссеминированным раком шейки матки.
В исследование было включено 24 больных диссеминированным РШМ, ECOG 0–2, ранее не получавших химиотерапию по поводу рецидивов и метастазов. У 18 пациенток в анамнезе была лучевая терапия, в том числе у 5 в сочетании с цисплатином, у 6 – комбинированное лечение. Всем больным проводили лечение по следующей схеме: паклитаксел 135 мг/м2 в/в инфузия в течение 3 ч с премедикацией в 1-й день, цисплатин 50 мг/м2 в/в инфузия в 1-й день. Лечение повторяли каждые 3–4 нед. У 3 больных с признаками компенсированного гидронефроза цисплатин был заменен на карбоплатин (AUC — 5). Количество проведенных курсов — 56 (в среднем 2,4).
Эффективность терапии и токсичность оценены у всех больных. Полная регрессия опухоли (ПР) была достигнута у 1 (4,2%) больной с множественными метастазами рака шейки матки в легкие, продолжительностью 4,9 мес. Частичная регрессия опухоли (ЧР>50%) была зафиксирована у 8 (33,3%) больных, стабилизация опухолевого процесса — у 9 (37,5%), прогрессирование заболевания после первого курса химиотерапии отмечено у 6 (25%) больных. Объективный эффект (ПР+ЧР) данной комбинации составил 37,5%. Средняя продолжительность достигнутых регрессий составила 3,7±0,6мес, средняя продолжительность жизни — 8,7±0,4 мес. Эффект чаще достигался при отдаленных метастазах, чем при внутритазовых рецидивах (50,2 и 28,8% соответственно). Лечение осложнилось нейтропенией (G1 +G2) у 8 больных, анемией (G1+G2) у 9, диареей (G1+G2) у 5больных. Периферическая нейропатия (G1) зафиксирована у 7 больных, артралгия, миалгия, астения — у 11 больных.
Комбинация паклитаксел + цисплатин является эффективным режимом химиотерапии у больных с рецидивами и метастазами рака шейки матки, после ранее проведенного лучевого или комбинированного лечения, с допустимым профилем токсичности.
Неоадъювантная химиотерапия в комбиниро-ванном лечении местно-распространенного рака шейки матки
А.В. Забунов, Л.А. Дударева-Истру, А.Г. Мунтяну,
С.В. Сидорова, Л.В. Манастырли, М.Д. Стерпу, Д.П. Болун
Институт онкологии, Молдова
В исследование включено 103 больных местно-распространенным плоскоклеточным раком шейки матки (15 — III А, 81 — III B, 7 — IVА), в относительно удовлетворительном состоянии (ЕСОG 0–2). Средний возраст 49,2 года (29—65). У 54 (52,4%) больных проводилась лучевая терапия, у 49 (47,6%) больных химиолучевое лечение. В качестве неоадъювантной химиотерапии использовали цисплатин (60 мг/м2 в/в капельно после водной нагрузки в 1-й день, ифосфамид (холоксан) 1,0 гр/м2 в/в капельно в 1–5-й дни, месна. Количество проведенных курсов — 102, интервалы между курсами — 3 нед. Лучевую терапию проводили спустя 2–3 нед после химиотерапии по общепринятой стандартной методике. Результаты химиотерапии оценены у 36 из 49 больных. Комбинация РI вызвала объективный эффект (ЧР>50%) у 17 (47,2%) больных. Стабилизацию опухолевого процесса наблюдали у 17 (47,2%), прогрессирование — у 2 больных. В группе лучевого лечении у 48 (88,9%) из 54 больных была достигнута полная регрессия опухоли, в 6 (11,1%) случаях регресс опухоли был неполным.
Прогрессирование заболевания в группе лучевого лечения отмечено у 31 (64,5%) из 48 больных. В группе химиолучевого лечения прогрессирование зафиксировано у 18 (54,5%) из 33 больных. Достоверных различий в частоте развития внутритазовых рецидивов не было получено: 22/31 (71,0%) и 13/18 (72,2%) соответственно в группах лучевого и химиолучевого лечения (Р>0,05). Частота отдаленных метастазов рака шейки матки в группах лучевого и химиолучевого лечения также существенно не различалась и составила соответственно: 9/31 (29,0%) и 5/18 (27,8%) (р>0,05). Результаты 5-летней общей выживаемости в группах химиолучевого и лучевого лечения составили 53,5±5,9% и 49,8±4,9% (р>0,05).
HAXT не улучшает отдаленные результаты лучевого лечения МРРШМ.
Психологічні аспекти порушення прихильності до лікування опіатами (комплаєнсу) у інкурабельних онкологічних хворих та їх психокорекція
О.В. Калачов, І.Р. Кужель
Київський міський клінічний онкологічний центр
За даними сучасних наукових досліджень близько 60–87% онкологічних хворих на термінальній стадії захворювання потребують призначення опіатів. Їх застосування у частини хворих викликає появу ряду психологічних бар’єрів, які спричиняють відмову від лікування або їх прийом у неадекватних дозах, тобто, порушення прихильності до терапії (комплаєнсу). Метою дослідження було проаналізувати основні психологічні причини порушення комплаєнсу у випадках призначення опіатів та способи їх психокорекції.
Протягом І кварталу 2011 р. було проведено клініко-психологічне обстеження 102 пацієнтів відділення паліативної медицини КМКОЦ, які отримували опіати (морфіну гідрохлорид 1%). У 62 пацієнтів (60,8%) було діагностовано порушення комплаєнсу. Психологічні причини зниження прихильності до прийому опіатів у онкологічних хворих на термінальній стадії захворювання включали: Побічну дію препарату (седація, нудота, блювання, свербіння шкірних покривів) — 43,6%. Страх виникнення залежності — 40,3%. Сприйняття призначення опіатів як перехід на термінальну стадію хвороби, що викликало внутрішній протест та відмову від лікування — 46,8%. Переживання «зміни свідомості або особистості» під впливом опіату — 19,4%.
Для корекції станів порушення комплаєнсу, обумовлених психологічними причинами, застосовували методи раціональної психотерапії, когнітивно-поведінкової психокорекції та центрованої на особистості психотерапії. У 59 (95,1%) хворих було досягнуто покращення прихильності до знеболення опіатами.
Заходи психокорекції сприяли покращенню прихильності до лікування опіатами та відповідно підвищували якість надання паліативної допомоги інкурабельним онкологічним хворим.
Сучасні підходи до консервативного лікування розповсюджених форм нейроендокринних пухлин шлунково-кишкового тракту та підшлункової залози
І.А. Крячок, С.А. Лялькін, Л.А. Сивак, А.В. Лукашенко, А.В. Аскольський, М.Ю. Кліманов
Національний інститут раку, Київ
Нейроендокринні пухлини (НЕП) вважаються рідкісними, але за останні 30 років їх розповсюдженість у світі збільшилась майже в 5 разів за рахунок новоутворень шлунково-кишкового тракту та підшлункової залози (гастроентеропанкреатичні нейроендокринні пухлини — ГЕП НЕП). Достовірної статистики частоти нейроендокринних пухлин в Україні на сьогодні не існує. За останні десятиріччя у світі досягнутий значний прогрес у розумінні біологічних основ розвитку НЕП. Змінилась концепція назви цієї групи захворювань, їх класифікації, а також основних принципів діагностики та лікування. Основним методом лікування НЕП є хірургічний, але слід зазначити, що внаслідок торпідного клінічного перебігу 65–70% хворих на НЕП шлунково-кишкового тракту на момент первинного звернення мають віддалені метастази в печінку та інші органи, що унеможливлює повну циторедукцію та вимагає комплексного підходу.
Основні методи системної терапії НЕП включають хіміотерапію та біотерапію (аналоги соматостатину, інтерферон, таргетні препарати). Вирішальним в плані вибору тактики лікування та прогнозу НЕП є ступінь диференціації пухлини, який поділяє всі НЕП на 3 групи (високої, помірної та низької диференціації). Проведений ретроспективний аналіз медичної документації 229 хворих на НЕП, які лікувалися в НІР з 1980 по 2010 р. З них у 85 хворих (37 %) діагностовано НЕП легенів, у 94 (41 %) — НЕП шлунково-кишкового тракту, у 38 пацієнтів (17 %) — підшлункової залози. На момент діагнозу 48 хворих на ГЕП НЕП мали віддалені метастази, їм проводили хіміотерапію, яка виявилася малоефективною (часткова регресія — 0%, стабілізація — 25%). Починаючи з 2009 р. в системному лікуванні хворих на НЕП був застосований диференційований підхід, який полягав у призначенні того чи іншого методу лікування відповідно до гістологічного ступеня диференціації пухлини. Застосування цього підходу дозволило досягти часткової регресії у 24 % (4 із 17 пролікованих), стабілізації — у 11 хворих (59%). Оцінка віддалених результатів не проводилась у зв’язку з невеликим терміном спостереження.
Коректний гістопатологічний діагноз з указанням ступеня диференціації пухлини є одним з ключових моментів призначення адекватного консервативного лікування, що дає можливість досягти покращання безпосередніх результатів лікування ГЕП НЕП.
Вплив динатрієвої солі дифенілфосфорної кислоти на токсичність та протипухлинну активність 5-фторурацилу
І.Г. Кудрявцева, Н.І. Шарикіна, А.М. Демченко, О.О. Хавич, Л.С. Бобкова, С.І. Пенделюк, К.В. Григор’єва, В.П. Даниленко
ДУ «Інститут фармакології та токсикології НАМН України», Київ
5-фторурацил широко використовується в онкологічній практиці як препарат широкого спектру протипухлинної дії протягом більше ніж 50 років завдяки його здатності блокувати метаболічні шляхи нуклеїнової основи урацилу. Поряд з активністю 5-фторурацилу щодо ряду форм пухлинної хвороби йому притаманні ряд побічних ефектів, які бажано послабити при збереженні рівню протипухлинної дії. Мета — провести комплексні дослідження хіміків, фармакологів, фармацевтів щодо зниження проявів токсичності 5-фторурацилу.
Використані методи органічного синтезу, фармакологічні, в тому числі онкофармакологічні, методи фармацевтичного аналізу, статистичні. На основі 5-фторурацилу синтезований аддукт 5-фторурацилу та динатрієвої солі дифенілфосфорної кислоти з лабораторною назвою Флудинат, який є оригінальною молекулою. Розчинність аддукту набагато вища, ніж у 5-фторурацилу. Носій 5-фторурацилу — динатрієва сіль дифенілфосфорної кислоти, за результатами токсикологічних досліджень, належить до V класу небезпечності (практично нетоксичні речовини). ЛД50 її при внутрішньоочеревинному введенні білим щурам становить 1630,0 (1400,0 :1800,0) мг/кг. При вивченні протипухлинної дії динатрієвої солі дифенілфосфорної кислоти in vivo не виявлено значущої протипухлинної активності на експериментальних моделях пухлин.
Показано, що нова сполука Флудинат (аддукт 5-фторурацилу та динатрієвої солі дифенілфосфорної кислоти) має токсичність у 3,5 раза нижчу, ніж 5-фторурацил, при збереженні рівня протипухлинної дії.
Флудинат як потенційний протипухлинний засіб підготовлений для клінічної апробації.
Применение химиотерапии в комплексном лечении больных злокачественными опухолями матки
Н.Ю. Лисовская, О.А. Никитина, П.В. Лифарь, М.Л. Тараненко
Донецкий областной противоопухолевый центр
Донецкий государственный медицинский университет им. Максима Горького
При операбельных опухолях матки актуальной является проблема использования полихимиотерапии (ПХТ) и составление наиболее рационального плана комплексного воздействия на опухоль, направленного на улучшение отдаленных результатов лечения этих пациентов. Целью работы явилось изучение эффективности комплексного лечения пациенток операбельными опухолями тела и шейки матки, у которых после операции была использована химиотерапия с последующей лучевой терапией.
Проанализирована эффективность лечения у 30 больных с опухолями матки, пролеченных в ДОПЦ с 2008 по 2010 г. В изучаемой группе у 60% были опухоли шейки матки, у 40% — опухоли тела матки. Средний возраст пациенток 53,3 года; исходная стадия процесса у всех пациенток была I; в результате рестадирования процесса после операции 6 пациенткам (20%) выставлена III стадия (за счет категории N+), в 33,3% случаев — II, в 46,7 % — I стадия. Все больные получали химиотерапию вторым этапом лечения, поскольку у всех пациенток выявлены признаки агрессивности или распространенности опухолевого процесса: низкая дифференцировка опухоли — в 56,7% случаев, глубокая инвазия опухоли — в 70%, опухолевые эмболы в сосудах — в 10%, метастатически измененные л/у — в 16,7%, неспецифические изменения в л/у (лимфаденит, синус-гистиоцитоз) — в 40% случаев. Проведено от 1 до 6 курсов ПХТ (в среднем — 2 курса), 86,7% пациенток получали эндолимфатическую ПХТ с препаратами платины: в сочетании с фторурацилом и блеоцином — у 80% больных, с гемцитабином, этопозидом, адриамицином — у 20% пациенток. В связи с проведением ПХТ послеоперационный курс лучевой терапии отсрочен в среднем на 51 день (от 25 до 186 дней). 13 пациенткам (43,3%) после лучевой терапии проведено от 1 до 3 курсов ПХТ.
В изучаемой группе живы на момент анализа данных без признаков прогрессирования болезни 29 пациенток (96,7%); средняя длительность безрецидивного периода составила 23,1 мес.
Таким образом, использование ПХТ в послеоперационный период у больных с операбельными опухолями матки, у которых диагностированы признаки агрессивности или распространенности опухолевого процесса, позволяет провести раннее системное воздействие на проявления опухолевой болезни и положительно влияет на отдаленные результаты лечения
Ефективність метрономної терапії у хворих на рак прямої кишки з метастатичним ураженням печінки
Г.І. Максим’як1, В.Є. Жильчук1, А.Л. Воронцова2, Ю.Й. Кудрявець2, В.Ф. Чехун2
1Рівненський обласний онкологічний диспансер
2Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
За останні роки активно досліджуються нові режими хіміотерапії, зокрема dose-dense, chemo-switch та метрономний режими. Останній з них має мішенню пухлинний неоангіогенез і особливо ефективний у поєднанні хіміопрепаратів із антиангіогенними засобами. Визначали ефективність метрономного режиму хіміотерапії хворих на метастатичний рак прямої кишки (РПК).
Дослідження включало 146 хворих на РПК з метастазами в печінку, яким проводили хірургічне лікування та подальшу медикаментозну терапію за такими режимами: 1-ша група (контроль) (20 хворих) — інфузійна терапія за стандартною схемою Roswell Park. Курси лікування повторювали через 8 тиж. Хворі основної групи (4 підгрупи) отримували терапію у метрономному режимі: 2) 42 хворих — цисплатин (6 мг/м2 2 рази/тиждень, в/в 3) 37 хворих — цисплатин (6 мг/м2 2 рази/тиждень, в/в), ІФН (Лаферобіон) 1млн МО щоденно, в/м 4) 26 хворих — циклофосфамід (15 мг/м2, 2 рази/тиждень per os), 5) 21 хворий — циклофосфамід (15 мг/м2, 2 рази/тиждень per os), ІФН 1млн МО щоденно, в/м. Тривалість терапії 12–15 міс, її результати оцінювали через 24 міс.
Частковий ефект відмічали у 25% хворих 1-ї групи, у 10–12% хворих 2–4-ї груп та у 31,8% хворих 5-ї групи. Стабілізація захворювання виявлена у 40% хворих 1-ї групи, а у разі метрономного режиму терапії — у 80% хворих. Середня тривалість часткового клінічного ефекту у хворих 1-ї групи становила 4,2 міс, а у хворих з метрономним режимом терапії цей показник був вдвічі більшим; додавання ІФН до цього режиму терапії статистично достовірно покращило такі показники, як тривалість часткового клінічного ефекту, стабілізація захворювання та медіана виживаності хворих. Виживаність хворих у контролі становила 10%, метрономний режим хіміотерапії підвищував виживаність у 2–7 разів, найбільш ефективним було використання у метрономному режимі циклофосфаміду (виживаність 42,6% хворих) та циклофосфаміду з ІФН (66,7% виживаності).
Метрономна терапія низькими дозами цисплатину або циклофосфаміду, особливо у поєднанні з ІФН, достовірно збільшує ефективність терапії, зокрема медіану виживаності хворих на метастатичний РПК порівняно із такою у хворих, яким проводилась терапія за схемою Roswell Park.
Перший досвід вивчення протипухлинної дії золедронової кислоти у хворих на рак грудної залози
Д.С. Мечев, М.М. Фірсова, Н.І. Полякова, Т.М. Говоруха
Національна медична академія післядипломної освіти ім. П.Л. Шупика МОЗ України
Київський міський клінічний онкологічний центр
Власний клінічний досвід використання препарату Зомета (більше 300 хворих) показав, що золедронова кислота є одним з найпотужніших серед відомих на сьогодні інгібіторів остеокластичної кісткової резорбції. Таким чином, як бісфосфонат четвертого покоління цей препарат може з успіхом використовуватися для лікування метастазів в скелет раку різних локалізацій (особливо гормонзалежних пухлин). Разом з цим, як показує світовий досвід, крім інгібіції кісткової резорбції золедронова кислота чинить пряму протипухлинну дію на клітини мієломи і раку грудної залози завдяки інгібіції проліферуючих клітин та індукції апоптозу, тобто виявляє і антиметастатичні властивості. Визначити ефективність застосування препарату Зомета, як потенційного протипухлинного (антиметастатичного) засобу.
Починаючи з 2007 р. нами було проліковано 14 хворих на рак грудної залози без наявності метастазів у кістки: ІІА стадія (Т2N0M0) — 9 і ІІБ стадія (Т2N1M0) — 5. Всі жінки були в передменопаузальний період (44–48 років) і гормонзалежним рецептор-позитивним раком. Контрольна група («сліпий вибір») становила 17 хворих аналогічних стадій, які в першому півріччі 2007 р. були прооперовані в КМКОЦ. 2 пацієнтки лікувались (інфузійним введенням Зомети по 4 мг кожні 6 міс) в 2007 р., 3 — 2008 р., 4 — 2009 р., 5 — 2010 р.
Моніторинг 14 хворих впродовж 1–4 років після операції та ад’ювантної хіміопроменевої терапії показав відсутність метастатичних уражень кісток. Показники якості життя за шкалою Карновського у цих пацієнток залишаються на рівні 80–90 балів, в той час коли у 17 хворих контрольної групи (~44%) були виявлені метастатичні ураження в терміни від 1 до 4 років.
Отримані перші результати ад’ювантної терапії хворих на рак грудної залози за допомогою золедронової кислоти в якості анти метастатичного препарату вказують на перспективність цього напрямку і необхідність всебічних глибоких рандомізованих досліджень.
Безопасность многократного фильтрационного плазмафереза у онкологических пациентов
К.Н. Олейников
Донецкий областной противоопухолевый центр
Плазмаферез является высокоэффективным и достаточно широко используемым методом как детоксикационного сопровождения химиолучевой терапии, так и симптоматического лечения. Однако влияние его многократного проведения на показатели гуморального гомеостаза онкологических пациентов практически не изучено. Цель исследования — изучение профиля клинико-биохимической безопасности плазмафереза с плотностью сеансов 25 и выше в год.
Проведен мониторинг основных показателей гуморального гомеостаза (функция печени и почек, коагулограмма, состояние белкового обмена, содержания электролитов, общего анализа крови) у 8 пациентов с плотностью проведения плазмафереза свыше 25 сеансов/год (максимально — 34 в течение года). У всех пациентов отмечали диссеминированные злокачественные новообразования различной локализации и получали множественные курсы химио-/химиолучевой терапии в рамках специального лечения. Физический статус по шкале ECOG колебался от 1 до 4 баллов. Показаниями к проведению плазмафереза служили клинико-лабораторные признаки эндоэкзотокикоза, дисфункция печени и почек, постхимиотерапевтическая детоксикация у пациентов с тяжелыми осложнениями химиотерапии в анамнезе. Низкообъемный проточный фильтрационный плазмаферез проводился на аппарате «Гемофер-01» (плазмофильтр ПФМ-800) с объемом плазмоэксфузии 0,2–0,25 ОЦП/сеанс без белкового возмещения.
Мониторинг основных показателей гомеостаза свидетельствовал, что, наряду со снижением проявлений интоксикации, улучшением параметров гемограммы, функции печени, снижением азотемии и общим улучшением клинического состояния пациентов, отсутствали негативные изменения электролитного баланса и коагулографических показателей. У пациентов с исходной гипопротеинемией (не ниже 55 г/л) отмечена тенденция к ее прогрессированию, не достигавшая, однако, значительного уровня (не более 10% исходных значений) и не требовавшая инфузий белковых препаратов.
Многократное проведение плазмафереза у онкологических пациентов обладает высоким профилем безопасности в отношении влияния на основные показатели гуморального гомеостаза. Проведение плазмафереза у больных с гипопротеинемией требует мониторинга показателей белкового обмена.
Плазмаферез как метод иммунологической реабилитации у пациентов, получающих противоопухолевую химиотерапию
К.Н. Олейников, В.В. Комендант
Донецкий областной противоопухолевый центр
В процессе прогрессирования опухолевой болезни у пациентов, как правило, формируется иммуносупрессия различной степени тяжести, обусловленная как заболеванием, так и проводимым лечением. Вместе с тем медикаментозная стимуляция иммунопоэза является потенциально опасной у онкологических больных в силу неоднозначной роли иммунной системы в процессе опухолевого роста, что влечет необходимость поиска альтернативных способов иммунокоррекции. Цель исследования: изучение иммунореабилитирующего потенциала плазмафереза у иммуносупрессивных онкологических больных.
Исследовано влияние плазмафереза на уровень абсолютного и относительного числа лимфоцитов периферической крови как центрального звена иммунной системы у 86 пациентов с исходной лимфопенией, обусловленной злокачественным новообразованием различных локализаций на стадии диссеминации и проводимым лечением (химио-/химиолучевая терапия). Физический статус пациентов по шкале ECOG колебался от 1 до 4 баллов. Показаниями к проведению плазмафереза служили клинико-лабораторные признаки эндо-экзотокикоза, дисфункция печени и почек, постхимиотерапевтическая детоксикация у пациентов с тяжелыми осложнениями химиотерапии в анамнезе. Низкообъемный проточный фильтрационный плазмаферез проводился на аппарате «Гемофер-01» (плазмофильтр ПФМ-800) с объемом плазмоэксфузии 0,2–0,3 ОЦП/сеанс. Количество сеансов колебалось от 1 до 3 в зависимости от клинико-лабораторных данных и визуальных характеристик эксфузируемой плазмы.
Исходные показатели абсолютного числа лимфоцитов до проведения эфферентной терапии составляли 220–1040/мкл (в среднем — 680), относительное их число колебалось в пределах 5–16%. После проведения плазмафереза у 78 (90,7% больных) начинался рост как относительного, так и абсолютного числа лимфоцитов, достигавший максимума на 4–6-е сутки. К этому времени нормализация абсолютного числа лимфоцитов произошла у 58 (67,4%) больных, относительного — у 52 (60,5%).
Низкообъемный мембранный плазмаферез является высокоэффективным способом нефармакологической иммунореабилитации, позволяющим в короткие сроки нормализовать число лимфоцитов у 67,4% онкологических больных, получающих химиолучевую терапию.
Влияние неоадъювантной полихимиотерапии на содержание некоторых цитокинов в крови больных раком яичника III-IV стадий
А.В. Прокопюк, М.В. Князева*, Н.Г. Яковлева, Т.Д. Павлова**
Харьковский областной клинический онкологический центр
*Харьковский национальній университет им. В.Н. Каразина
**ОО «Новое мышление в медицине»
Цитокины входят в число характеристик микроокружения опухоли, воздействие на которое оказывает химиотерапия (ХТ). Их можно использовать для оценки характера течения РЯ и эффективности ХТ. С целью оценки эффективности лечения методом ИФА изучена динамика содержания комплекса цитокинов (Il-4, Il-6, Il-1β, TNFα, INFα) в сыворотке крови 82 больных РЯ III–IV стадий развития процесса при увеличении количества курсов НПХТ (1–6 курсов). Применение 1–2 курсов НПХТ, что вызвало повышение уровня всех исследованных нами цитокинов, сопровождалось клинически и по данным УЗИ уменьшением размеров опухолевого конгломерата и метастазов в ректовлагалищной перегородке (на 10–15%), уменьшением размеров подкапсульных метастазов в печени и метастазов в забрюшинных лимфоузлах (на 10–20%), значительным уменьшением (или исчезновением) асцитической и плевральной жидкости. Применение 3–4 курсов НПХТ вызвало еще большее повышение Il-4, Il-1β, TNFα, снижение уровней Il-6 и INFα и сопровождалось еще большим уменьшением размеров опухоли и метастазов. Снижение содержания всех цитокинов (кроме Il-6) после 5–6 курсов НПХТ до уровня контрольных значений сопровождалось той же тенденцией в изменениях клинической картины заболевания и УЗИ-критериев, сочеталось с результатами морфологических исследований — увеличением степени выраженности лекарственного патоморфоза с увеличением количества курсов НПХТ.
Это является основанием для использования изменений уровней исследованных цитокинов в качестве дополнительных критериев в диагностике прогнозирования операбельности больных в процессе проведения НПХТ и индивидуализации лечения. Сопоставление результатов изменений содержания цитокинов с клинической картиной РЯ и результатами морфологических исследований позволило установить, что повышенный уровень Il-1β, TNFα, INFα на фоне сниженного содержания Il-6 и неизменного уровня Il-4, клинически сопровождался наличием неподвижного опухолевого конгломерата до стенок таза, метастазом в ректовлагалищной перегородке, наличием асцита (в 86,6% случаев) и наличием метастатического плеврита (14,6%), что подтверждено данными УЗИ.
Застосування препарату Бластомуніл як компоненту терапії супроводу при проведенні хіміотерапії у онкологічних хворих
А.В. Русин, М.Ф. Рішко, Л.П. Любомирова, Л.І. Лапоног, В.І. Мондик, М.П. Козодаєва
Ужгородський національний університет
Закарпатський обласний клінічний онкологічний диспансер, Ужгород
Одним із основних побічних ефектів хіміотерапії (ХТ) є лейкопенія різного ступеня тяжкості, що може призвести до переривання лікування або редукції дози хіміопрепаратів. В свою чергу це обумовлює зниження ефективності ХТ та розвитку резистентності злоякісних клітин. Тому виникла потреба у додатковому лікуванні для запобігання та послаблення побічних реакцій ХТ. Дослідити дію вітчизняного препарату Бластомуніл при лікуванні лейкопенії, яка виникає на фоні ХТ.
В дослідженні взяли участь 410 хворих на рак з різними локалізаціями та стадіями захворювання, які знаходились на лікуванні в Закарпатському облклінонкодиспансері з 2006 р. по 2010 р. Бластомуніл призначали з приводу лейкопенії І, ІІ та ІІІ ступенів тяжкості, яка виникла при проведенні мієлосупресивної ХТ. Ефективність препарату Бластомуніл як стимулятора лейкопоезу оцінювалася за динамікою показників лейкоцитів та абсолютного числа нейтрофилів в периферічній крові, які визначали на 3-й день після кожного введення препарату. Бластомуніл вводили в дозі 0,6 мг 1 раз на тиждень ( 5 введень на курс лікування).
В процесі лікування Бластомунілом відмічена стійка позитивна нормалізація кількості лейкоцитів та абсолютного числа нейтрофилів в периферичній крові у 369 (90%) хворих, яка наступила: після 1-го введення — у 41 хворого (11%); після 2-го введення — у 184 хворих (50%); після 3-го введення — у 107 хворих (29%); після 4,5-го введень — у 37 хворих (10%). Застосування препарату супроводжувалося значним покращанням загального стану хворих. В процесі лікування препаратом Бластомуніл виражених побічних реакцій не спостерігалось. У 20 хворих (5%) мала місце локальна реакція у вигляді гіперемії шкіри та підвищення загальної температури тіла в межах 37,2–38,1 °С, які мали короткотривалий характер. Бластомуніл дав змогу зменшити ступінь тяжкості та скоротити тривалість лейкопенії у переважної більшості пацієнтів та завершити курс ХТ в повному обсязі без редукції дози хіміопрепаратів.
Бластомуніл забезпечує стійку нормалізацію кількості лейкоцитів та абсолютного числа нейтрофілів, що дозволяє провести ХТ в повному обзязі. Препарат Бластомуніл добре переноситься хворими, є зручним для введення і може використовуватися в амбулаторних умовах. Вітчизняний препарат Бластомуніл по своїй ефективності, безпеки та економічній доступності виступає як важливий компонент терапії супроводу при проведенні ХТ у хворих онкологічного профілю.
Адъювантная внутриартериальная полихимиотерапия в органосохраняющем лечении рака молочной железы
И.Е. Седаков, А.И. Александров, А.А. Борота, Д.А. Винничук
Донецкий областной противоопухолевый центр
Донецкий национальный медицинский университет им Максима Горького
Настоящее исследование проведено на основе сведений из историй болезни, амбулаторных карт, контрольных карт диспансерного наблюдения о 342 больных с первично-операбельным Т1–3 N0–2 М0, раком молочной железы, комплексное лечение которым было проведено в Донецком областном противоопухолевом центре за 1999–2005 годы. В исследуемую группу включены 172 больные РМЖ, комплексное лечение которых включало проведение селективной внутриартериальной полихимиотерапии в бассейне внутренней грудной артерии, которым выполнена квадрантэктомия с лимфаденэктомией. Контрольную группу составили 170 женщин с первично-операбельным РМЖ, сопоставимых по категориям TNM с исследуемой группой, которым выполнена квадрантэктомия с лимфаденэктомией. Больные контрольной группы получали комплексное лечение в условиях ДОПЦ, включающее системную полихимиотерапию в адьювантном режиме. Средний период ремиссии после окончания консервативного лечения у больных исследуемой группы составил 2,81 года. При этом одногодичная выживаемость составила 99,4±4,27% , 2-летняя — 97,1±7,3 % и 3-летняя выживаемость — 97,1±8,1%, 4-летняя — 94,8±10,1%; 5-летняя — 83,9±12,3 соответственно. При этом одногодичная выживаемость в контрольной группе составила — 97,3±4,5%, 3-летняя выживаемость — 88,9±9,9%, 5-летняя — 75,3±11,7%. Средний период ремиссии в контрольной группе составил 1,73 года.
Амбулаторная химиотерапия как стационарзамещающая технология
Б.Д. Сеферов, В.М. Соркин, В.И. Проняков, М.И. Касич
Крымский государственный медицинский университет, Симферополь
Согласно современным стандартам лечения онкологических больных 60–90% пациентов нуждаются в проведении химиотерапии (ХТ). Коечный фонд большинства онкологических учреждений не позволяет проводить специальное лекарственное лечение в полном объеме. Цель работы — изучить эффективность и безопасность проведения химиотерапии в амбулаторных условиях.
В исследование было включено 775 больных, получивших амбулаторно 2682 сеанса ХТ. Пациенты были с опухолями различных локализаций. Использовали клинические и инструментальные методы обследования, (анализы крови, рентгенография, УЗИ, СКТ, ЭКГ, сцинтиграфия костей).
За весь период наблюдения в исследуемой группе не было зарегистрировано летальных случаев в момент проведения ХТ и в ближайший период после ее окончания. В момент проведения химиотерапии аллергическая реакция немедленного типа была у 35 пациентов (4,5%), которая купировалась введением антигистаминных препаратов и кортикостероидов. Из 775 больных 58 (7,48%) получили неоадъювантную ХТ, 315 (40,64%) — адъювантную ХТ, 402 (51,87%) — паллиативную. Причем, из 2682 сеансов проведенных курсов ХТ — 241 (8,98%) курс был осуществлен с использованием инфузионных силиконовых систем. Необходимость их применения была обусловлена проведением длительных сеансов химиотерапии (более 24 ч), при таких курсах как — FOLFOX, FOLFIRI, FOLFOXIRI, OFL. Эффект от проводимой ХТ оценивали вышеуказанными методами исследования и не отличался от ожидаемых в онкологической практике.
Таким образом, на достаточном клиническом материале была показана эффективность и безопасность амбулаторной химиотерапии как альтернативного варианта улучшения оказания медицинской помощи онкологическим больным.
Вплив терміну проведення променевої терапії в комбінації з хіміотерапією на результати лікування хворих на локалізовані форми дрібноклітинного раку легені
Л.А. Сивак, С.А. Лялькін, В.С. Іванкова, А.В. Ганул, В.М. Совенко, М.Ю. Кліманов, А.В. Аскольський
Національний інститут раку, Київ
Дрібноклітинний рак легені (ДРЛ) належить до пухлин із дуже агресивним перебігом, характеризується швидким та раннім метастазуванням. Лікування локалізованих форм ДРЛ зазвичай полягає в комбінації хіміо- та променевої терапії і в світі є добре стандартизованим, однак існують декілька невирішених питань. Одним з них є оптимальний термін проведення променевої терапії (ПТ): ранній (впродовж 30 днів після першого курсу ПХТ) або пізній (пізніше вказаного строку). Результати досліджень з цього приводу є суперечливими. Метою даної роботи було вивчення впливу термінів проведення променевої терапії в комбінації з ПХТ на віддалені результати лікування.
Проведено ретроспективне дослідження 108 хворих на локалізовані форми ДРЛ (ІІ-ІІІ стадії), які лікувалися в НІР у 1990–2008 рр. У 1-шу групу (n=60) увійшли хворі, яким променева терапія проводилась у ранні строки, 2-гу (n=58) — пацієнти з пізнім початком ПТ. Групи були однорідні за основними ознаками, що впливають на прогноз захворювання. Хіміотерапія проводилась за стандартними режимами ЕР або ЕС, променева терапія проводилась у 2 етапи, кожний по 30 Гр.
При аналізі віддалених результатів встановлено, що 1-річна виживаність у 1-й групі становила 53,3%, у 2-й — 55 % (р>0,05); 2-річна виживаність у 1-й групі була 20%, 2-й — 15,5% (р>0,05); 5-річна виживаність становила відповідно 10 та 3,5% (р<0,05). В групах не відмічено статистично достовірних розбіжностей щодо токсичності лікування.
Раннє призначення променевої терапії після ПХТ у хворих на локалізовані форми ДРЛ не впливає на 1-річну виживаність, але призводить до збільшення 2-річної та достовірного покращання 5-річної виживаності. Одночасне призначення хіміо- та променевої терапії не збільшує токсичності лікування порівняно з послідовним і може бути рекомендованим для лікування локалізованих форм ДРЛ.
Роль электрокардиографии в прогнозировании кардиотоксических осложнений антрациклин-содержащей полихимиотерапии
Л.А. Сивак, А.В. Аскольский, С.А. Лялькин, М.Ю. Климанов, Н.Н. Майданевич
Национальный институт рака, Киев
Электрокардиография (ЭКГ) — широкодоступный и удобный метод мониторинга функции сердца у онкобольных, которые получают полихимиотерапию (ПХТ). Проявления антрациклин-индуцированной кардиотоксичности неспецифичны (кардиомиопатия, синусовая тахикардия, ишемия миокарда), носят кумулятивный и отсроченный характер. С целью предотвращения тяжелых кардиотоксических эффектов, учитывая простоту, доступность и распространенность метода, возникает необходимость в поиске ЭКГ прогностических факторов развития кардиальных осложнений ПХТ.
Проведен ретроспективный сравнительный анализ данных ЭКГ 38 больных раком молочной железы (РМЗ) получивших 4–6 стандартных адъювантных циклов ПХТ. В I группу (основную) вошли 19 пациенток, получивших лечение по схеме FAC, во II группу (контрольную) — 19 пациенток, лечившихся по схеме СМF. Обе группы сопоставимы по возрасту и факторам риска развития кардиотоксичности (у всех больных в анамнезе отсутствовали кардиоваскулярные заболевания, предшествующая полихимиотерапия и облучение органов грудной клетки). ЭКГ исследование выполняли до начала ПХТ, после каждого 2-го цикла и по окончании лечения. Определяли изменение длины интервала QT, который отражает электрическую систолу желудочков и является предиктором развития аритмий и кардиомиопатий. Удлинение интервала QT устанавливалось в том случае, если длительность QTc (корригированный QT по формуле Базетта) превышала 0,45 с. Также изучали показатель дисперсии величины QTcD в 12 отведениях по формуле QTсD = Qtmax — QTmin.
В основной группе с каждым циклом ПХТ отмечали нарастание длины QTс у 16 пациентов (69%), а повышение дисперсии величины QTcD отмечено у всех пациентов. В контрольной группе зарегистрирован 1 случай (4,3%) удлинения интервала QTс, а величина дисперсии QTсD оставалась стабильной на протяжении всего лечения.
Корригированный интервал QTс и дисперсия величины QTcD могут использоваться как прогностические факторы кардиальных осложнений антрациклинсодержащей полихимиотерапии. Требуются дальнейшие клинические исследования для подтверждения достоверности вышеуказанных показателей с помощью одновременного выполнения УЗИ сердца, а также определения их роли в мониторинге отсроченной и поздней кардиотоксичности.
Клінічні особливості токсичних флебітів та екстравазацій на фоні хіміотерапії
Л.А. Сивак, І.А. Крячок, К.С. Філоненко, Г.О. Губарева, С.А. Лялькін, О.М. Алексик
Національний інститут раку, Київ
Хіміотерапія (ХТ) онкологічних хворих сприяє розвитку токсичних флебітів (ТФ) та екстравазацій (Ек), що впливає на якість життя та зменшує ефективність лікування. Мета: вивчити профіль токсичних уражень шкіри та венозних судин у онкологічних хворих.
Вивчено розвиток ТФ та Ек на фоні ХТ у 604 хворих, 286 чоловіків та 318 жінок, віком 18–82 років (медіана віку 47 років).
Найбільшу частину пролікованих становили пацієнти з лімфомами (76%), хворі на рак молочної залози (РМЗ) (15%), рак легені (5%) та колоректальний рак (4%). Всім хворим проведено 2840 курсів ХТ, від 1 до 9 курсів, в середньому 4,7 курса на пацієнта. Найбільшу частину (82%) становили схеми СНОР-like, ABVD, BEACOPP-14/esc, FAC, FMC (РМЗ). Розвиток ТФ виявлено у 90 хворих (15%), Ек — у 12 хворих (2 %). ТФ виникали уже після 1 курсу ПХТ. Серед курсів ХТ з вінорельбіном ТФ виникали у 100%, доксорубіцином — у 25%, дакарбазином — 23%, етопозидом — 10%. Лікування ТФ проводили з використанням нестероїдних протизапальних препаратів (НПЗП), антиагрегантів, знеболювальних препаратів, місцево наносили гепаринові та мазі з НПЗП. Залишкові зміни у вигляді індурації стінки вени виявлені лише при вінорельбінових флебітах. Ек виникали після 4–7 курсів ПХТ, та у 6 з 12 хворих призвели до порушення інтенсивності ХТ. Серед усіх курсів з доксорубіцином Ек виявлено у 10%, циклофосфамідом — у 9%, дакарбазином — 5%, етопозидом — 1%. В одному випадку відмічали Ек вінкристину. 23% Ек супроводжувалися порушенням цілісності шкірного покриву. Для лікування застосовували введення знеболювальних та антигістамінних препаратів, 1% мазь гідрокортизону, при порушенні цілісності шкірних покривів — аплікації 25–50% розчину димексиду і компреси з ним. Процес репарації тривав у середньому 76 днів (40–156 днів), у 44% завершився повним одужанням хворих.
ТФ та Ек є частими та серйозним ускладненням ПХТ, розвиток яких може призводити до зниження інтенсивності ХТ та вимагає активного лікування і профілактики.
Гастроінтестинальна токсичність режиму FAC при лікуванні хворих на рак молочної залози
Л.А. Сивак, Н.М. Майданевич, С.А. Лялькін, А.В. Аскольський, М.Ю. Кліманов
Національний інститут раку, Київ
Останнім часом в сучасній хіміотерапії все більшої актуальності набуває індивідуальний підхід до вибору препаратів та їх доз, спрямований на зниження токсичності хіміотерапії, в тому числі і гастроінтестинальної, яка є найбільш поширеним побічним її ускладненням. Визначали фактори прогнозу гастроінтестинальної токсичності для оптимізації результатів лікування та якості життя хворих на рак молочної залози.
Проведено ретроспективний аналіз результатів лікування 70 хворих на рак молочної залози IV стадії, віком 40–74 років. В роботі аналізували анамнез, скарги, результати клініко-лабораторних, інструментальних та молекулярно-генетичних (визначення генотипу GSTP1) методів дослідження. Пацієнтки отримали 273 курси ПХТ за схемою FAC. Оцінка ефективності лікування проводилася за шкалою RECIST, оцінка токсичності — за критеріями NCIC-СТС.
Метастази в кістки виявлено у 22 хворих (31,4%), кістки та легені — у 11 хворих (15,7%), легені — у 17 хворих (24,2%), легені і печінку — у 6 хворих (8,5%), печінку — у 6 хворих (8,5%), кістки і печінку — у 8 хворих (11,4%). При аналізі результатів лікування повної регресіїї захворювання не було відмічено в жодному випадку. Часткову регресію пухлини отримано у 22 (31,4%) хворих на РМЗ. Стабілізація процесу виявлена в більшості випадків — у 41 (58,5%) хворих. Прогресування захворювання на фоні хіміотерапії було у 7 (10,0%) хворих. Серед ускладнень хіміотерапії найбільш часто відмічали нудота — у 65 (92,8%), нудоту і блювання — у 21 (30%) хворих. Нудота І ступеня — у 46 (65,7%), ІІ ступеня — у 14 (27,1% ), ІІІ ступеня — у 5 (7,1%) хворих. Блювання І ступеня — у 12 (17,1%), ІІ ступеня — у 7 (12,8%), ІІІ ступеня — у 2 (2,8%) хворих. Нами визначено прямий кореляційний зв’язок, гастроінтестинальної токсичності ІІ–ІІІ ступеня з нявністю в анамнезі гастродуоденіту (r=0,71, p<0,05); віком хворих до 45 років (r=0,58, p<0,05); проведення більше трьох циклів ПХТ (r=0,37, p<0,05). Попередні результати дослідження генотипу GSTP1 показали, що в групі пацієнток, що мали ускладнення хіміотерапії ІІ–ІІІ ступеня переважав гетерозиготний тип успадкування (Ile/Val).
Таким чином, комплекс об’єктивних клінічних показників дозволяє визначити фактори високого ризику гастроінтестинальної токсичності. Проте, отримані дані потребують подальших досліджень та пошуку інших факторів прогнозу токсичності для досягнення максимального лікувального ефекту з мінімальними побічними явищами.
Особливості методики комплексного лікування онкологічних хворих з використанням вітчизняного апарата «Магнітерм»
Л.А. Сивак, В.І. Орел, М.Ю. Кліманов, С.А. Лялькін, А.В. Аскольский
Національний інститут раку, Київ
Радіочастотна гіпертермія (РГ) вже багато років використовується в клінічній практиці для подолання ефекту хіміо- або радіорезистентності злоякісних пухлин. Напрямок РГ, відомий як індуктотермія (магнітотермія), використовує не лише електричну, а й магнітну компоненту електромагнітного поля (ЕМП). При зазначеному електромагнітному опроміненні механізм деструкції злоякісних клітин пов’язаний не лише з температурним фактором, а базується і на ефекті формування просторово-неоднорідного ЕМП, що впливає на процеси поділу злоякісних клітин шляхом руйнування їх мікротрубочок з тубулінових димерів.
Ми використовуємо апарат «Магнітерм», розроблений фірмою «Радмір» (Україна), на базі прототипу, розробленого та експериментально апробованого у Національному інституті раку. МТ проводиться лише на фоні хіміо- або променевої терапії не пізніше ніж через 30 хв після ПХТ, або за 30 хв до променевої тераії. Аплікатор повинен мати достатньо щільний контакт з поверхнею шкіри пацієнта. Залежно від локалізації пухлини або метастазів вихідна потужність становить від 30 до 75 Вт. Температура у зоні опромінення не повинна перевищувати 3–5 °С і контролюється за допомогою інфрачервоного термометра. Сеанс МТ не повинен перевищувати 30 хв. Дослідження впливу МТ на апараті «Магнітерм» в Національному інституті раку проводяться з 2005 р. і на даний час проліковано 200 пацієнтів, виконано понад 1000 сеансів магнітотермії.
Використання ПХТ на фоні МТ при комплексному лікуванні хворих на рак грудної залози збільшило на 43,2% кількість випадків часткової регресії первинної пухлини та на 28,2% регресію метастатичних л/в й зменшити побічні ефекти порівняно з групою хворих, в який застосовували лише ПХТ. Проведення МТ разом з променевою терапією збільшило кількість часткової регресії первинної пухлини 21,9%. На даний час вивчається ефективність хіміотерапії на фоні МТ при лікуванні метастазів у печінку рака грудної залози, попередні результати свідчать про перспективність застосування даного методу.
Клініко-лабораторні фактори прогнозу токсичності хіміотерапевтичного лікування хворих на злоякісні пухлини молочної залози
Л.А. Сивак, І.І. Смоланка, Г.О. Губарєва, С.А. Лялькін, О.М. Алексик, Н.М. Майданевич, К.С. Філоненко, М.Ю. Кліманов, А.В. Аскольський, Н.М. Свергун, Л.А. Шевчук
Національний інститут раку, Київ
На сьогодні злоякісні пухлини молочної залози (ЗПМЗ) вважають біологічно гетерогенною групою захворювань з різним прогнозом та відповіддю на протипухлинне лікування. Відомо, що метаболізм лікарських препаратів залежить від ферментів глутатіон-S-трансферази (GST), а поліморфізм гену GST призводить до синтезу фермента зі зміненою каталітичною активністю. Актуальним є визначення прогностичних маркерів токсичності хіміопрепаратів та розробка шляхів її подолання. Мета — поліпшити результати хіміотерапевтичного (ХТ) лікування та якість життя хворих на ЗПМЗ шляхом розробки терапії супроводу на підставі визначення клініко-лабораторних факторів прогнозу токсичності протипухлинних препаратів.
Визначали комплекс клінічних, інструментальних, лабораторних та молекулярно-генетичних факторів прогнозу токсичності ХТ за схемою FAC у 18 хворих на ЗПМЗ з метою формування групи хворих високого ризику розвитку токсичних ускладнень для розробки терапії супроводу з урахуванням виду та ступеня ускладнень. Хворим первинно проведено 1–3 курси FAC з неоад’ювантною, ад’ювантною або паліативою метою.
Попередні дослідження показали, що алопеція виявлена у всіх хворих. У 12 хворих на 3-му курсі FAC відмічали нудоту та блювання 1–2-го ступеня, а у 1 хворої — 3-го ступеня на тлі антиеметичної терапії. У останньої хворої похилого віку та з наявністю супутньої патології виявлена гепатотоксичність 2 ступеня. При визначенні поліморфізму генів гомозиготний генотип GSTP1 Val/Val виявлено у 7 жінок, гетерозиготний генотип GSTP1 Іle/Val — у 10, а гомозиготний генотип GSTP1 Ile/Ile — у хворої з гепатотоксичністю. Виявлено, що у хворих з токсичними ускладненнями переважав гетерозиготний генотип GSTP1 Ile/Ile. Токсичні прояви хіміотерапії у хворих на ЗПМЗ залежали від кількості проведених курсів FAC та сумарних доз введених препаратів (r=0,52, p<0,05), гомозиготним генотипом успадкування GSTP1 Ile/Ile (r = 0,41, p<0,05) і наявністю токсичних проявів.
Виявлена індивідуальна варіабельність токсичних проявів ХТ за стандартною схемою FAC. Ступінь токсичності корелює з молекулярно-генетичними успадкованими маркерами токсичності та наявністю супутньої патології. Продовження дослідження в даному напрямку є перспективним.
Стоматотоксичность у пациенток с раком молочной железы на этапах полихимиотерапии
О.Н. Тарасова, И.И. Соколова, И.С. Сухина, А.Н. Насонова
ГУ «Институт медицинской радиологии им. С.П. Григорьева НАМН Украины», Харьков
Харьковский национальный медицинский университет
Воздействие химиотерапии на пациентов с онкологическими заболеваниями может влиять на нормальное состояние полости рта, что приводит к изменениям слизистой оболочки (мукозиту), инфекциям, дисфункции слюнных желез, кариесу и заболеваниям пародонта. Цель исследования: изучение влияния адъювантной полихимиотерапии у больных РМЖ на состояние органов ротовой полости.
Анализ частоты и характера появления жалоб у больных РМЖ во время проведения полихимиотерапии показал, что максимальный процент всех жалоб отмечали при проведении II цикла ПХТ, за исключением наличия эрозии, воспаления СОПР и высыпаний на губах, показатель которых был максимален на V цикле лечения — 43,8, 25,0, 25,0%. Наиболее частой жалобой в I цикле ПХТ являлось наличие сухости губ, сухости в полости рта и обусловленная этим жажда, которые развились у 59,1; 45,5 и 50,0 % пациенток, и оставались превалирующими на протяжении всех 6 циклов ПХТ. Частота жалоб пациенток на сухость губ остается одинаковой на протяжении 4 циклов ПХТ, несколько снижаясь на V и VI циклах (36,3%), сухость в полости рта и жажда увеличивались на II цикле (52,2%) с последующим снижением и составляли на VI цикле 18,2 и 13,6%. Проведение 1 цикла ПХТ сопровождалась развитием стоматологической токсичности у 84,6% пациенток, что было самым низким показателем в процессе всего курса лечения. С увеличением количества циклов данный показатель увеличивался, достигая максимального значения на V цикле — 96,2%, что связано с увеличением кумулятивной токсичности. В то же время на VI цикле лечения этот показатель несколько снижался и коррелировал со значением I цикла.
Основным проявлением токсичности являются хейлит — наиболее часто выявляемая патология с максимальным проявлением на I — 77,3% и III цикле ПХТ — 75,0% с последующим постепенным снижением до 40,9% на VI цикле. Частота дисфункции слюнных желез максимальна при проведении I и II цикла ПХТ — 68,2 и 69,6% соответственно, с последующим снижением частоты ее проявлений до 31,8% при VI. Частота мукозитов увеличивается к III циклу до 79,2%, с последующим снижением до 40,9% на VI цикле ПХТ.
Порівняльне вивчення фармакологічних властивостей хлофідену та циклофосфану у комбінаціях з доксорубіцином та цисплатином
О.О. Хавич, Н.І. Шарикіна, І.Г. Кудрявцева, С.І. Пенделюк, Н.Я. Скульська, Д.П. Михайлюк
ДУ «Інститут фармакології та токсикології НАМН України», Київа
Одним з провідних напрямків онкофармакології є створення на основі сучасного арсеналу протипухлинних засобів медичних технологій для лікування пухлинної хвороби, серед яких значне місце відводиться комбінаціям протипухлинних препаратів. В ДУ «Інститут фармакології та токсикології НАМН України» проводиться пошук нових протипухлинних засобів, можливостей їх введення в існуючі комбінації протипухлинних препаратів. Мета — провести дослідження щодо можливостей введення створених в інституті препаратів в схеми лікування замість препаратів з близькими механізмами дії задля зниження їх токсичності при збереженні високого рівня протипухлинної дії.
Використані онкофармакологічні методи, методи фармацевтичного аналізу, статистичні. В дослідженнях використовувалася комбінація (доксорубіцин, цисплатин, циклофосфан), яка входить до складу протоколів для лікування злоякісних новоутворень, затверджених МОЗ України. Методом зворотної екстраполяції проведений перерахунок клінічних доз для експериментальних досліджень. Показаний виражений токсичний ефект комбінації, до складу якого входить циклофосфан, а саме: пригнічення гемопоезу, підвищення рівня гемоглобіну, підвищення активності АлАТ та АсАТ в сироватці крові та гомогенатах печінки; зменшення загальної кількості лейкоцитів, маси тимусу та маси селезінки, що свідчить про прямий токсичний вплив на організм тварин. При заміні циклофосфану на хлофіден виявлено більш щадний вплив на стан імунної системи, хоча при цьому також відмічено їх вплив на інші системи з високим рівнем проліферативних процесів.
Заміна комбінації циклофосфану на розроблений в інституті хлофіден призводить до зниження токсичного впливу на організм тварин при збереженні рівня протипухлинної дії.
Индивидуализация лечения как основа новой стратегии противоопухолевой терапии
В.Ф. Чехун
Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, Киев
На сегодня среди существующих методов лечения онкологических больных одно из ведущих мест занимает медикаментозная терапия. Однако до настоящего времени не существует четкой научно обоснованной концепции целесообразности назначения в каждом конкретном случае тех или иных химиопрепаратов, гормонов, средств биотерапии.
Как правило, в клинической практике используются стандартные схемы лечения, которые чаще всего, не дают желаемого эффекта. Это объясняется тем, что при существующем тактическом подходе не учитывается ряд факторов, которые, без сомнения, определяют исход заболевания. Прежде всего, это значительная вариабельность индивидуальной чувствительности организма больных к противоопухолевым средствам и формирование резистентности опухолевых клеток к химиопрепаратам. Поэтому решение о выборе лекарственных препаратов для каждого пациента должно основываться на определении чувствительности больного к лекарственным средствам и использовании комплекса диагностических критериев, способствующих выявлению резистентных форм опухолей. Кроме того, до настоящего времени не принимаются в расчет современные данные молекулярной биологии и генетики об особенностях функционирования генома опухолевых клеток. Хотя именно они позволяют составить молекулярный «портрет» конкретной опухоли, на основании которого складывается представление о ее адгезивных свойствах, пролиферативном потенциале, гормонально-рецепторном статусе, нарушении баланса между процессами пролиферации, дифференцировки и апоптоза, что в целом определяет характер роста, скорость метастазирования новообразования и ответную реакцию на медикаментозное лечение. Уже накоплено достаточно сведений о значительном повышении эффективности противоопухолевой терапии больных раком молочной железы, желудка, толстой кишки, яичников, благодаря исследованию молекулярного профиля каждой конкретной опухоли. Таким образом, накопленные на настоящий момент данные научно-практических разработок позволяют говорить о том, что пришло время отказаться от эмпирического назначения лекарственных препаратов онкологическим больным и перейти к активному внедрению в клиническую практику индивидуализированных схем лечения, основанных на фенотипических характеристиках опухоли и особенностях организма каждого пациента.
Фармакологічна класифікація протипухлинних засобів
Н.І. Шарикіна, Т.А. Бухтіарова, І.Г. Кудрявцева, Т.І. Григор’єва, О.О. Хавич
ДУ «Інститут фармакології та токсикології НАМН України», Київ
Існуючі класифікації протипухлинних засобів поєднують групи за хімічною структурою, походженням речовин, механізмами їх дії. Протягом багатьох років належним чином не переглядається група «Інші протипухлинні засоби», де містяться речовини, які згідно з існуючими даними вже мають своє місце серед класифікованих речовин. Нами зроблена спроба створення фармакологічної класифікації за механізмами дії цитостатиків на підставі аналізу існуючих класифікацій фармакологів та онкологів. Всі класифікації мають раціональні частини та ряд недоліків, значна частина яких переходить з однієї класифікації в інші.
Фармакологічна класифікація, на нашу думку, повинна мати наступний вигляд: алкілуючі агенти, антиметаболіти, антибіотики з протипухлинною дією та споріднені препарати, інгібітори мітозу, інгібітори топоізомераз I та II, ферменти з протипухлинною дією, гормональні препарати та антигормони, таргетні (молекулярно спрямовані) препарати.
Проведена рубрифікація підгруп з розподілом в них цитостатиків згідно з сучасними даними щодо механізмів їх протипухлинної дії. Так, в групі «Алкілуючі агенти» і підгрупах означені традиційні цитостатики та цитостатики з латентною активністю. В групу перенесений мітоміцин С та гідроксикарбамат, які мають механізми алкілування біосубстратів. В цій групі місце похідним платини та нітрозосечовини, чого немає в багатьох класифікаціях. Група «Препарати природного походження» поєднує засоби з різними механізмами дії. В класифікації поставлені «Інгібітори мітозу», «Інгібітори топоізомераз I та II» та ін. Групу «Антибіотики» доцільно назвати «Антибіотики з протипухлинною дією та споріднені препарати». В формуванні групи «Таргетні препарати» означені сучасні дані щодо речовин і механізмів їх біологічної дії. В групах і підгрупах розміщені протипухлинні препарати, зареєстровані в Україні.
Наступним кроком буде робота щодо імунних препаратів та модифікаторів біологічних реакцій, препаратів супроводження.
Влияние противоопухолевых химиопрепаратов на активность ферментов клеток рака молочной железы в первичной культуре
Н.А. Шуканова1, Н.А. Козловская2, Л.А. Путырский2, М.А. Мартынова1, И.М. Бушмакина1, М.М. Молчан1
1ГНУ «Институт биофизики и клеточной инженерии Национальной академии наук Беларуси», Беларусь
2ГУ «РНПЦ онкологии и медицинской радиологии им. Н.Н. Александрова» МЗ РБ, Беларусь
Проведение химиотерапии при заболевании раком молочной железы (РМЖ) неэффективно в 25–50% случаев, в связи с чем разработка критериев оценки индивидуальной чувствительности опухоли к цитостатикам до начала лечения приобретает особую актуальность. Исследовать влияние цитостатиков на ферментативную активность клеток РМЖ в первичной культуре, полученной из трепан-биоптатов больных и сопоставить с изменением размеров опухоли пациенток после неоадьювантной химиотерапии.
Исследовано влияние цитостатиков групп АР (доксорубицин + паклитаксел) и АС (доксорубицин + циклофосфан) на активность ацетилхолинэстеразы (АХЭ) и дегидрогеназ (МТТ-тест) опухолевых клеток в первичной культуре из трепан-биоптатов 15 больных РМЖ. Клетки РМЖ инкубировали без и в присутствии цитостатиков в течение 48 ч в среде RPMI 1640. Пациенткам впоследствии выполнялись курсы неоадъювантной полихимиотерапии по одной из выше указанных схем. Активность ферментов клеток РМЖ сопоставляли с размерами опухоли после терапии.
В культуре клеток из трепан-биоптатов пациенток со средней степенью злокачественности опухоли и позитивных по уровню рецепторов половых гормонов (гиперэкспрессия Her-2/neu не выявлена) цитостатики вызывали незначительное уменьшение активности ферментов. Размеры опухоли после лечения уменьшались также незначительно. Наиболее заметное уменьшение активности ферментов клеток РМЖ цитостатики вызывали в первичной культуре, полученной из триплет-негативных опухолей. В группе пациенток с триплет-негативными опухолями отмечали наиболее выраженное клиническое уменьшение размеров опухоли, подтвержденное инструментальными методиками.
Выявленная корреляция между изменением активности ферментов при культивировании с химиопрепаратами в первичной культуре и изменением размеров опухоли в результате курса неоадьювантной химиотерапии может быть положена в основу разработки метода определения индивидуальной чувствительности клеток РМЖ к цитостатикам в условиях in vitro.
Чрескожная пункционная имплантация венозного порта в онкологической практике
О.Г. Югринов, С.А. Родзаевский, Е.М. Новак, А.А. Супруненко, Б.Т. Киндратишин, К.В. Скрынник
Национальный институт рака, Киев
Многократные пункции периферических вен и введения противоопухолевых препаратов со временем приводят к техническим трудностям в достижении адекватного венозного доступа и ограничению возможностей дальнейшей химиотерапии. В клинике Института рака для обеспечения центрального венозного доступа и проведения химиотерапии применяется рентгеноэндоваскулярная технология имплантации под кожу специальной конструкции (венозного порта). В Украине зарегистрированы и разрешены к применению в медицинской практике биосовместимые венозные порты для имплантации и линии соединения к ним (Polysite implantable port Laboratories Perouse (France)). Мембрана порта и венозный катетер изготовлены из рентгенконтрастного силикона, что предусматривает использование прецизионных методик навигации имплантируемого устройства.
Тотальная имплантация порт-системы в центральное венозное русло рентгеноэндоваскулярным способом проведена у 35 онкологическим больным. Из них у 15 больных с саркомами длинных трубчатых костей было показано проведение длительной неоадъювантной химиотерапии. В послеоперационный период указанным больным на протяжении 6–12 мес назначали курсы адъювантной химиотерапии. Всего проведено 180 курсов химиотерапии короткого действия и средней продолжительности. Длительная инфузия цитостатиков выявлена у 15 больных, резистентных к химиотерапии 1-й линии. Применяли адриобластин, метотрексат, цисплатин, циклофосфан, 5-фторурацил, элоксатин, иринотекан. Среднее время пребывания катетера в центральном венозном русле составило 305 дней (минимальное — 132 дня, максимальное — 916 дней). Средний возраст — 26 лет (14–52 года). Мужчин — 19, женщин — 16. У 3 больных отмечена катетерассоциированная бактериемия и окклюзия катетера, что потребовало извлечения имплантированного устройства оперативным путем.
Таким образом, при ультразвуковой навигации прицельная пункция выбранной вены была проведена успешно с первой попытки у 99% больных. Постоянный рентгеновский контроль за перемещением металлического проводника позволял низвести по нему венозный катетер и безопасно разместить его в заданом месте верхней полой вены. Длительное введение в порт-сиситему местно-раздражающих веществ в высоких концентрациях не сопровождалось побочными кожными реакциями.
Результати лікування хворих на занедбані форми раку яєчника з метастазами у печінку
О.Г. Югрінов, В.С. Свінціцький, Л.І. Воробйова
Національний інститут раку, Київ
Виживаність хворих з метастазами раку яєчника у печінку не перевищує 5–6 міс після встановлення діагнозу. Основним методом лікування хворих з метастазами раку яєчника в печінку є 3–4 курси системної поліхіміотерапії: цисплатин 75 мг/м2 + циклофосфан 750 мг/м2 або паклітаксел 175мг/м2 + цисплатин 75 мг/м2.
Розроблена та апробована методика лікування хворих із занедбаними формами раку яєчника з метастазами у печінку, яка заключається в селективному або суперселективному введенні оксаліплатину (50 мг/м2) в печінкову артерію. Всього у відділенні онкогінекології Національного інституту раку у 2000–2010 рр. лікувалось 155 хворих на рак яєчника з метастазами в печінку, яким проводилась наступна терапія: в/в поліхіміотерапія за різними схемами — 111 хворих; в/а ХТ — 27 хворих, з них 15 хворим проводилась в/а ХТ оксаліплатином.
Результати внутрішньоартеріальної хіміотерапії показали вищу ефективність, особливо при застосуванні оксаліплатину, — регресію пухлини після першого і другого введення препарату, на відміну від хворих, які отримали оксаліплатин в/в. Результати лікування об’єктивно зареєстровані під час комп’ютерної томографії та УЗД печінки. Аналіз результатів використання, розробленої методики показав, що 1-річна виживаність хворих на рак яєчника з метастазами в печінку після в/а ХТ на 20% вища, ніж у хворих, яким проводилась в/в ХТ, і достовірно не відрізняються від результатів виживаності хворих, яким були проведені резекції печінки (р>0,05). При цьому слід ще раз підкреслити, що у хворих, яким проводилась в/а ХТ, метастази у печінку визнані нерезектабельними. При в/в введенні цитостатиків жодна хвора не прожила більше 18 міс, тоді як виживаність хворих протягом 18 і 24 міс відмічена у хворих на рак яєчника з метастазами у печінку саме при в/а ХТ оксаліплатином.
Внутрішньоартеріальна ХТ хворих з метастазами раку яєчника у печінку дає можливість суттєво покращити ефективність лікування (безпосередні та віддалені результати), знизити системну токсичність оксаліплатину. При цьому разова та сумарна дози препарату можуть бути знижені у 1,5 раза порівняно з такими при в/в способі введення цитостатика, що важливо не лише з погляду зменшення системного впливу препарату на організм хворого, а й з економічного щодо вартості лікування.
Якість життя хворих, пролікованих поліплатилленом
Л.Д. Яценко
Національний інститут раку, Київ
Якість життя онкологічних хворих, які проходять лікування, є важливим об’єктом дослідження сьогодення. Вважається оптимальною така протипухлинна терапія, яка забезпечує контроль над пухлинним процесом і побічною дією цитостатиків, тому проблема якості життя онкологічних хворих займає значне місце в їх лікуванні. Дуже часто препарати, що застосовуються для корекції токсичних проявів протипухлинного лікування, мають власну токсичність, що в свою чергу потребує додаткової корекції, тому постійно продовжується пошук нових препаратів з високою протипухлинною активністю і низькою токсичністю. Метою даного дослідження було вивчення токсичності протипухлинного препарату поліплатиллену при паліативному лікуванні хворих на рак шлунка, рак підшлункової залози, рак легені.
Токсичні прояви вивчали у 80 хворих, до схем лікування яких входив поліплатилен. В схеми лікування 80 хворих групи контролю було включено цисплатин. Загальний стан пацієнтів під час лікування оцінювали за шкалою ЕCOG. Протягом всіх курсів лікування проводили систематичне клінічне обстеження хворих, досліджували параметри загального і біохімічного аналізу крові ЕКГ та інші методи дослідження.
Статус хворих основної і контрольної груп до початку лікування був стабільним. Після проведеної протипухлинної терапії в основній групі не спостерігалося жодного хворого з статусом за шкалою ЕCOG в 3 бали, в групі контролю у 17 хворих загальний стан відповідав статусу 3 бали, а у 8 хворих статус погіршився і оцінювався в 4 бали за шкалою ЕCOG. Було виявлено, що ступінь токсичності поліплатиллену нижчій ніж в цисплатину по низці важливих параметрів: нудота, блювання, больовий синдром, слабкість, тахікардія, порушення сну, алергічні реакції, підвищення рівня білірубіну, підвищення рівня АЛТ і АСТ, підвищення рівня креатенину та зниження показників крові.
Застосуванням поліплатилену має високий рівень безпеки при паліативному лікуванні онкологічних хворих з різними локалізаціями злоякісних новоутворень. Відсутність потреби в застосуванні препаратів супроводу (антиеметиків, гранулоцитарних та колонієстимулювальних факторів, еритропоетинів, протигрибкових препаратів) робить поліплатилен препаратом вибору в платиновмісних схемах лікування.
Знеболювальна дія поліплатилену при лікуванні хворих на рак підшлункової залози
Л.Д. Яценко
Національний інститут раку, Київ
Досвід хіміотерапії раку підшлункової залози (РПЗ) маловтішний навіть з урахуванням застосування нових препаратів. На сьогодні проблема лікування нерезиктабельного РПЗ відкрита і відповідно залишається актуальним пошук нових методів лікування. Метою даного дослідження є зниження больового синдрому та підвищення ефективності хіміотерапевтичного лікування за допомогою застосування препарату на основі сполук платини на ДНК-носії — поліплатилену.
Спостереженням охоплено 108 хворих на РПЗ, серед яких основна група включала 48 хворих, пролікованих поліхіміотерапією (ПХТ) з поліплатиленом, група контролю — 60 хворих, пролікованих (ПХТ) з цисплатином. Дослідження якості життя хворих основної і групи контролю визначалося за шкалою ECOG до лікування, під час проведення хіміотерапії і після її завершення. Вираженість больового синдрому визначали за аналоговою 10-бальною шкалою. Моніторинг інтенсивності больового синдрому проводили під час хіміотерапії щоденно, у період перерви між циклами 1 раз на тиждень, до початку першого і кожного наступного циклу хіміотерапії.
На фоні проведеного протипухлинного лікування була відмічена наступна динаміка больового синдрому, пов’язаного з протипухлинним процесом: кількість хворих без больового синдрому була однакова в обох групах до лікування. Після 3 курсу ПХТ з поліплатилленом відмічали зменшення больового синдрому у 3,5 раза порівнянні з групою контролю (46,3% проти 13,3%). В процесі подальшого спостереження на фоні хіміотерапії виявлена стійка позитивна динаміка зменшення больового синдрому в основній групі, тоді як у групі контролю відзначали збільшення кількості хворих з помірно і значно вираженим ступенем больового синдрому. Число пацієнтів з помірно вираженим больовим синдромом 1–3 бали до лікування в основній групі 8,9%, у групі контролю 6,7%, після завершення лікування 34,25 і 20,45 відповідно. Хворі з достатньо вираженим больовим синдромом 4,7 балів до початку лікування в основній групі 55,2%, у групі контролю 55,7%. Після завершення лікування 16,3 і 40,9% відповідно.
Використання поліплатилену при паліативному лікуванні хворих на рак підшлункової залози дозволяє ефективно усувати больовий синдром, пов’язаний з основним захворюванням та допомагає стабілізувати статус пацієнта за шкалою ECOG.














Leave a comment