Двохетапна резекція печінки у хворої з метастазами нейроендокринної пухлини. Клінічний випадок
Колеснік О.О., Лукашенко А.В., Зубарєв М.Г., Остапенко Ю.В.
Резюме. Останнім часом відмічається підвищення захворюваності на нейроендокринні пухлини (НЕП), яка становить 3 випадки на 100 тис. неселення на рік. Результати лікування НЕП залежать від стадії захворювання, наявності карциноїдного синдрому, ступеня диференціації пухлини, показників проліферативного індексу Кi-67. Комбіноване лікування хворих з метастазами (Мтс) НЕП у печінці дозволяє досягти медіани виживаності 80–120 міс. Основною проблемою хірургії печінки є недостатній майбутній об’єм залишкової паренхіми печінки. Перев’язка гілок ворітної вени сприяє збільшенню залишкової паренхіми печінки. У роботі представлено результати лікування пацієтки з діагнозом НЕП тонкої кишки, T3N0M0 G1 ІІ стадії, Ki-67 <3%, стан після радикального лікування (2009 р.), прогресування хвороби. Множинні Мтс у печінці, об’єм залишкової паренхіми печінки <30%. У Національному інституті раку виконано двохетапну резекцію печінки з перев’язкою гілок ворітної вени: 1-й етап — бісегментектомія II–III сегментів та селективна перев’язка ніжки ворітної вени до задньої секції. КТ-волюметрія через 1 міс, ступінь гіпертрофії +56%. 2-й етап — задня правобічна секторектомія (VI–VII сегменти). Післяопераційних ускладнень не було. Строк спостереження — 102 міс. Пацієнтка зі стійкою ремісією без ознак продовження хвороби. Результати клінічного випадку свідчать про ефективність та безпечність двохетапного хірургічного лікування з перев’язкою гілок ворітної вени з метою гіпертрофії контралатеральної частки у хворих з множинними Мтс НЕП у печінці.

ВСТУП
Нейроендокринні пухлини (НЕП) — це гетерогенні новоутворення, які формуються з клітин дифузної ендокринної системи і є відносно рідкісним онкологічним захворюванням. Клінічною особливістю НЕП є латентний перебіг та їх повільне прогресування. Хоча, за даними Всесвітньої організації охорони здоров’я, захворюваність на НЕП становить усього 2–3 випадки на 100 тис. населення на рік, за останні роки спостерігається підвищення частоти їх виявлення до 3,65 випадку [1–3].
НЕП об’єднують доволі велику групу пухлин, які характеризуються біологічною різноманітністю та найчастіше локалізуються у легенях та бронхах (так звані бронхопульмональні), рідше у шлунку, тонкій кишці та підшлунковій залозі, апендиксі, прямій кишці та тимусі. Незначну кількість НЕП виявляють у паращитоподібних залозах, щитоподібній залозі, наднирковій залозі, гіпофізі [1, 3].
Етіологія НЕП невідома, доволі часто вони асоціюються з генетичними ендокринними синдромами Гіппеля — Ліндау, множинною ендокринною неоплазією та ін. Усі НЕП мають злоякісний потенціал [4–6].
Зростання частоти виявлення НЕП пов’язують з удосконаленням та покращенням неспецифічних методів діагностики, таких як комп’ютерна томографія (КТ), магнітно-резонансна томографія, ендоскопічне ультразвукове дослідження, позитронно-емісійна томографія/КТ, та, можливо, більшою мірою специфічних методів — октреоскан, визначення у крові циркулюючих хромогранінів А та В, гормонів, які продукуються цими пухлинами у надмірній кількості (серотонін, гастрин та ін.), імуногістохімічного аналізу біологічного матеріалу (видаленої пухлини, матеріалу біопсії та ін.) з дослідженням експресії специфічних рецепторів, визначення мітотичної активності та індексу проліферації Ki-67 пухлинних клітин. Усі перелічені методи дозволяють з високою точністю встановити діагноз НЕП та їх походження і застосувати специфічне високоефективне лікування [1, 5, 6].
Безпосередні та віддалені результати лікування пацієнтів із НЕП залежать від стадії захворювання, локалізації пухлини, наявності карциноїдного синдрому, ступеня диференціації та мітотичної активності пухлини, показників проліферативного індексу Кi-67. Тільки 20% пацієнтів мають карциноїдний синдром, який дозволяє виявити НЕП у ранній стадії, оскільки його наявність насторожує лікаря, до якого безпосередньо звертається пацієнт. Відповідно, спочатку проводиться неспецифічне обстеження, яке дозволяє виявити пухлину та згодом, за допомогою специфічних методів діагностики, встановлюється діагноз НЕП, проводиться відповідне лікування, результати якого у початкових стадіях захворювання є доволі оптимістичними [7].
У близько 80% пацієнтів перебіг НЕП є безсимптомним, аж до генералізації процесу з погіршенням стану хворого внаслідок множинного метастазування. Але навіть при метастатичній НЕП можливе комбіноване лікування. Слід звернути увагу на те, що за наявності віддалених метастазів (Мтс) НЕП медіана виживаності пацієнтів без лікування є вищою порівняно зі злоякісними пухлинами іншої морфологічної будови, наприклад з аденокарциномою підшлункової залози, 35 міс проти 6 міс відповідно. А при проведенні відповідного хірургічного або медикаментозного лікування показники виживаності пацієнтів з IV стадією захворювання значно зростають. Так, медіана загальної виживаності пацієнтів, спеціально пролікованих з приводу Мтс НЕП, в середньому становить 80–120 міс і більше порівняно з 40 міс при Мтс колоректального раку, 14 міс — раку шлунка, 6 міс — раку підшлункової залози [9–11].
За даними літератури, НЕП тонкої кишки становить 10% усіх локалізацій, в основному серед пухлин шлунково-кишкового тракту, та за частотою поступається тільки НЕП підшлункової залози [22]. Слід відмітити, що НЕП тонкої кишки найчастіше малосимптомні та повільно прогресуючі, практично недосяжні візуальним методам діагностики, що певною мірою унеможливлює їх раннє виявлення. Найчастішим проявом НЕП тонкої кишки є біль у черевній порожнині [22]. На жаль, майже у половині випадків пацієнти звертаються по медичну допомогу вже з наявними Мтс у інші органи (заочеревинні лімфатичні вузли, печінка, кістки і т.д.), які були виявлені під час звичайних рутинних обстежень (ультразвукове дослідження черевної порожнини). Рідше перебіг НЕП тонкої кишки асоційований з карциноїдним синдромом, кровотечею, тонкокишковою непрохідністю, що дозволяє виявити захворювання у ранній стадії [2, 8].
Успіх методів лікування пацієнтів із НЕП тонкої кишки напряму залежить від стадії захворювання, морфологічних аспектів та індексу проліферації.
Оптимальним методом терапії при ранніх стадіях НЕП тонкої кишки є резекція з регіонарною лімфодисекцією та детальною оцінкою кишки по всій довжині з метою виявлення множинного ураження. П’ятирічна виживаність пацієнтів з І–ІІ стадією за наявності високодиференційованої пухлини з низьким Ki-67 (<20%) коливається в межах 90–100%, ІІІ — за наявності Мтс у регіонарних лімфатичних вузлах — 80%. У разі низькодиференційованої НЕП тонкої кишки з високим ступенем мітотичної активності та індексом проліферації Ki-67 >20% перебіг хвороби доволі агресивний з раннім метастазуванням у інші органи та несприятливим прогнозом, таким як, наприклад, при аденокарциномі тонкої кишки.
У двох мультицентрових дослідженнях CLARINET та PROMID, в яких вивчали ефективність медикаментозного лікування із застосуванням пролонгованого октреотиду та ланреотиду поширених метастатичних форм НЕП, виявлено збільшення медіани безрецидивної виживаності та стабілізацію пухлинного процесу у 67% пацієнтів у групі з вищезазначеними препаратами порівняно з 37% пацієнтів групи плацебо. Найкращий ефект лікування був у пацієнтів з меншою кількістю Мтс у печінці (<10% ураженої паренхіми) та у яких було виконано хірургічне лікування первинної пухлини. Медіана загальної виживаності становила 84 міс проти 35 міс у плацебо-групі. Найчастіше НЕП шлунково-кишкового тракту метастазують у печінку. Нерідко виявляють множинні Мтс у печінці. Але навіть за наявності такого ураження допустиме хірургічне лікування в обсязі максимального видалення Мтс шляхом анатомічної резекції печінки або атипових резекцій зі збереженням достатнього об’єму залишкової паренхіми печінки (ЗПП). За даними літератури, медіана загальної виживаності пацієнтів із НЕП, яким проведене хірургічне лікування Мтс у печінці, становить 9,6 року [9–11].
Також виявлено, що наявність позитивного краю резекції при лікуванні Мтс НЕП в печінці не погіршує віддалені результати [11].
Завдяки активному розвитку гепатобіліарної хірургії кількість показань до хірургічного лікування хворих з Мтс НЕП значно збільшилася. За останні 10 років були ґрунтовно переглянуті критерії резектабельності метастатично ураженої печінки пухлинами шлунково-кишкового тракту. Сьогодні такі показники, як кількість Мтс у печінці та їх локалізація, залучення у процес портальних ніжок та печінкових вен, поширення на суміжні органи, є відносними факторами при плануванні хірургічного лікування, які впливають на резектабельність. Основною проблемою хірургії печінки у таких хворих є недостатній майбутній об’єм ЗПП. Печінкова недостатність (ПН) є одним з найбільш значущих ускладнень та причиною смертності у ранній післяопераційний період після таких об’ємних втручань на печінці, як розширена гемігепатектомія або комбіновані двосторонні резекції. Завдяки впровадженню методів двохетапної резекції печінки, а також методик, що сприяють прискоренню гіпертрофії ЗПП, досягнуті певні хірургічні успіхи. Таким чином, аналіз безпосередніх та віддалених результатів хірургічного лікування хворих з приводу об’ємного ураження печінки є досить складним питанням. Запропоновані новітні методи потребують вивчення та аналізу їх ефективності з метою оптимізації хірургічного лікування в умовах двохетапної резекції печінки, ураженої Мтс НЕП [12–15].
Мета публікації цього клінічного випадку — представити можливості двохетапної резекції печінки при її масивному ураженні для покращення безпосередніх та віддалених результатів лікування хворих з Мтс НЕП.
КЛІНІЧНИЙ ВИПАДОК
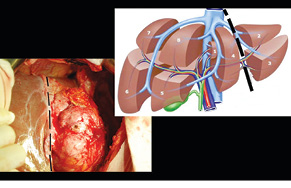
У відділенні малоінвазивної хірургії, ендоскопії та інтервенційної радіології Національного інституту раку було проведене хірургічне лікування хворої 55 років, яка поступила з діагнозом НЕП тонкої кишки T3N0M0 G1 ІІ стадії, Ki-67 <3%, стан після лікування (2009 р.). Продовження хвороби. Множинні Мтс в печінку. У 2009 р. з приводу цього захворювання їй було проведено хірургічне лікування в об’ємі резекції тонкої кишки. У період з 2009 по 2011 р. пацієнтка була під спостереженням в онколога за місцем проживання. У 2011 р. за допомогою КТ виявлено прогресування хвороби у вигляді метастазування у печінку з ураженням VI–VII та III сегментів. При плануванні хірургічного лікування в обсязі правобічної гемігепатектомії та бісегментектомії (II–III сегменти) виявлено, що майбутній об’єм ЗПП становитиме менше 30% і не дозволить виконати заплановану операцію (рис. 1). Оскільки у цьому випадку оптимальним методом лікування із задовільними віддаленими результатами є резекція метастатично ураженої печінки, вирішено провести хірургічне лікування у два етапи. Перший етап складався з лівої латеральної секторектомії печінки (видалення II–III сегментів) та селективної перев’язки гілки ворітної (портальної) вени до задньої секції (рис. 2).

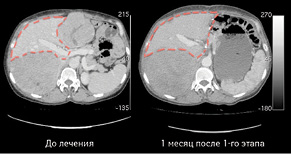
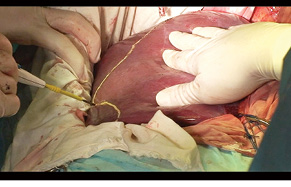
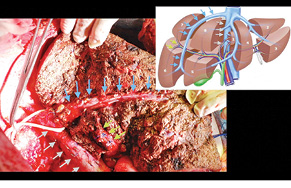
Через 1 міс за допомогою КТ виконано волюметрію об’єму ЗПП для оцінки ступеня гіпертрофії паренхіми, яка становила +56% на момент обстеження (рис. 3). Відразу був проведений 2-й етап хірургічного лікування в обсязі задньої правобічної секторектомії. На рис. 4 зображено демаркаційну лінію, зроблену коагуляційним ножем. На рис. 5 представлено поверхню печінки після задньої секторектомії, при якій вдалося зберегти гілку правої печінкової вени завдяки суттєвій гіпертрофії IV сегмента. На рис. 6 — вигляд печінки після 2-го етапу хірургічного лікування, об’єм ЗПП (V, IV та I сегменти) становить 56%. На рис. 7 зображено видалені сегменти печінки з Мтс. Пацієнтка задовільно перенесла двохетапне лікування, яке пройшло без ускладнень. Строк спостереження становив 102 міс. Станом на травень 2017 р. у пацієнтки відмічається стійка ремісія без ознак продовження хвороби.
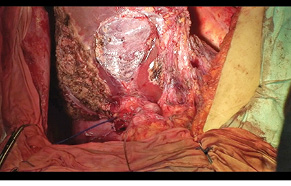
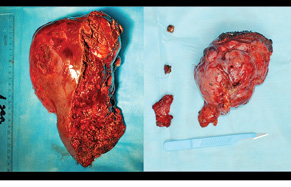
ОБГОВОРЕННЯ
Останніми роками резекція печінки з приводу Мтс НЕП вважається стандартною та безпечною операцією. Більшість провідних хірургічних центрів досягають задовільних результатів лікування таких хворих. Післяопераційна смертність не перевищує 4%. У хворих із НЕП за наявності синхронних або метахронних Мтс R0–R1 резекція є одним зі способів лікування, що дозволяє ефективно контролювати перебіг хвороби. Швидкість одужання пацієнта після резекції печінки пропорційно залежить від об’єму ЗПП [12, 13].
Частота виникнення ПН після резекції печінки, за даними літератури, становить 1,2–32%, що напрямузалежить від об’єму ЗПП. Відповідно, ризик виникнення ПН зростає пропорційно зменшенню об’єму ЗПП на 30% від загального об’єму печінки. Для зниження ризику виникнення ПН співвідношення об’єму ЗПП та маси тіла пацієнтів за відсутності супутніх захворювань печінки має бути <0,5, за їх наявності — <0,8 [12–14].
На сьогодні розроблено методи гіпертрофії печінки, зокрема, перев’язка гілок ворітної вени, емболізація гілок ворітної вени, які мають свої переваги та недоліки. Результати використання двохетапної резекції печінки у хворих з приводу білобарного ураження є обмеженими внаслідок очікуваних тяжких ускладнень. За останні роки стандартним підходом до досягнення гіпертрофії ЗПП було застосування емболізації гілок ворітної вени. Проте така тактика не завжди забезпечує задовільний ступінь гіпертрофії парехніми контралатеральної частки печінки. Найчастіше для досягнення більш-менш адекватної гіпертрофії ЗПП з використанням емболізація гілок ворітної вени необхідно не менше 8 тиж. Інтраоперційна перев’язка гілок ворітної вени дозволяє більш ефективно збільшити об’єм ЗПП протягом 4 тиж. Крім того, 1-й етап оперативного втручання дає можливість провести більш ретельну ревізію печінки, застосувати інтраопераційне ультразвукове обстеження з метою оцінки ураження печінки та іноді провести невелику за об’ємом резекцію печінки контралатеральної частки [16–18].
У сучасній хірургії існує ще один альтернативний метод двохетапної резекції печінки, який складається з прецизійного розсічення паренхіми печінки зі збереженням печінкових вен, правої та лівої гілки печінкової артерії та жовчних проток з перев’язкою правої гілки ворітної вени на першому етапі та правобічною гемігепатектомією на другому (associated liver partition and portal vein ligation for staged hepatectomy — ALPPS), що у свою чергу зумовлює гіпертрофію контралатеральної частки за короткий час (до 7–9 діб). Частота післяопераційних ускладнень після розсічення печінки з лігуванням ворітної вени є порівняно вищою, ніж після лігування ворітної вени або емболізації гілок ворітної вени. Безперечно, позитивним моментом є те, що двохетапне хірургічне лікування можна виконати досить швидко, що є важливим, наприклад, при Мтс колоректального раку, які швидко прогресують [15, 19]. Мтс НЕП прогресують доволі повільно, тому для зниження ризику післяопераційних ускладнень при масивному ураженні печінки обґрунтовано використання двохетапного лікування з використанням перев’язки гілок ворітної вени.
Хірургічне лікування Мтс НЕП у печінці є ефективним методом локального контролю хвороби. Так, при агресивних формах НЕП має застосовуватися комбіноване лікування з хіміотерапією. При менш агресивних високодиференційованих НЕП обов’язкове проведення гормонотерапії (пролонгований октреотид). Така комбінація дозволяє контролювати метастатичний процес, збільшує медіану безрецидивної виживаності пацієнтів із поширеною НЕП. Дані літератури свідчать про те, що у 70–90% пацієнтів у термін до 5 років виникає рецидив захворювання [9, 20, 21]. Тому використання всіх можливих методів лікування, таких як резекція печінки, ураженої Мтс, медикаментозне лікування (гормонотерапія, хіміотерапія) та ін., які значно покращують безпосередні та віддалені результати терапії, є надзвичайно важливим у стратегії ведення пацієнтів з метастатичними НЕП.
ВИСНОВКИ
1. Застосування агресивної хірургічної тактики при лікуванні хворих із НЕП з білобарним метастатичним ураженням печінки у комбінації з медикаментозним підходом дозволяє досягти найкращих віддалених результатів.
2. Застосування двохетапної резекції печінки дозволяє виконати великі за об’ємом операції та тим самими запобігти виникненню ПН.
3. Використання інших методик двохетапних хірургічних втручань на печінці, таких як розсічення печінки з лігуванням ворітної вени (ALPPS), є недоцільним у зв’язку з повільним прогресуванням Мтс НЕП в печінці.
4. Розробка критеріїв застосування двохетапної резекції печінки за методикою перев’язки гілок ворітної вени з метою гіпертрофії контралатеральної частки є перспективним напрямом подальших досліджень як метод, який дозволяє проводити хірургічне лікування пацієнтів із НЕП з білобарним метастатичним ураженням печінки.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Кэплин М., Кволс Л. (ред.) (2011) Нейроэндокринные опухоли: руководство для врачей: пер. с англ. М.: Практическая медицина, 224 с.
2. Hemminki K., Li X. (2010) Incidence trends ans risk factors of carcinoid tumors. A nationwide epidemiologic study from Sweden. Cancer, 92(8): 2204–2210.
3. Modlin I.M., Lye K.D., Kidd M.A. (2003) 5-decade analysis of 13,715 carcinoid tumors. Cancer, 97(4): 934–959.
4. Rindi B., Bordi C. (2005) Aetilogy, molecular pathogenesis and genetics. Best. Pract. Res. Clin. Gastroeneterology, 19(40): 519–534.
5. Yao J.C., Hassan M., Phan A. et al. (2008) One hundred years after «carcinoid»: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J. Clin. Oncol., 26: 3063–3072.
6. Fraenkel M., Kim M., Faggiano A. et al. (2014) Incidence of gastroenteropancreatic neuroendocrine tumours: a systematic review of the literature. Endocr. Relat. Cancer, 21: 153–163.
7. Jenson R.T., Norton J.A. (2001) Carcinoid Tumors and Carcinoid Syndrome. In: DeVita V.T., Hellman S., Rosenberg S.A., eds. Cancer: Principles and Practice of Oncology, 2(ed. 6). Philadelphia, Pa: Lippincott Williams and Wilkins: 1813–1826.
8. Pasieka J.L., McKinnon J.G., Kinnear S. et al. (2001) Carcinoid syndrome symposium on treatment modalities for gastrointestinal carcinoid tumours: symposium summary. Can. J. Surg., 44(1): 25–32.
9. Rinke A., Muller H.H., Schade-Brittinger C. et al. (2009) Placebo-controlled, double-blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J. Clin. Oncol., 27: 4656–4663.
10. Caplin M.E., Pavel M., Cwikla J.B. et al. (2014) Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N. Engl. J. Med., 371: 224–233.
11. Glazer E.S., Tseng J.F., Al-Refaie W. et al. (2011) Long-term survival after surgical management of neuroendocrine hepatic metastases. HPB (Oxford), 12: 427–433.
12. Rahbari N.N., Garden O.J., Padbury R. et al. (2011) Posthepatectomy liver failure: a definition and grading by the International Study Group of Liver Surgery (ISGLS). Surgery, 149: 713–724.
13. Okabe H., Beppu T., Nakagawa S. et al. (2013) Percentage of future liver remnant volume before portal vein embolization influences the degree of liver regeneration after hepatectomy. J. Gastrointest. Surg., 17: 1447–1451.
14. Giraudo G., Greget M., Oussoultzoglou E. et al. (2008) Preoperative contralateral portal vein embolization before major hepatic resection is a safe and efficient procedure: a large single institution experience. Surgery, 143(4): 476–482.
15. Li J., Girotti P., Kоnigsrainer I. et al. (2013) ALPPS in right trisectionectomy: a safe procedure to avoid post operative liver failure? J. Gastrointest. Surg., 17(5): 956–961.
16. Lam V.W., Laurence J.M., Johnston E. et al. (2013) A systematic review of two-stage hepatectomy in patients with initially unresectable colorectal liver metastases. HPB (Oxford), 15: 483–491.
17. Van Lienden K.P., Van den Esschert J.W., De Graaf W. et al. (2013) Portal vein embolization before liver resection: a systematic review. Cardiovasc. Int. Radiol., 36(1): 25–34.
18. Donati M., Stavrou G.A., Basile F. et al. (2012) Combination of in situ split and portal ligation: lights and shadows of a new surgical procedure. Ann. Surg., 256: 11–12.
19. Knoefel W.T., Gabor I., Rehders A. et al. (2013) In situ liver transection with portal vein ligation for rapid growth of the future liver remnant in two-stage liver resection. Br. J. Surg., 100: 388–394.
20. Arnold R., Wittenberg M., Rinke A. et al. (2013) Placebo controlled, double blind, prospective, randomized study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors (PROMID): Results on long-term survival [abstract]. ASCO Meeting Abstracts 2013, 31: 4030.
21. Saxena A., Chua T.C., Perera M. et al. (2012) Surgical resection of hepatic metastases from neuroendocrine neoplasms: a systematic review. Surg. Oncol., 21: 131–141.
22. Pape U.F., Perren P.P., Bruno N. et al. (2012) ENETS Consensus Guidelines for the Management of Patients with Neuroendocrine Neoplasms from the Jejuno-Ileum and the Appendix Including Goblet Cell Carcinomas. Neuroendocrinology, 95: 135–156.
Двухэтапная резекция печени у больной с метастазами нейроэндокринной опухоли. Клинический случай
Национальный институт рака, Киев
Резюме. В последнее время отмечается повышение заболеваемости нейроэндокринными опухолями (НЭО), которая составляет 3 случая на 100 тыс. неселения в год. Результаты лечения НЭО зависят от стадии заболевания, наличия карциноидного синдрома, степени дифференциации опухоли, показателей пролиферативного индекса Ki-67. Комбинированное лечение больных с метастазами (Мтс) НЭО в печени позволяет достичь медианы выживаемости 80–120 мес. Основной проблемой хирургии печени является недостаточный будущий объем остаточной паренхимы печени. Перевязка ветвей портальной вены способствует увеличению остаточной паренхимы печени. В работе представлено результаты лечения пациентки с диагнозом НЭО тонкой кишки, T3N0M0 G1 ІІ стадии, Ki-67 <3%, состояние после радикального лечения (2009 г.), прогрессирование болезни. Множественные Мтс в печени, объем остаточной паренхимы печени <30%. В Национальном институте рака выполнена двухэтапная резекция печени с перевязкой ветвей воротной вены: 1-й этап — бисегментэктомия II–III сегментов и селективная перевязка ножки портальной вены к задней секции. КТ-волюметрия через 1 мес, степень гипертрофии +56%. 2-й этап — задняя правосторонняя секторэктомия (VI–VII сегменты). Послеоперационных осложнений не было. Период наблюдения — 102 мес. Пациентка со стойкой ремиссией без признаков продолжения болезни. Результаты клинического случая свидетельствуют об эффективности и безопасности двухэтапного хирургического лечения с перевязкой ветвей воротной вены с целью гипертрофии контралатеральной доли у больных с множественными Мтс НЭО в печени.
нейроэндокринные опухоли с метастазами в печени, двухэтапная резекция














Leave a comment