Цитоморфологічні квантитативні ознаки гепатоцелюлярного раку
Туганова Т.Н., Болгова Л.С., Махортова М.Г., Алексеенко О.И.
Резюме. Досліджено цитоморфологічні ознаки гепатоцелюлярного раку за спеціально розробленою «Схемою для формалізованої оцінки якісного і кількісного складу пухлинних клітин», що включає 67 ознак і їх градацій. Виявлено найбільш характерні цитоплазматичні, ядерні і ядерцеві структурні компоненти клітин у пункційному матеріалі 50 хворих. Ідентифікацію цитогенетичних особливостей пухлинних клітин проводили в 2500 ядрах Ag-позитивних клітин на основі дослідження 14 394 ядерець клітин гепатоцелюлярного раку за матеріалом тонкоголкової аспіраційної біопсії печінки і 1110 ядерець в 500 ядрах гепатоцитів умовної норми. Проведені дослідження дозволили виявити квантитативні морфофункціональні типи ядерцеутворюючих регіонів хромосом для диференційної діагностики клітин гепатоцелюлярного раку і гепатоцитів умовної норми. Виявлені цитоморфологічні, цитогенетичні та фонові складові в матеріалі пунктатів пухлин печінки можуть бути основними для встановлення морфологічного діагнозу.
Резюме. Исследованы цитоморфологические квантитативные признаки гепатоцеллюлярного рака по специально разработанной «Схеме для формализованной оценки качественного и количественного состава опухолевых клеток», включающей 67 признаков и их градаций. Выявлены наиболее характерные цитоплазматические, ядерные и ядрышковые структурные компоненты клеток на пункционном материале 50 больных. Определение цитогенетических особенностей опухолевых клеток проводили в 2500 ядрах Ag-положительных клеток на основании исследования 14 394 ядрышек клеток гепатоцеллюлярного рака по материалу тонкоигольной аспирационной биопсии печени и 1110 ядрышек 500 ядер гепатоцитов условной нормы. Проведенные исследования позволили выявить квантитативные морфофункциональные типы ядрышкообразующих регионов хромосом для дифференциальной диагностики клеток гепатоцеллюлярного рака и гепатоцитов условной нормы. Выявленные цитоморфологические, цитогенетические и фоновые составляющие в материале пунктатов опухолей печени могут быть основополагающими для установления морфологического диагноза.
 Среди относительно редко выявляемых онкологических заболеваний первичный рак печени (2–5%) отличается быстрым прогрессированием и низкими показателями продолжительности жизни больных [1, 4, 8]. Ежегодно в мире регистрируют >600 000 случаев рака печени [1, 7]. Мужчины заболевают примерно в два раза чаще, чем женщины [6].
Среди относительно редко выявляемых онкологических заболеваний первичный рак печени (2–5%) отличается быстрым прогрессированием и низкими показателями продолжительности жизни больных [1, 4, 8]. Ежегодно в мире регистрируют >600 000 случаев рака печени [1, 7]. Мужчины заболевают примерно в два раза чаще, чем женщины [6].
В Украине в 2014 г. рак печени диагностирован у 1344 пациентов, а умерли в период до года со дня установления диагноза 77,7% больных. Следует подчеркнуть, что морфологическая верификация патологического процесса в печени довольно низкая и составила 53,2% [6].
В настоящее время все чаще проводится тонкоигольная биопсия патологического очага в печени для цитологической верификации.
В большинстве случаев удается получить информативный материал, который позволяет цитопатологу установить морфологический тип и степень дифференцировки данного варианта опухоли, что является основанием для дальнейшего обследования и соответствующего специального лечения пациента [2, 3, 7–9].
В ряде наблюдений из-за неадекватного пункционного материала цитологическая диагностика бывает весьма затруднительной [4, 5]. Кроме того, значительная сложность может возникнуть при дифференциальной диагностике пролиферирующих с признаками атипической гиперплазии гепатоцитов с клетками гепатоцеллюлярного рака (ГЦР). Известно, что гепатоциты отличаются высокой реактивностью и, как правило, активно реагируют на любое воздействие различных факторов на печень. При этом в цитологических препаратах отмечается пролиферация гепатоцитов, проявляющаяся увеличением их размеров, появлением двухъядерных экземпляров, относительным полиморфизмом и гиперхроматозом ядер, гипертрофией ядрышек. Упомянутые признаки значительно затрудняют дифференциальную диагностику пролиферирующих гепатоцитов с проявлениями атипической гиперплазии и клетками ГЦР.
Принцип сравнения цитоморфологических признаков клеток органа или ткани в норме с таковыми при оценке патологически измененных экземпляров, обнаруживаемых в препаратах с различной патологией, является в цитологической диагностике определяющим. При этом чем объективнее исследование дифференциальных признаков, тем достовернее морфологическая верификация патологического процесса. В этой связи представляется обоснованным для более точной дифференциальной диагностики применение дополнительных методов исследования клеток.
Для более объективной оценки цитоморфологических признаков целесообразно применение квантитативного (количественного) исследования всех клеточных, структурных и фоновых компонентов и их частоты в цитологических препаратах.
Другим методом, позволяющим на субклеточном уровне выявлять степень пролиферации клеток и наличие малигнизации, является изучение ядрышковых организаторов (или ядрышкообразующих регионов — ЯОР) в гепатоцитах неизмененной печени, так называемой условной нормы, и в клетках ГЦР. Определение качественных признаков и количественного состава основных морфофункциональных типов ЯОР позволяет по наличию крупных активных (компактных и нуклеолонемных) и мелких неактивных (кольцевидных и микроядрышек) вариантов определить особенности их проявлений и отнести исследованные клетки к доброкачественным или злокачественным образованиям, уточняя таким образом характер патологического процесса.
Цель исследования — выявить объективизированные цитоморфологические и цитогенетические признаки ГЦР.
Объект и методы исследования
Изучены цитологические признаки опухолевых клеток (ОК) у 50 больных ГЦР. Цитоморфологические критерии изучали по специально разработанной нами «Схеме цитоморфологических признаков для формализованной оценки качественного и количественного состава клеток» (далее — Схема), включающей 67 признаков и их градаций. При этом учитывались особенности цитоплазматических, ядерных и ядрышковых структурных компонентов клеток.
Оценивая цитологические препараты, изучали фоновые элементы при ГЦР, определяли общую характеристику клеток (количество, расположение, размер и форму). Размер клеток и их составляющих визуально сравнивали с диаметром эритроцита: малый размер — в 1,5–2 раза больше, средний — в 2–5, крупный — в ≥5 раз больше диаметра эритроцита. Изучали характерные признаки цитоплазмы (сохранность, размер, форму и тинкториальные свойства), учитывали ее морфофункциональные критерии — наличие вакуолизации и зернистости. Оценивали также характеристику ядра и ядрышек (форму, размер, контуры, структуру хроматина, степень окраски). Всего исследовано 5000 клеток ГЦР.
Объектом цитогенетического исследования были клетки пункционного материала ГЦР (25 больных) и гепатоцитов условной нормы в виде соскобов из неизмененного участка печени (5 больных) Изучены основные морфофункциональные типы ЯОР хромосом в ядрах упомянутых клеток для уточнения биологического характера роста.
Цитогенетические особенности ОК печени определяли в 2500 ядрах Аg-позитивных клеток на основании исследования 14 394 ядрышек с разными морфофункциональными типами и 1110 ядрышек в 500 ядрах гепатоцитов условной нормы. Качественные и количественные показатели морфофункциональных типов ЯОР оценивали по 100 клеткам в материале каждого пациента.
Проведено исследование внеядрышковых аргентофильных гранул (ВАГ), их количество и характер распределения — в виде преимущественно равномерного или неравномерного расположения (гранулы образовывали скопления, бороздки, концентрировались маргинально или состояли в различных сочетаниях). Для выявления ЯОР цитологические препараты окрашивали раствором азотнокислого серебра по методике W. Howell и D. Black. Исследования основных вариантов ЯОР проводили в соответствии с классификацией П.В. Челидзе, О.В. Зацепиной и разработанной нами рабочей схемой идентификации морфофункциональных типов ядрышек при последовательном 1000-кратном увеличении иммерсионной системы светового микроскопа OLYMPUS CX 41; СХ 21.
Полученные результаты исследований отражены на диаграммах и микрофотографиях (рис. 1–14).
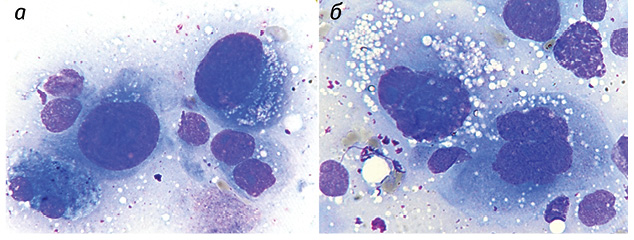
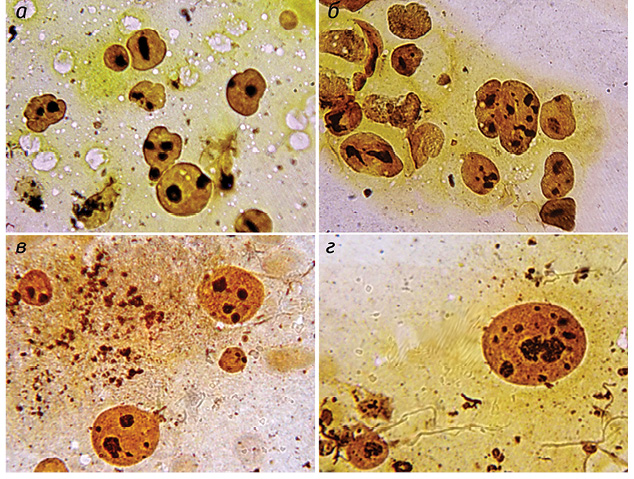
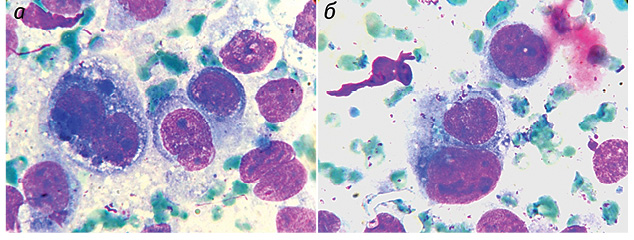
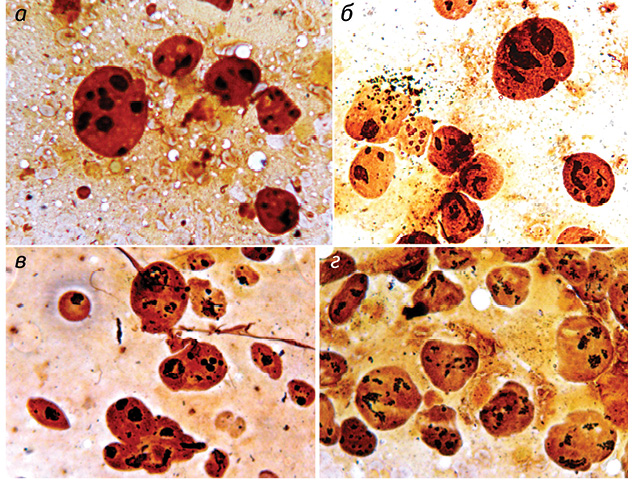
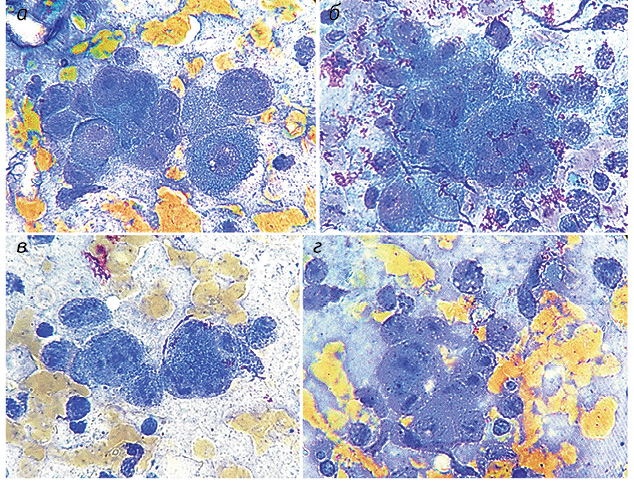

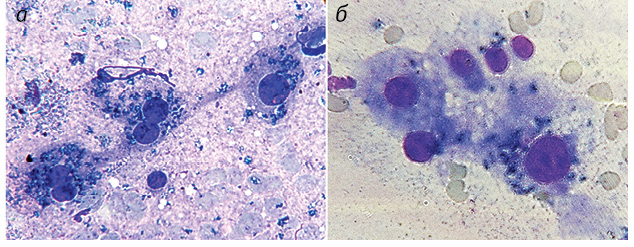
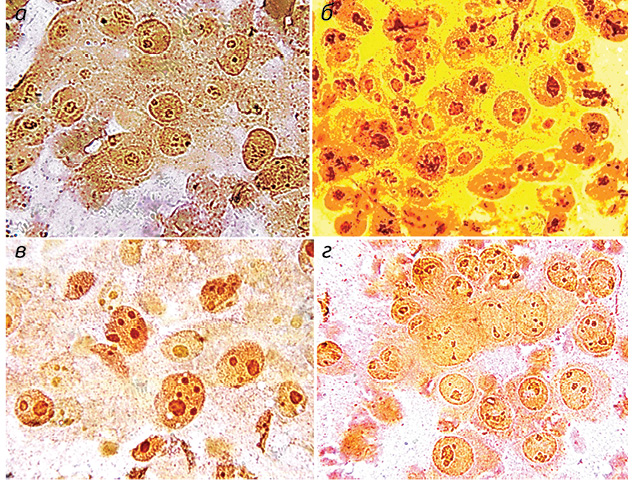
По цитологическим препаратам пунктатов новообразований печени устанавливали морфологический диагноз в соответствии с Международной гистологической классификацией [10] и с учетом клинических данных.
Для статистической обработки полученных результатов использовали t-критерий Стьюдента с уровнем достоверности р<0,05.
Результаты
При исследовании цитологических препаратов по разработанной нами Схеме выявлены наиболее характерные фоновые компоненты при ГЦР: эритроциты (82,00±2,25%), жирнокапельный детрит (66,67±1,94%), лейкоциты (61,11±0,75%), соединительнотканные элементы (66,67±0,75%) и гепатоциты без признаков атипии (44,45±1,5%). Кроме того, одинаково часто определялись обрывки сосудов и оксифильная субстанция (38,88±0,75%), реже — лимфоциты (27,77±0,30%). Выявляли также некротические массы (22,22±0,75%), мелкозернистый детрит (16,66±0,75%) и желчные пигменты в виде темных гранул различного размера (16,00±1,5%). В каждом десятом препарате встречались отдельные макрофаги.
По результатам исследований выявлено, что цитологические препараты содержали значительное количество ОК (66,66±0,30%), которые располагались преимущественно разрозненно (66,67±1,50%) и в группах (33,33±1,50%). Небольшое количество клеток отмечали в 22,22±0,30% наблюдений и единичные клетки ГЦР выявляли в 11,11±0,30% препаратов.
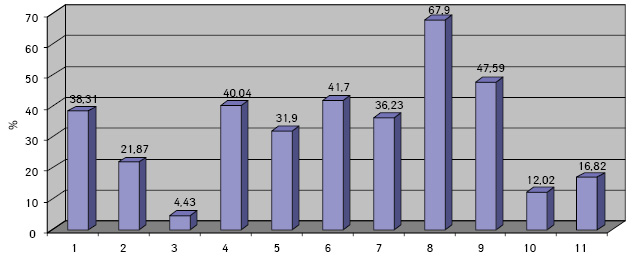
Проведенные по разработанной Схеме цитоморфологические исследования позволили выявить, что для ГЦР характерны клетки с частично (41,70±1,08%) и полностью лизированной (36,23±1,20%) цитоплазмой. Преобладали крупные клетки (55,45±0,97%). Они имели овальную (38,31±0,70%), полиморфную (21,87±0,30%), реже — округлую и отростчатую форму. Признаки выраженной анаплазии клеток отмечали в 4,43±0,25% образцов. Ядерно-цитоплазматическое соотношение составляло ½ (42,21±0,58%), ⅓ (35,52±0,77%), в остальных клетках оно было более выраженным. Преобладали клетки с умеренно развитой (40,04±0,53%), широкой (31,90±0,88%) и слабобазофильной (47,59±1,57%) цитоплазмой с нечеткими контурами (67,90±1,13%). В части клеток в цитоплазме определялись зернистость (16,82±0,20%) и мелкие вакуоли (12,02±0,40%).
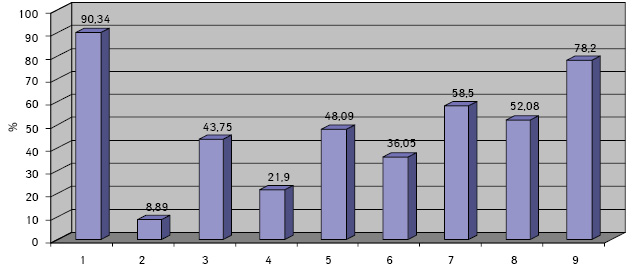
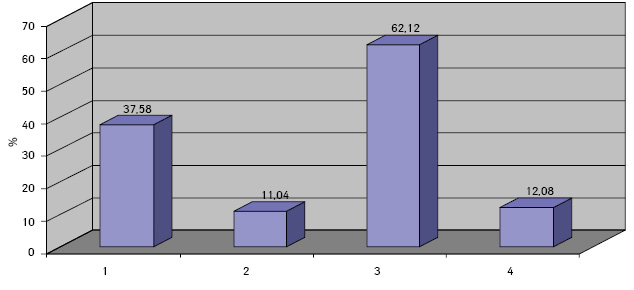
Клетки ГЦР содержали в основном по одному ядру (90,34±0,08%), реже два и более (8,89±0,06%). Превалировали мелкие ядра (43,75±0,51%), в два раза реже выявляли ядра крупного размера (21,90±0,52%). У остальных (35,01±0,19%) клеток ядра укрупнены, средних размеров. По форме ядра чаще — округлые (48,09±0,57%), реже — овальные (15,02±0,09%) и полиморфные (36,05±0,60%). Преобладали нормохромные ядра (58,50±0,28%) с неравномерной мелкоглыбчатой структурой хроматина (52,08±0,40%). Ядра клеток ГЦР располагались чаще эксцентрично (78,20±0,21%) и содержали по одному (37,58±0,37%), реже — по два и более (11,04±0,60%) ядрышек, в 47,28±0,27% случаев ядрышки не визуализировались. Ядрышки были мелкого (62,12±0,60%), крупного (12,08±0,61%) и среднего (23,07±0,67%) размера.
Для уточнения характера процесса, степени функциональной активности исследуемых клеток проведен сравнительный анализ основных морфофункциональных типов ядрышковых организаторов (ЯОР) в элементах ГЦР и гепатоцитов условной нормы, основанный на качественной и количественной характеристиках всех выявляемых вариантов ЯОР.
Качественное типирование Ag-положительных ЯОР в ядрах клеток ГЦР выявило колебание количества всех морфофункциональных типов ядрышек от 4,67±0,04 до 8,03±0,07 единицы в ядре, что в среднем составило 5,76±0,04. В гепатоцитах условной нормы общее количество ядрышек определялось от 1,51±0,02 до 2,94±0,02 в ядре при среднем значении 2,21±0,02, что существенно ниже, чем в ОК. Среднее и процентное содержание компактных ядрышек выявляли в ОК в диапазоне показателей от 0,08±0,01 единицы и 1,40±0,01% до 0,37±0,01 единицы и 6,90±0,01% соответственно при М = 0,17±0,01 единицы и 2,90±0,03%.
При этом отмечали выраженный полиморфизм компактных ядрышек, их различные размеры — от мелких, обычно множественных, до крупных, частично с неровными контурами. Необходимо подчеркнуть, что при исследовании условной нормы в подавляющем большинстве клеток компактные ЯОР отсутствовали. Они определялись в единичных наблюдениях, при выраженной пролиферации гепатоцитов, были преимущественно крупные, правильной округлой формы, с ровными, четкими контурами и варьировали от 0 до 0,04±0,01 (1,40±0,01%) при М = 0,03±0,01 (1,25±0,02%).
Показатели нуклеолонемных ядрышек в опухолевых гепатоцитах колебались в пределах от 1,18±0,02 (21,90±0,06%) до 2,56±0,04 (38,6±0,03%) при М = 1,70±0,03 (29,60±0,06%). В 98,3% ядрышек нуклеолонемного типа определялись различные варианты переходных форм. В них преобладали средние (32,6%) и крупные (38,2%) аргентофильные гранулы.
Мелкие градации аргентофильных гранул выявляли в 21,5%, пылевидно-точечные — в 7,7% нуклеолонемных ядрышек. В дистрофически измененных ОК отмечали выраженный полиморфизм ядрышек нуклеолонемного типа (см. рис. 11, 12). По мере нарастания процесса опухолевой трансформации постепенное накопление крупных гранул в ядрышках переходного типа приводит, как правило, к формированию высокоактивных ядрышек компактного типа (см. рис. 8, 10).
Показатели нуклеолонемных ядрышек в неопухолевых клетках снижены и находятся в диапазоне от 1,12±0,01 (38,1±0,03%) до 1,49±0,02 (87,1±0,03%) при М = 1,25±0,02 (62,3±0,01%). При этом процентное их содержание значительно выше, чем в ОК. При различных доброкачественных пролиферативных процессах они, как правило, превалируют среди активных форм ядрышек.
Варианты переходных форм выявляли в ядрышках нуклеолонемного типа при условной норме в 41%. В них, в отличие от опухолевых гепатоцитов, преобладало количество пылевидно-точечных, мелких гранул (68%), которые часто создавали видимость компактных ядрышек, особенно в тех наблюдениях, в которых располагались плотно и густо по центру. Аргентофильные гранулы средних градаций определялись в 25% нуклеолонемных ядрышек, при этом большая часть — в виде единичных форм. Крупные гранулы (7,0%) дифференцировали значительно реже в виде четких аргентофильных образований по контуру единичных нуклеолонемных ядрышек.
Различалось также количество малоактивных ядрышек кольцевидного типа: от 1,35±0,02 (20,8±0,04%) до 1,74±0,02 (26,9±0,04%) при М = 1,50±0,02 (24,2±0,04%) в клетках ГЦР и от 0,15±0,01 (8,8±0,04%) до 0,80±0,04 (29,6±0,04%) при М = 0,48±0,03 (19,5±0,02%) в неопухолевых клетках печени. При ГЦР значительно преобладало количество неактивных микроядрышек — от 1,97±0,01 (34,6±0,02%) до 3,24±0,05 (49,5±0,02%) при М = 2,70±0,04 (43,7±0,10%) по сравнению с неопухолевыми клетками печени — от 0,07±0,01 (4,7±0,02%) до 1,00±0,05 (34,0±0,02%) при М = 0,46±0,02 (16,9±0,02%).
ВАГ в 100% ядер клеток ГЦР выявляли в умеренном количестве с преобладанием неравномерного распределения в виде скоплений (30,3%), бороздок (20,6%), сочетания скоплений и бороздок (22,5%), скоплений и маргинального расположения (13,5%), бороздок и маргинального расположения (5,6%), скоплений, бороздок и маргинального расположения (5,4%), маргинального расположения (2,1%).
В отличие от ОК ВАГ в гепатоцитах условной нормы определялись в небольшом количестве во всех наблюдениях с превалированием равномерного распределения (85,0%) по поверхности ядер. В 15,0% ядер расположение ВАГ носило неравномерный характер в виде преимущественно рыхлых скоплений различной протяженности (см. рис. 14).
При сравнительном количественном анализе основных морфофункциональных типов ЯОР при опухолевой трансформации гепатоцитов и условной норме выявлено явное преобладание показателей при раке печени. Диапазон общих параметров и их средних значений выше в ОК при подсчете общего количества морфофункциональных типов ядрышек, активных ядрышек компактного и нуклеолонемного типа, малоактивных кольцевидных и неактивных микроядрышек. При раке, в отличие от неопухолевых гепатоцитов, значительно выше содержание ядрышек переходного типа, что составляет 98,3%, в них преобладают гранулы средней и крупной градации. В гепатоцитах условной нормы нуклеолонемные ядрышки переходного типа (41,0%) образуются преимущественно пылевидно-точечными, мелкими (68,0%) гранулами.
Значительно отличается количество и распределение ВАГ: при ГЦР в 100% наблюдений ВАГ в умеренном количестве распределяются неравномерно, в гепатоцитах условной нормы они в небольшом количестве размещаются в 85% случаев относительно равномерно по всей поверхности ядер и лишь в 15% — неравномерно в виде рыхлых скоплений, чем существенно отличаются от распределения в ОК.
Выводы
Проведенные многофакторные исследования позволяют сформулировать следующие выводы:
1. Установлено, цитологические препараты ГЦР в 70% наблюдений имеют высокую клеточность. ОК более чем в 77% с частично или полностью лизированной цитоплазмой. Выраженные признаки атипии ОК выявили в 4% наблюдениях. Ядерно-цитоплазматическое соотношение составляет ½ или ⅓ в ⅔ всех клеток.
2. Клетки ГЦР в 90% содержали по одному эксцентрично расположенному округлому ядру с неравномерно-глыбчатой структурой хроматина, в каждом из них определяются преимущественно по одному, а в каждом десятом наблюдении — по два крупных ядрышка.
3. Слабобазофильная цитоплазма ОК имеет нечеткие контуры (68%), содержит зернистость (желчный пигмент; 16%) и мелкие вакуоли (12%).
4. Фоновые компоненты цитограмм ГЦР характеризуются наличием эритроцитов (82%), лейкоцитов (61%), лимфоцитов (28%), соединительнотканных элементов и жирнокапельного детрита (67%), наличием гепатоцитов без признаков атипии (44%), сосудов и оксифильной субстанции (39%), некротических масс (22%), мелкозернистого детрита (17%), желчных пигментов (16%).
5. Высокий процент переходных типов нуклеолонемных ядрышек (98,30%) с преобладанием в них аргентофильных гранул крупных (38%) и средних (33%) градаций и наличие ядрышек компактного типа соответствуют высокой степени пролиферации и злокачественной трансформации клеток.
6. Подтверждением наличия малигнизации исследуемых клеток является также неравномерное распределение ВАГ по поверхности ядер, чаще в виде скоплений (30,3%), бороздок (20,6%), сочетания скоплений и бороздок (22,5%), скоплений и маргинального расположения (13,5%).
7. В отличие от ОК, в гепатоцитах условной нормы общее количество различных типов ядрышковых организаторов значительно меньше. Выявляемые в части клеток единичные ядрышки компактного типа отличаются мономорфностью. Определяется низкий процент нуклеолонемных ядрышек переходного типа (41%) с преобладанием пылевидно-точечных и мелких гранул (68%).
8. Выявленные квантитативные цитоморфологические и цитогенетические особенности клеток ГЦР являются объективными показателями, и их применение может способствовать повышению эффективности цитологической диагностики и своевременному началу специального лечения, улучшению прогноза заболевания.
Список использованной литературы
1. Гарин А.М., Базин И.С. (2003) Злокачественные опухоли пищеварительной системы. Инфомедиа паблишерз, Москва, 264 с.
2. Ершов В.А., Рылло А.Г., Сидорин В.С. (2007) Диагностика узловых образований печени в онкологической практике. Под ред. Г.М. Манихаса. СПб.
3. Ершов В.А., Вязовая А.Л., Наварская Р. (2009) Цитологические критерии цирроза-рака и цирроза печени человека. Клин. лаб. диагностика, 9: 43–48.
4. Колосов А.Е., Журавлёв В.А. (2002) Рак печени и прогноз для больных. СПб.
5. Усков Г.А., Лейбович Б.Е., Лобанов В.Л. (2003) Гистологическое исследование пункционных биоптатов печени и его роль в системном подходе к диагностике и лечению диффузных поражений органа. Новости клинической цитологии России, 7(1–2): 16–19.
6. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2016) Рак в Україні, 2014–2015. Бюл. Нац. канцер-реєстру України, № 17, 144 с.
7. Шапиро Н.А., Батароев Ю.К., Дворниченко В.В. (2012) Цитологическая диагностика опухолей печени, желчного пузыря и поджелудочной железы. Москва, 260 с.
8. Capell M.C. (Ed) (2005) Screening, prevention and treatment of esophageal, gastric and hepatic malignancies. Med. Clin., 89(2): 11–14.
9. Schreiner F.M., Yang Grace C.H. (2012) Hepatocellular carcinoma with striking rosette-like structures on smears. Diagn. Cytopathol., 40(11): 991–992.
10. Hamilton S.R., Aaltonen L.A. (Eds) (2000) Tumours of the liver and intrahepatic bile ducts. Pathology and genetics of tumours of the digestive system: World Health Organization classification of tumours. Lyon.
Адрес:
Туганова Тамара Николаевна
03022, Киев, Ломоносова, 33/43
Национальный институт рака
Тел.: 380 (44) 257-51-59














Leave a comment