Кісткова алопластика в разі хірургічного лікування пацієнтів з пухлинами довгих кісток
Вырва О.Е. 1, Головина Я.А.2, Малык Р.В.2
- 1ДУ «Інститут патології хребта та суглобів ім. проф. М.І. Ситенка НАМН України», Харків
- 2ГУ «Институт патологии позвоночника и суставов им. профессора М.И. Ситенко НАМН Украины», Харьков
Резюме. Адекватне відновлення функції ураженої пухлиною кінцівки є найважливішим завданням сучасної онкоортопедії. Існує велика кількість варіантів заміщення післярезекційних дефектів: від біологічних матеріалів до штучних ендопротезів. Кожен вид реконструкції має свої чіткі показання. Різні методики кісткової алопластики наразі широко використовуються в онкоортопедії. Проаналізовано результати лікування 74 пацієнтів з онкопатологією довгих кісток, що проходили лікування в клініці ДУ «Інститут патології хребта та суглобів ім. професора М.І. Ситенка НАМН України». Усім хворим проводили кісткову алопластику післярезекційних дефектів довгих кісток за різними методиками. Визначено показання до кожної методики заміщення післярезекційних дефектів кісток. Інфекційних ускладнень не відмічено в жодному випадку. Виявлено 2 випадки рецидиву пухлини та 1 — відсутності зрощення алотрансплантата та кістки реципієнта. Використання алокомпозитного ендопротезування дозволяє заміщати сегментарні кістково-суглобові дефекти, підвищувати стабільність ендопротеза, відновлювати резектовані ділянки кісткової тканини і скорочувати ризики повторних ревізійних оперативних втручань.
Резюме. Адекватное восстановление функции пораженной конечности — одна из самых важных задач современной онкоортопедии. Существует множество вариантов замещения пострезекционных дефектов костей и суставов: от биологических материалов до искусственных эндопротезов. Каждый метод имеет свои четкие показания. Различные методики костной аллопластики на данный момент широко используются в онкоортопедии. Проанализированы результаты лечения 74 пациентов с онкопатологией длинных костей, которые проходили лечение в клинике ГУ «Институт патологии позвоночника и суставов имени профессора М.И. Ситенко НАМН Украины». Всем больным проводили костную аллопластику пострезекционных дефектов длинных костей с использованием различных методик. Определены показания к каждой методике замещения пострезекционных дефектов костей. Инфекционных осложнений не отмечено. Выявлено 2 случая рецидива опухоли и 1 — отсутствия сращения аллотрансплантата и кости реципиента. Использование аллокомпозитного эндопротезирования позволяет замещать сегментарные костно-суставные дефекты, повышать стабильность эндопротеза, восстанавливать резецированные участки костной ткани и сокращать риски повторных ревизионных оперативных вмешательств.

Вступление
Проблема замещения пострезекционных дефектов длинных костей различных размеров и локализаций всегда была, есть и будет актуальной для ортопедов всего мира. Это связано с тем, что постоянно ведутся работы по углублению знаний о биологических особенностях и клиническом течении роста отдельных видов опухолей костей, развитию полихимиотерапии в лечении при злокачественных опухолях и, следовательно, повышению выживаемости пациентов. Адекватное восстановление функции пораженной конечности — одна из самых важных задач современной онкоортопедии. Существует множество вариантов замещения пострезекционных дефектов костей и суставов: от биологических материалов до искусственных эндопротезов. Каждый метод имеет свои четкие показания, свои достоинства и недостатки. Применение аллотрансплантатов остается одним из основных методов реконструкции костной ткани в костной онкологии. Сообщения о широком применении аллотрансплантации в лечении больных с опухолями костей встречаются в многочисленных зарубежных и отечественных источниках литературы. Используются различные варианты аллотрансплантатов: от костных «чипсов» до массивных структурных трансплантатов с сохранением на них мест прикрепления связок и сухожилий. Аллопластику в настоящее время все чаще сочетают с керамопластикой, костной аутопластикой, эндопротезами (аллокомпозитное эндопротезирование) [1–5].
В ГУ «Институт патологии позвоночника и суставов имени профессора М.И. Ситенко НАМН Украины» методика использования консервированных аллотрансплантатов берет свое начало от первой удачно проведенной операции Н.П. Новаченко в 1946 г. по поводу замещения дефекта нижней трети бедренной кости. В последующем эта идея была активно развита такими учеными, как А.А. Корж, В.Д. Чаклин, Р.Р. Талышинский, Н.И. Кузьмин и др., которые разработали и внедрили в практику «радикально-сохраняющие» операции. Особенно интересным представляется изучение вопросов наиболее раннего и эффективного восстановления функции конечности и суставов за счет модификации и усовершенствования оперативной техники, способов фиксации аллотрансплантатов к кости реципиента, разработки методов профилактики осложнений данного оперативного вмешательства. В нашем институте разработан способ консервирования аллотрансплантатов, что позволило значительно снизить процент инфекционных осложнений и добиться до 80% положительных результатов. Накопленный в институте опыт позволяет продолжать работу по применению биореконструктивных органосохраняющих операций при опухолевых процессах в костях [6–8].
Цель работы — проанализировать результаты различных видов хирургических вмешательств с использованием костных аллотрансплантатов, применяемых в ГУ «Институт патологии позвоночника и суставов имени профессора М.И. Ситенко НАМН Украины» в настоящее время.
Объект и методы исследования
В клинике института за период 2013–2016 гг. находились на лечении 74 пациента, у которых применяли костную аллопластику. Средний возраст больных составил 21,4±10,7 года (диапазон 3–68 лет). Распределение по полу было следующим: 52% мужчин и 48% женщин. Среди наиболее часто выявляемых нозологических единиц были аневризмальная костная киста (40 случаев), фиброзная дисплазия (15 пациентов), доброкачественные опухоли костей (14 случаев) и злокачественные костные опухоли (5 больных).
Из всех видов хирургических вмешательств с применением аллотрансплантатов в данной группе пациентов использовали: широкую резекцию (околосуставную) с замещением пострезекционного дефекта структурным кортикально-губчатым аллотрансплантатом (11 больных), пристеночную резекцию с замещением дефекта кости «чипсами» из костного аллотрансплантата (58 пациентов) и сегментарную резекцию кости с аллокомпозитным эндопротезированием (2 пациента) или замещением дефекта кости диафизарным аллотрансплантатом (3 пациента) (таблица).
Таблица. Виды хирургических вмешательств в зависимости от нозологической формы
| Диагноз | Пристеночная резекция + «чипсы» из костного аллотрансплантата | Широкая резекция + структурный аллотрансплантат | Сегментарная резекция кости + аллокомпозитное эндопротезирование | Сегментарная резекция кости + диафизарный аллотрансплантат |
| Костная киста | 38 | 2 | − | − |
| Фиброзная дисплазия | 11 | 4 | − | − |
| Доброкачественные опухоли | 9 | 5 | − | − |
| Злокачественные опухоли |
− | − | 2 | 3 |
| Всего | 58 | 11 | 2 | 3 |
Результаты
Показаниями к выполнению пристеночной резекции и замещения дефекта кости «чипсами» из аллотрансплантата являлось наличие доброкачественных опухолей и опухолеподобных заболеваний небольших размеров (менее половины поперечника кости) в пределах кортикального слоя кости. Техника операции традиционная: после выполнения пристеночной резекции, удаления опухоли производилось замещение образовавшейся полости «аллочипсами», импактируемыми в костный дефект очень плотно. Данная методика в некоторых случаях дополнялась керамопластикой (использовались гранулы гидроксилапатитовой керамики и/или блоки корундовой керамики) или аутотрансплантатами. Чаще такую комбинированную пластику применяли у более взрослых пациентов.
Клинический пример 1
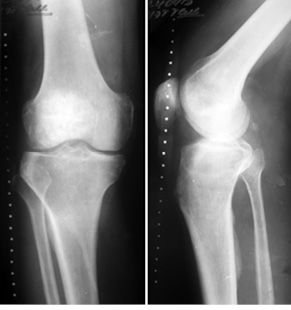
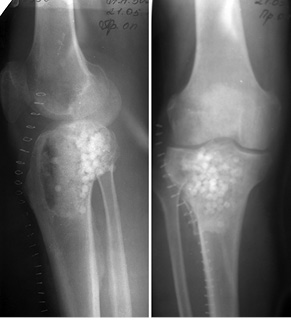
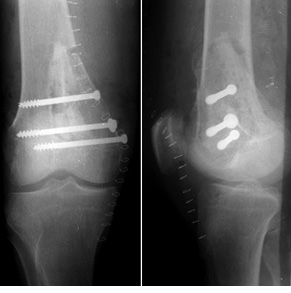
Пациент К., 40 лет, обратился в клинику с жалобами на боль в области проксимального отдела правой голени. Боль появилась после травмы (прямой удар) и беспокоила в течение 3 мес. На рентгенограммах и компьютерной томограмме правой голени определялся очаг литической деструкции верхней трети большеберцовой кости с четкими краями, без нарушения целостности кортикального слоя (рис. 1). По данным биопсии патологического очага, клинико-рентгенологическим данным установлен диагноз: аневризмальная костная киста проксимального отдела правой большеберцовой кости. Произведено оперативное вмешательство: пристеночная резекция, удаление образования, замещение пострезекционного дефекта верхней трети большеберцовой кости аллотрансплантатом («чипсами») в сочетании с комбинацией гранул гидроксилапатитовой керамики и корундового блока (рис. 2). В послеоперационный период производили иммобилизацию нижней конечности ортезом в положении максимального разгибания в течение 1 мес. После снятия иммобилизации — лечебная физкультура и разработка движений в коленном суставе. На контрольном осмотре через 1 год отмечается полная функция коленного сустава, на рентгенограммах — перестройка костно-керамического имплантата (рис. 3).
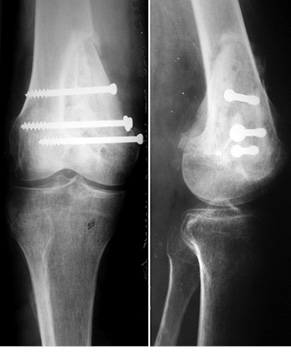
Показаниями к широкой резекции с замещением дефекта кости структурным аллотрансплантатом были доброкачественные опухоли больших размеров с поражением одного из кортикальных слоев кости или доброкачественные опухоли с агрессивным течением. Наиболее частой локализацией в данных случаях был дистальный метаэпифиз бедренной кости с эксцентричным расположением опухоли (преимущественное поражение одного из мыщелков). Выполнялось удаление опухоли путем широкой резекции с устранением пораженного мыщелка. Во всех случаях сохранялся суставной хрящ на пораженной стороне кости. Затем сформированный по размеру и форме дефекта кости структурный кортикально-губчатый аллотрансплантат плотно имплантировали в зону новообразования и фиксировали к материнскому ложу при помощи винтов.
Клинический пример 2
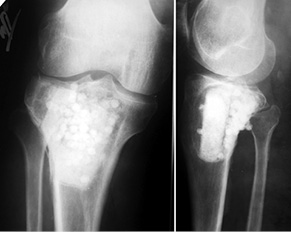
Пациент Б., 34 года, поступил в клинику с жалобами на боль в области нижней трети правого бедра. Симптомы появились без видимой причины и беспокоили на протяжении 3 мес. На рентгенограммах правого бедра определялась литическая ячеистая деструкция внутреннего мыщелка правой бедренной кости (рис. 4). Клинико-рентгенологически и патоморфологически установлен диагноз: липома внутреннего мыщелка правой бедренной кости. Произведена операция — широкая резекция, замещение пострезекционного дефекта внутреннего мыщелка бедренной кости структурным аллотрансплантатом с его фиксацией тремя винтами (рис. 5). Послеоперационный патоморфологический диагноз подтвердился. Иммобилизацию нижней конечности ортезом проводили также в течение 1 мес, после чего пациент прошел реабилитационное лечение. Через 6 мес после операции отмечается полное восстановление функции коленного сустава, на контрольных рентгенограммах — процесс консолидации аллотрансплантата с костью реципиента (рис. 6).
Показанием к выполнению сегментарной резекции кости и последующего аллокомпозитного эндопротезирования были злокачественные опухоли длинных костей с различным объемом поражения кости, но без большого мягкотканного компонента и без вовлечения в опухоль сосудисто-нервного пучка. Удаление опухоли производили согласно общепринятым правилам абластики, в виде сегментарной резекции «en block». Замещение пострезекционного дефекта выполняли массивным структурным аллотрансплантатом с дополнительным использованием индивидуального эндопротеза (при поражении метаэпифизарных зон костей) или интрамедуллярного стержня либо накостной пластины (при поражении диафизарных зон костей). Преимуществами данного метода биологической реконструкции дефектов костей являются: возможность заместить большие пострезекционные костно-суставные дефекты без использования массивных индивидуальных модульных эндопротезов, максимально сохранить костную ткань и быстро восстановить функцию пораженной конечности.
Клинический пример 3
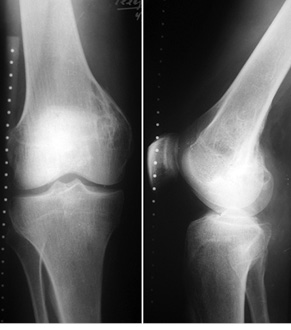
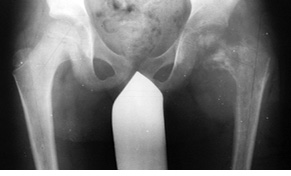
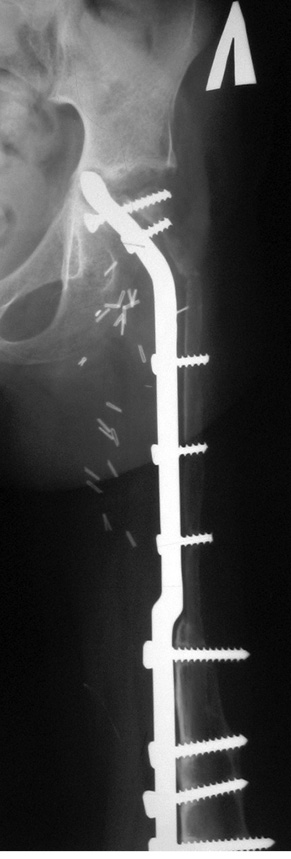
Пациент Я., 11 лет, поступил в клинику с жалобами на боль в области левого тазобедренного сустава, усиливающуюся при движениях. Из анамнеза известно, что в возрасте 5 лет у пациента диагностирована саркома Юинга проксимального отдела левой бедренной кости, T2N2M0, II клиническая группа, II стадия (рис. 7). Пациент прошел неоадъювантную полихимиотерапию, выполнена операция — удаление опухоли «en block», замещение пострезекционного дефекта верхней половины бедренной кости аутотрансплантатом (малоберцовой костью) и фиксацией его пластиной. После операции проведена адъювантная полихимиотерапия. Через 6 лет отмечается хороший онкологический результат (отсутствие метастазов и локальных рецидивов опухоли), однако зафиксированы лизис аутотрансплантата и миграция пластины в вертлюжную впадину (рис. 8). В институте произведено оперативное вмешательство: удаление пластины и фрагментов аутотрансплантата, индивидуальное аллокомпозитное эндопротезирование (рис. 9–11). Через год после операции на рентгенограммах отмечается полное сращение аллотрансплантата с костью реципиента (рис. 12), отсутствие клинических послеоперационных осложнений, укорочение левой нижней конечности, удовлетворительная функция левого тазобедренного сустава. В последующем пациенту планируется ревизионное эндопротезирование проксимальных ⅔ левой бедренной кости «растущей» конструкцией с использованием минимальных модулей эндопротеза. Аллокомпозитное эндопротезирование максимально позволило сохранить костную ткань диафиза бедренной кости.

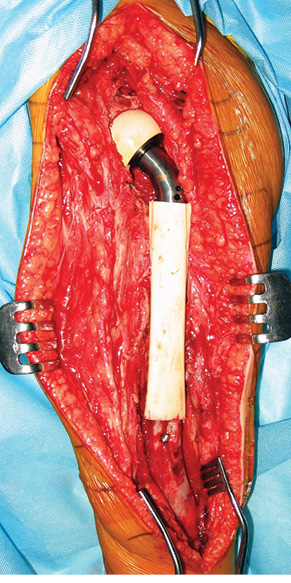
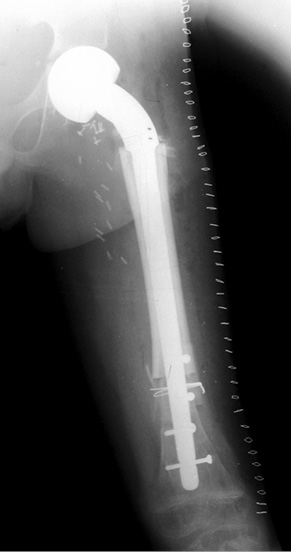
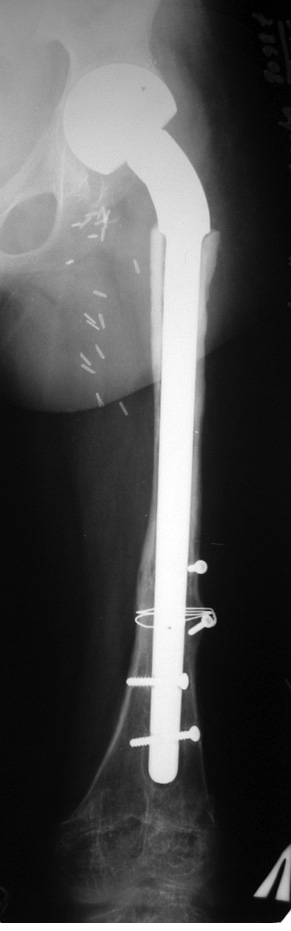
Клинический пример 4
Пациент М., 33 года, обратился в институт с жалобами на боль в области средней трети левого бедра. Из анамнеза известно, что первичное обращение за медицинской помощью было по месту жительства, где произведена биопсия патологического очага бедренной кости и стабилизация патологического перелома стержневым аппаратом внеочаговой фиксации (рис. 13). Пациент был направлен в клинику института. Установлен патоморфологический диагноз: злокачественная фиброзная гистиоцитома левой бедренной кости T2N2M0, II клиническая группа, II стадия. Проведена неоадъювантная полихимиотерапия. Выполнена операция — удаление опухоли «en block» (сегментарная резекция), замещение пострезекционного дефекта бедренной кости алло-, аутотрансплантатами. Из особенностей оперативного вмешательства: использовали структурный диафизарный аллотрансплантат, в который был помещен расщепленный аутотрансплантат из малоберцовой кости. Дополнительно вторая часть расщепленного аутотрансплантата была уложена снаружи и перекрывала зоны соединения аллотрансплантата и бедренной кости. Трансплантаты фиксировали к кости реципиента при помощи накостной пластины (рис. 14, 15). Иммобилизацию нижней конечности ортезом производили в течение 2 нед, до заживления раны. В послеоперационный период — разработка движений в коленном суставе, ограничение осевой нагрузки, адъювантная полихимиотерапия.
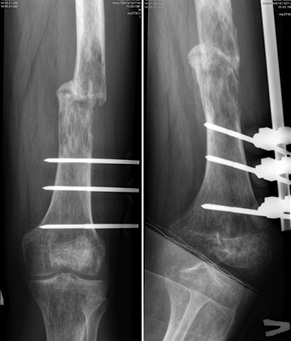
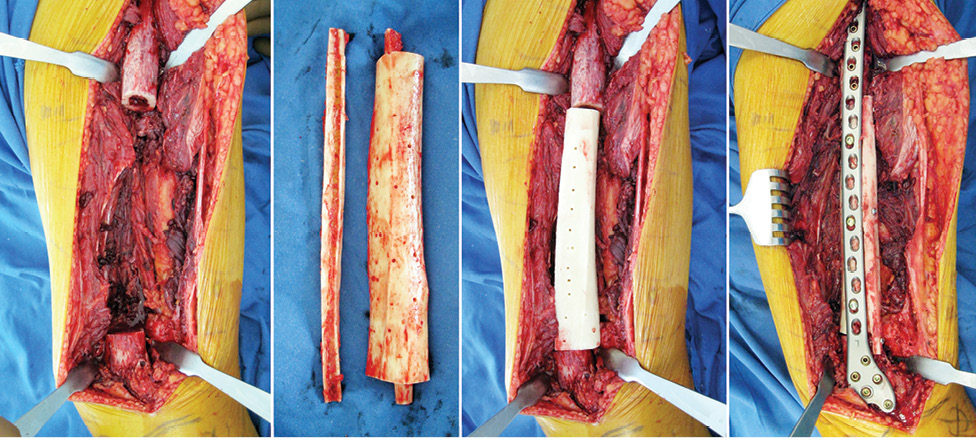
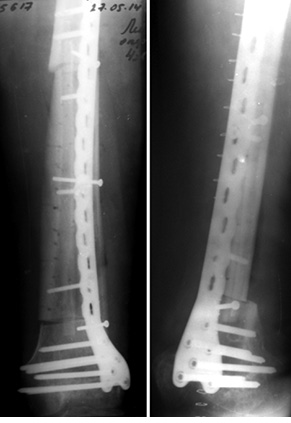
Во всех проанализированных 74 случаях инфекционных осложнений не зафиксировано, у 2 пациентов отмечали рецидив опухоли и рассасывание аллотрансплантата (оба случая с широкой резекцией мыщелка бедренной кости и аллопластикой), в 1 случае — отсутствие сращения аллотрансплантата с костью реципиента в зоне дистальной фиксации (при диафизарном дефекте большеберцовой кости).
Таким образом, применение аллопластики для замещения пострезекционных дефектов длинных костей у пациентов с опухолями костей получило свое дальнейшее развитие, а диапазон операций расширился за счет различных комбинаций аллотрансплантатов с керамическими имплантатами, металлоконструкциями и индивидуальными опухолевыми эндопротезами.
Основным условием успешной аллопластики при всех видах ее применения является плотное прилегание поверхности аллотрансплантата к ложу кости реципиента и стабильная его фиксация, что позволяет получить хорошее сращение трансплантата с материнским ложем и адекватную перестройку костной ткани в зоне дефекта.
Выводы
Аллопластика уже много десятилетий является одним из основных методов замещения пострезекционных дефектов длинных костей у пациентов с опухолевыми поражениями. За все время применения этого метода произошла его эволюция, были проанализированы различные осложнения и неудачи, разработаны показания к выполнению аллопластики в различных объемах и комбинациях — от костных «чипсов» до аллокомпозитного эндопротезирования.
Использование аллопластики имеет ряд преимуществ перед другими методами замещения дефектов костей: сокращение времени операции по сравнению с костной аутопластикой, возможность заместить значительные дефекты кости без применения эндопротеза, биологическая однородность трансплантата с ложем кости реципиента. А использование аллокомпозитного эндопротезирования позволяет замещать сегментарные костно-суставные дефекты, улучшать стабильность эндопротеза, восстанавливать резецированные участки костной ткани и сокращать риски повторных ревизионных оперативных вмешательств.
Таким образом, аллопластика в костной онкологии в настоящее время является актуальным, востребованным и современным методом биологической реконструкции пострезекционных дефектов костей практически любых размеров и локализаций. Применение каждого вида аллопластики по строгим показаниям, в комбинации с другими материалами и с учетом возможных осложнений позволяет получать положительные ортопедические и онкологические результаты хирургического и комплексного лечения пациентов с костными новообразованиями.
Список использованной литературы
1. Вырва О.Е., Головина Я.А., Малык Р.В. (2015) Аллокомпозитное эндопротезирование при хирургическом лечении пациентов со злокачественными опухолями длинных костей (обзор литературы). Ортопедия, травматология, протезирование, 2: 120–126.
2. Вырва О.Е., Бурлака В.В., Малышкина С.В., Никольченко О.А. (2012) Влияние различных видов покрытий имплантатов головки бедренной кости на ткани сустава. Ортопедия, травматология, протезирование, 2: 20–26.
3. Вырва О.Е., Делевский Ю.П., Кладченко Л.А., Димитрова Н.В. (2002) Анализ использования костных аллотрансплантатов в клинической практике. Ортопедия, травматология, протезирование, 2: 57–61.
4. Вирва О.Є. (2003) Кісткова алопластика післярезекційних пухлинних дефектів. Зб. наук. робіт інституту онкології АМН України «Злоякісні новоутворення», 7: 3.
5. Benedetti M.G., Bonatti E., Malfitano C., Donati D. (2013) Comparison of allograft reconstruction and modular prosthetic replacement in proximal femur bone tumors. Acta. Orthopaedica, 84(2): 218–223.
6. Bian D.J., Larousserie F., Thevenin F. et al. (2010) Results of 32 allograft-prosthesis composite reconstructions of the proximal femur. Clin. Orthop. Relat. Res., 468: 834–845.
7. Bullens P.H.J., de Waal Malefisit M.C., Schrender H.W.B. (2009) Survival of massive allografts in segmental oncological bone defect reconstructions. Int. Orthop. (SICOT), 33: 757–760.
8. Langlais F., Lambotte JC., Thomazeau C.P. (2003) Long-term results of allograft composite total hip prostheses for tumors. Clin. Orthop. Relat. Res., 414: 197–211.
Адрес:
Головина Янина Александровна
61024, Харьков, ул. Пушкинская, 80
ГУ «Институт патологии позвоночника и суставов им. М.И. Ситенко НАМН Украины», отдел костной онкологии
Тел.: (057) 704-14-77
E-mail: yanina_golovina@mail.ru














Leave a comment