Комплексне лікування пацієнтів з метахронними метастазами остеосаркоми: оптимізація лікувального алгоритму
Резюме. Проведено рандомізоване дослідження для вибору оптимального лікувального алгоритму у хворих з метахронними метастазами остеосаркоми (ОС) в легенях. 73 пацієнтів розподілено на 2 групи залежно від передопераційної хіміотерапії (ХТ) 2-ї лінії. Запропонованo оригінальний режим ХТ 2-ї лінії з використанням іфосфаміду, карбоплатину, етопозиду. Встановлено, що оптимальною тактикою лікування пацієнтів з метастазами ОС в легені є хірургічне втручання в обсязі видалення усіх метастатичних вузлів із подальшою ХТ альтернуючими блоками: карбоплатини/етопозид та іфосфамід/етопозид. Загальна 3-річна виживаність хворих у цій групі становила 41,9% з медіаною 24,6 міс проти 26,5% з медіаною 15,2 міс у групі хворих з перед- та післяопераційною ХТ за тією самою схемою. Аналіз рівня ускладнень показав зі статистичною достовірністю нижчі показники токсичності терапії 2-ї лінії в ад’ювантному режимі при збереженні її високої ефективності.
 Вступ
Вступ
За останні роки досягнуто значного прогресу в комплексному лікуванні хворих з первинною неметастатичною формою остеосаркоми (ОС). Агресивні схеми поліхіміотерапії дозволяють досягти 55–65% загальної 5-річної виживаності. Однак у 40% хворих розвиваються віддалені метастази у перші 2 роки після закінчення лікування, у 92% з них метастази виявляють у легенях.
Найактивнішими цитостатиками в лікуванні рецидивів ОС є іфосфамід, етопозид та карбоплатин [1–3]. Дослідження в рамках робочої групи Children’s Cancer Group показало, що використання таких цитостатичних агентів виявилося ефективним у 51% хворих, а у 27% пацієнтів відмічено повний терапевтичний ефект. У групі повних та часткових відповідей 2-річна виживаність досягла 40% [2].
Аналогічні результати представлені Memorial Sloan-Kettering Cancer Center. У роботі викладено результати лікування 43 пацієнтів з метастазами ОС в легенях: у 22 випадках отримано стійку ремісію з медіаною спостереження 15,2 міс. Але автор описує 3 випадки смерті під час проведення хіміотерапії (ХТ) через виражені цитотоксичні ускладнення [4].
Широкою популярністю в світі користується схема гемцитабіну з доцетакселом у лікуванні рецидиву ОС. Доказом цього є наявність вказаної комбінації цитостатиків в оновлених настановах ESMO та NCCN [5, 6]. Більшість повідомлень про результати із застосуванням схеми гемцитабін + доцетаксел базуються на незначній кількості включених пацієнтів, що, на думку деяких авторів, свідчить про недостовірність отриманих результатів досліджень [7]. X. Xiao та співавтори (2014) системно класифікували опубліковані дані різних схем ХТ 2-ї лінії (іфосфамід + етопозид, циклофосфамід + топотекан, гемцитабін + доцетоксел) за показниками часткової або повної відповіді та рекомендували використовувати комбінації на основі іфосфаміду та етопозиду (режим у пацієнтів з метастатичними, рецидивуючими та рефрактерними ОС) як найбільш ефективні [8].
Дискусійними залишаються також питання щодо застосування тільки хірургічного методу або комбінації ХТ та хірургічного видалення метастатичних вогнищ з легень. У дослідженні R.T. Schaller та співавторів (1982) із залученням 60 пацієнтів із метастазами ОС в легенях показали 5-річну загальну виживаність у 50% з використанням комбінації ХТ та метастазектомії порівняно з 24% — при використанні тільки хірургічного лікування [9]. Також за комбінацію ХТ та хірургії в лікуванні метастатичного рецидиву ОС висловлюються італійські автори: у спостереженні серед 162 хворих з метастазами 5-річної загальної виживаності досягли 40% пацієнтів, які одержували комбіноване лікування, і 12% хворих, у яких застосовували тільки хірургічне втручання [10].
Мета дослідження — на основі порівняльного аналізу двох режимів ХТ 2-ї лінії виявити оптимальний алгоритм в лікуванні пацієнтів з метахронними метастазами ОС.
Об’єкт і методи дослідження
У дослідження включено 73 хворих на ОС з метахронними метастазами в легені. Усі пацієнти шляхом рандомізації розподілені на дві групи залежно від схеми лікування. Перша група пацієнтів (n=34) отримала передопераційну ХТ альтернуючими курсами за схемою: карбоплатин 600 мг/м2 (по 300 мг/м2 — 2 дні), етопозид 300 мг/м2 (по 150 мг/м2 — 2 дні) — 1-й та 3-й курс; іфосфамід 9 г/м2 (по 3 г/м2 — 3 дні, месна 4 г/м2 — 4 дні), етопозид 300 мг/м2 (по 150 мг/м2 — 2 дні) — 2-й курс з інтервалом 21 день з подальшим хірургічним лікуванням та післяопераційною ХТ за аналогічною схемою. Друга група (n=39) — без передопераційної ХТ, а тільки хірургічне лікування та післяопераційна ХТ зазначеними препаратами.
Після завершення передопераційної ХТ пацієнтам першої групи проведено комп’ютерну томографію та оцінку відповіді на терапію згідно зі стандартними критеріями RECIST 1.1 [11].
Чоловіків було 45 (61,64%), жінок — 28 (38,36%). Середній вік хворих на момент встановлення діагнозу становив 18,58 року (від 6 до 60 років) (табл. 1). Середній термін виявлення метастазів в легенях після закінчення основного лікування становив 20,37 міс (6–118 міс). Медіана метастазування в легені — 16,2 міс.
Таблиця 1. Порівняльна характеристика пацієнтів у групах
|
Показники, що аналізуються |
Перша група (з передопераційною ХТ), n=34 |
Друга група (без передопераційної ХТ), n=39 |
||
| Вік, років | 19,4 | 22,5 | ||
Стать:
|
n | % | n | % |
|
|
|
|
|
| Стадія процесу ІІB | 34 | 100,00 | 39 | 100,00 |
Локалізація пухлини, кістка:
|
|
|
|
|
Кількість метастазів:
|
|
|
|
|
Локалізація метастазів у легені:
|
|
|
|
|
Середній термін спостереження в обох групах сягав 28,76±3,73 міс (1–178 міс).
У дослідженні оцінено частоту та вираженість токсичних проявів після проведення ХТ 2-ї лінії лікування згідно з критеріями Американської асоціації онкологів — Common Terminology Criteria for Adverse Events (CTCAE v 4.0).
Аналіз показників виживаності хворих проводили за методом Каплана — Мейєра. Достовірність у двох групових порівняннях визначали за t-критерієм Стьюдента (якщо дані були розподілені нормально) та непараметричним критерієм χ2 Пірсона або Т-критерієм Вілкоксона (у разі, якщо розподіл даних не узгоджувався з нормальним). Розбіжності вважали істотними при рівні р<0,05. Для розрахунків використовували програми MS Excel та Statistica 6.0.
Результати та їх обговорення
У 28 (82,36%) хворих першої групи зареєстровано стабілізацію процесу. Повного рентгенологічного ефекту не досягнуто у жодного з пацієнтів. Після двох курсів ХТ у 4 (11,76%) хворих першої групи на фоні ХТ 2-ї лінії відмічено прогресування у вигляді появи нових вогнищ пухлинного процесу та збільшення розміру попередніх. Частковий ефект виявлено у 2 (5,88%) пацієнтів у вигляді зменшення діаметра метастатичних вузлів більш ніж на 30% порівняно з попередніми зображеннями комп’ютерної томографії (табл. 2).
Таблиця 2. Відповідь на ХТ 2-ї лінії за критеріями RECIST
| Критерій ефекту за RECIST | Кількість пацієнтів (n=34) | |
| n | % | |
| Прогресування | 4 | 11,76 |
| Стабілізація | 28 | 82,36 |
| Частковий ефект | 2 | 5,88 |
| Повний ефект | 0 | 0,00 |
Серед 4 хворих, у яких зафіксовано прогресування після проведення передопераційної ХТ, хірургічне лікування виконано у двох. Два пацієнти були визнані неоперабельними через значне ураження паренхіми легень метастатичним процесом, надалі проходили курс променевої терапії та одержували альтернативні схеми ХТ. Жоден пацієнт, у якого виявлено прогресування на фоні ХТ 2-ї лінії, не залишився живим до закінчення дослідження, а середній термін спостереження становив 8,6 міс.
Усі пацієнти першої групи, у яких відбулася регресія або стабілізація патологічного процесу на фоні ХТ, пройшли хірургічне лікування в обсязі метастазектомії (атипова резекція легень). Усього в дослідженні в обох групах виконано хірургічне лікування у 71 пацієнта з приводу метастатичного ураження легень ОС, із них у 32 (45,07%) хворих першої групи та у 39 (54,93%) — другої.
З-поміж усіх прооперованих (n=71) пацієнтів у 26 (36,62%) виявлено повторний розвиток метастазів у легенях через 9–14 міс. Їх прооперували повторно. 58 (81,70%) хворих перебували в ремісії більш ніж 12 міс: 26 (36,62%) пацієнтів з першої групи та 32 (45,08) — з другої.
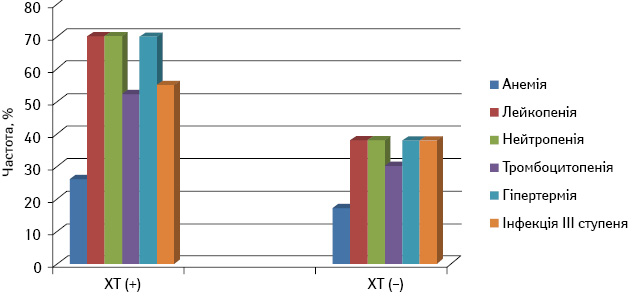
Аналіз результатів лікування 73 пацієнтів показав, що рівень тяжких проявів токсичності після ХТ не перевищував 29,4%. Найбільш значущими проявами токсичності були гематологічні. При порівнянні частоти токсичних побічних ефектів ХТ у двох групах виявлено достовірну різницю: лейкопенія та гранулоцитопенія III–IV ступеня розвинулися у 70,59% пацієнтів першої групи та 38,46% — другої. Фебрильну нейтропенію у першій групі виявлено у 29,41%, а в другій — у 15,38% осіб. Частота тромбоцитопеній III ступеня становила 52,94 та 30,77% відповідно. Кровотеч на фоні тромбоцитопенії не діагностовано в жодного пацієнта. Явища анемії відмічено у 26,47 та 17,95% випадків в обох групах з рівнем гемоглобіну <80 г/л. У табл. 3 представлено прояви гематологічної токсичності III–IV ступеня в обох групах.
Таблиця 3. Порівняння проявів токсичності III–IV ступеня у досліджуваних групах
| Критерії токсичності | Ступінь токсичності III–IV | |||||
| Перша група | Друга група | χ | p | |||
| n | % | n | % | |||
| Анемія | 9 | 26,47 | 7 | 17,95 | 0,77 | 0,19 |
| Лейкопенія | 24 | 70,59 | 15 | 38,46 | 7,535 | 0,003 |
| Нейтропенія | 24 | 70,59 | 15 | 38,46 | 7,535 | 0,003 |
| Тромбоцитопенія | 18 | 52,94 | 12 | 30,77 | 3,689 | 0,027 |
| Стоматит | 24 | 70,59 | 15 | 38,46 | 7,535 | 0,003 |
| Гіпертермія | 24 | 70,59 | 15 | 38,46 | 7,535 | 0,003 |
| Інфекція | 19 | 55,87 | 15 | 38,46 | 2,215 | 0,06 |
Співвідношення найважливіших проявів токсичності III–IV ступеня у хворих обох груп упродовж лікування відображено на рис. 1.
Загальна 3-річна виживаність у групі з передопераційною ХТ сягала 30,3% з медіаною виживаності 15,2 міс, у групі без передопераційної ХТ — 41,9% з медіаною виживаності 24,4 міс (р=0,02) (рис. 2).
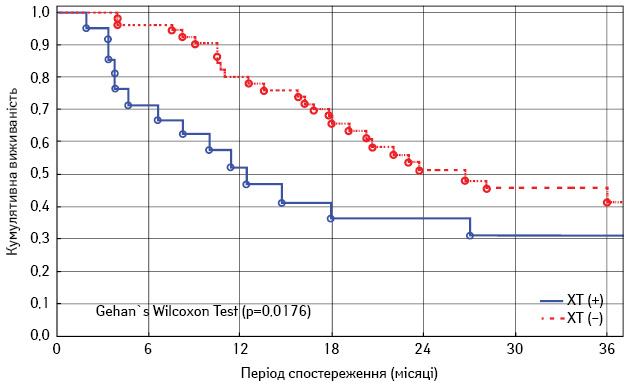
Таким чином, порівнюючи результати лікування пацієнтів з метастазами ОС в легенях, яким проведено передопераційну ХТ, з групою без передопераційної ХТ, ми отримали достовірну різницю в 3-річній виживаності хворих.
Висновки
1. Оптимальним алгоритмом комбінованого лікування пацієнтів із метахронними метастазами ОС в легенях є хірургічне лікування з подальшою післяопераційною ХТ (загальна 3-річна виживаність 41,9% проти 30,3% у хворих з передопераційною ХТ (р=0,02) та медіаною виживаності 24,4 та 15,2 міс відповідно).
2. Альтернуючі блоки ХТ 2-ї лінії карбоплатин + етопозид та іфосфамід + етопозид мають помірну токсичність, що дозволяє виконувати увесь запланований обсяг лікування. Доведено достовірну різницю в проявах гематологічної токсичності запропонованих режимів ХТ: 44,52% — у передопераційному режимі проти 25,6% — в післяопераційному (χ=10,81; р<0,05).
Список використаної літератури
1. Angiolillo L., Krailo M., Laver J. et al. (2004) A comparison of rhTPO and rhIL-11 following ifosfamide (I), carboplatin (C) and etoposide (E) (ICE) in pediatric patients with recurrent solid tumors or lymphoma. Proc. ASCO: Abstr. 8535.
2. Van Winkle P., Angiolillo A., Krailo M. et al. (2005) Ifosfamide, carboplatin, and etoposide (ICE) reinduction chemotherapy in a large cohort of children and adolescents with recurrent/refractory sarcoma: the Children’s Cancer Group (CCG) experience. Pediatr. Blood. Cancer, 44: 338–347.
3. Weigel B.J., Thompson R.C., Clohisy D. et al. (1998) Successful treatment of high risk relapsed osteogenic sarcoma with ifosfamide, carboplatin and etoposide. Proc. ASCO; Abstr. 2015.
4. Chou A.J., Merola P.R., Wexler L.H. et al. (2005) Treatment of osteosarcoma at first recurrence after contemporary therapy: The Memorial Sloan-Kettering Cancer Center experience. Cancer (Philad.), 104: 2214–2221.
5. Bone Cancer. In: NCCN Clinical Practice Guidelines in Oncology. National Comprehensive Cancer Network, Ink. Version 2.2015; 2015.
6. Hogendoorn PCW, Athanasou N., Bielack S. et al. (2010) Bone sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 21 (Suppl. 5): v204–213.
7. Navid F., Willert J.R., McCarville M.B. et al. (2008) Combination of gemcitabine and docetaxel in the treatment of children and young adults with refractory bone sarcoma. Cancer, 113: 419–425.
8. Xiao X., Wang W., Wang Z. et al. (2014) The role of chemotherapy for metastatic, relapsed and refractory osteosarcoma. Paediatr. Drugs, 16: 503–512.
9. Schaller R.T. Jr., Haas J., Schaller J. et al. (1982) Improved survival in children with osteosarcoma following resection of pulmonary metastases. J. Pediatr. Surg., 17: 546–550.
10. Ferrari S., Briccoli A., Mercuri M. et al. (2003) Postrelapse survival in osteosarcoma of the extremities: Prognostic factors for long-term survival. J. Clin. Oncol., 21: 710–715.
11. Eisenhauera E.A., Therasseb P., Bogaertsc J. et al. (2009) New response evaluation criteria in solid tumours: Revised RECIST guideline. Eur. J. Cancer, 45: 228–247.
Комплексное лечение пациентов с метахронными метастазами остеосаркомы: оптимизация лечебного алгоритма
Национальный институт рака, Киев
Резюме. Проведено рандомизированное исследование для выбора оптимального лечебного алгоритма у больных с метахронными метастазами остеосаркомы (ОС) в легких. 73 пациента разделены на 2 группы в зависимости от предоперационной химиотерапии (ХТ) 2-й линии. Предложено оригинальный режим ХТ 2-й линии с использованием ифосфамида, карбоплатина, этопозида. Установлено, что оптимальной тактикой лечения пациентов с метастазами ОС в легкие является хирургическое вмешательство в объеме удаления всех метастатических узлов с последующей ХТ альтернирующими блоками: карбоплатин + этопозид и ифосфамид + этопозид. Общая 3-летняя выживаемость больных в данной группе составила 41,9% с медианой 24,6 мес против 26,5% с медианой 15,2 мес в группе больных с пред- и послеоперационной ХТ по той же схеме. Анализ уровня осложнений показал со статистической достоверностью низкие показатели токсичности терапии 2-й линии в адъювантной режиме при сохранении высокой эффективности.
остеосаркома, метастазы в легкие, химиотерапия 2-й линии.
Адреса:
Дєдков Анатолій Григорович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: an.dedkov@gmail.com














Leave a comment