Iмунотерапія генералізованої меланоми шкіри
Кукушкина М.Н., Коровин С.И., Кукушкина С.Н., Паливец А.Ю., Остафийчук В.В., Дедков А.Г.
Резюме. Прорив в імунотерапії злоякісних пухлин, що стався в останні роки, пов’язаний із розумінням механізмів взаємодії між пухлиною та імунною системою, особливостей Т-клітинної регуляції і зі створенням препаратів, що вибірково діють на компоненти цього процесу. Одним з найбільш перспективних в аспекті застосування імунотерапії онкологічних захворювань є меланома шкіри, що зумовлено високою імуногенністю пухлини та мутаційним навантаженням.
Резюме. Прорыв в иммунотерапии злокачественных опухолей, произошедший в последние годы, связан с пониманием механизмов взаимодействия между опухолью и иммунной системой, особенностей Т-клеточной регуляции и с созданием препаратов, избирательно действующих на компоненты этого процесса. Одним из наиболее перспективных в аспекте применения иммунотерапии онкологических заболеваний является меланома кожи, что обусловлено высокой иммуногенностью опухоли и мутационной нагрузкой.
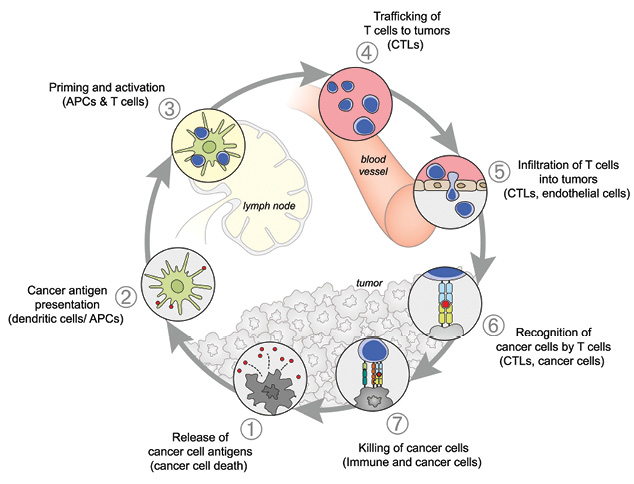
 Согласно современным представлениям, для развития противоопухолевого иммунного ответа, приводящего к уничтожению опухолевых клеток, должна произойти серия последовательных событий, которые получили название «цикл рак — иммунитет» (cancer — immunity cycle) [1]. Он состоит из 7 этапов и включает в себя:
Согласно современным представлениям, для развития противоопухолевого иммунного ответа, приводящего к уничтожению опухолевых клеток, должна произойти серия последовательных событий, которые получили название «цикл рак — иммунитет» (cancer — immunity cycle) [1]. Он состоит из 7 этапов и включает в себя:
1. Выброс опухолевых антигенов и их захват дендритными клетками для последующего процессинга. На этом этапе для развития специфического противоопухолевого Т-клеточного иммунного ответа и во избежание формирования периферической толерантности к опухолевым антигенам необходим ряд сигналов, таких как провоспалительные цитокины, факторы, высвобождающиеся при гибели опухолевых клеток или микрофлоры кишечника.
2. Презентация опухолевых антигенов с участием молекул главного комплекса гистосовместимости I и II класса дендритными клетками Т-лимфоцитам.
3. Праймирование и активация эффекторного Т-клеточного иммунного ответа против опухолеспецифических антигенов, распознаваемых как чужеродные или к которым сформировалась неполная толерантность.
4. Перемещение активированных эффекторных Т-лимфоцитов к очагу опухолевого роста.
5. Инфильтрация опухоли Т-лимфоцитами.
6. Специфическое распознавание и связывание Т-лимфоцитами опухолевых клеток, происходящие путем взаимодействия Т-клеточного рецептора и соответствующего опухолевого антигена, встроенного в молекулу главного комплекса гистосовместимости I класса.
7. Киллинг опухолевых клеток, приводящий к выбросу новых опухолеассоциированных антигенов, то есть к 1-му этапу и, как следствие, к усилению ответа в последующих циклах (рис. 1).
Для активации Т-клеток необходимо: 1) распознавание антигена (в том числе опухолевого), представляемого антигенпрезентирующими клетками (АПК), Т-клеточным рецептором; 2) связывание рецепторов костимуляции (CD28), экспрессируемых на Т-лимфоцитах, с активирующими их В7-1 (CD80) и В7-2 (CD86) костимулирующими молекулами АПК.
Конкурентная активация Т-клеточного рецептора и CD28 приводит к индукции сигналов в ядре Т-клетки и ее активации.
Инактивация Т-клеток, предотвращающая развитие аутоиммунных процессов, также осуществляется 2 путями:
- экспрессией CTLA-4 (антигена цитотоксического Т-лимфоцита 4) рецепторов на поверхности Т-клеток после их активации, которые связываются с В7 на АПК, подавляя таким образом сигналы к ядру Т-клеток;
- экспрессией PD-1 (рецептора программируемой клеточной гибели 1) на поверхности Т-клетки, которые затем связываются с лигандами PD-L1 или PD-L2 в опухолевой ткани (как на иммунокомпетентных, так и опухолевых клетках) [2].
Таким образом, CTLA-4 играет важную роль в ранней фазе иммунного ответа, реализующейся в периферических иммунных органах (лимфатических узлах и селезенке), в то время как PD-1 приобретает свое значение в поздней фазе, которая развивается непосредственно в периферических тканях, включая опухоль (рис. 2).

Подавление CTLA-4, либо PD-1, либо PD-L1 приводит к стимуляции противоопухолевого иммунного ответа. Это явление получило название «блокада контрольных точек» (checkpoint blockade), а препараты, подавляющие вышеуказанные рецепторы и лиганды, — «ингибиторы контрольных точек».
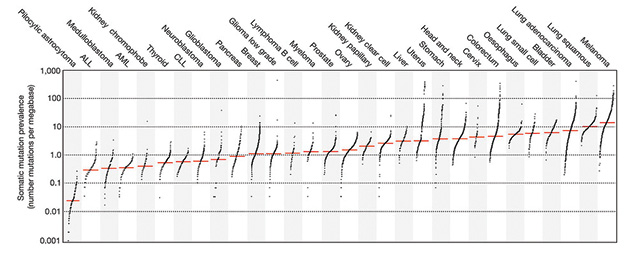
Одним из наиболее перспективных для иммунотерапевтического воздействия онкологических заболеваний является меланома кожи (МК), что обусловлено высокой иммуногенностью опухоли. Подтверждением тому является высокая частота спонтанных регрессий меланомы; возникновение паранеопластической депигментации, ассоциированной с продолжительным течением метастатического процесса; развитием витилиго на фоне иммунотерапии; наличием в гистологических препаратах удаленных диспластических невусов и первичной меланомы лимфоидной инфильтрации; данные иммунологических исследований свидетельствуют о существовании гуморального и клеточного иммунитета против аутологичной меланомы [3]. Кроме того, МК, наряду с немелкоклеточным раком легкого, характеризуется высокой мутационной нагрузкой, что обусловливает продукцию большего числа неоантигенов, а это, в свою очередь, усиливает иммунный ответ (рис. 3) [4].
Анти-CTLA-4
Первым ингибитором контрольных точек, зарегистрированным для лечения генерализованной МК, стал ипилимумаб, представляющий собой человеческое анти-CTLA-4 моноклональное антитело IgG1 изотипа, которое подавляет взаимодействие CTLA-4 с молекулами В7.1 и В7.2. Препарат одобрен Управлением по контролю качества пищевых продуктов и медикаментов США (US Food and Drug Administration — FDA) для лечения метастатической или нерезектабельной меланомы в 2011 г. на основании исследования III фазы MDX010-20, в котором пациенты были рандомизированы в 3 группы: одна из них получала ипилимумаб по 3 мг/кг внутривенно каждые 3 нед 4 раза, вторая — пептидную вакцину gp100, третья — оба препарата. Объективный ответ отмечен в группе ипилимумаба у 10,9% больных, в группе вакцины — у 1,5% пациентов и в группе, получавшей оба препарата, — у 5,7%. Однолетняя общая выживаемость (ОВ) составила 45,6; 25,3 и 43,6%, а 2-летняя ОВ — 23,5; 13,7 и 21,6% соответственно. При этом у части больных констатирована псевдопрогрессия заболевания на фоне терапии ипилимумабом с последующей регрессией опухолевых очагов [5].
У 60% пациентов, получавших терапию ипилимумабом, отмечены иммуноопосредованные побочные явления, при этом у 10–15% больных они достигали III–IV степени. Чаще всего развивались поражения кожи, желудочно-кишечного тракта и эндокринных органов. Для их купирования требовалось применение кортикостероидов, реже — инфликсимаба (моноклональное антитело к фактору некроза опухоли α), что, однако, не препятствовало развитию противоопухолевого ответа. В процессе лечения отмечена четкая корреляция между возникновением иммуноопосредованных побочных явлений и ответом опухоли на проводимую терапию.
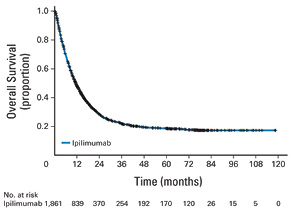
Объединенный анализ долгосрочных результатов выживаемости в исследованиях ипилимумаба II и III фазы, включавший 1861 больного, показал, что медиана ОВ составила 11,4 мес, а 3-летняя выживаемость — 22%. При этом после 3 лет на кривой выживаемости начинается плато, которое сохраняется в течение последующих 10 лет (рис. 4) [6].
Данный вид лечения оказался эффективным и при метастазах меланомы в головной мозг: 1- и 2-летняя выживаемость пациентов c асимптоматическими метастазами составила 31 и 26% соответственно, а с симптоматическими — 19 и 10% соответственно [7].
Представляют интерес данные о повторном применении ипилимумаба при генерализованной МК. Среди 855 пациентов, включенных в исследование ЕАР, у 51 (6,0%) отмечена прогрессия заболевания после предшествующей стабилизации либо регрессии. После повторной терапии ипилимумабом у 6 (12,8%) из них развилась частичная регрессия, а у 19 (40,8%) отмечена стабилизация заболевания [8].
В 2015 г. ипилимумаб был одобрен FDA в качестве адъювантной терапии МК III стадии после выполнения радикальной регионарной лимфодиссекции. В плацебо-контролируемом исследовании III фазы EORTC 18071 медиана безрецидивной выживаемости больных с метастазами в регионарных лимфатических узлах, получавших ипилимумаб после лимфодиссекции, составила 26,1 мес, а пациентов, применявших плацебо, — 17,1 мес [9]. Спустя год были опубликованы результаты 5-летней общей и безрецидивной выживаемости. Пятилетняя ОВ в группе ипилимумаба составила 65,4%, а в группе плацебо — 54,4%; 5-летняя безрецидивная выживаемость — 40,8 и 30,3% соответственно [10]. Следует отметить, что на сегодня ипилимумаб является единственным ингибитором контрольных иммунных точек, разрешенным к применению в адъювантном режиме.
Анти-PD-1
В 2014 г. для лечения генерализованной МК зарегистрированы препараты, направленные на увеличение противоопухолевого Т-клеточного ответа на опухолеспецифическом уровне путем блокирования взаимодействия PD-1 с PD-L1 и PD-L2, а также предотвращения Т-клеточной инактивации.
Первым анти-PD-1 препаратом, получившим одобрение FDA в сентябре 2014 г., стал пембролизумаб, представляющий собой гуманизированное моноклональное антитело IgG4 изотипа.
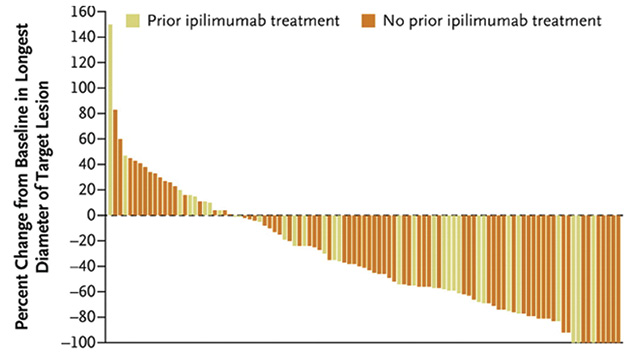
В открытое мультикогортное исследование Ib фазы KEYNOTE-001 было включено 655 больных МК, как леченных ипилимумабом, так и наивных. В частности, в одной из рандомизированных когорт исследования участвовали 173 пациента с генерализованной МК с прогрессией заболевания после лечения ипилимумабом. Пациенты получали пембролизумаб в дозе 2 мг/кг либо 10 мг/кг каждые 3 нед. Первичной конечной точкой исследования был объективный ответ, который составил 26% в обеих группах, при этом у 70% больных отмечено уменьшение размеров таргетных очагов поражения (рис. 5). Однолетняя выживаемость без прогрессии в обеих группах составила 57%. Наиболее распространенными проявлениями токсичности при дозе 2 мг/кг либо 10 мг/кг были: утомляемость (33 и 37% соответственно), зуд (26 и 19% соответственно) и сыпь (18% в обеих группах) [11, 12].
В 2016 г. опубликованы обновленные результаты исследования KEYNOTE-001, медиана наблюдения в котором составила 21 мес [13]. Показано, что применение пембролизумаба вызывает объективный ответ у 33% больных, 12-месячная выживаемость без прогрессии составляет 35%, а медиана ОВ — 23 мес. У ранее нелеченных пациентов эти показатели несколько лучше и составляют 45%, 52% и 31 мес соответственно. Полная и частичная регрессия опухоли у больных, не леченных ипилимумабом, составляет 39%, в то время как ответ у пациентов, получавших данную терапию, — 29%. Тем не менее, авторы не считают, что предшествующую терапию ипилимумабом можно рассматривать в качестве предиктора ответа на пембролизумаб, и полагают, что наибольшее значение имеет размер опухоли в начале лечения, что подтверждается данными аналогичных исследований [14].
Терапия пембролизумабом, как и лечение ипилимумабом, характеризуется формированием плато кривой выживаемости после 3 лет наблюдения. Многообещающим фактором являются данные, что у 59 (97%) из 61 пациента, получавших пембролизумаб в исследовании KEYNOTE-001 и достигших полной регрессии опухоли, результат сохранился и после прекращения терапии.
В исследовании KEYNOTE-002 изучали эффективность терапии пембролизумабом в дозах 2 мг/кг или 10 мг/кг по сравнению с химиотерапией у больных генерализованной МК с прогрессией опухолевого процесса после лечения ипилимумабом и ингибиторами BRAF-мутации (у больных с положительной BRAF-мутацией). Объективный ответ составил 21 и 25% в группах, получавших пембролизумаб в дозах 2 мг/кг и 10 мг/кг соответственно, в то время как в группе химиотерапии — 4%. Шестимесячная выживаемость без прогрессии составила 34; 38 и 16% соответственно. Таким образом, доказано преимущество применения пембролизумаба перед химиотерапией после неудачного лечения ипилимумабом.
Как и в предыдущем исследовании, наиболее распространенными проявлениями токсичности в группе пембролизумаба были утомляемость, зуд и сыпь в отличие от группы химиотерапии, где превалировали утомляемость, тошнота, рвота, анемия и алопеция. Токсичность III–IV степени отмечена у 26% пациентов, получавших химиотерапию, и у 11 и 14% больных, применявших пембролизумаб в дозах 2 и 10 мг/кг соответственно [15].
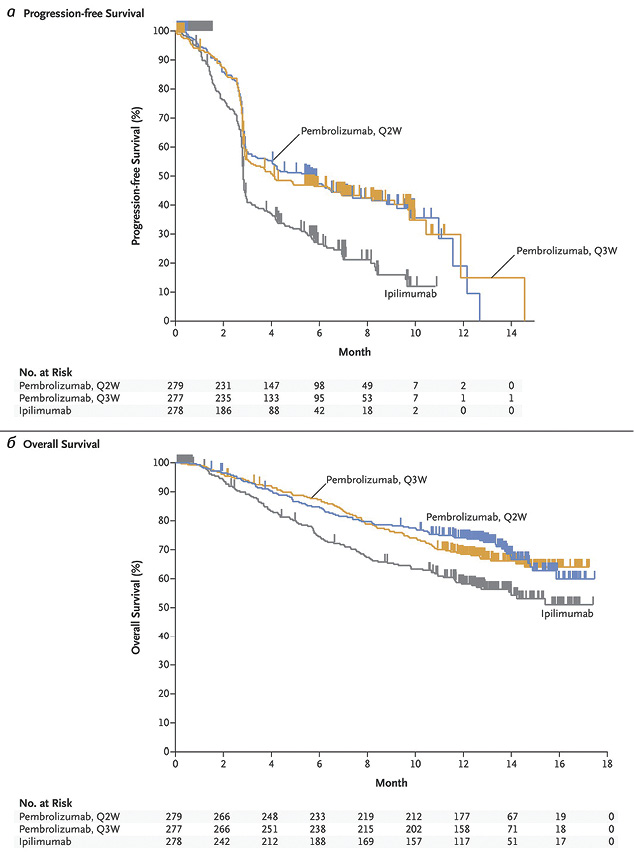
В 2015 г. опубликованы результаты исследования III фазы KEYNOTE-006, в котором больных рандомизировали в три группы в соотношении 1:1:1. Две из них получали пембролизумаб в дозе 10 мг/кг каждые 2 или 3 нед, а третья — ипилимумаб в дозе 3 мг/кг каждые 3 нед, 4 введения. Первичными конечными точками исследования были выживаемость без прогрессии и ОВ. Шестимесячная выживаемость без прогрессии в группах пембролизумаба была практически одинаковой и составила 47,3 и 46,4%, а в группе ипилимумаба — 25,6%. При этом преимущество пембролизумаба над ипилимумабом отмечено независимо от экспрессии PD-L1 в опухолевой ткани. Однолетняя ОВ составила 74,1% при приеме пембролизумаба каждые 2 нед, 68,4% — при применении пембролизумаба каждые 3 нед и 58,2% — при приеме ипилимумаба (рис. 6). Объективный ответ отмечен в 33,7; 32,9 и 11,9% случаев соответственно, продолжаясь у подавляющего большинства пациентов (89,4; 96,7 и 87,9% соответственно) при медиане наблюдения 7,9 мес. Нежелательные явления III–V степени чаще регистрировали в группе ипилимумаба (19,9%), чем в группах пембролизумаба (13,3 и 10,1%) [16].
Другим анти-РD-1 моноклональным антителом является ниволумаб. В исследовании препарата I фазы принимали участие 107 больных генерализованной МК, из которых 25% получили 3 и более линии предшествующей системной терапии. Лечение назначали в дозах 0,1–10 мг/кг в виде инфузий каждые 2 нед в 8-недельном цикле. Частота объективного ответа в целом составила 31%, а у больных, получавших 3 мг/кг, — 41%. Примерно в 5% случаев развилась псевдопрогрессия заболевания, обусловленная инфильтрацией опухолевых очагов Т-лимфоцитами и натуральными киллерами. Примечательно, что у ряда больных (12 из 17), у которых лечение было прекращено по причинам, отличным от прогрессии заболевания, продолжалась регрессия опухоли даже после прекращения терапии. Медиана выживаемости без прогрессии составила 3,7 мес (9,7 мес при дозе 3 мг/кг), медиана продолжительности ответа — 24 мес (17,3 мес при дозе 3 мг/кг), а медиана ОВ — 16,8 мес (20,3 мес при дозе 3 мг/кг) [17].
Токсические явления отмечены у 82% больных и включали в себя усталость, сыпь, зуд и диарею. У 21% пациентов развилась токсичность III–IV степени в виде лимфопении, усталости, тошноты, диареи и анемии. Не выявлено четкой зависимости между дозой препарата и его токсичностью, однако доза 3 мг/кг была выбрана как наиболее эффективная для исследования III фазы по сравнению ниволумаба и дакарбазина в качестве первой линии терапии [18].
Одним из перспективных направлений иммунотерапии является использование комбинации анти-PD1 и анти-CTLA-4, что подтверждено данными исследования CheckMate 067, в котором пациентов рандомизировали на 3 группы: одна из них получала комбинацию ниволумаба и ипилимумаба, другая — ниволумаб и третья — ипилимумаб. Наиболее эффективным оказалось применение комбинации ниволумаба и ипилимумаба: при их одновременном использовании регрессия опухоли ≥80% зафиксирована у 40% больных, при этом в 17% случаев отмечена полная регрессия; медиана выживаемости без прогрессии составила 11,5 мес в группе ниволумаба и ипилимумаба, 6,9 мес — в группе ниволумаба и 2,9 мес — в группе ипилимумаба (рис. 7).
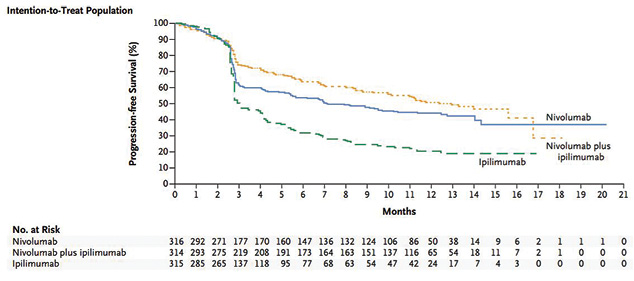
В то же время нежелательные явления при одновременном назначении препаратов развивались раньше и протекали тяжелее. Различные проявления токсичности зафиксированы у 98% пациентов, III–IV степени — у 53%, в 20% случаев требовали прекращения лечения [19, 20].
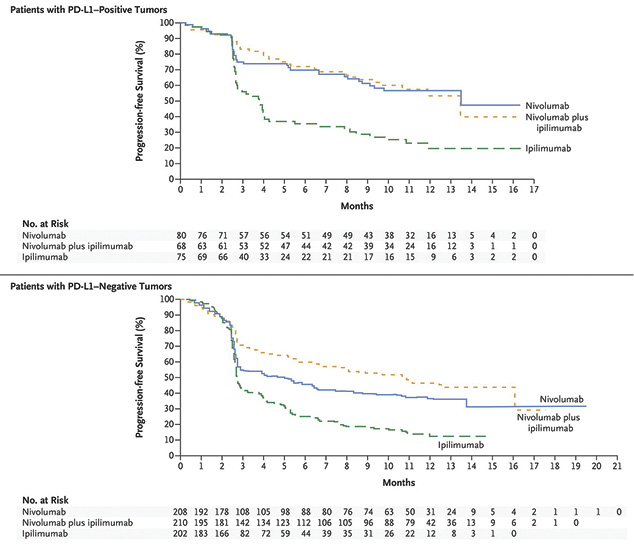
Примечательно, что при низкой экспрессии PD-L1 в опухолевой ткани, определяемой как <5%, выявлено явное преимущество комбинированной терапии ниволумабом и ипилимумабом над монотерапией как ниволумабом, так и ипилимумабом (медиана выживаемости без прогресии — 11,2 и 5,3 мес), в то время как при высокой экспрессии (≥5%) эффективность комбинированной терапии ниволумабом и ипилимумабом не отличалась от монотерапии ниволумабом (медиана выживаемости без прогрессии — 14 мес) (рис. 8) [20].
На вопрос о последовательности применения анти-PD1 и анти-CTLA-4 ответило исследование CheckMate 064, в котором продемонстрировано, что назначение ниволумаба с последующей терапией ипилимумабом повышает 12-месячную выживаемость пациентов до 76%, в то время как применение ипилимумаба с дальнейшим лечением ниволумабом — до 54% [21].
В исследовании, посвященном эффективности ниволумаба при солидных опухолях, показано, что отсутствие экспрессии PD-L1 ассоциируется с отсутствием объективного ответа на проводимое лечение. В частности, ни у одного из 17 больных с отрицательной экспрессией PD-L1 не отмечено признаков регрессии заболевания, в то время как у 9 из 25 пациентов, имевших положительную экспрессию, развилась регрессия [22]. В последующих работах показано, что пациенты с генерализованной МК могут отвечать на лечение анти-PD1 и анти-PD-L1, несмотря на отсутствие экспрессии PD-L1, однако объективный ответ в подобных случаях развивается реже [23].
Еще одной точкой приложения для иммунотерапевтического воздействия может быть блокирование лигандов PD-L1. В исследовании BMS-936559 I фазы 55 больных с генерализованной МК получали человеческое IgG4 PD-L1 антитело 1 раз в 2 нед в дозе 0,3–10 мг/кг. Регрессия опухоли отмечена в 17% случаев, с наибольшей частотой при дозе 3 мг/кг. Среди 9 больных, ответивших на лечение, у 5 ответ продолжался более года. Среди всей когорты пациентов с солидными опухолями, включенных в исследование, у 39% больных возникли иммуноопосредованные нежелательные явления в виде сыпи, гипотиреоидизма, гепатита, саркоидоза, эндофтальмита, диабета, миастении, редко — пневмонита; токсичность III степени развилась в 9% случаев [24].
Несмотря на то что новые иммунотерапевтические препараты продемонстрировали свое преимущество перед химиотерапией, результаты лечения больных генерализованной МК далеки от удовлетворительных. В связи с этим вполне естественными являются попытки комбинации иммунотерапевтических препаратов, МАРК-ингибиторов (ингибиторы митоген-активированного протеинкиназного пути) и химиотерапевтических препаратов.
Первое исследование по изучению комбинации BRAF-ингибитора вемурафениба и ипилимумаба было досрочно прекращено из-за гепатотоксичности, характерной для обоих препаратов при использовании в монорежиме, однако продолжается исследование комбинации дабрафениба с/без траметиниба и ипилимумаба [25].
Ряд исследований направлено на изучение комбинации ипилимумаба с различными химиопрепаратами. В исследовании СА184024 больных генерализованной МК рандомизировали в 2 группы: одна из них получала ипилимумаб и дакарбазин, другая — дакарбазин и плацебо. Показатель общей 3-летней выживаемости в первой группе составил 20,8%, во второй — 12,2% [26].
Онколитическая виротерапия
В 2015 г. зарегистрирован первый онколитический виропрепарат для лечения пациентов с МК — Talimogene laherparepvec (T-VEC), который представляет собой ген-модифицированный онколитический вирус простого герпеса I типа (HSV-1), способный к избирательной репликации в опухолевых клетках и экспрессии собственного гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ). Внутриочаговое введение T-VEC вызывает как локальный эффект в виде вирус-индуцированного лизиса опухолевых клеток, что приводит к высвобождению опухолевых антигенов, так и системный эффект в виде повышения противоопухолевого иммунного ответа, который осуществляется путем активации АПК ГМ-КСФ. Таким образом, происходит воздействие на первый (высвобождение опухолевых антигенов) и третий (прайминг и активация Т-клеток) цикл опухоль — иммунитет.
T-VEC получил одобрение для лечения нерезектабельной метастатической МК IIIB–IV стадии в виде внутриочагового введения, то есть при наличии метастазов в кожу, подкожную клетчатку и лимфатические узлы. В исследовании OPTiM III фазы внутриочаговое введение T-VEC сравнивали с терапией ГМ-КСФ. Объективный ответ при введении T-VEC составил 26,4%, при ГМ-КСФ — 5,7%, а 4-летняя выживаемость достигла 33 и 21% соответственно. При этом отмечено уменьшение как инъецируемых, так и неинъецируемых очагов, в том числе висцеральных, что доказывает системный эффект препарата в виде повышения противоопухолевого иммунного ответа [27].
В исследовании комбинации T-VEC с ипилимумабом Ib фазы получено увеличение объективного ответа до 50%, а в исследовании комбинации T-VEC с анти-PD1 пембролизумабом Ib фазы — 57,1% [28].
Иммуноопосредованный ответ на лечение
При использовании ингибиторов иммунных контрольных точек требуется время для развития ответа на лечение и у части пациентов наблюдается псевдопрогрессия, то есть развитие полного или частичного ответа после увеличения размеров или появления новых опухолевых очагов, что замечено еще при первых исследованиях ипилимумаба примерно у 14% больных.
В связи с этим в 2009 г. для оценки ответа на лечение ингибиторами иммунных контрольных точек предложено использовать иммуноопосредованные критерии оценки (immune-related response criteria — irRC), главной отличительной особенностью которых является включение новых очагов в общую опухолевую нагрузку и необходимость повторного подтверждения ответа опухоли на лечение [29]. В исследовании KEYNOTE-001 псевдопрогрессия возникла у 7% пациентов. Отмечено, что среди 592 больных, проживших >12 нед после начала лечения, у 14% развилась прогрессия по критериям RECIST v.1.1, что, однако, не соответствовало критериям прогресссии согласно irRC (таблица). Двухлетняя ОВ составила 77,6% у больных без прогрессии согласно обоим критериям оценки, 37,5% — с прогрессией согласно RECIST v.1.1, но без прогрессии согласно irRC, 17,3% — у пациентов с прогрессией по обоим критериям [30].
Таблица. Сравнение RECIST v.1.1 и иммуноопосредованных критериев оценки ответа на лечение [30]
| Категория | RECIST v.1.1 | irRC |
| Таргетные очаги | Максимум 5 | Максимум 15 |
| Новые очаги | Оцениваются как прогрессия заболевания при первом появлении | До 10 новых висцеральных и 5 кожных очагов могут быть добавлены к сумме произведений двух наибольших перпендикулярных диаметров всех очагов поражений в любое время |
| Полный ответ | Исчезновение всех целевых и нецелевых очагов Лимфатические узлы должны регрессировать к менее чем 10 мм по короткой оси Нет новых поражений Требуется подтверждение |
|
| Частичный ответ | Снижение опухолевой нагрузки на ≥30% по сравнению с исходным уровнем Требуется подтверждение |
Снижение опухолевой нагрузки на ≥50% по сравнению с исходным уровнем Требуется подтверждение |
| Прогрессия заболевания | ≥20% + 5 мм абсолютного увеличения опухолевой нагрузки по сравнению с наименьшим значением Появление новых очагов или прогрессирование нетаргетных очагов |
≥25% увеличения опухолевой нагрузки по сравнению с исходным уровнем, наименьшим значением или сбросом исходного уровня Новые очаги добавляются к опухолевой нагрузке Требуется подтверждение |
| Стабилизация заболевания | Не частичный ответ и не прогрессия заболевания | |
Таким образом, на сегодня доказано преимущество иммунотерапии ингибиторами контрольных иммунных точек анти-CTLA-4 и анти-PD1 перед химиотерапией генерализованной МК. При этом терапия анти-PD1 более эффективна по сравнению с анти-CTLA-4, а комбинация анти-CTLA-4 и анти-PD1 превышает по эффективности монотерапию анти-PD1. 97% пациентов, ответивших на лечение анти-PD1, продолжают находиться в ремиссии, прекратив терапию. Особенностями применения анти-CTLA-4 и анти-PD1 является развитие псевдопрогрессии, что требует применения иммуноопосредованных критериев оценки лечения.
Список использованной литературы
1. Chen D.S., Mellman I. (2013) Oncology meets immunology: the cancer-immunity cycle. Immunity, 39(1): 1–10.
2. Pardoll D.M. (2012) The blockade of immune checkpoints in cancer immunotherapy. Nat. Rev. Cancer, 12(4): 252–264.
3. Вита Д. (2002) Биологические методы лечения онкологических заболеваний. Медицина, Москва.
4. Alexandrov L.B., Nik-Zainal S., Wedge D.C. et al. (2013) Signatures of mutational processes in human cancer. Nature, 500(7463): 415–421.
5. Hodi F.S., O’Day S.J., McDermott D.F. et al. (2010) Improved survival with ipilimumab in patients with metastatic melanoma. N. Engl. J. Med., 2010(363): 711–723.
6. Schadendorf D., Hodi F.S., Robert C. et al. (2015) Pooled analysis of long-term survival data from phase II and phase III trials of ipilimumab in unresectable or metastatic melanoma. J. Clin. Oncol., 33(17): 1889–1894.
7. Margolin K. (2012) Ipilimumab in a Phase II trial of melanoma patients with brain metastases. Oncoimmunology, 1(7): 1197–1199.
8. Ascierto P.A., Simeone E., Sileni V.C. et al. (2014) Clinical experience with ipilimumab 3 mg/kg: real-world efficacy and safety data from an expanded access programme cohort. J. Transl. Med., 12(1): 116.
9. Eggermont A.M.M., Chiarion-Sileni V., Grob J.J. et al. (2015) Adjuvant ipilimumab versus placebo after complete resection of high-risk stage III melanoma (EORTC 18071): a randomised, double-blind, phase 3 trial. The Lancet Oncol., 16(5): 522–530.
10. Eggermont A.M.M., Chiarion-Sileni V., Grob J.J. et al. (2016) Prolonged survival in stage III melanoma with ipilimumab adjuvant therapy. New Engl. J. Med., 375(19): 1845–1855.
11. Robert C., Ribas A., Wolchok J.D., Daud A. (2014) Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. The Lancet, 384(9948): 1109–1117.
12. Hamid O. Robert C., Daud A. et al. (2013) Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma. New Engl. J. Med., 369(2): 134–144.
13. Ribas A., Hamid O., Daud A. et al. (2016) Association of pembrolizumab with tumor response and survival among patients with advanced melanoma. Jama, 315(15): 1600–1609.
14. Joseph R.W., Elassaiss-Schaap J., Wolchok J.D. et al. (2014) Baseline tumor size as an independent prognostic factor for overall survival in patients with metastatic melanoma treated with the anti-PD-1 monoclonal antibody MK-3475. J. Clin. Oncol., 32: 5.
15. Ribas A., Puzanov I., Dummer R. et al. (2015) Pembrolizumab versus investigator-choice chemotherapy for ipilimumab-refractory melanoma (KEYNOTE-002): a randomised, controlled, phase 2 trial. The Lancet Oncol., 16(8): 908–918.
16. Robert C., Schachter J., Long G.V. et al. (2015) Pembrolizumab versus ipilimumab in advanced melanoma. New Engl. J. Med., 372(26): 2521–2532.
17. Topalian S.L., Sznol M., McDermott D.F. et al. (2014) Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab. J. Clin. Oncol., 32(10): 1020–1030.
18. Sznol M., Kluger H.M., Hodi F.S. et al. (2013) Survival and long-term follow-up of safety and response in patients (pts) with advanced melanoma (MEL) in a phase I trial of nivolumab (anti-PD-1; BMS-936558; ONO-4538). J. Clin. Oncol., 31.
19. Wolchok J.D., Kluger H., Callahan M.K. et al. (2013) Nivolumab plus ipilimumab in advanced melanoma. New Engl. J. Med., 369(2): 122–133.
20. Larkin J., Chiarion-Sileni V., Gonzalez R. et al. (2015) Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N. Engl. J. Med., 373(13): 23–34.
21. Weber J.S., Gibney G., Sullivan R.J. et al. (2016) Sequential administration of nivolumab and ipilimumab with a planned switch in patients with advanced melanoma (CheckMate 064): an open-label, randomised, phase 2 trial. The Lancet Oncol., 17(7): 943–955.
22. Grosso J., Horak C.E., Inzunza D. et al. (2013) Association of tumor PD-L1 expression and immune biomarkers with clinical activity in patients (pts) with advanced solid tumors treated with nivolumab (anti-PD-1; BMS-936558; ONO-4538). J. Clin. Oncol., 31.
23. Sunshine J., Taube J.M. (2015) Pd-1/Pd-L1 Inhibitors. Curr. Opin. Pharmacol., 23: 32–38.
24. Brahmer J.R., Tykodi S.S., Chow L.Q.M. et al. (2012) Safety and activity of anti–PD-L1 antibody in patients with advanced cancer. New Engl. J. Med., 366(26): 2455–2465.
25. Ribas A., Hodi F.S., Callahan M. et al. (2013) Hepatotoxicity with combination of vemurafenib and ipilimumab. New Engl. J. Med., 368(14): 1365–1366.
26. Wolchok J.D., Thomas L., Bondarenko I.N. et al. (2011) Phase III randomized study of ipilimumab (IPI) plus dacarbazine (DTIC) versus DTIC alone as first-line treatment in patients with unresectable stage III or IV melanoma. J. Clin. Oncol., 29(18 suppl.): LBA5–LBA5.
27. Andtbacka R.H.I., Kaufman H.L., Collichio F. et al. (2015) Talimogene laherparepvec improves durable response rate in patients with advanced melanoma. J. Clin. Oncol., 33(25): 2780–2788.
28. Long G.V., Dummer R., Ribas A. et al. (2016) Efficacy analysis of MASTERKEY-265 phase 1b study of talimogene laherparepvec (T-VEC) and pembrolizumab (pembro) for unresectable stage IIIB-IV melanoma. J. Clin. Oncol., 34.
29. Wolchok J.D., Hoos A., O’Day S. et al. (2009) Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin. Cancer Res., 15(23): 7412–7420.
30. Hodi F.S., Hwu W.-J., Kefford R. et al. (2016) Evaluation of immune-related response criteria and RECIST v1.1 in patients with advanced melanoma treated with pembrolizumab. J. Clin. Oncol., 34(13): 1510–1517.
Адрес:
Кукушкина Мария Николаевна
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака
Тел.: +38 (044) 257-87-41
E-mail: kukushkina_07@mail.ru














Leave a comment