Можливості та обмеження ПЕТ-сканування в плануванні променевої терапії при раку легені (стан проблеми)
Резюме. Проаналізовано дані літератури про використання позитронно-емісійної томографії (ПЕТ) в плануванні променевої терапії, зокрема, раку легені. Наведено можливості й обмеження ПЕТ-технології у визначенні обсягів опромінення пухлини з метою створення ескалаційної лікувальної дози і захисту навколишніх тканин.
Резюме. Проанализированы данные литературы об использовании позитронно-эмиссионной томографии (ПЭТ) в планировании лучевой терапии, в частности, рака легкого. Представлены возможности и ограничения ПЭТ-технологии в определении объемов облучения опухоли с целью создания эскалационной лечебной дозы и защиты окружающих тканей.
 Лучевая терапия (ЛТ) является одним из ключевых методов нехирургического лечения больных с немелкоклеточным (НМРЛ) и мелкоклеточным (МРЛ) раком легкого. Прогресс в комбинированной радиохимиотерапии с или без хирургического вмешательства, а также технические достижения в создании большой дозы излучения в опухоли способствовали значительному улучшению результатов лечения с приемлемыми побочными эффектами.
Лучевая терапия (ЛТ) является одним из ключевых методов нехирургического лечения больных с немелкоклеточным (НМРЛ) и мелкоклеточным (МРЛ) раком легкого. Прогресс в комбинированной радиохимиотерапии с или без хирургического вмешательства, а также технические достижения в создании большой дозы излучения в опухоли способствовали значительному улучшению результатов лечения с приемлемыми побочными эффектами.
Наиболее важным в достижении эффективности лучевого воздействия на опухолевый очаг является точное определение целевых объемов, а именно макроскопического (gross tumour volume — GTV) и клинического (clinical target volume — CTV) объема опухоли. Нарушения в определении этих объемов являются источником систематических ошибок, которые могут привести к недостаточному дозовому лечению и снизить вероятность контроля опухоли.
В отличие от применения технологий позитронно-эмиссионной томографии (ПЭТ) для решения диагностических вопросов, в ЛТ должны использоваться специальные унифицированные протоколы, так как влияние фактора измерения стандартизованного показателя уровня накопления радиофармпрепарата (РФП; «Uptake», США) не может быть переоценено [1].
Немелкоклеточный рак легкого
Во многих исследованиях проводили сравнительное изучение чувствительности и специфичности компьютерной томографии (КТ) и ПЭТ, совмещенной с КТ с применением фтордезоксиглюкозы (ФДГ-ПЭТ/КТ). Установлено, что для оценки неопределенных участков поражения легких показатели чувствительности и специфичности колебались от 79 до 96% для КТ-сканирования и от 40 до 83% — для ФДГ-ПЭТ/КТ [2]. Основные ограничения ФДГ-ПЭТ/КТ в оценке легочных узелков обусловлены повышенным поглощением РФП воспалительными участками, что приводит к снижению специфичности. Чувствительность (около 90%) является достаточно высокой.
При необходимости планировать облучение лимфатических узлов средостения ФДГ-ПЭТ/КТ может быть эффективно использована, так как чувствительность рентгеновской КТ составляет 56%, а ФДГ-ПЭТ/КТ — 83% для всех стадий. Соответственно, специфичность КТ достигает 81%, ФДГ-ПЭТ/КТ — 89% для всех стадий [2].
Эти результаты следует рассматривать в сочетании с золотым стандартом — медиастиноскопией, специфичность которой составляет 100%, а чувствительность — 82% для всех стадий.
Установлено также, что ФДГ-ПЭТ/КТ имеет высокую прогностическую информативность (>90%) для выявления лимфатических узлов средостения. Однако эти результаты более достоверны в случаях, когда одновременно не применяли химиотерапию, так как, по данным некоторых авторов, химиотерапия существенно снижает точность сканирования ФДГ-ПЭТ/КТ [3].
Точная идентификация метастазов в лимфоузлах имеет факультативное значение для планирования радиотерапии при узловых формах НМРЛ [4].
В нескольких исследованиях показано, что планирование с помощью ПЭТ/КТ существенно уточняет определение GTV [5, 6]. В большинстве случаев объемы GTV по ПЭТ/КТ в целом были меньше, чем при КТ, что обеспечивало уменьшение радиационного облучения легких и пищевода в сочетании с достаточной эскалацией лечебной дозы [7, 8].
По результатам проспективного клинического исследования с использованием этого подхода выявлен только 1 отрицательный случай в группе из 44 пациентов [9] (рис. 1).
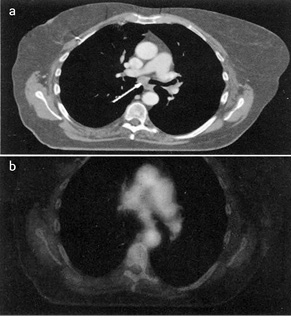
Следовательно, полученные сопоставительные данные определили более точные границы целевого объема облучения. Аналогичные подтверждения получены в другом проспективном исследовании Нидерландского онкологического института [10].
В ретроспективном исследовании, проведенном в США, достигнуты не столь убедительные результаты, что может быть связано с отсутствием четко определенного протокола этапа ПЭТ-оконтуривания [11]. В заключение отмечается, что абсолютно необходимым является введение в клиническую практику обновляющегося на регулярной основе протокола определения объема опухоли по данным ПЭТ/КТ [6, 12].
Таким образом, если ФДГ-ПЭТ/КТ используется на протяжении всего радиотерапевтического лечения, то он является методом выбора для планирования, так как характеризуется более высокой воспроизводимостью по сравнению с КТ. С целью уменьшения количества неудач при планировании ЛТ необходимо учитывать и данные других методов исследования, таких как медиастиноскопия, эндоскопическое ультразвуковое исследование.
Определение целевого объема облучения является одним из важнейших этапов планирования ЛТ. Так, в некоторых исследованиях предлагается по данным ФДГ-ПЭТ/КТ при установлении стадии первичной опухоли и уточнении ее анатомической локализации использовать преимущества метаболической визуализации по сравнению с КТ и магнитно-резонансной томографией. Несмотря на то что ПЭТ-сканирование не всегда решает проблему разграничения опухоли, определения окружающего ателектаза и гетерогенных участков внутри опухоли, ПЭТ/КТ характеризуется значительным снижением интрамодальной вариабельности по сравнению с КТ в покое [12–15] (рис. 2).
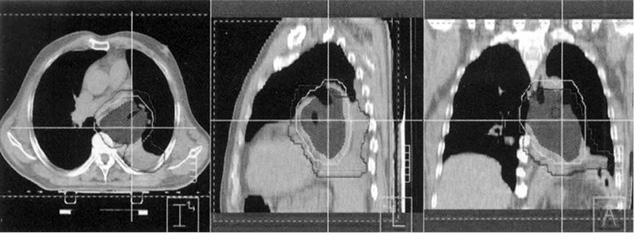
Кроме того, комплексная ПЭТ/КТ позволяет использовать сигнал для автоматического разграничения опухоли, что дополнительно редактирует оконтуривание объема облучения [16].
Следующим преимуществом использования ФДГ-ПЭТ/КТ в планировании ЛТ является тот факт, что ПЭТ-сканирование длится несколько минут, за счет чего уменьшается движение опухоли вследствие дыхания или застойной сердечной недостаточности. В настоящее время селекцию влияния фаз дыхания на определение объема облучения с помощью ФДГ-ПЭТ/КТ изучают в клинических исследованиях [17, 18].
В некоторых работах оценивали распределение дозы излучения на основе КТ и ФДГ-ПЭТ/КТ [4]. Показано существенное уменьшение облучаемых объемов при использовании ФДГ-ПЭТ/КТ для планирования ЛТ. Это, прежде всего, касается случаев ателектаза, когда ФДГ-ПЭТ/КТ позволяет дифференцировать опухоль и коллапс легкого. Более чем у 80% пациентов отмечали уменьшение объемов, что позволяло обеспечивать эскалацию дозы при той же токсичности и уменьшение воздействия на нормальные ткани [19].
В настоящее время нет ни одного клинического рандомизированного исследования III фазы, в котором бы сравнивали клинические результаты использования в планировании ЛТ ФДГ-ПЭТ/КТ и КТ. Тем не менее показано, что ФДГ-ПЭТ/КТ позволяет выявить отдаленные метастазы у 30% пациентов с НМРЛ III стадии, у которых они отсутствовали по данным КТ, что определило ведение пациента и его последующее лечение [19, 20].
В клинических исследованиях последних лет изучаются несколько направлений использования ФДГ-ПЭТ/КТ в планировании ЛТ. Прежде всего, это возможность уменьшения размеров радиационных полей и, следовательно, уменьшения выраженности побочных эффектов ЛТ [7, 8]. Является ли увеличение дозы таргетного облучения фактором повышения эффективности лечения — в настоящее время изучают в текущих клинических исследованиях [21].
В экспериментальных работах показано, что ПЭТ-сканирование может идентифицировать гетерогенные и более устойчивые к терапии области опухоли, к которым необходимо подвести более высокие дозы излучения для достижения лечебного эффекта [22–24]. В связи с этим исследовали изменения накопления 18F-ФДГ во время курса ЛТ [16]. В среднем отмечали повышение поглощения РФП на 15%, что позволило авторам сделать вывод о включении ПЭТ-сканирования на ранних стадиях лечения для адаптации терапии [25].
Мелкоклеточный рак легкого
Несмотря на то что многие исследователи изучали специфичность и чувствительность КТ по сравнению с ПЭТ-сканированием для выявления МРЛ, роль ПЭТ не была четко установлена [26–31]. Однако точность определения для медиастинальных лимфатических узлов выше у ФДГ-ПЭТ/КТ в сравнении с КТ [32].
Исследований, посвященных определению целевого объема по данным ФДГ-ПЭТ/КТ при планировании ЛТ у пациентов с МРЛ в доступной литературе мы не нашли.
В одной научной работе в результате использования ФДГ-ПЭТ/КТ у 25% пациентов с МРЛ были изменены размеры радиационных полей — как в сторону уменьшения, так и в сторону увеличения [33].
В единственном проспективном исследовании, в котором объемы облучения определяли на основе ФДГ-ПЭТ/КТ и КТ, изучали частоту поражения пищевода [32].
Невзирая на то что 18F-ФДГ максимально используется для планирования ЛТ при раке легкого, исследуются возможности новых РФП для получения более специфичных опухолевых характеристик, таких как пролиферация и гипоксия. Эти индикаторы находятся в настоящее время в стадии клинических исследований.
Таким образом, ФДГ-ПЭТ/КТ у больных НМРЛ позволяет сократить процесс планирования ЛТ за счет более автоматизированного оконтуривания объемов облучения и экономии ресурсов. Это создает перспективы для планирования ЛТ малых карцином легкого. Тем не менее существуют ограничения, связанные с уровнем поглощения индикаторного РФП эффектами индукции системной терапии на поглощение 18F-ФДГ, различиями и мобилизацией пациента при диагностических и терапевтических процедурах, влиянием дыхательных экскурсий. Эти и многие другие вопросы могут быть решены при использовании новой ФДГ-ПЭТ/КТ-технологии, специально предназначенной для планирования ЛТ.
Список использованной литературы
1. Boellaard R., Oyen W.J., Hoekstra C.J. et al. (2008) The Netherlands protocol for standardisation and quantification of FDG whole body PET studies in multicentre trials. Eur. J. Nucl. Med. Mol. Imaging, 35: 2320–2333.
2. Hellwig D., Baum R.P., Kirsch C. (2009) FDG-PET, PET/CT and conventional nuclear medicine procedures in the evaluation of lung cancer: a systematic review. Nuklearmedizin, 48: 59–69.
3. Dooms C., Verbeken E., Stroobants S. et al. (2008) Prognostic stratification of stage IIIA-N2 non-small-cell lung cancer after induction chemotherapy: a model based on the combination of morphometric-pathologic response in mediastinal nodes and primary tumor response on serial 18-fluoro-2-deoxy-glucose positron emission tomography. J. Clin. Oncol., 26: 1128–1134.
4. Senan S., De Ruysscher D., Giraud P. et al. (2004) Literature-based recommendations for treatment planning and execution for high-precision radiotherapy in lung cancer. Radiother. Oncol., 71: 139–146.
5. Nestle U., Kremp S., Grosu A.L. (2006) Practical integration of [18F]-FDG-PET and PET-CT in the planning of radiotherapy for non-small cell lung cancer (NSCLC): the technical basis, ICRU-target volumes, problems, perspectives. Radiother. Oncol., 81: 209–225.
6. Nestle U., Schaefer-Schuler A., Kremp S. et al. (2007) Target volume definition for 18F-FDG PET-positive lymph nodes in radiotherapy of patients with non-small cell lung cancer. Eur. J. Nucl. Med. Mol. Imaging, 34: 453–462.
7. van Der Wei A., Nijsten S., Flochstenbag M. et al. (2005) Increased therapeutic ratio by 18FDG-PET-CT planning in patients with clinical CT stage N2/N3 M0 non-small cell lung cancer (NSCLC): a modelling study. Int. J. Radiat. Oncol. Biol. Phys., 61: 648–654.
8. De Ruysscher D., Wanders S., Minken A. et al. (2005) Effects of radiotherapy planning with a dedicated combined PET-CT-simulator of patients with non-small cell lung cancer on dose limiting normal tissues and radiation dose-escalation: results of a prospective study. Radiother. Oncol., 77: 5–10.
9. De Ruysscher D., Wanders S., van Flaren E. et al. (2005) Selective mediastinal node irradiation on basis of the FDG-PET scan in patients with non-small cell lung cancer: a prospective clinical study. Int. J. Radiat. Oncol. Biol. Phys., 62: 988–994.
10. Belderbos J.S., Heemsbergen W.D., De Jaeger K. et al. (2006) Final results of a Phase l/II dose escalation trial in non-small-cell lung cancer using three-dimensional conformai radiotherapy. Int. J. Radiat. Oncol. Biol. Phys, 66: 126–134.
11. Sura S., Greco C., Gelblum D. et al. (2008) F-Fluorodeoxyglucose positron emission tomography-based assessment of local failure patterns in non-small-cell lung cancer treated with definitive radiotherapy. Int. J. Radiat. Oncol. Biol. Phys., 70: 1397–1402.
12. Nestle U., Kremp S., Schaefer-Schuler A. et al. (2005) Comparison of different methods for delineation of 18F-FDG PET-positive tissue for target volume definition in radiotherapy of patients with non-small cell lung cancer. J. Nucl. Med., 46: 1342–1348.
13. van Baardwijk A., Bosmans G., Boersma L. et al. (2007) PET-CT-based auto-contouring in non-small-cell lung cancer correlates with pathology and reduces interobserver variability in the delineation of the primary tumor and involved nodal volumes. Int. J. Radiat. Oncol. Biol. Phys., 68: 771–778.
14. Stroom J., Blaauwgeers H., van Baardwijk A. et al. (2007) Feasibility of pathology-correlated lung imaging for accurate target definition of lung tumors. Int. J. Radiat. Oncol. Biol. Phys., 69: 267–275.
15. Schaefer A., Kremp S., Hellwig D. et al. (2008) A contrast-oriented algorithm for FDG-PET-based delineation of tumour volumes for the radiotherapy of lung cancer: derivation from phantom measurements and validation in patient data. Eur. J. Nucl. Med. Mol. Imaging, 35: 1989–1999.
16. MacManus M., Nestle U., Rosenzweig K.E. et al. (2009) Use of PET and PET/CT for radiation therapy planning: IAEA expert report 2006-2007. Radiother. Oncol., 91: 85–94.
17. Nehmeh S.A., Erdi Y.E., Rosenzweig K.E. et al. (2003) Reduction of respiratory motion artifacts in PET imaging of lung cancer by respiratory correlated dynamic PET: methodology and comparison with respiratory gated PET. J. Nucl. Med., 44: 1644–1648.
18. Grgic A., Nestle U., Schaefer-Schuler A. et al. (2009) FDG-PET-based radiotherapy planning in lung cancer: optimum breathing protocol and patient positioning — an intraindividual comparison. Int. J. Radiat. Oncol. Biol. Phys., 73: 103–111.
19. Hicks R.J., Kalff V., MacManus M.P. et al. (2001) 18F-FDG PET provides high-impact and powerful prognostic stratification in staging newly diagnosed non-small cell lung cancer. J. Nucl. Med., 42: 1596–1604.
20. MacManus M.P., Hicks R.J., Matthews J.P. et al. (2001) High rate of detection of unsuspected distant metastases by PET in apparent stage III non-small-cell lung cancer: implications for radical radiation therapy. Int. J. Radiat. Oncol. Biol. Phys., 50: 287–293.
21. van Baardwijk A., Wanders S., Boersma L. et al. (2010) Mature results of an individualized radiation dose prescription study based on normal tissue constraints in stage I–III non-small cell lung cancer. J. Clin. Oncol., 28: 1380–1386.
22. Aerts H.J., Bosmans G., van Baardwijk A.A. et al. (2008) Stability of F-deoxyglucose uptake locations within tumor during radiotherapy for NSCLC: a prospective study. Int. J. Radiat. Oncol. Biol. Phys., 71: 1402–1407.
23. Aerts H.J., van Baardwijk A.A., Petit S.F. et al. (2009) Identification of residual metabolic-active areas within individual NSCLC tumours using a pre-radiotherapy (18)fluorodeoxyglucose-PET-CT scan. Radiother. Oncol., 91: 386–392.
24. van Baardwijk A., Bosmans G., Dekker A. et al. (2007) Time trends in the maximal uptake of FDG on PET scan during thoracic radiotherapy in relation to metabolic response. A prospective study in locally advanced non-small cell lung cancer patients. Radiother. Oncol., 82: 145–152.
25. Brink I., Schumacher T., Mix M. et al. (2004) Impact of [18F]FDG-PET on the primary staging of small-cell lung cancer. Eur. J. Nucl. Med. Mol. Imaging, 31: 1614–1620.
26. Fischer B.M., Mortensen J., Langer S.W. et al. (2007) A prospective study of PET/CT in initial staging of small-cell lung cancer: comparison with CT, bone scintigraphy and bone marrow analysis. Ann. Oncol., 18: 338–345.
27. Niho S., Fujii H., Murakami K. et al. (2007) Detection of unsuspected distant metastases and/or regional nodes by FDG-PET in LD-SCLC scan in apparent limited-disease small-cell lung cancer. Lung Cancer, 57: 328–333.
28. Pandit N., Gonen M., Krug L. et al. (2003) Prognostic value of [18F]FDG-PET imaging in small cell lung cancer. Eur. J. Nucl. Med. Mol. Imaging, 30: 78–84.
29. Shen Y.Y., Shiau Y.C., Wang J.J. et al. (2002) Whole-body 18F-2-deoxyglucose positron emission tomography in primary staging small cell lung cancer. Anticancer Res., 22: 1257–1264.
30. Kamel E.M., Zwahlen D., Wyss M.T. et al. (2003) Whole-body (18)F-FDG PET improves the management of patients with small cell lung cancer. J. Nucl. Med., 44: 1911–1917.
31. van Loon J., De Ruysscher D., Wanders R. et al. (2010) Selective nodal irradiation on basis of 18FDG-PET scans in limited disease small cell lung cancer: a phase II trial. Int. J. Radiat. Oncol. Biol. Phys., 77: 329–336.
32. van Loon J., Offermann C., Bosmans G. et al. (2008) (18)FDG-PET based radiation planning of mediastinal lymph nodes in limited disease small cell lung cancer changes radiotherapy fields: a planning study. Radiother. Oncol., 87: 49–54.
33. Mees G., Dierckx R., Vangestel C. et al. (2009) Molecular imaging of hypoxia with radiolabeled agents. Eur. J. Nucl. Med. Mol. Imaging, 36: 1674–1686.
34. Christian N., Lee J.A., Bol A. et al. (2009) The limitation of PET imaging for biological adaptive-IMRT assessed in animal models. Radiother. Oncol., 91: 101–106.
Адрес:
Столярова Оксана Юрьевна
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака














Leave a comment