Сучасні підходи до лікування пацієнтів із неоперабельним недрібноклітинним раком легені
Климанов М.Ю., Сивак Л.А., Тарасенко Т.Є., Аскольский А.В., Майданевич Н.Н., Лялькин С.А., Верьовкіна Н.О.
Резюме. Недрібноклітинний рак легені продовжує займати перше місце у структурі захворюваності і смертності від онкологічних захворювань. Застосування стандартної хіміотерапії не забезпечує задовільних результатів тривалої виживаності у пацієнтів з метастатичним недрібноклітинним раком легені. Наявність драйверних мутацій дозволяє досягнути покращення показників об̓єктивної відповіді тільки у 25–30% пацієнтів. Таким чином, для лікування раку легені актуальна розробка альтернативних схем терапії з використанням принципово нових механізмів дїї препаратів. Значний прогрес в лікуванні отриманий завдяки поглибленому вивченню взаємодії імунної системи з пухлиною через систему імунних чекпоінтів (рецептора PD-1 i ліганда PD-L1).
Резюме. Немелкоклеточный рак легкого продолжает занимать первое место в структуре заболеваемости и смертности среди онкологических заболеваний. Применение стандартной химиотерапии не обеспечивает удовлетворительных результатов длительной выживаемости у пациентов с метастатическим немелкоклеточным раком легкого. Наличие драйверных мутаций позволяет добиться улучшения показателей объективного ответа только у 25–30% пациентов. Таким образом, для лечения рака легкого актуальна разработка альтернативных схем терапии с использованием принципиально новых механизмов действия препаратов. Значительный прогресс в лечении получен благодаря углубленному изучению взаимодействия иммунной системы с опухолью через систему иммунных чекпоинтов (рецептора PD-1 и лиганда PD-L1).
 Рак легкого (РЛ) продолжает занимать лидирующую позицию в структуре онкологической заболеваемости. В мире ежегодно регистрируют более 1,5 млн новых случаев РЛ, из которых 15–20% приходится на мелкоклеточный (МРЛ) и 80–85% — на немелкоклеточный (НМРЛ) его варианты. По-прежнему нет стандартного метода, который мог бы быть рекомендован данным пациентам. Пятилетняя выживаемость всей популяции пациентов с НМРЛ в разных странах составляет 9–13% [1, 2].
Рак легкого (РЛ) продолжает занимать лидирующую позицию в структуре онкологической заболеваемости. В мире ежегодно регистрируют более 1,5 млн новых случаев РЛ, из которых 15–20% приходится на мелкоклеточный (МРЛ) и 80–85% — на немелкоклеточный (НМРЛ) его варианты. По-прежнему нет стандартного метода, который мог бы быть рекомендован данным пациентам. Пятилетняя выживаемость всей популяции пациентов с НМРЛ в разных странах составляет 9–13% [1, 2].
Применение химиотерапии (ХТ) при РЛ позволяет обеспечить контроль симптомов заболевания и умеренное повышение выживаемости. Сегодня широкое применение у пациентов с НМРЛ в качестве 1-й линии ХТ нашли комбинированные платиносодержащие схемы с цитотоксическими препаратами третьего поколения (паклитаксел, гемцитабин, винорельбин, доцетаксел). Однако результаты последних клинических исследований свидетельствуют в пользу того, что современная ХТ достигла определенного пика терапевтических возможностей без тенденции к дальнейшему повышению эффективности у пациентов с НМРЛ [3]. Кроме того, после проведения 1-й линии ХТ значительная часть пациентов (до 50%) не получает дальнейшего лечения из-за быстрого ухудшения состояния. Таким образом, для больных НМРЛ, безусловно, оправдана необходимость поиска принципиально новых подходов к лечению с максимальным профилем безопасности [4].
Достигнутые успехи в изучении взаимоотношений иммунной системы и опухоли определяют иммунотерапию, в частности РЛ, как перспективное многообещающее направление. Суть иммунотерапевтических методов лечения злокачественных новообразований состоит в преодолении супрессии иммунологического надзора, распознавании опухолевых клеток иммунной системой организма и, как следствие, подавлении развития опухоли.
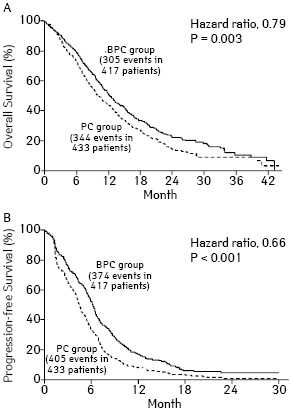
Cдвиг в современной парадигме лечения НМРЛ начался с использования группы препаратов из арсенала моноклональных антител (МкАТ) — ингибиторов VEGF (vascular endothelial growth factor), представленных бевацизумабом и рамуцирумабом, которые были одобрены FDA (Food and Drug Administration — FDA) к использованию в лечении РЛ. Прочие МкАТ (бавитуксимаб, патритумаб, рилотумумаб, цетуксимаб, демцизумаб, IMMU-132) проходят клинические исследования. Согласно рекомендациям ESMO (European Society for Medical Oncology), бевацизумаб может быть применен при отсутствии противопоказаний у больных метастатическим НМРЛ в комбинации с 1-й линией ХТ паклитакселом/карбоплатином, а также другими платиносодержащими режимами [11]. По результатам рандомизированного исследования [12], проведенного ECOG (Eastern Cooperative Oncology Group) с включением 878 больных НМРЛ (IIIB– IV стадии), использование бевацизумаба в сочетании с платиносодержащими режимами ХТ (паклитаксел + карбоплатин) по сравнению с проведением только ХТ сопровождается как снижением относительного риска (ОР) на 35% (р<0,001) и улучшением показателей выживаемости без прогрессирования (ВБП) — 6,2 и 4,5 мес (р<0,001), так и повышением общей выживаемости (ОВ) — 51 и 44% соответственно. Медиана продолжительности жизни в группе с бевацизумабом составила 12,3 и 10,3 мес (р=0,003) для пациентов, не получавших таргетный препарат (рис. 1).
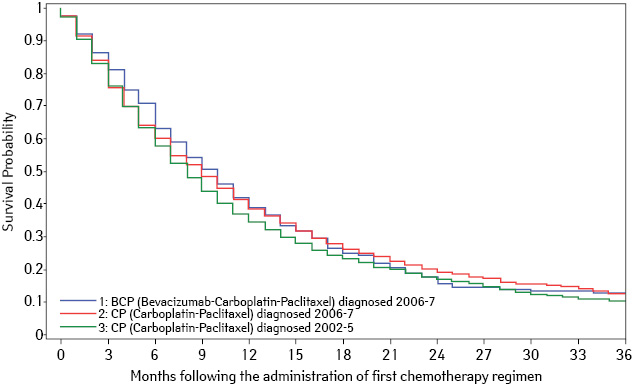
Однако не выявлено преимуществ в добавлении бевацизумаба к ХТ у пациентов с НМРЛ в возрасте старше 65 лет (что составляет примерно ⅔ случаев). 18 апреля 2012 г. в журнале Американской медицинской ассоциации (JAMA) опубликованы результаты исследования Dana-Farber Cancer Institute в Бостоне, в котором приняли участие 4168 пациентов в возрасте старше 65 лет с НМРЛ [13]. Дизайн исследования аналогичен вышеприведенному: 2 группы, одна из которых получала курс ХТ паклитакселом и карбоплатином, во 2-й группе к этим же препаратам добавляли бевацизумаб. Одногодичная выживаемость существенно не отличалась и составила 40,1 и 39,6% соответственно. При этом, подчеркивается риск серьезных побочных эффектов, связанный с включением бевацизумаба (рис. 2).
Значительные успехи в терапии больных НМРЛ достигнуты благодаря возможности молекулярно-генетического профилирования опухолей, что позволило выявить новые мишени для медикаментозной терапии. Одной из наиболее изучаемых в последние годы мишенью является рецептор эпидермального фактора роста (epidermal growth factor receptor — EGFR). EGFR представляет собой трансмембранный тирозинкиназный гликопротеин, участвующий в регуляции клеточного роста и дифференцировки. Гиперэкспрессия EGFR и/или одного из его лигандов (EGF; TGF-α) может служить причиной повышенной пролиферативной активности трансформированных клеток [14, 15]. Установлено, что постоянная стимуляция рецептора обусловлена мутацией гена, кодирующего EGFR (делеция экзона 19 или точечная мутация L858R в экзоне 21). Данную мутацию при НМРЛ отмечают примерно у 10% представителей европейской популяции и у 30% пациентов в странах Азии [16].
Первым селективным ингибитором EGFR стал таргетный препарат — гефитиниб, впоследствии был создан эрлотиниб.
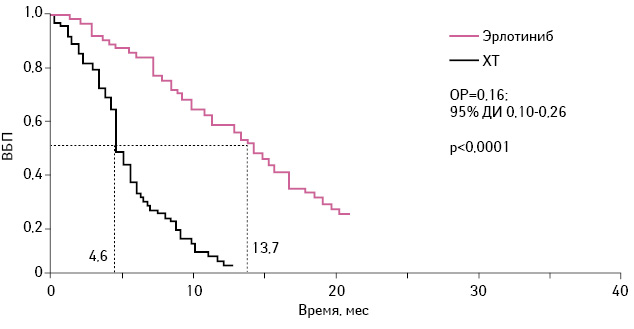
В ходе III фазы открытого рандомизированного клинического исследования OPTIMAL (CTONC0802) сравнивали эффективность и профиль безопасности 1-й линии терапии при метастатическом НМРЛ с применением эрлотиниба и стандартной ХТ у пациентов азиатской популяции с мутациями EGFR [17]. В исследовании принимали участие 165 больных НМРЛ, которые были рандомизированы в 2 группы: больным 1-й группы (82 пациента) был назначен эрлотиниб (перорально — 150 мг 1 раз в сутки, до прогрессирования заболевания), 2-й (72 пациента) — карбоплатин и гемцитабин (4 цикла: гемцитабин 1000 мг/м2 в 1-й и 8-й дни + карбоплатин AUC 5 в 1-й день). Медиана ВБП заболевания составляла 13,7 мес (95% доверительный интервал (ДИ) 10,58–16,53) в группе пациентов, получавших эрлотиниб, и 4,6 мес в группе больных, принимавших гемцитабин + карбоплатин (95% ДИ 0,10–0,26). Полный ответ на применение эрлотиниба был достигнут у 2 (2%) пациентов и ни у одного из получавших ХТ. У 66 (80%) из 82 больных был получен частичный ответ на применение эрлотиниба по сравнению с 26 (36%) из 72 пациентов, которым была назначена ХТ (рис. 3).
4 мая 2013 г. эрлотиниб был одобрен FDA в качестве 1-й линии терапии при метастатическом НМРЛ с делецией в экзоне 19 или мутацией в экзоне 21 (L858R) рецептора EGFR. Официально одобрен тест на соответствующие мутации.
При РЛ, независимо от EGFR, часто происходит активация RAS/MAPK-пути за счет мутации гена KRAS. Известно, что мутации KRAS не препятствуют действию ингибиторов EGFR гефитиниба и эрлотиниба, но снижают эффективность терапии [18].
Исследования ингибиторов EGFR продолжаются. Стоит отметить результаты ретроспективного анализа медицинской документации по 5387 больным НМРЛ, проходившим лечение в онкологическом институте Гуандун (Китай) в период с января 2011 г. по июнь 2015 г. [19]. Статус мутаций гена EGFR был определен у 3775 больных, у 1258 из которых была выявлена мутация, а у 2517 — она отсутствовала. У 184 (3,4%) из 5387 участников исследования были выявлены лептоменингеальные метастазы. Интересно, что число больных с карциноматозом мозговых оболочек и мутацией EGFR (118/1258 [9,4%]), было значительно больше, чем количество пациентов с «диким» типом EGFR (42/2517 [1,7%]; p<0,001). ОВ больных с карциноматозом мозговых оболочек, получавших ингибиторы EGFR, была выше по сравнению с ОВ больных терапией (ХТ+/– лучевая терапия) без их включения (10 мес (95% ДИ 8,9–11,1) и 3,3 мес (95% ДИ 0,5–6,1) соответственно; p<0,001). Проведение ХТ способствовало увеличению ОВ больных с лептоменингеальными метастазами, в отличие от тех пациентов, у кого она не проводилась (21,0 мес (95% ДИ 14,8–27,1) и 8,7 мес (95% ДИ 6,8–10,6) соответственно; p=0,001).
В августе 2011 г. FDA в ускоренном порядке (за 2 года от подачи заявки на регистрацию) одобрило для лечения пациентов с НМРЛ еще один препарат — кризотиниб, мишенью которого является специфический белок ALK-EML4. Появление аномального белка ALK-EML4 обусловлено транслокацией хромосом, что приводит к слиянию двух белков-ферментов: киназы анапластической лимфомы (ALK) и протеина, участвующего в образовании микротрубочек (EML4). Данный белковый комплекс приводит к очень быстрому прогрессированию рака.
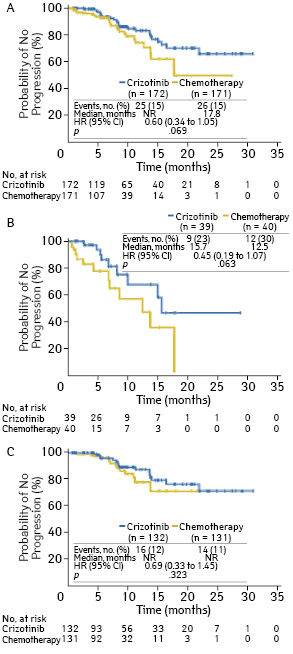
В клиническом исследовании III фазы PROFILE 1014 показатели ВБП и частоты объективного ответа у больных, получавших кризотиниб, были выше, чем у пациентов, находившихся на терапии комбинацией пеметрексед + платина. Полученные результаты явились основанием одобрения FDA кризотиниба в ноябре 2013 г. в качестве стандарта 1-й линии терапии больных метастатическим ALK-позитивным НМРЛ [20]. 343 пациента были рандомизированы в соотношении 1:1 на 2 группы, в одной из которых (n=172) принимали кризотиниб (250 мг 2 раза в сутки ежедневно), а во второй (n=171) — каждые 3 нед проводилось 6 курсов ХТ пеметрекседом (500 мг/м) и цисплатином (75 мг/м) или карбоплатином (AUC 5 или 6). У 79 (23%) исследуемых на момент начала лечения было метастатическое поражение головного мозга, по поводу которого они получали лечение. Время до прогрессирования заболевания в головном мозгу у больных, получавших кризотиниб, не было статистически значимо выше как во всей популяции больных (ОР 0,60; p=0,069), так и у участников исследования с первичным метастатическим поражением головного мозга (ОР 0,45; p=0,063), а также у пациентов без метастазов в головном мозгу (ОР 0,69; p=0,323). При оценке показателя только по очагам в головном мозгу у больных с метастатическим поражением головного мозга он оказался значительно выше в группе пациентов, получавших кризотиниб, чем ХТ. На 12-й неделе лечения он составил 85 и 45% соответственно (p<0,001), на 24-й неделе — 56 и 25% соответственно (p=0,006) (рис. 4).
Показатель ВБП был значительно выше у больных, получавших кризотиниб. У пациентов с метастатическим поражением головного мозга он составил 9,0 и 4,0 мес соответственно (ОР 0,40; p<0,001). У больных с отсутствием метастазов в головном мозгу он достиг 11,1 и 7,2 мес соответственно (ОР 0,51; p<0,001). Медиана ВБП во всей популяции больных, получавших/не получавших кризотиниб, составила 10,9 и 7,0 мес соответственно (ОР 0,45; p<0,001).
Следовательно, терапия кризотинибом у больных с метастатическим поражением головного мозга способствует контролированию метастазов. Увеличение времени до прогрессирования заболевания в головном мозгу не оказалось статистически значимым у пациентов с/без поражения головного мозга.
Исследования на экспериментальных моделях и людях показали, что защита от опухоли осуществляется с помощью различных типов клеток (Т-лимфоциты, NK-клетки, макрофаги, нейтрофилы, эозинофилы, эритроциты, тромбоциты), обладающих специфическим и неспецифическим цитотоксическим эффектами. Центральная роль в противоопухолевом ответе отводится клеточному иммунитету, в котором наибольшим цитотоксическим противоопухолевым потенциалом обладают Т-лимфоциты.
Наибольший интерес в качестве мишени для воздействия препаратов в настоящее время представляет рецептор, участвующий в регуляции клеточного звена иммунитета — PD-1. Этот рецептор экспрессируется на активированных эффекторных Т-лимфоцитах и в норме служит для защиты собственных клеток от аутоиммунной реакции в условиях инфекции и воспаления в тканях (рис. 5).
Взаимодействие рецептора PD-1 с лигандом (PD-L1 или PD-L2) на поверхности антигенпрезентирующих клеток или клеток-мишеней является стимулом, угнетающим активность Т-лимфоцитов, вызывающим их апоптоз. Этот механизм используют и опухолевые клетки, экспрессируя на своей поверхности лиганды PD-L1/2 (рис. 6) [5–7].
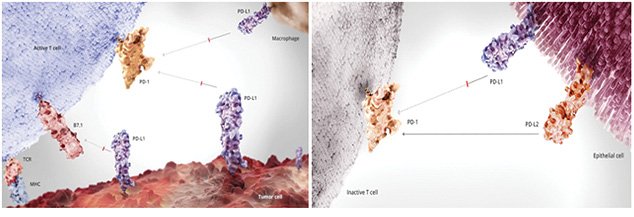
Открытие возможности селективного ингибирования рецептора PD-1 и его лигандов (PD-L1/2) дало начало новому классу препаратов — препаратов иммунотерапии. Первые представители данной группы — ниволумаб и пембролизумаб.
Первым препаратом, изученным в рандомизированных исследованиях у больных НМРЛ, был ниволумаб. В исследовании CheckMate 017 было проведено сравнение эффективности и токсичности ниволумаба и доцетаксела в качестве лекарственной терапии 2-й линии у больных плоскоклеточным РЛ с прогрессированием после цисплатинсодержащей ХТ [8]. Больные получали ниволумаб в дозе 3 мг/кг внутривенно (в/в) каждые 2 нед или доцетаксел 75 мг/м2 каждые 3 нед. В среднем больные получили 8 доз ниволумаба и 3 дозы доцетаксела. Основным критерием эффективности была ОВ. При медиане наблюдения 11 мес медиана общей продолжительности жизни в группе ниволумаба составила 9,2 мес, в группе доцетаксела — 6,0 мес, что соответствует относительному снижению риска смерти на 41% в группе ниволумаба (ОР 0,59%; p<0,001).
Показатель одногодичной ОВ составил 42 и 24% соответственно. Способность ниволумаба увеличивать продолжительность жизни по сравнению с доцетакселом зарегистрирована во всех анализируемых подгруппах, за исключением больных в возрасте старше 75 лет. При назначении ниволумаба чаще наблюдали объективный ответ в сравнении с доцетакселом (20 и 9% соответственно). Медиана ОВ при назначении доцетаксела составила 8,4 мес (от 1,4 до 15,2 мес и более), в то время как в группе ниволумаба не была достигнута (2,9–20,5 мес). Медиана времени до прогрессирования была больше в группе ниволумаба (3,5 и 2,8 мес соответственно), что соответствовало снижению ОР прогрессирования на 38% (ОР 0,62; p<0,001). Показатель одногодичной ВБП составил 21 и 6% в группе ниволумаба и доцетаксела соответственно (рис. 7).
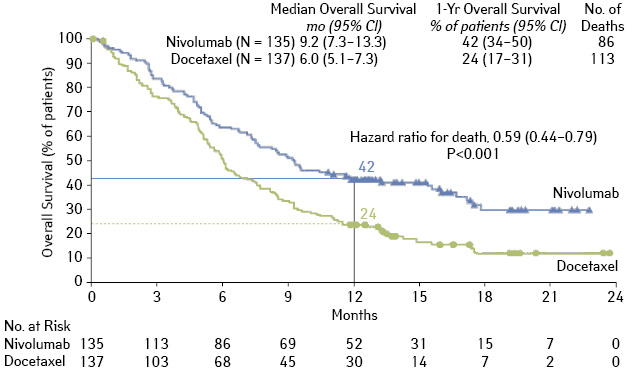
Авторы проанализировали результаты терапии в зависимости от уровня экспрессии PD-L1 в опухоли и показали отсутствие его прогностического или предиктивного значения как в группе ниволумаба, так и в группе доцетаксела. Частота побочных эффектов любой выраженности была реже в группе ниволумаба, чем доцетаксела (58 и 68% соответственно). Больные, получавшие ниволумаб, реже испытывали токсичности III–IV степени (7 и 55%). Основными нежелательными явлениями на фоне лечения ниволумабом были слабость (16%), снижение аппетита (11%) и астения (10%). На фоне лечения ниволумабом были зарегистрированы специфичные для этого препарата побочные эффекты: гипотиреоз — 4%, пневмониты — 5%, которые, как правило, были слабой степени выраженности и контролировались приемом глюкокортикоидов. Отмена препаратов по причине токсичности проведена у 3% больных в группе ниволумаба и у 10% — в группе доцетаксела.
По результатам данного исследования, опубликованного в 2015 г., авторами был сделан вывод, что у больных плоскоклеточным РЛ с прогрессированием после цисплатинсодержащих комбинаций назначение ниволумаба в качестве 2-й линии приводит к увеличению продолжительности жизни и лучшей переносимости лечения по сравнению с доцетакселом.
Параллельно было проведено аналогичное исследование CheckMate 057, в рамках которого сравнивали эффективность и токсичность ниволумаба с доцетакселом в качестве 2-й линии терапии, но уже у больных аденокарциномой легкого [9]. Причем разрешалось назначать ниволумаб в качестве 3-й линии для больных с мутациями гена EGFR и транслокацией ALK в случае прогрессирования при применении таргетных препаратов и последующей ХТ на основе цисплатина.
Медиана возраста больных составила 62 года, большинство имели IV стадию заболевания и были активными или бывшими курильщиками (79%). Мутация гена EGFR или транслокация гена ALK отмечены у 14 и 4% больных соответственно. Все пациенты ранее получали цисплатинсодержащую ХТ, эффект от которой был отмечен у 24% больных. Медиана введений ниволумаба и доцетаксела составила 6 и 4 дозы соответственно.
При медиане наблюдения 13 мес медиана продолжительности жизни составила 12,2 и 9,4 мес для группы ниволумаба и доцетаксела, что соответствует снижению ОР смерти на 27% в группе ниволумаба (ОР 0,73; p=0,002) (рис. 8).
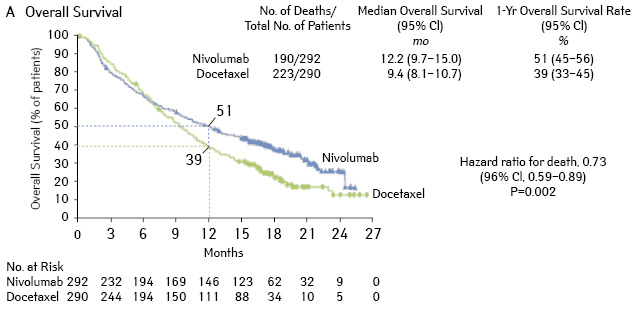
Показатель одногодичной выживаемости составил 51 и 39%. Объективный ответ чаще отмечался в группе ниволумаба (19 и 12%) и имел большую продолжительность (17,2 и 5,4 мес). Медиана времени до прогрессирования составила 4,4 мес в группе ниволумаба и 2,3 мес — и группе доцетаксела с показателями одногодичной ВБП 19 и 8% соответственно.
Также интересным и значимым оказался анализ эффективности ниволумаба в зависимости от экспрессии PD-L1 при аденокарциномах, выявленной у 78% больных. Предварительные результаты показывают предиктивность наличия экспрессии PD-L1 в опухолевых клетках для увеличения продолжительности жизни больных аденокарциномой легкого. Частота побочных эффектов любой степени, обусловленных лечением, была существенно ниже в группе ниволумаба (69 и 88%), так же как и частота серьезной токсичности III–IV степени (10 и 54% соответственно). Отмена препарата вследствие токсичности произведена у 5% больных в группе ниволумаба и у 15% — в группе доцетаксела.
Таким образом, назначение ниволумаба больным аденокарциномой легкого после ХТ 1-й линии увеличивает продолжительность жизни и снижает токсичность лечения по сравнению с доцетакселом. Исключение составляют больные с наличием мутации гена EGFR. Наибольший выигрыш от назначения ниволумаба отмечается у больных аденокарциномой c PD-L1 в опухоли.
Другой препарат, который также является МкАТ, блокирующим рецептор PD-1, — пембролизумаб, показал свою эффективность с первого рандомизированного исследования с его использованием — KEYNOTE-010. Обязательным условием включения в это исследование было наличие экспрессии PD-L1 ≥1% опухолевых клеток. Пембролизумаб назначали в дозе 2 мг/кг или 10 мг/кг в/в каждые 3 нед, доцетаксел вводили в дозе 75 мг/м2 каждые 3 нед до признаков прогрессирования или непереносимой токсичности. В исследование были включены 1034 больных, большинство из которых были бывшими или активными курильщиками. При медиане наблюдения 13,1 мес медиана общей продолжительности жизни составила 10,4; 12,7 и 8,5 мес для пембролизумаба в дозе 2 мг/кг и 10 мг/кг и доцетаксела соответственно. Это соответствует снижению ОР смерти по сравнению с доцетакселом на 29% (ОР 0,71; p=0,0008) при использовании пембролизумаба в дозе 2 мг/кг и 39% (ОР 0,61; p<0,0001) — при дозе 10 мг/кг. В группе больных с выраженной экспрессией PD-L1 (>50% опухолевых клеток) медиана продолжительности жизни составила 14,9 мес в группе пациентов, которая получала пембролизумаб в дозе 2 мг/кг, 17,3 мес — в группе пембролизумаба в дозе 10 мг/кг и 8,2 мес — в группе доцетаксела (рис. 9).
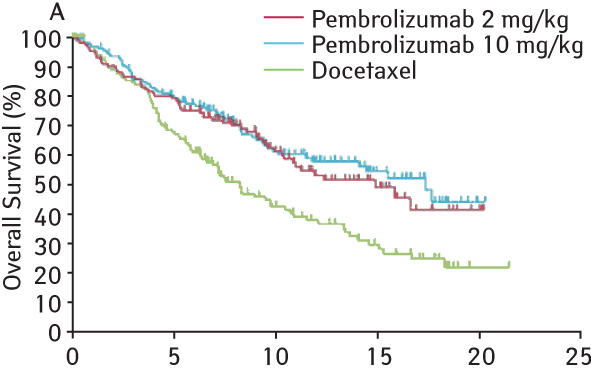
Пембролизумаб был одинаково эффективен независимо от гистологического типа опухоли. Не отмечено достоверного увеличения общей продолжительности жизни у больных с наличием мутации гена EGFR. Частота объективного ответа составила 18% среди общей популяции, 30% — у пациентов с высокой экспрессией PD-L1, принимавших пембролизумаб, и 9% — в группе доцетаксела. Продолжительность ответа была больше при назначении пембролизумаба (медиана не достигнута ни в одной дозовой группе) по сравнению с доцетакселом (медиана 6 мес). Лечение пембролизумабом в низкой и высокой дозах обладало меньшей токсичностью (частота серьезных побочных эффектов III–IV степени — 13 и 16% соответственно) по сравнению с доцетакселом (35%).
На основании полученных результатов авторы сделали вывод о большей эффективности и меньшей токсичности пембролизумаба по сравнению с доцетакселом у больных НМРЛ с прогрессированием после цисплатинсодержащих комбинаций.
Обнадеживающие результаты опубликованных исследований вызвали резонанс в онкологическом сообществе, иммунотерапия ранее не была сопоставима с ХТ, а тем более при лечении при РЛ, это дало мощный толчок к дальнейшим исследованиям ингибиторов чекпоинтов.
Самые свежие данные исследования KEYNOTE-024 [10], которое было представлено в октябре на последнем конгрессе ESMO 2016 г. в Копенгагене, продемонстрировали беспрецедентные результаты при лечении НМРЛ. В исследование включали больных метастатическим НМРЛ с экспрессией PD-L1 на мембране ≥50% опухолевых клеток. Пациенты были рандомизированы в группу пембролизумаба, который назначали в/в в дозе 200 мг каждые 3 нед до признаков прогрессирования или токсичности (но не более 35 введений) или ХТ по одной из схем: карбоплатин + гемцитабин, цисплатин + гемцитабин, карбоплатин + паклитаксел или карбоплатин/цисплатин в сочетании с пеметрекседом для аденокарцином, каждые 3 нед 4–6 курсов. Больные в группе ХТ в случае прогрессирования заболевания могли получать пембролизумаб в качестве терапии 2-й линии.
Медиана времени до прогрессирования составила 10,3 мес в группе пембролизумаба и 6,0 мес — в группе ХТ (ОР 0,50; p<0,001). Медиана продолжительности жизни не достигнута ни в одной группе, 6-месячная выживаемость составила 80,2% в группе пембролизумаба и 72,4% — в группе ХТ. Назначение пембролизумаба снижает риск смерти на 40% по сравнению с ХТ (ОР 0,60; p=0,005) с частотой объективного ответа соответственно 44,8 и 27,8% (рис. 10).
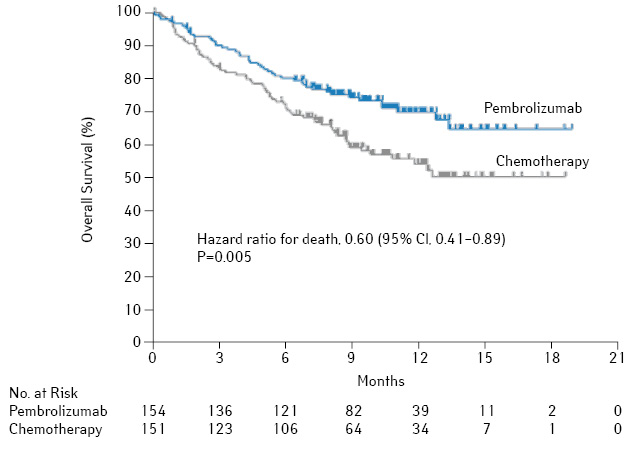
Частота побочных осложнений III–IV степени составила 53,3% в группе ХТ и 26,6% — в группе пембролизумаба. Наиболее частыми осложнениями были диарея (14,3% больных), слабость (10,4%) и лихорадка (10,4%) в группе пембролизумаба и анемия (44%), тошнота (43,3%) и слабость (28,7%) — в группе ХТ.
Таким образом, в популяции больных НМРЛ с высокой экспрессией PD-L1 проведение системной терапии 1-й линии пембролизумабом обеспечивает преимущества в ВБП и ОВ с одновременным снижением токсичности лечения по сравнению со стандартной ХТ 1-й линии. На основании полученных результатов FDA одобрило пембролизумаб к использованию в качестве терапии 1-й линии у пациентов с НМРЛ и высокой экспрессией PD-L1 (>50% опухолевых клеток) при отсутствии геномных аберраций EGFR и ALK. Это отображено в последнем обновлении рекомендаций NCCN.
В скором времени ожидаются результаты исследования KEYNOTE-042, в котором сравнивают эффективность и токсичность пембролизумаба и ХТ в качестве 1-й линии у больных НМРЛ с экспрессией PD-L1 >1% опухолевых клеток. Эти данные позволят дать ответ на вопрос о целесообразности назначения препарата в 1-й линии у больных с невысокой экспрессией лиганда PD-L1 (таблица).
Таблица. Результаты рандомизированных исследований по сравнению эффективности PD-1 ингибиторов с ХТ у больных НМРЛ
| Препарат,доза |
Медиана продолжительности объективного ответа |
Медиана продолжительности жизни |
Медиана времени до прогрессирования |
Снижения риска смерти |
Частота побочных эффектов III–IV степени |
| Ниволумаб: плоскоклеточный НМРЛ, исследование ChekMate 017 (n=272) | |||||
| Ниволумаб 3 мг/кг | Не достигнута (2,9–20,5 мес) |
9,2 мес | 3,5 мес | 41% (р<0,001) |
3,5 мес |
| Доцетаксел 75 мг/м² | 8,4 мес (1,4–15,2 мес) |
6,0 мес | 2,8 мес | 2,8 мес | |
| Ниволумаб: аденокарцинома легкого, исследование ChekMate 057 (n=382) | |||||
| Ниволумаб 3 мг/кг | 17,2 мес | 12,2 мес | 2,3 мес | 27% (р=0,002) |
10% |
| Доцетаксел 75 мг/м² | 5,4 мес | 9,4 мес | 4,4 мес | 54% | |
| Пембролизумаб: НМРЛ, исследование KEYNOTE-010 (n=1034) | |||||
| Пембролизумаб 2 мг/кг | Не достигнута (частота ответа 18%) |
10,4 мес | 3,9 мес | 29% (р=0,0008) |
13% |
| Пембролизумаб 10 мг/кг | Не достигнута (частота ответа 18%) |
12,7 мес | 4,0 мес | 39% (р<0,0001) |
16% |
| Доцетаксел 75 мг/м² | 6 мес (частота ответа 9%) |
8,5 мес | 4,0 мес | 35% | |
| Пембролизумаб: НМРЛ, исследование KEYNOTE-024 (n=305) | |||||
| Пембролизумаб 200 мг (единая дозировка) 1 раз в 3 нед | Не достигнута (частота ответа 45%) |
Не достигнута | 10,3 мес | 40% (р=0,005) |
26% |
| ХТ: дублет с обязательным включением препарата платины, 4–6 курсов | 6,3 мес (частота ответа 28%) |
Не достигнута | 6 мес | 51% | |
| Атезолизумаб: НМРЛ, исследование POPLAR (n=850) | |||||
| Атезолизумаб 1200 мг | 16,3 мес | 12,6 мес | 2, 8 мес | 27% (р=0,04) |
15% |
| Доцетаксел 75 мг/м² | 6,2 мес | 9,7 мес | 4 мес | 43% | |
Новые данные свидетельствуют о том, что иммунотерапевтический подход к лечению больных НМРЛ может значимо улучшить результаты терапии по сравнению со стандартной ХТ. Текущие исследования приближают нас к возможно новой эре терапии РЛ, где основополагающую концепцию определит иммунология.
Список использованной литературы
1. Ганул А.В., Совенко В.М., Храновская Н.Н. и др. (2013) Применение иммунотерапевтических методов в лечении больных раком легкого. Клин. онкол., 3(11).
2. Siegel R.L., Miller K.D., Jema L.A. (2015) Cancer staistics, 2015. CA Cancer J. Clin., 65(1): 5–29.
3. Breathnach O.S., Freidlin B., Conley B. еt al. (2001) Twenty-two years of phase III trials for patients with advanced non-small-cell lung cancer: sobering results. J. Clin. Oncol., 19: 1734–1742.
4. Stinchcombe T.E., Socinski M.A. (2009) Treatment paradigms for advanced stage non-small cell lung cancer in the era of multiple lines of therapy. J. Thoracic. Oncol., 4: 243–50.
5. Topalian S.L., Drake C.G., Pardoll D.M. (2012) Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity. Curr. Opin. Immunol., 24: 207–212.
6. Chen D.S., Irving B.A., Hodi F.S. (2012) Molecular pathways: next-generation immunotherapy — inhibiting programmed death-ligand 1 and programmed death-1. Clin. Cancer Res., 18: 6580–6587.
7. Keir M.E., Butte M.J., Freeman G.J., Sharpe A.H. (2008) PD-1 and its ligands in tolerance and immunity. Annu. Rev. Immunol., 26: 677–704.
8. Brahmer J., Reckamp K.L., Baas P. et al. (2015) Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N. Engl. J. Med., 373: 123–135.
9. Borghaei H., Paz-Ares L., Horn L. et al. (2015)Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N. Engl. J. Med., 373: 1627–1639.
10. Reck M., Rjdriguez-Abreu D., Robinson A.G. et al. (2016) Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N. Engl. J. Med. (published ahead October 9, 2016).
11. Peters S., Adjei A.A., Gridelli C et al. (2012) On behalf of the ESMO Guidelines Working Group. Metastatic non-small-cell lung cancer (NSCLC): ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 23 (Suppl 7): 56–64.
12. Sandler A., Gray R., Perry M.C. et al. (2006) Paclitaxel-carboplatin alone or with bevacizumab for non-small cell lung cancer. N. Engl. J. Med., 355: 2542–2550.
13. Zhu J., Sharma D.B., Gray S.W. et al. (2012) Carboplatin and paclitaxel with vs without bevacizumab in older patients with advanced non-small cell lung cancer. Apr 18; 307(15): 1593–1601.
14. Bridges A.J. (1999) The rationale and strategy used to develop a series of highly potent, irreversible, inhibitors of the epidermal growth factor receptor family of tyrosine kinases. Curr. Med. Chem., 6: 825–843.
15. Todderud G., Carpenter G. (1989) Epidermal growth factor: the receptor and its function. Bio. Factors; 2: 11–15.
16. Rosell R., Molina M.A., Serrano M.J. (2012) EGFR mutations in circulating tumour DNA. Lancet Oncol., 13: 239–246.
17. Zhou C., Wu Y.L., Chen G. et al. (2011) Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a andomized, open-label, andomized, phase 3 study. Lancet Oncol.,12: 735–742.
18. Bonanno L., Schiavon M., Nardo G. et al. (2010) Prognostic and predictive implications of EGFR mutations, EGFR copy number and KRAS mutations in advanced stage lung adenocarcinoma. Anticancer Res., 30(12): 5121–5128.
19. Li Y.-S., Jiang B.-Y., Yang J.-J. et al. (2016) Leptomeningeal metastases in non-small cell lung cancer patients with EGFR mutations. J. Thorac. Oncol. Doi: 10.1016/j.jtho.2016.06.029.
20. Solomon B.J., Mok T., Kim D.W. et al. (2014) First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N. Engl. J. Med., 371: 2167–2177.
Адрес:
Климанов Михаил Юрьевич
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака














Leave a comment