Роль ПЕТ-КТ-діагностики у ранньому виявленні рецидиву рака яєчника
Харченко Е.В., Олийниченко Е.Г., Клюсов А.Н.
Резюме. Мета дослідження — оцінити чутливість, специфічність і точність позитронно-емісійної томографії і комп’ютерної томографії (ПЕТ-КТ) для виявлення рецидиву раку яєчника (РЯ). Проведено ретроспективний аналіз даних пацієнток з діагнозом РЯ, яким в Київському міському клінічному онкологічному центрі було виконано ПЕТ-КТ-дослідження в період з 2011 по 2015 р. Усі пацієнтки отримали первинне комбіноване лікування. Загальна чутливість ПЕТ-КТ становила 93%, специфічність — 100%, рівень хибнонегативних і хибнопозитивних результатів — 4 і 0% відповідно, точність — 96%, прогностична цінність позитивного і негативного результатів — 93 і 100% відповідно. ПЕТ-КТ дозволяє виявити рецидив РЯ з високою чутливістю і специфічністю. Метод повинен використовуватися у моніторингу пацієнтів за наявності високого ризику рецидиву захворювання, при сумнівних результатах застосування інших методів візуалізації (ультразвукове дослідження, комп’ютерна томографія, магнітно-резонансна томографія) та підвищених рівнях CA-125 в сироватці крові.
Резюме. Цель исследования — оценить чувствительность, специфичность и точность позитронно-эмиссионной томографии и компьютерной томографии (ПЭТ-КТ) для выявления рецидива рака яичника (РЯ). Проведен ретроспективный анализ данных пациенток с диагнозом РЯ, которым в Киевском городском клиническом онкологическом центре выполнено ПЭТ-КТ-исследование в период с 2011 по 2015 г. Все больные получили первичное комбинированное лечение. Общая чувствительность ПЭТ-КТ составила 93%, специфичность — 100%, уровень ложноотрицательных и ложноположительных результатов — 4 и 0% соответственно, точность — 96%, прогностическая ценность положительного и отрицательного результатов — 93 и 100% соответственно. ПЭТ-КТ позволяет выявить рецидив РЯ с высокой чувствительностью и специфичностью. Метод должен использоваться в мониторинге пациентов при наличии высокого риска рецидива заболевания, сомнительных результатах применения других методов визуализации (ультразвуковое исследование, компьютерная томография, магнитно-резонансная томография) и повышенных уровнях CA-125 в сыворотке крови.
 Введение
Введение
В настоящее время рак яичника (РЯ) остается одним из наиболее распространенных онкогинекологических заболеваний, характеризующихся неблагоприятным течением. В 2014 г. в Украине зарегистрировано 3494 больные с впервые установленным диагнозом РЯ. Догодичная летальность составила 27,2%. РЯ диагностируют на I–II стадии в 35,4% случаев, на III — в 45,4%, на IV — в 13,4% [1]. На протяжении первых 2 лет после окончания лечения при IA–IIA стадии РЯ рецидивы возникают в 20–30% случаев, при IIB–IV — до 75% [2]. Раннее выявление рецидивов и метастазов обеспечивает возможность своевременного изменения плана лечения, что может повлиять на прогноз и исход заболевания.
Большинство онкогинекологов в настоящее время проводят мониторинг состояния пациентов с диагнозом РЯ путем регулярных клинических обследований и оценки опухолевых маркеров (обычно концентрации СА-125 в сыворотке крови). Онкомаркер СА-125 является чувствительным за 3–6 мес до возникновения клинического рецидива заболевания, но он не предоставляет информации о распространенности опухолевого процесса. Анатомическая локализация рецидива РЯ важна для последующего планирования лечения. Использование ультразвукового исследования (УЗИ), компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ) имеет ограниченную ценность в ранней диагностике и оценке рецидива РЯ из-за относительно низкой чувствительности и специфичности.
Более чувствительные методы визуализации помогут локализовать опухолевые поражения и выбрать тактику лечения. Большой интерес вызывает современный метод радионуклидной визуализации — позитронно-эмиссионная томография (ПЭТ). Он дополняет диагностический процесс информацией о метаболических расстройствах в очагах поражения, что существенно детализирует характеристику опухолевого заболевания.
РЯ характеризуется значительным увеличением поглощения 18-фтордезоксиглюкозы (F-ФДГ), что может быть использовано в качестве мишени для получения изображений с помощью ПЭТ. Комбинированная ПЭТ-КТ представляет собой технологию визуализации, сопоставляющую метаболические данные ПЭТ с анатомической информацией КТ.
Ввиду дороговизны ПЭТ-КТ его рутинное использование в мониторинге больных РЯ ограничено. Потенциально метод можно применять в диагностике рецидива РЯ при отсутствии признаков опухолевого процесса по данным КТ/МРТ, но с повышенной концентрацией опухолевого маркера.
Цель исследования состояла в том, чтобы оценить эффективность ПЭТ-КТ для выявления рецидива РЯ у пациенток с высоким риском рецидива заболевания после терапии первой линии, отрицательной рентгенологической визуализацией в сочетании с повышением уровня сывороточного CA-125.
Объект и методы исследования
Проведен ретроспективный анализ медицинской документации 69 пациенток с диагнозом РЯ, которым в Киевском городском клиническом онкологическом центре выполнено ПЭТ-КТ-исследование в период с 2011 по 2015 г. Все больные получили первичное комбинированное лечение (циторедуктивное хирургическое вмешательство и адъювантные курсы платиносодержащей полихимиотерапии).
Отбор участниц исследования был основан на одной из клинических ситуаций, представленных в табл. 1. Группа № 1 (n=25) представлена пациентками, которые проходили рутинное обследование без признаков prolongatio morbi. Группа № 2 (n=21) — ПЭТ-КТ выполнено при повышении уровня онкомаркера СА-125 и отсутствии клинических проявлений болезни при инструментальных методах обследования (УЗИ/КТ/МРТ) либо ввиду неоднозначных результатов визуализации независимо от уровня СА-125 в сыворотке крови. Группа № 3 (n=6) — пациентки с наличием клинических симптомов рецидива РЯ при нормальном уровне СА-125 и отрицательных или сомнительных данных КТ. Группа № 4 (n=7) — отмечены повышение CA-125 и патологические изменения по данным КТ. У этих больных ПЭТ-КТ была выполнена для планирования дальнейшего лечения, точной локализации рецидива и определения распространенности опухолевого процесса с целью планирования дальнейшего лечения. В группу № 5 вошли 10 пациенток, которым ПЭТ-КТ выполняли для оценки эффективности проводимого лечения (оценка ответа на проведенную химиотерапию).
Таблица 1. Распределение пациенток согласно клиническим ситуациям
| Группа № | СА-125 | Клиническая симптоматика | Данные инструментальных методов исследования |
|---|---|---|---|
| 1 | N | − | N |
| 2 | ↑ | − | N/неоднозначные результаты (независимо от СА-125) |
| 3 | N | + | N/неоднозначные результаты |
| 4 | ↑ | +/− | Патологические изменения |
| 5 | N/↑ | +/− | N/патологические изменения |
N — показатели в пределах нормы.
Протокол проведения исследования. ПЭТ-КТ-исследование проводили на аппаратах GE Discovery STE и PHILIPS GEMINI TF. Обследование выполняли после введения F-ФДГ (4 МБк/кг). Подготовка пациента перед сканированием: воздержание от приема пищи в течение 6 ч, водная нагрузка, перед инъекцией F-ФДГ обязательное измерение уровня глюкозы. Сканирование проводилось через 60 мин после введения активности по стандартным протоколам ПЭТ-КТ (зона обследовании от темени до верхней трети бедра) и включало: топографию, low-dose КТ-сканирование без задержки дыхания (срез 3 мм) и ПЭТ-сканирование, которое выполняли в непрерывном режиме и без изменения положения тела пациентки сразу после КТ-сканирования (положение тела определяли по индексу массы тела). Весь период сканирования составлял 20–30 мин.
Анализ изображений проводился исключительно врачами ядерной диагностики, которые были осведомлены об анамнезе заболевания, данных биохимических маркеров и результатах других методов инструментальной диагностики.
При повышенном поглощении F-ФДГ определяли точное анатомическое местоположение на КТ-изображениях. Все участки с повышенным поглощением F-ФДГ, соответствующие патологическим участкам при КТ, а не связанные с физиологическим поглощением F-ФДГ, были интерпретированы как положительные по поводу рецидива РЯ. Подозрительные участки, структурные аномалии, выявленные по данным КТ, были интерпретированы как отрицательные, если они не соответствовали зоне повышенного поглощения F-ФДГ. Для окончательного анализа диагностических показателей результаты ПЭТ-КТ сопоставляли с клинико-инструментальными данными, патогистологическим заключением (в случае выполнения хирургической вторичной циторедукции).
На основе полученных данных была рассчитана чувствительность, специфичность, уровень ложноотрицательных и ложноположительных результатов, точность и прогностическая ценность положительного и отрицательного результатов ПЭТ-КТ.
Результаты
В исследование включено 69 пациенток, клинические характеристики которых суммированы в табл. 2.
Таблица 2. Клинические характеристики пациенток (n=69)
| Характеристика | Показатель |
|---|---|
| Средний возраст, лет | 55,43±8,71 (41–72) |
| Гистологический тип, n (%) | |
| Папиллярно-серозная аденокарцинома | 46 (67%) |
| Муцинозная аденокарцинома | 9 (13%) |
| Светлоклеточная аденокарцинома | 8 (12%) |
| Эндометриоидная аденокарцинома | 6 (8%) |
| Стадия, n (%) | |
| II | 37 (54%) |
| III | 24 (35%) |
| IV | 8 (11%) |
| Степень дифференцировки опухоли, n (%) | |
| 1 | 14 (20%) |
| 2 | 21 (30%) |
| 3 | 34 (50%) |
В группе № 1 (n=25) по данным ПЭТ-КТ не выявлено рецидива заболевания. Аналогичная клиническая картина подтверждена в течение последующих 6 мес.
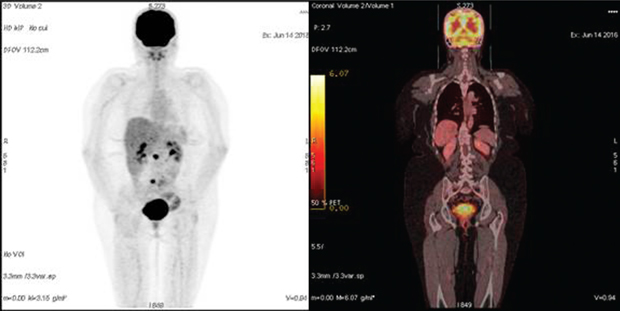
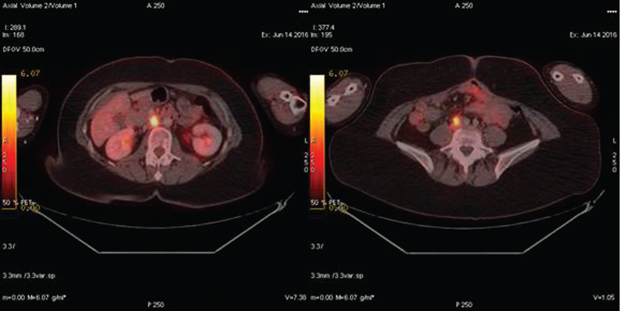
Медиана безрецидивной выживаемости в группе № 2 (n=21) составила 17 мес (1,5–60 мес). Медиана концентрации СА-125 на момент выполнения ПЭТ-КТ — 127 Ед/мл (49–796 Ед/мл). Рецидив РЯ был подтвержден в 18 случаях. Из них у 10 пациенток этой группы проведено комбинированное лечение: курсы полихимиотерапии и вторичное циторедуктивное хирургическое лечение, во время которого рецидив РЯ подтвержден морфологически. В 8 случаях больные получали курсы полихимиотерапии второй линии с положительной динамикой онкомаркера на фоне проводимого лечения; пациентки находились под клиническим наблюдением в течение последующих 3–36 мес (медиана — 22 мес). В 1 случае результаты ПЭТ-КТ были интерпретированы неверно, повышенное поглощение F-ФДГ висцеральной брюшиной было ошибочно расценено как неспецифическое накопление радиофармпрепарата в кишечнике (рис. 1). Впоследствии у этой пациентки при повторной лапаротомии выявлен канцероматоз малого таза. В 3 случаях результаты ПЭТ-КТ были отрицательными, однако в течение 3–4 мес клинически проявился рецидив болезни в виде асцита.
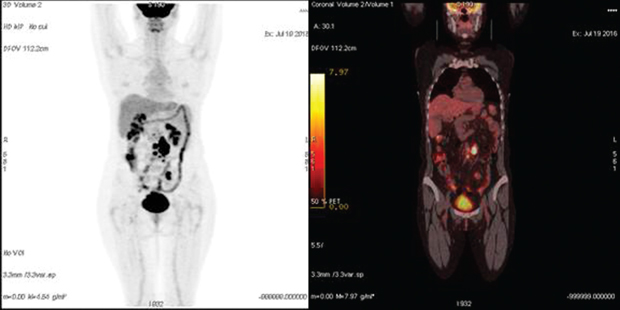
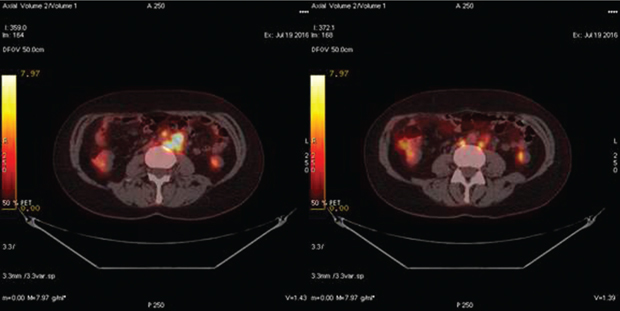
Чувствительность и специфичность ПЭТ-КТ для выявления рецидива РЯ при повышенной концентрации сывороточного СА-125 и отрицательного или сомнительного заключения КТ составили 90 и 100% соответственно.
У всех пациенток группы № 3 (n=6) по данным ПЭТ-КТ подтвержден рецидив РЯ, что в очередной раз доказало преимущества метода ПЭТ-КТ-исследования перед другими инструментальными методами.
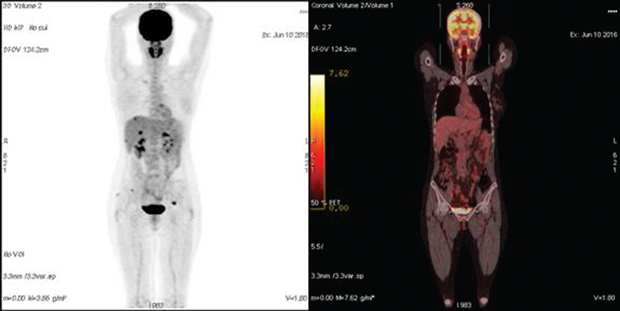
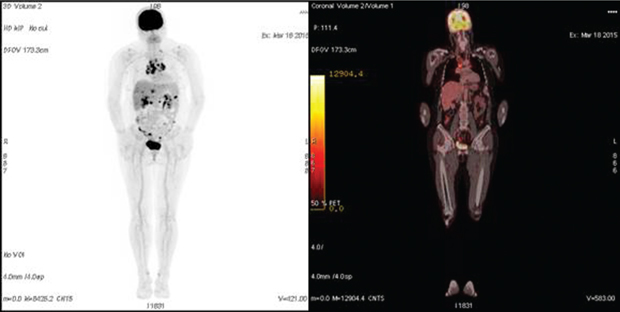
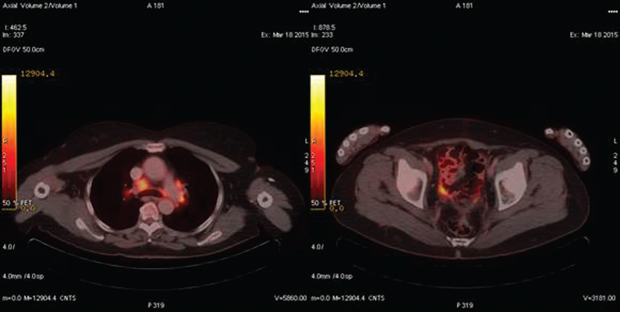
В группе № 4 (n=7) ПЭТ-КТ проводили для определения распространенности опухолевого процесса при планировании вторичной циторедукции. В 3 случаях выявлены поражения, которые не визуализировались по данным КТ (метастазы на уровне диафрагмы и селезенки), что позволило отказаться от операции и изменить тактику лечения (рис. 2). У остальных 4 пациенток результаты ПЭТ-КТ подтвердили данные предварительного инструментального метода, уточнив размеры и степень инвазии рецидивной опухоли в окружающие ткани (рис. 3). В последующем всем пациенткам успешно выполнена вторичная циторедуктивная операция, результаты патогистологического исследования подтвердили рецидив РЯ.
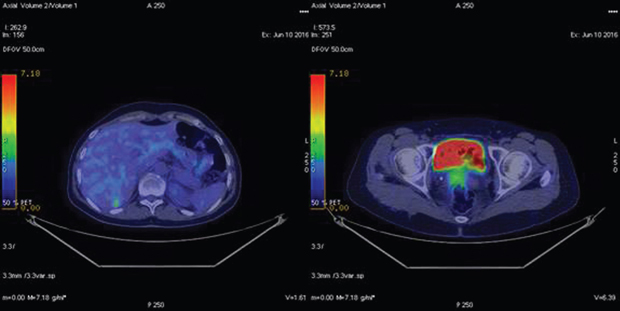
В группе № 5 (n=10) медиана времени между завершением лечения и проведением ПЭТ-КТ составила 1,6 мес (1–4 мес). В 2 случаях пациентки не реагировали на терапию, данные ПЭТ-КТ свидетельствовали в пользу прогрессирования заболевания (рис. 4). Это подтвердилось в течение 3 мес последующего наблюдения — концентрация сывороточного СА-125 повысилась с 32 до 220 Ед/мл и с 34 до 410 Ед/мл. У 2 других больных отмечена стабилизация заболевания. 6 пациенток ответили на лечение снижением сывороточной концентрации СА-125, что подтверждалось по результатам ПЭТ-КТ. В группе № 5 ПЭТ-КТ была полезной для оценки ответа на проводимую противоопухолевую терапию, так как по данным КТ четко визуализировать опухолевый процесс не представлялось возможным. Результаты ПЭТ-КТ коррелировали с клиническим течением онкологического заболевания у всех пациенток. Данное исследование было особенно полезным при отсутствии четкой визуализации опухолевых очагов согласно КТ.
По данным 5 групп пациенток, общая чувствительность ПЭТ-КТ у больных с рецидивом РЯ составила 93%, специфичность — 100%, уровень ложноотрицательных и ложноположительных результатов — 4 и 0% соответственно, точность — 96% (табл. 3), прогностическая ценность положительного и отрицательного результатов — 93 и 100% соответственно.
Таблица 3. Информативность ПЭТ-КТ при рецидиве РЯ
| Группа | Se, % | Sp, % | FN, % | FP, % | Ac, % |
|---|---|---|---|---|---|
| Группа № 1 (n=25) | − | 100 | 0 | 0 | 100 |
| Группа № 2 (n=21) | 86 | − | 14 | 0 | 86 |
| Группа № 3 (n=6) | 100 | − | 0 | 0 | 100 |
| Группа № 4 (n=7) | 100 | − | 0 | 0 | 100 |
| Группа № 5 (n=10) | 100 | − | 0 | 0 | 100 |
| Всего (n=69) | 93 | 100 | 4 | 0 | 96 |
Se — чувствительность; Sp — специфичность; FN — уровень ложноотрицательных результатов; FP — уровень ложноположительных результатов; Ac — точность.
Обсуждение
Развитие методики ПЭТ-КТ является важной вехой в визуализации в онкологии, поскольку метод совмещает функциональную и анатомическую информацию в выявлении первичных и вторичных опухолей. Дискутабельным остается вопрос определения метода контроля информативности ПЭТ-КТ. Большинство исследований используют в качестве референтного метода патогистологическое заключение исследования материала, полученного во время «second-look» лапаротомии. При отсутствии опухолевого поражения в 5–57% случаев развивается рецидив заболевания [3, 4]. Это ставит под сомнение хирургическое стадирование как золотой стандарт для сравнения эффективности других методов. Рецидив РЯ нередко вовлекает лимфатические узлы и прочие экстраабдоминальные локализации, что невозможно в полной мере оценить при «second-look» лапаротомии. В 11% случаев при таком вмешательстве не удается установить локализацию рецидива (при повышенной концентрации онкомаркера) [5]. В качестве более точного критерия рассматривается влияние диагностического подхода на течение заболевания, что отражается на показателях безрецидивной и общей выживаемости [6]. Поэтому в проведенном исследовании, как и во многих других (по данным мировой литературы), патогистологическое подтверждение не являлось обязательным для верификации результатов ПЭТ-КТ.
Чувствительность серологической диагностики CA-125, которая стандартно используется у пациенток с РЯ, не является оптимальной для выявления рецидива [7, 8]. ПЭТ-КТ позволяет выявлять поражения у 58% пациенток с концентрацией онкомаркера в пределах нормы, а также у 31% пациенток при отсутствии клинико-инструментальной симптоматики рецидива заболевания [9]. После исследования 83% пациенток нуждаются в интенсификации лечения, обратный эффект на тактику терапии необходим в 17% случаев [10]. По данным литературы, смена плана лечения происходит в среднем в 42–69% случаев [8, 11–14].
По данным метаанализа, чувствительность УЗИ в диагностике рецидива РЯ составляет 66–96%, специфичность — 23–80% [15, 16]. Метод доступный, однако его информативность оставляет желать лучшего.
Ограниченность МРТ состоит в точности 36% для выявления очагов размером менее 2 см. Существенное снижение точности ПЭТ-КТ наблюдается при исследовании образований менее 1 см [15].
ПЭТ-КТ превосходит КТ по возможностям диагностики вторичного поражения лимфатических узлов. При сопоставлении результатов послеоперационного патогистологического исследования 59,3% патологически измененных лимфатических узлов не имели соответствующей радиологической симптоматики [17]. Это обосновывает необходимость расширенных вмешательств на лимфатических коллекторах при подозрении локализации рецидива РЯ в них и повышенной концентрации СА-125 в сыворотке крови.
По результатам ПЭТ-КТ превосходят обычные методы визуализации (табл. 4), чувствительность которых относительно низка в отношении небольших поражений, особенно когда присутствуют изменения после ранее проведенного лечения (хирургические рубцы или постлучевой фиброз), которые усложняют интерпретацию изображений. В связи с этим биохимические особенности злокачественных тканей используются для выявления различий между метаболически активной тканью и наличием рубца. При рецидиве РЯ происходят изменения в метаболизме глюкозы, что, в зависимости от размера опухоли, отражается на реакции на проводимую системную терапию. Поглощение F-ФДГ зависит от гистологического типа опухоли. Светлоклеточная аденокарцинома, наличие некротических или кистозных очагов, неверная интерпретация накопления F-ФДГ кишечником являются основными источниками ложноотрицательных результатов [18–22].
Таблица 4. Сравнение информативности ПЭТ-КТ с УЗИ и КТ для диагностики рецидива РЯ (данные литературы)
| Автор, год | n | УЗИ | КТ | ПЭТ-КТ | р | |||
|---|---|---|---|---|---|---|---|---|
| Se, % | Sp, % | Se, % | Sp, % | Se, % | Sp, % | |||
| Risum S. et al. (2009) [16] | 60 | 66,0 | 90,0 | 81,1 | 90,0 | 97,0 | 90,0 | <0,05 |
| Kitajima K. et al. (2008) [26] | 40 | − | − | 37,6 | 97,1 | 69,4 | 97,5 | <0,05 |
| Kim H.W. et al. (2008) [27] | 46 | − | − | 88,5 | 65,0 | 96,2 | 90,0 | − |
| Bilici A. et al. (2010) [14] | 60 | − | − | 55,5 | 66,6 | 95,5 | 93,3 | <0,05 |
| Rusu D. et al. (2015) [10] | 53 | − | − | 60,8 | − | 92,2 | − | <0,001 |
| Tawakola A. et al. (2016) [28] | 111 | − | − | 84,0 | 59,0 | 96,0 | 92,0 | <0,001 |
Se — чувствительность; Sp — специфичность.
Метаболические параметры (SUVmax, MTV, WBMTV, TLG, WBTLG) при рецидиве РЯ ассоциированы с возможностью выполнения оптимальной вторичной хирургической циторедукции и длительностью безрецидивного периода, что имеет немаловажную прогностическую значимость [23–25]. При этом показано отсутствие корреляции между SUVmax и концентрацией СА-125 в сыворотке крови [8].
В текущем исследовании пациентки были разделены на 5 групп в зависимости от клинического сценария и показаний к ПЭТ-КТ. Метод показал удовлетворительный результат для наблюдения за пролеченными пациентами и оценки динамики проводимой терапии. Исследование позволяет уточнить наличие рецидива РЯ при дискордантных клинико-инструментальных и лабораторных показателях. На этапе планирования вторичной циторедукции диагностические возможности ПЭТ-КТ позволяют выбрать пациентов, для которых вмешательство будет с большой вероятностью выполнено в объеме оптимальной циторедукции, а также более точно планировать объем хирургического вмешательства. Полученные в текущем исследовании результаты аналогичны данным мировой литературы, посвященной изучению этого вопроса (табл. 5).
ПЭТ-КТ позволяет выявить рецидив РЯ с высокой чувствительностью и специфичностью. Метод должен использоваться в мониторинге пациентов при наличии высокого риска рецидива заболевания, сомнительных результатах других методов визуализации (УЗИ, КТ, МРТ) и повышенных уровнях CA-125 в сыворотке крови.
Таблица 5. Информативность ПЭТ-КТ при рецидиве РЯ (данные литературы)
| Автор, год | n | Se, % | Sp, % | Ac, % |
|---|---|---|---|---|
| Оригинальные исследования* | ||||
| Bristow R.E. et al. (2003) [29] | 22 | 83,3 | 75,0 | − |
| Sironi S. et al. (2004) [30] | 31 | 78,0 | 75,0 | − |
| Nanni C. et al. (2005) [6] | 41 | 88,2 | 71,4 | − |
| Simcock B. et al. (2006) [11] | 57 | 89,0 | 100 | − |
| Thrall M.M. et al. (2007) [31] | 42 | 94,5 | 100 | − |
| Fagotti A. et al. (2008) [32] | 70 | 93,0 | 55,6 | 78,6 |
| Risum S. et al. (2009) [16] | 60 | 97,0 | 90,0 | − |
| Bilici A. et al. (2010) [14] | 60 | 95,5 | 93,3 | 95,0 |
| Bhosale P. et al. (2010) [9] | 66 | 95,0 | 100 | − |
| Palomar A. et al. (2011) [33] | 175 | 100 | 100 | 100 |
| Sanli Y. et al. (2012) [34] | 47 | 97,5 | 100 | 97,8 |
| Kitajima K. et al. (2012) [35] | 120 | 86,9 | 95,9 | 92,5 |
| Antunovic L. et al. (2012) [36] | 121 | 82,0 | 87,0 | 83,0 |
| Panagiotidis E. et al .(2012) [37] | 73 | 92,4 | 85,0 | 91,0 |
| Chen Y.M. et al. (2014) [38] | 152 | 98,3 | 91,2 | 96,8 |
| Hebel C.B. et al. (2014) [39] | 48 | 97,0 | 90,0 | − |
| Takeuchi S. et al. (2014) [7] | 48 | 94,0 | 100 | 97,0 |
| Evangelista L. et al. (2015) [8] | 125 | 98,6 | 100 | − |
| Метаанализы | ||||
| Gu P. et al. (2009) [40] | 1895 | 91,0 | 88,0 | − |
| Limei Z. et al. (2013) [15] | 1651 | 88,6 | 90,3 | − |
*Степень доказательности 2В или ниже при количестве пациентов ≥40; Se — чувствительность; Sp — специфичность; Ac — точность.
Выводы
Данное исследование доказывает целесообразность применения ПЭТ-КТ в качестве предпочтительного диагностического метода визуализации в контексте рецидива РЯ. Анализ данных литературы свидетельствует о том, что огромный потенциал ПЭТ-КТ при РЯ до настоящего времени раскрыт недостаточно. Публикации в отечественной литературе на эту тему практически отсутствуют, а материалы зарубежных авторов в большинстве случаев представлены немногочисленными клиническими наблюдениями. Необходимы дальнейшие исследования, направленные на уточнение роли и места ПЭТ-КТ в комплексном обследовании пациенток с РЯ. Метод имеет значительный потенциал для повышения уровня индивидуализации лечения. Тем не менее эффективность затрат должна быть тщательно оценена в последующих работах.
Список использованной литературы
1. Рак в Україні, 2014–2015. Захворюваність, смертність, показники діяльності онкологічної служби. (2016) Бюл. нац. канцер-реєстру України № 17. Київ. 144 с.
2. Palma M.D., Gregianin M., Fiduccia P. et al. (2012) PET/CT imaging in gynecologic malignancies: a critical overview of its clinical impact and our retrospective single center analysis. Crit. Rev. Oncol. Hematol., 83: 84–98.
3. Friedman J.B., Weiss N.S. (1990) Second thoughts about second-look laparotomy in advanced ovarian cancer. N. Engl. J. Med., 322(15): 1079–1082.
4. Podratz K.C., Malkasian Jr. G.D., Wieand H.S. et al. (1988) Recurrent disease after negative second-look laparotomy in stages III and IV ovarian carcinoma. Gynecol. Oncol., 29(3): 274–282.
5. Sijmons E.A., Heintz A.P. (2000) Second-look and second surgery: second chance or second best? Semin. Surg. Oncol., 19: 54–61.
6. Nanni C., Rubello D., Farsad M. et al. (2005) (18)F-FDG PET/CT in the evaluation of recurrent ovarian cancer: a prospective study on forty-one patients. Eur. J. Surg. Oncol., 31(7): 792–797.
7. Takeuchi S., Lucchini M., Schmeler K.M. et al. (2014) Utility of 18F-FDG PET/CT in follow-up of patients with low-grade serous carcinoma of the ovary. Gynecol. Oncol., 133(1): 100–104.
8. Evangelista L., Palma M.D., Gregianin M. et al. (2015) Diagnostic and prognostic evaluation of fluorodeoxyglucose positron emission tomography/computed tomography and its correlation with serum cancer antigen-125 (CA125) in a large cohort of ovarian cancer patients. J. Turk. Ger. Gynecol. Assoc., 16(3): 137–144.
9. Bhosale P., Peungjesada S., Wei W. et al. (2010) Clinical utility of positron emission tomography/computed tomography in the evaluation of suspected recurrent ovarian cancer in the setting of normal CA-125 levels. Int. J. Gynecol. Cancer., 20: 936–944.
10. Rusu D., Carlier T., Colombié M. et al. (2015) Clinical and survival impact of FDG PET in patients with suspicion of recurrent ovarian cancer: a 6-year follow-up. Front. Med. (Lausanne), 2: 46.
11. Simcock B., Neesham D., Quinn M. et al. (2006) The impact of PET/CT in the management of recurrent ovarian cancer. Gynecol. Oncol., 103(1): 271–276.
12. Mangili G., Picchio M., Sironi S. et al. (2007) Integrated PET/CT as a first-line re-staging modality in patients with suspected recurrence of ovarian cancer. Eur. J. Nucl. Med. Mol. Imaging, 34(5): 658–666.
13. Fulham M.J., Carter J., Baldey A. et al. (2009) The impact of PET-CT in suspected recurrent ovarian cancer: A prospective multi-centre study as part of the Australian PET Data Collection Project. Gynecol. Oncol., 112(3): 462–468.
14. Bilici A., Ustaalioglu B.B., Seker M. et al. (2010) Clinical value of FDG PET/CT in the diagnosis of suspected recurrent ovarian cancer: is there an impact of FDG PET/CT on patient management? Eur. J. Nucl. Med. Mol. Imaging, 37: 1259–1269.
15. Limei Z., Yong C., Yan X. et al. (2013) Accuracy of positron emission tomography/computed tomography in the diagnosis and restaging for recurrent ovarian cancer. Int. J. Gynecol. Cancer, 23(4): 598–607.
16. Risum S., Hogdall C., Markova E. et al. (2009) Influence of 2-(18F) fluoro-2-deoxy-D-glucose positron emission tomography/computed tomography on recurrent ovarian cancer diagnosis and on selection of patients for secondary cytoreductive surgery. Int. J. Gynecol. Cancer, 19: 600–604.
17. Bristow R.E., Giuntoli II R.L., Pannu H.K. et al. (2005) Combined PET/CT for detecting recurrent ovarian cancer limited to retroperitoneal lymph nodes. Gynecol. Oncol., 99(2): 294–300.
18. Avril N., Weber W.A. (2005) Monitoring response to treatment in patients utilizing PET. Radiol. Clin. North. Am., 43(1): 189–204.
19. Torizuka T., Nobezawa S., Kanno T. et al. (2002) Ovarian cancer recurrence: role of whole-body positron emission tomography using 2-[fluorine-18]-fluoro-2-deoxy-D-glucose. Eur. J. Nucl. Med. Mol. Imaging, 29(6): 797–803.
20. Grant P., Sakelliset C., Jacene H.A. (2014) Gynecologic oncologic imaging with PET/CT. Semin. Nucl. Med., 44: 461–478.
21. Gouhar G.K., Siam S., Sadek S.M. et al. (2013) Prospective assessment of 18F-FDG PET/CT in detection of recurrent ovarian cancer. Egypt. J. Radiol. Nucl. Med., 44: 913–922.
22. Du X.I., Jiang T., Sheng X.G. et al. (2012) PET/CT scanning guided intensity-modulated radiotherapy in treatment of recurrent ovarian cancer. Eur. J. Radiol., 81: 3551–3556.
23. Kim C.Y., Jeong S.Y., Chong G.O. et al. (2015) Quantitative metabolic parameters measured on F-18 FDG PET/CT predict survival after relapse in patients with relapsed epithelial ovarian cancer. Gynecol. Oncol., 136(3): 498–504.
24. Vargas H.A., Burger I.A., Goldman D.A. et al. (2015) Volume-based quantitative FDG PET/CT metrics and their association with optimal debulking and progression-free survival in patients with recurrent ovarian cancer undergoing secondary cytoreductive surgery. Eur. Radiol., 25(11): 3348–3353.
25. Mayoral M., Fernandez-Martinez A., Vidal L. et al. (2016) Prognostic value of 18F-FDG PET/CT volumetric parameters in recurrent epithelial ovarian cancer. Rev. Esp. Med. Nucl. Imagen. Mol., 35(2): 88–95.
26. Kitajima K., Murakami K., Yamasaki E. et al. (2008) Diagnostic accuracy of integrated FDG-PET/contrast-enhanced CT in staging ovarian cancer: comparison with enhanced CT. Eur. J. Nucl. Med. Mol. Imaging, 35(10): 1912–1920.
27. Kim H.W., Won K.S., Zeon S.K. et al. (2013) Peritoneal carcinomatosis in patients with ovarian cancer: enhanced CT versus 18F-FDG PET/CT. Clin. Nucl. Med., 38(2): 93–97.
28. Tawakola A., Abdelhafezd Y.G., Osamab A. et al. (2016) Diagnostic performance of 18F-FDG PET/contrast-enhanced CT versus contrast-enhanced CT alone for post-treatment detection of ovarian malignancy. Nucl. Med. Commun., 37: 453–460.
29. Bristow R.E., del Carmen M.G., Pannu H.K. et al. (2003) Clinically occult recurrent ovarian cancer: patient selection for secondary cytoreductive surgery using combined PET/CT. Gynecol. Oncol., 90(3): 519–528.
30. Sironi S., Messa C., Mangili G. et al. (2004) Integrated FDG PET/CT in patients with persistent ovarian cancer: correlation with histologic findings. Radiology, 233(2): 433–440.
31. Thrall M.M., DeLoia J.A., Gallion H. et al. (2007) Clinical use of combined positron emission tomography and computed tomography (FDG-PET/CT) in recurrent ovarian cancer. Gynecol. Oncol., 105(1): 17–22.
32. Fagotti A., Fanfani F., Rossitto C. et al. (2008) A treatment selection protocol for recurrent ovarian cancer patients: the role of FDG-PET/CT and staging laparoscopy. Oncology, 75(3–4): 152–158.
33. Palomar A., Nanni C., Castellucci P. et al. (2012) Value of FDG PET/CT in patients with treated ovarian cancer and raised CA125 serum levels. Mol. Imaging Biol., 14: 123–129.
34. Sanli Y., Turkmen C., Bakir B. et al. (2012) Diagnostic value of PET/CT is similar to that of conventional MRI and even better for detecting small peritoneal implants in patients with recurrent ovarian cancer. Nucl. Med. Commun., 33: 509–515.
35. Kitajima K., Ueno Y., Suzuki K. et al. (2012) Low-dose non-enhanced CT versus full-dose contrast-enhanced CT in integrated PET/CT scans for diagnosing ovarian cancer recurrence. Eur. J. Radiol., 81: 3557–3562.
36. Antunovic L., Cimitan M., Borsatti E. et al. (2012) Revisiting the clinical value of 18F-FDG PET/CT in detection of recurrent epithelial ovarian carcinomas. Clin. Nucl. Med., 37(8): e184–188.
37. Panagiotidis E., Datseris I.E., Exarhos D. et al. (2012) High incidence of peritoneal implants in recurrence of intra-abdominal cancer revealed by 18F-FDG PET/CT in patients with increased tumor markers and negative findings on conventional imaging. Nucl. Med. Commun., 33(4): 431–438.
38. Chen Y.M., Chen T., Zee C.S .et al. (2014) Is there an impact of 18F-FDG PET/CT on the surveillance and clinical management of recurrent ovarian cancer? Research based on a large sample in a single PET/CT center. Nucl. Med. Commun., 35(4): 347–452.
39. Hebel C.B., Behrendt F.F., Heinzel A. et al. (2014) Negative 18F-2-fluorodeoxyglucose PET/CT predicts good cancer specific survival in patients with a suspicion of recurrent ovarian cancer. Eur. J. Radiol., 83(3): 463–467.
40. Gu P., Pan L.L., Wu S.Q. et al. (2009) CA 125, PET alone, PET-CT, CT and MRI in diagnosing recurrent ovarian carcinoma: a systematic review and meta-analysis. Eur. J. Radiol., 71: 164–174.
Адрес:
Харченко Екатерина Владимировна
03115, Киев, ул. Верховинная, 69
Киевский городской клинический онкологический центр
E-mail: kharchenkokv@i.ua














Leave a comment