Онкопластична та реконструктивна хірургія раку грудної залози. Досвід впровадження
Жигулін А.В., Палиця В.Я., Дмитренко О.А., Вінницька А.Б., Вінницька Д.К., Бондаренко В.В., Бернштейн Г.Б.
Резюме. Рак грудної залози потребує комплексного міждисциплінарного підходу в рамках спеціалізованого мамологічного центру. Це дозволяє ефективно впроваджувати та розвивати принципи онкопластичної та реконструктивної хірургії для покращання онкологічних та естетичних результатів терапії. Представлено структуру операцій, підходи до хірургічного лікування та досвід Центру сучасної мамології (ЦСМ) Лікарні ізраїльської онкології LISOD. З 2007 по лютий 2015 р. в ЦСМ було виконано 703 операції у 512 пацієнток. Проведено 295 онкопластичних органозберігаючих втручань у 288 хворих. Віддалені результати лікування відстежені у 249 (86,5%) пацієнток. Середній термін спостереження становив 39,7 (5–93) міс. Місцеві рецидиви виникли у 6 (2,4%) випадках, у 24 (9,6%) пацієнток виявлено метастатичне ураження, 15 (6,0%) з них померли. Одномоментних реконструкцій після мастектомій виконано 94 у 78 пацієнток. Одноетапні реконструкції із встановленням постійного імпланта проведено в 32 (34,0%) хворих, двохетапні операції (експандер/імплант) — 29 (30,9%). Реконструкцію торакодорсальним клаптем (ТДК) проведено у 7 (7,4%), ТДК + імплант — у 6 (6,3%), TRAM-клаптем на ніжці — у 4 (4,2%) пацієнток. Шкірозберігаючі мастектомії виконано у 35 (37,2%), сосокзберігаючі — у 24 (25,5%) пацієнток. Віддалені результати відстежено у 67 (86,0%) прооперованих. Середній термін спостереження становив 28 міс (6–70 міс). Місцевий рецидив виявлено в 1 (1,5%) пацієнтки. Віддалені метастази розвинулися у 9 (13,4%) хворих, 2 (3,0%) з них померли. Представлені результати показують високу ефективність функціонування ЦСМ, організованого відповідно до критеріїв EUSOMA, що є оптимальною моделлю і дозволяє надавати комплексну допомогу пацієнткам із раком грудної залози на найвищому рівні згідно з міжнародними стандартами.

Вступ
Рак грудної залози (РГЗ) займає провідні позиції в захворюваності та смертності у жінок як в Україні, так і у світі [1–3]. Через психологічні та соціальні аспекти, що супроводжують проблему РГЗ, страх пацієнток втратити внаслідок лікування своє самовідчуття повноцінності, привабливості та соціальний статус особливе значення мають не тільки онкологічні, але й естетичні аспекти лікування. Адже результатом будь-якого лікування має бути не лише збільшення тривалості життя, а й забезпечення його відповідної якості, що принципово важливо для пацієнток із РГЗ. Це призвело до залучення в процес терапії пластичного хірурга з усім арсеналом технологій, напрацьованих у пластичній та реконструктивній хірургії. Якщо оперувати грудну залозу, то чому б не робити це красиво?
Широке використання методів пластичної хірургії в хірургічному лікуванні РГЗ сприяло формуванню нового напряму — онкопластичної хірургії.
Онкопластична хірургія грудної залози — це стратегія, що використовує принципи пластичної хірургії для часткової чи повної реконструкції дефектів грудної залози або грудної стінки, що утворюються при видаленні пухлини [4, 5]. Згідно з критеріями W. Audretsch, який запропонував цей термін в 1998 р., підхід включає в себе такі ознаки [4]:
- адекватний онкологічний обсяг видалення пухлини;
- планування розрізів шкіри та онкологічних ексцизій паренхіми з використанням принципів мамопластики та мастопексії;
- ремоделювання залози після адекватного видалення пухлини;
- централізація сосково-ареолярного комплексу (САК);
- відновлення контралатеральної симетрії;
- збільшення або заміщення об’єму грудної залози за допомогою імпланта чи власних тканин (за потреби).
Вказані принципи з успіхом реалізуються як в органозберігаючій, так і в реконструктивній хірургії у хворих на РГЗ. Багаторічні спостереження показали повну онкологічну безпеку такого підходу із значним збільшенням задоволеності пацієнтів результатами хірургічного лікування [8, 9]. Поступово ця стратегія стає золотим стандартом у світі та все більше поширюється в Україні. Найефективніше описана стратегія реалізується в умовах спеціалізованого мамологічного центру, організованого відповідно до критеріїв Європейського товариства мамологів (European Society of Mastology — EUSOMA). Концепція мамологічного центру була розроблена та оформлена на конференції в Мілані в 1998 р. [6, 7, 10]. Прикладом її реалізації в Україні є Центр сучасної мамології (ЦСМ) Лікарні ізраїльської онкології LISOD.
Об’єкт і методи дослідження
Ми проаналізували результати хірургічного лікування пацієнток із РГЗ з 2007 по лютий 2015 р. Усі операції були виконані в ЦСМ. Пацієнток обстежували згідно з рекомендаціями Міністерства охорони здоров’я України та Національної загальної онкологічної мережі (National Comprehensive Cancer Network — NCCN) США [3]. Для встановлення діагнозу стандартним було виконання трепан-біопсії пухлини з гістологічним та імуногістохімічним дослідженням. Після діагностування та проведення стадіювання відповідно до клінічних даних кожен випадок обговорювали на міждисциплінарному онкологічному консиліумі у складі клінічного онколога, рентгенолога-мамолога, хірурга-онколога, радіотерапевта та патолога, який відбувається двічі на тиждень. Ми віддаємо перевагу органозберігаючій онкопластичній хірургії, яка, за умови подальшого опромінення грудної залози, має такі самі віддалені результати, як і мастектомія [11–17]. Протипоказанням до органозберігаючої хірургії є мультицентричні пухлини (розташовані в різних квадрантах), набрякова форма РГЗ, неможливість проведення променевої терапії (наявність опромінення ділянки грудної залози в анамнезі, вагітність, системні колагенози з ураженням шкіри) [3]. Відносним протипоказанням є наявність у пацієнтки мутації генів BRCA1/2 [3]. В усіх інших випадках рішення про варіант хірургічного лікування приймалося спільно лікарем і пацієнткою на основі конкретної клінічної ситуації. Кожній хворій пропонувалася одномоментна або відтермінована симетризуюча операція на контралатеральній грудній залозі. Усі органозберігаючі операції виконували за принципами онкопластичної хірургії. Для закриття дефектів, які утворювалися після видалення пухлини, використовували методики «переміщення» тканини (volume displacement) грудної залози, внаслідок її мобілізації і переміщення в межах самої залози відповідно до різних варіантів редукційної мамопластики та мастопексії чи відповідно до формування ротаційних клаптів. Якщо дефект був значний і перевищував 20–30% об’єму залози або якщо хвора бажала залишити незмінним об’єм оперованої залози, застосовували метод «привнесення» тканини (volume replacement). При цьому дефект заповнювався клаптем, сформованим за межами залози. Ми використовували бокові торакальні, епігастральні, торакодорсальні та інші клапті на ніжці або на перфорантних судинах. Під час операції зону ложа пухлини позначали титановими кліпсами для подальшого прицільного опромінення, а також проводили кольорове маркування країв резекції з інтраопераційною макро-, а за необхідності — і мікроскопічною оцінкою патологом на заморожених зрізах. Остаточну обов’язкову оцінку країв резекції проводили при гістологічному дослідженні після парафінової проводки препарату відповідно до попереднього маркування та вирізування патологом. При виявленні пухлини в краю резекції хворій пропонували повторне втручання з розширенням відповідного краю резекції.
Якщо була необхідна мастектомія, то перевагу надавали шкірозберігаючим мастектоміям і мастектоміям із збереженням САК, оскільки такі варіанти операцій дозволяють значно покращити естетичні результати хірургічного втручання без погіршання онкологічних [18–22]. Кожній пацієнтці пропонували реконструкцію, одномоментну чи відстрочену. За відсутності протипоказань (місцево-розповсюджена пухлина з поганою відповіддю на неоад’ювантне лікування, набрякова форма РГЗ, виражена супутня патологія, небажання пацієнтки, метастатичне ураження) перевагу надавали одномоментній реконструкції. Варіант реконструкції — імплантом, клаптем (торакодорсальний клапоть (ТДК), TRAM (transverse rectus abdominis muscle)-клапоть на ніжці) або поєднанням цих методів — вибирали залежно від стану м’яких тканин у зоні операції та в донорській зоні, необхідності ад’ювантної радіотерапії, розмірів залози та побажань самої пацієнтки. При виборі одномоментної реконструкції на основі імпланта використовували схему одно- або двохетапної реконструкції. Одноетапна схема включала в себе реконструкцію грудної залози постійним імплантом за умови адекватного закриття його місцевими тканинами (нижнім шкірним клаптем та/або м’язами), привнесеними клаптями чи біологічним імплантом — ацелюлярним дермальним матриксом (АДМ), який використовується для закриття нижнього полюса імпланта [23]. При виконанні шкірно-редукційної мастектомії із нижнього сегмента шкіри залози формували клапоть шкіри, який деепідермізували і використовували для укриття нижнього полюса імпланта [24, 25]. При неможливості забезпечити якісне покриття для імпланта з бажаним об’ємом на першому етапі застосовували експандер, що вводиться під м’язи передньої грудної стінки. За необхідності проведення ад’ювантної радіотерапії, перед її застосуванням експандер наповнювали максимально, що дозволяло ефективно створити запас м’яких тканин до розвитку постпроменевих ускладнень. Наступним етапом була заміна експандера на постійний імплант. При цьому за потреби виконували корекцію субмамарної складки та проводили ліпографтинг у зоні реконструйованої грудної залози для підвищення якості покривного шару. Також, як правило, пацієнткам пропонували і проводили симетризуючу операцію на контралатеральній грудній залозі.
При виборі методу реконструкції власними тканинами перевагу також надавали одномоментній реконструкції, якщо не було протипоказань з боку супутньої патології.
Відстрочену реконструкцію проводили у ЦСМ пацієнткам, які пройшли всі етапи онкологічного лікування та у яких були відсутні ознаки рецидиву хвороби, або пацієнткам, які одержували лікування в інших закладах, але звернулися у LISOD із бажанням реконструювати грудну залозу чи виправити дефекти після попередніх операцій.
Оптимальним терміном відстроченої реконструкції ми вважаємо період не раніше 6 міс після закінчення онкологічного лікування. Після всіх операцій у ранній післяопераційний період одразу розпочинали реабілітаційні заходи за участю спеціаліста з фізичної реабілітації та медичного психолога. Для кожної пацієнтки розробляли індивідуальну програму з наборами вправ і режимами їх виконання. Відстеження віддалених результатів лікування проводили за даними внутрішньолікарняної бази за умови регулярного відвідування пацієнтками ЦСМ. Хворих, які не зверталися в LISOD у подальшому, або їхніх родичів ми опитували по телефону.
Результати
За період з 2007 по лютий 2015 р. у ЦСМ Лікарні ізраїльської онкології LISOD оперовано 512 пацієнток із РГЗ, виконано 703 операції. Структура оперативних втручань зображена на рис. 1.
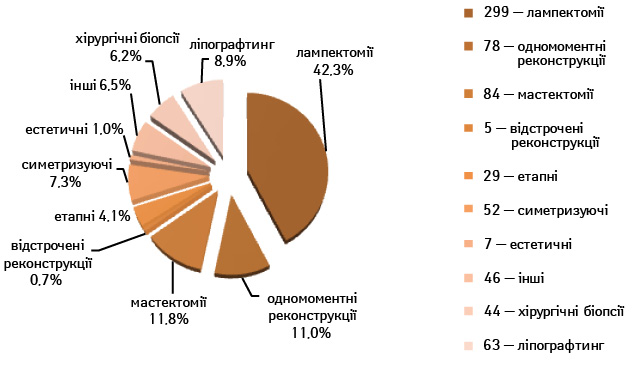
Органозберігаюча хірургія
За вказаний період у ЦCМ LISOD виконано 295 (42,0%) онкопластичні органозберігаючі операції у 288 пацієнток. Середній вік пацієнток становив 53 (22–85) роки. Двобічні операції з приводу білатерального раку виконано у 7 (2,4%), одномоментні симетризуючі — у 14 (4,7%) жінок. Розподіл за стадіями представлено в табл. 1.
Таблиця 1. Розподіл за стадіями пацієнтів, яким виконано органозберігаючі онкопластичні операції
| 0 | 1 | 2а | 2b | 3a | 3b | 3c |
| 8 (2,7%) | 70 (23,7%) | 106 (36,6%) | 62 (21,0%) | 32 (10,9%) | 3 (1,0%) | 12 (4,1%) |
Неоад’ювантну хіміотерапію отримала 51 (17,7%) пацієнтка. Показаннями до неоад’ювантного лікування були III стадія хвороби чи велике співвідношення розміру пухлини та розміру грудної залози. Ми відстежили віддалені результати лікування у 249 (86,5%) пацієнток. Середній термін спостереження становив 39,7 (5–93) міс. Місцеві рецидиви виникли у 6 (2,0%) хворих, причому у 2 із них прояви місцевого рецидиву з’явилися одночасно з віддаленими метастазами. У 24 (9,6%) пацієнток виявили метастатичне ураження, 15 (6,0%) з них померли.
Аналізуючи періопераційні дані, ми виявили, що середня маса видаленого препарату становила 105 г (6–1034 г), середній розмір — 3,1 см (0,8–7,7 см). Біопсія сигнального лімфовузла була виконана у 195 (66,1%), а аксилярна лімфаденектомія — у 126 (42,7%) випадках. В ситуації, коли пухлина не пальпувалася, ми використовували тонкоголкову локалізацію під контролем мамографії у 38 пацієнток, радіоактивну розмітку (radioactive occult lesion localization —ROLL) — у 18, а інтраопераційне ультразвукове дослідження — у 25. Пухлина в краї резекції була виявлена у 13 (4,4%) випадках.
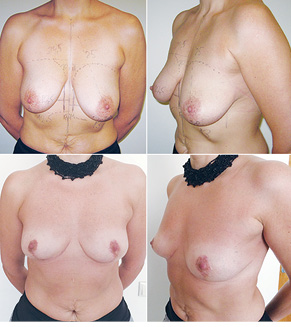
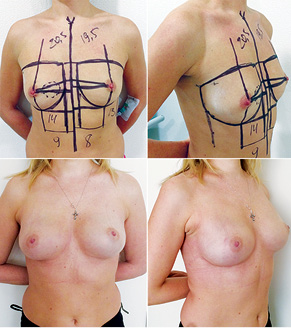
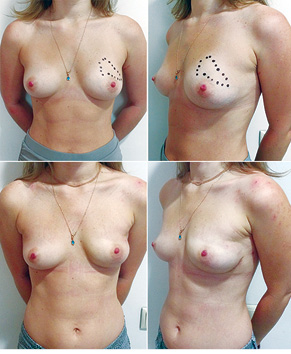
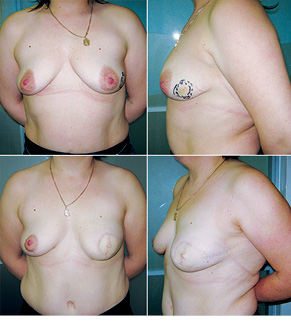
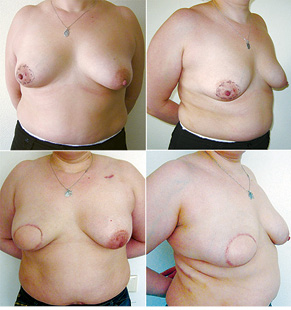
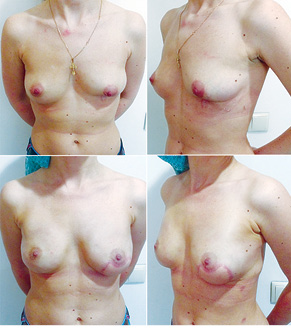
Відповідно до технік, які використовувалися при закритті дефектів після видалення пухлини, операції розподілили таким чином: пластика 1-го рівня відповідно до класифікації K. Clough [26] — 104 (36,2%) (рис. 2), пластики за принципом редукційної мамопластики — 59 (20,0%) (рис. 3–5), мамопластики за принципом мастопексії (періареолярна, вертикальна) — 24 (8,3%) (рис. 6, 7) пацієнтки. Переміщення тканин (volume replacement) з використанням клаптів (епігастральний, різні варіанти бокового торакального, торакодорсальний, розширений ротаційний клапті та ін.) — у 71 (24,1%) пацієнтки (рис. 8–12).
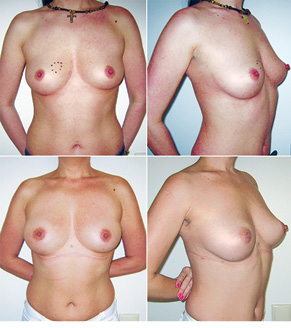
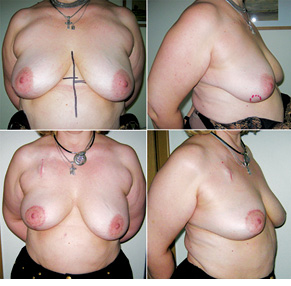
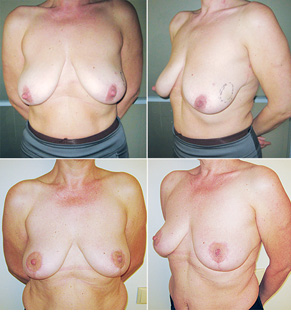
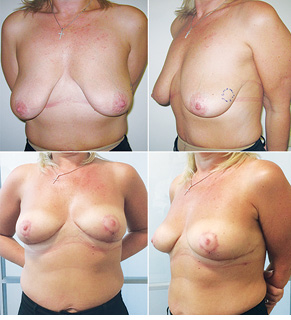
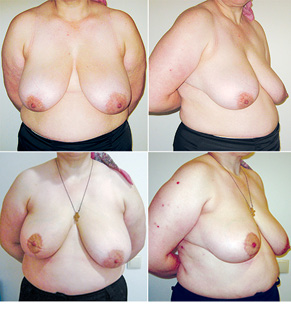

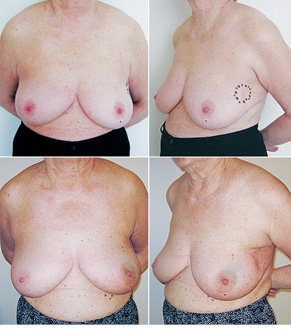
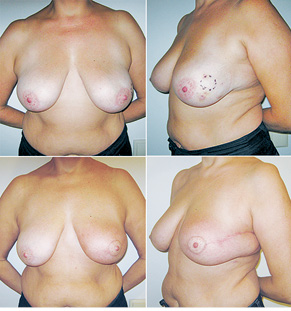

Ускладнення виникли у 55 (24,7%) хворих: серома ділянки післяопераційної рани — 23, серома в донорській ділянці (спина) — 3, гематома — 12, целюліт — 4, ранній жировий некроз — 3, ішемія країв рани — 3, некроз країв рани — 4, некроз клаптя — 2, спонтанний пневмоторакс — 1.
Одномоментні реконструкції
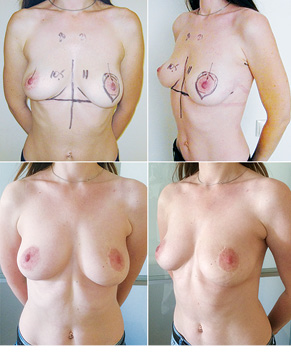
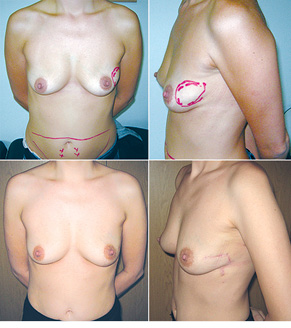
З 2007 по лютий 2015 р. виконано 94 одномоментні реконструкції у 78 пацієнтів. Середній вік пацієнток становив 45 років (29–71 рік). Проведено 16 (17,0%) двобічних операцій. Одноетапні реконструкції зі встановленням постійного імпланта виконано у 32 (34,0%) випадках, із використанням АДМ для підтримки нижнього полюса проведено 16 (17,0%) операцій, із використанням синтетичної сітки — 7 (7,4%). Двохетапні операції (експандер/імплант) виконано у 29 (30,9%) пацієнток. Реконструкцію ТДК проведено у 7 (7,4%) пацієнток, із використанням ТДК + імплант — у 6 (6,3%). Реконструкція TRAM-клаптем на ніжці застосована у 4 (4,2%) пацієнток. Шкірозберігаючі мастектомії виконано у 35 (37,2%), шкірно-редукційні — у 19 (20,2%), а сосокзберігаючі — у 24 (25,5%) хворих. Реконструкцію методом ліпографтингу за допомогою системи BRAVA проведено в 1 (1,0%) пацієнтки (рис. 13–20).
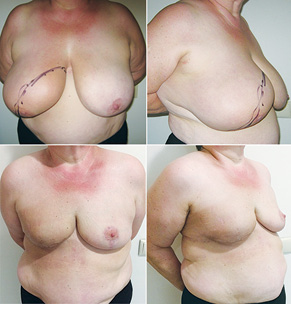
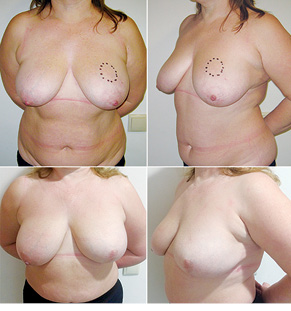
Розподіл за стадіями наведено в табл. 2. Пацієнтки з III стадією хвороби, як правило, отримували повний курс неоад’ювантної хіміотерапії відповідно до біологічних характеристик пухлини. І тільки в разі хорошої відповіді на лікування, яку констатували при повторному обстеженні після завершення хіміотерапії, пацієнткам пропонували одномоментну реконструкцію.
Таблиця 2. Розподіл за стадіями пацієнток з одномоментною реконструкцією грудної залози
| 0 | 1 | 2а | 2b | 3a | 3b | 3c |
| 8 (10,3%) | 17 (21,8%) | 19 (24,4%) | 5 (6,4%) | 12 (15,4%) | 14 (17,9%) | 3 (3,8%) |
Середня маса видаленої залози становила 451,3 г (124–2136 г). Середній розмір пухлини — 3,72 см (0,4–12 см). Біопсія сигнального лімфатичного вузла виконана у 42 (53,8%) пацієнток, аксилярна лімфаденектомія — у 34 (43,6%). Неоад’ювантну хіміотерапію отримали 30 (38,5%) пацієнток, ад’ювантну променеву терапію — 33 (42,3%), ад’ювантну хіміотерапію — 27 (34,6%). Віддалені результати відстежено у 67 (86,0%) хворих. Середній термін спостереження становив 28 міс (6–70 міс). Місцевий рецидив виявлено в 1 (1,5%) пацієнтки — рак Педжета після сосокзберігаючої мастектомії, який був успішно пролікований видаленням САК із пластикою шкірним трансплантатом. Віддалені метастази розвинулися у 9 (13,4%) пацієнток, 2 (3,0%) з них померли. Ранні післяопераційні ускладнення виявлено у 27 (28,7%) пацієнток: серома — 7, гематома — 2, целюліт — 1, ішемія країв рани — 7, некроз країв рани — 7; у 3 пацієнток внаслідок ускладнень довелося видалити імпланти. Протягом часу спостереження капсульна контрактура III ступеня розвинулася у 10 (12,0%) прооперованих.
Обговорення
Органозберігаюча хірургія грудної залози з подальшою променевою терапією, як і мастектомія, є однаково безпечними за своїми онкологічними результатами (виживаність) [11–13, 15] при лікуванні раннього РГЗ — в 0, I та II стадії. Це відображено в американських, європейських і національних українських стандартах [3, 37, 38]. Однак звичайні секторальні резекції чи лампектомії у вигляді широкого висічення та ушивання майже завжди призводять до грубих деформацій, що позначається на якості життя пацієнток [8, 9]. Впровадження принципів пластичної хірургії, зокрема техніки мастопексії та редукційної мамопластики в процес видалення пухлини та відновлення грудної залози, дозволило значно покращити не тільки естетичні, але й онкологічні результати [27], оскільки при цьому з’являється можливість більш широкого видалення паренхіми навколо пухлини. Це сприяє зменшенню кількості випадків позитивного хірургічного краю резекції і кращим естетичним результатам. Запропоновано декілька алгоритмів вибору операції залежно від співвідношення розмірів пухлини та грудної залози, локалізації пухлини відповідно до квадранта, щільності паренхіми залози, що впливає на ступінь кровообігу в ній, відстані від САК, ступеня птозу залози, вихідної асиметрії, а також готовності пацієнтки до симетризуючої операції. K. Clough [26] запропонував розділяти техніки онкопластичних операцій на два рівня складності. Перший рівень (level 1) — це просте широке висічення паренхіми з широкою мобілізацією шкіри над пухлиною та паренхіми залози над великим грудним м’язом із формуванням хірургічного доступу відповідно до природних меж (ареола, субмамарна та латеральна складка) залози. Така методика є дуже ефективною при невеликих розмірах пухлини та вираженому паренхіматозному компоненті, що забезпечує хороший кровообіг мобілізованої залози. Другий рівень (level 2) включає в себе операції, базовані на принципах мастопексії та редукційної мамопластики різноманітними варіантами — періареолярної, вертикальної мамопластики, пластики верхнім, нижнім клаптем, мамопластики за Рібейро, горизонтальної пластики та ін. Ці методики ефективні навіть при відносно великих (до 20–25%) зонах видалення і дозволяють не тільки запобігти деформаціям, але часто навіть покращити зовнішній вигляд грудної залози. Суть цих методик полягає у формуванні внутрішніх шкірно-паренхіматозних клаптів з адекватним кровопостачанням відповідно до конкретних анатомічних особливостей залози, які можна переміщати в межах самої залози із закриттям дефекту після видалення пухлини. S. McCulley та R. Macmillan запропонували розділяти підходи при другому рівні мамопластик на дві категорії [28]. Перша — сценарій А, коли пухлина міститься в межах видалення частини залози як при редукційній мамопластиці за стандартним варіантом, і друга — сценарій В, коли пухлина знаходиться в естетично значущій зоні, втручання на якій призводить до значних естетичних дефектів. Як правило, мова йде про верхній, медіальний та верхньомедіальний сектори. У такій ситуації доцільно використовувати широку мобілізацію шкіри в «мастектомічному шарі» (як при виконанні шкірозберігаючої мастектомії) із подальшим формуванням і переміщенням внутрішніх паренхіматозних клаптів, з подальшим укриттям паренхіми «незміненою» мобілізованою шкірою. Цим вимогам відповідають модифіковані техніки Ribeiro та Auber-Hester [29]. Коли дефект після видалення пухлини становить 25% і більше, а залоза має невеликі розміри, або в ситуації, коли пацієнтка бажає зберегти форму та розмір залози для запобігання симетризуючим операціям, широко застосовуються методи переміщення тканин (volume replacement). У своїй практиці ми використовували епігастральний шкірно-фасціальний клапоть, різні модифікації бокового торакального клаптя (на верхній середній та нижній основі), розширений ротаційний клапоть, LICAP-клапоть і ТДК зі шкірним острівцем або без нього.
Як видно з аналізу частоти застосування різних методик, найчастіше ми використовуємо різноманітні варіанти редукційної мамопластики та переміщення тканин. Це пов’язано з досить великим вихідним розміром пухлини на момент встановлення діагнозу, а також найкращими та стабільними естетичними результатами таких операцій. При виборі варіанта операції ми намагаємося враховувати максимальну кількість параметрів і бажання самої пацієнтки («хочу, щоб оперована залоза змінилася якнайменше» або «хочу, щоб стало краще»).
Що стосується реконструкцій, то роботи U. Veronesi, M. Nava та співавторів довели, що шкіро- та сосокзберігаючі мастектомії за умови відсутності пухлини в краї резекції, тобто ознак інфільтрації шкіри пухлиною, є безпечною альтернативою класичним мастектоміям [12, 19–22]. Також доведено, що жоден із варіантів реконструкції грудної залози — як одномоментні, так і відстрочені — не впливають на онкологічні результати лікування [3, 30–34]. Отже, кожна пацієнтка повинна бути поінформована про можливість виконання реконструкції, а також всі технічні її варіанти, навіть якщо лікар, що виконує онкологічний етап, не володіє технікою відновлення залози. Ми виходимо з презумпції реконструкції та пропонуємо її всім пацієнткам, які не мають безпосередніх протипоказань (інфільтрація шкіри пухлиною, інфільтративно-набрякова форма). У ЦСМ найчастіше виконується реконструкція із використанням імплантів, одно- або двоетапна. Під час виконання мастектомії ми намагаємося максимально зберігати шкіру та САК для збереження шкірного конверта, забезпечення оптимального укриття зони імпланта та досягнення оптимального естетичного результату. При великих розмірах залози та значній кількості шкіри з адекватним кровообігом методом вибору є шкірно-редукційна мастектомія з укриттям нижнього полюса імпланта деепідермізованим нижнім шкірним клаптем. При середньому та невеликому розмірі грудної залози перевагу надаємо сосокзберігаючим мастектоміям із нижньолатерального доступу в субмамарній складці та укриттям нижнього полюса імпланта АДМ або синтетичною сіткою. При необхідності видалення частини шкіри можливе застосування ТДК для компенсації шкіри. ТДК може використовуватися як самостійно (при невеликих розмірах залози), так і разом з імплантом (для створення додаткового об’єму при середніх розмірах залози). ТДК є надійним і простим методом реконструкції з відносно невеликою кількістю ускладнень. Проблемою цього варіанта операції є значне зменшення м’язового об’єму в пізній післяопераційний період внаслідок пересічення м’яза.
При аналізі результатів онкопластичних і реконструктивних операцій можна відмітити доволі високий відсоток післяопераційних ускладнень: 24% — при органозберігаючих онкопластичних операціях і 28% — при реконструктивних. З одного боку, це зрозуміло, оскільки складність таких операцій значно вища порівняно зі звичайними мастектоміями чи лампектоміями. Такий рівень відповідає даним літератури, де відсоток ускладнень становить від 9 до 90% [35]. З іншого боку, ці ускладнення не впливають на процес онкологічного лікування, а також на естетичні результати і задоволення пацієнток [35, 36].
Висновки
Важливим наслідком лікування є не тільки тривалість, але й якість життя пацієнток, що вимагає високих результатів від хірурга, який оперує грудну залозу. Кожна пацієнтка має право на хороший естетичний результат операції, а хірург повинен забезпечити його усіма силами. Це реалізується впровадженням у практику принципів онкопластичної та реконструктивної хірургії як частини мультидисциплінарного підходу до лікування РГЗ.
Оскільки органозберігаюча хірургія з подальшою променевою терапією дає такі самі онкологічні результати, як і мастектомія з реконструкцією чи без неї, то у хірурга та пацієнтки майже завжди є вибір у варіанті операції. Ми глибоко переконані, що хірург, який проводить операцію на грудній залозі, повинен добре володіти принципами редукційної мамопластики, мастопексії, реконструктивної хірургії імплантами та клаптями на ніжці.
Ми представили досвід хірургічного лікування пацієнток із РГЗ у рамках мультидисциплінарного підходу на базі ЦСМ LISOD з 2007 по лютий 2015 р. Центр був організований і функціонує згідно з принципами EUSOMA. Ми показали результати органозберігаючої онкопластичної хірургії та одномоментних реконструкцій після повного видалення грудної залози як із хірургічного, так і з онкологічного боку.
Онкологічні результати відповідають загальносвітовим тенденціям і даним літератури. ЦСМ, організований відповідно до критеріїв EUSOMA, є оптимальною моделлю, що дозволяє надавати комплексну допомогу пацієнткам із РГЗ на найвищому рівні згідно з міжнародними стандартами.
Список використаної літератури
1. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2015) Рак в Україні, 2013–2014. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Національного канцер-реєстру України, 16: 106.
2. Jemal A., Bray F., Center M.M. et al. (2011) Global cancer statistics. CA Cancer J. Clin., 61: 69–90.
3. NCCN guidelines (https://subscriptions.nccn.org/gl_login.aspx?ReturnURL=http://www.nccn.org/professionals/physician_gls/pdf/breast.pdf).
4. Audretsch W.P. (1998) Reconstruction of the partial mastectomy defect: classification and method. In: Spear S.L., ed. Surgery of the breast: Principles and Art. Philadelphia: Lippincott-Raven.
5. Audretsch W., Kolotas Ch., Rezai M. et al. (1998) Tumor-specific immediate reconstruction (TSIR) in breast cancer patients. Perspectives in Plast. Surg., 11: 71–106.
6. Cataliotti L., Costa A., Daly P.A. et al. (1999) Florence Statement on breast cancer, 1998. Forging the way ahead for more research on and better care in breast cancer. Eur. J. Cancer, 35: 14.
7. Piccart M., Blamey R., Buchanan M. et al. (2001) Brussels statement on breast cancer. Eur. J. Cancer, 37: 1335–1337.
8. Asgiersson K., Rached T., McCulley S.J., Macmillan R.D. (2005) Oncological and cosmetic outcomes of oncoplastic breast conserving surgery. Eur. J. Surg. Oncol., 31: 817–823.
9. Franceschini G., Terribile D., Magno S. et al. (2012) Update on oncoplastic breast surgery. Eur. Rev. Med. Pharmacol. Sci., 16(11): 1530–1540.
10. Jassem J., Buchanan M., Jänicke F. et al. (2004) The Hamburg statement: the partnership driving the European agenda on breast cancer. Eur. J. Cancer, 40: 1810–1811.
11. Fisher B., Anderson S., Bryant J. et al. (2002) Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer. N. Engl. J. Med., 347(16): 1233–1241.
12. Veronesi U., Cascinelli N., Mariani L. et al. (2002) Twenty-year follow-up of a randomized study сomparing breast-conserving surgery with radical mastectomy for early breast cancer. N. Engl. J. Med., 347: 1227–1232.
13. Clarke M., Collins R., Darby S. et al. (2005) Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: An overview of the randomised trials. Lancet, 366: 2087–2106.
14. Blichert-Toft M., Nielsen M., Ring M. et al. (2008) Long-term results of breast conserving surgery vs. mastectomy for early stage invasive breast cancer: 20-year follow-up of the Danish randomized DBCG-82TM protocol. Acta Oncologica, 47: 672–681.
15. Morrow A.M. (2011) The evolution of the locoregional therapy of breast cancer. The Oncologist, 16: 1367–1379.
16. Hwang E., Lichtensztajn D., Gomez S. et al. (2013) Survival after lumpectomy and mastectomy for early stage invasive breast cancer: the effect of age and hormone receptor status. Cancer, 119: 1402–1411.
17. Agarwal S., Pappas L., Neumayer L. et al. (2014) Effect of breast conservation therapy vs mastectomy on disease-specific survival for early-stage breast cancer. JAMA Surg.; 149(3): 267–274.
18. Agrawal A., Sibbering D.M., Courtney C.A. (2013) Skin sparing mastectomy and immediate breast reconstruction: A review. Eur. J. Surg. Oncol., 39(4): 320–328.
19. Carlson G., Bostwick J.Ill, Styblo T. et al. (1997) Skin-sparing mastectomy oncologic and reconstructive considerations. Ann. Surg., 225(5): 570–578.
20. Nava M., Catanuto G., Pennati A. et al. (2009) Conservative Mastectomies. Aesth. Plast. Surg., 33: 681–686.
21. Lanitis S., Tekkis P.P., Sgourakis G. et al. (2010) Comparison of skin-sparing mastectomy versus non-skin-sparing mastectomy for breast cancer: a meta-analysis of observational studies. Ann. Surg., 251(4): 632–639.
22. Patani N., Mokbel K. (2008) Oncological and aesthetic considerations of skin-sparing mastectomy. Breast Cancer Res. Treat., 111(3): 391–403.
23. Martin L., O’Donoghue J.M., Horgan K. et al. (2013) Acellular dermal matrix (ADM) assisted breast reconstruction procedures: Joint guidelines from the Association of Breast Surgery and the British Association of Plastic, Reconstructive and Aesthetic Surgeons EJSO, 39: 425–429.
24. Nava M.B., Cortinovis U., Ottolenghi J. et al. (2006) Skin-reducing mastectomy. Plast. Reconstr. Surg., 118: 603.
25. Colizzi L., Lazzeri D., Agostini T. et al. (2010) Skin-reducing mastectomy: new refinements. J. Plast. Surg. Hand Surg., 44(6): 296–301.
26. Clough K., Kaufman G., Nos C. et al. (2010) Improving breast cancer surgery: a classification and quadrant per quadrant atlas for oncoplastic surgery. Ann. Surg. Oncol., 17: 1375–1391.
27. Losken A., Dugal C.S., Styblo T.M., Carlson G.W. (2014) A meta-analysis comparing breast conservation therapy alone to the oncoplastic technique. Ann. Plast. Surg., 72(2): 145–149.
28. McCulley S.J., Macmillan R.D. (2005) Planning and use of therapeutic mammoplasty — Nottingham approach. Brit. J. Plast. Surg., 58: 889–901.
29. Scott L., Shawna C. (2011) Surgery of the breast: principles and art. Lippincott Williams & Wilkins: 1602 р.
30. Bryant H., Brasher P. (1995) Breast implant and breast cancer — reanalysis of a linkage study. N. Engl. J. Med., 332: 1535–1539.
31. Nelson N.J. (2000) Silicone breast implants not linked to breast cancer risk. J. Natl. Cancer Inst., 92: 1714–1715.
32. Skinner K.A., Silberman H., Dougherty W. et al. (2001) Breast cancer after augmentation mammoplasty. Ann. Surg. Oncol., 8: 138–144.
33. Englert H., Joyner E., McGill N. et al. (2001) Women’s health after plastic surgery. Int. Med., 31: 77–89.
34. Petit J.Y., Lê M., Rietjens M. et al. (1998) Does long-term exposure to gel-filled silicone implants increase the risk of relapse after breast cancer? Tumori, 84(5): 525–528.
35. McIntosh J., O’Donoghue J.M. (2012) Review еherapeutic mammaplasty — a systematic review of the evidence. EJSO, 38: 196–202.
36. Kahn J., Barrett S., Forte C. et al. (2013) Oncoplastic breast conservation does not lead to a delay in the commencement of adjuvant chemotherapy in breast cancer patients. EJSO, 39: 887–891.
37. Наказ МОЗ України від 30.06.2015
№ 396 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при раку молочної залози» (www.moz.gov.ua/ua/portal/dn_20150630_0396.html).
38. Senkus E., Kyriakides S., Ohno S. et al. (2015) On behalf of the ESMO Guidelines Committee Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 26(5): v8–v30.
Онкопластическая и реконструктивная хирургия рака грудной железы. Опыт внедрения
Резюме. Рак грудной железы требует комплексного междисциплинарного подхода в рамках специализированного маммологического центра. Это позволяет эффективно внедрять и развивать принципы онкопластической и реконструктивной хирургии для улучшения онкологических и эстетических результатов терапии. Представлены структура операций и подходы к хирургическому лечению, а также опыт Центра современной маммологии (ЦСМ) Больницы израильской онкологии LISOD. С 2007 по февраль 2015 г. в ЦСМ выполнено 703 операции у 512 пациенток. Онкопластических органосохраняющих операций проведено 295 у 288 больных. Отдаленные результаты лечения отслежены у 249 (86,5%) пациенток. Средний срок наблюдения составил 39,7 мес (5–93 мес). Местные рецидивы возникли у 6 (2,4%) прооперированных, у 24 (9,6%) выявлены метастазы, 15 (5,0%) из них умерли. Одномоментных реконструкций после мастэктомий выполнено 94 у 78 пациенток. Одноэтапные реконструкции с установкой постоянного импланта проведены у 32 (34,0%) пациенток, двухэтапные (экспандер/имплант) — 29 (30,9%). Реконструкция торакодорсальным лоскутом (ТДЛ) выполнена у 7 (7,4%), ТДЛ + имплант — у 6 (6,3%), TRAM-лоскутом на ножке — у 4 (4,2%) пациенток. Кожесохраняющие мастэктомии виполнены у 35 (37,3%), сосоксохраняющие — 24 (25,5%) пациенток. Отдаленные результаты отслежены у 67 (86,0%). Средний срок наблюдения составил 28 мес (6–70 мес). Местные рецидивы выявлены у 1 (1,5%) пациентки. Метастазы развились у 9 (13,4%) больных, 2 (3,0%) из них умерли. Представленные результаты демонстрируют высокую эффективность функционирования ЦСМ, организованного согласно критериям EUSOMA, что является оптимальной моделью и позволяет оказывать комплексную помощь пациенткам с раком грудной железы на самом высоком уровне в соответствии с международными стандартами.
рак грудной железы, онкопластическая хирургия, реконструкция грудной железы, маммологический центр.
Адреса:
Жигулін Андрій Валентинович
08720, Київська обл., Обухівський р-н, с. Плюти, вул. А. Малишка, 27
Лікарня ізраїльської онкології LISOD
E-mail: zhygulin@lisod.ua














Leave a comment