Морфологічне обґрунтування вибору аналгезії з метою профілактики гіпералгезії в післяопераційний період у дітей, прооперованих з приводу пухлин черевної порожнини
Резюме. У статті описано морфологічні зміни шкіри в ділянці післяопераційної рани. Виявлено, що застосування фентанілу у високих дозах (10–20 мкг/кг/год) методом постійної інфузії для знеболення в ранній післяопераційний період у дітей, прооперованих з приводу пухлин черевної порожнини, може призводити до опіоїд-індукованої гіпералгезії, яка супроводжується морфологічними змінами в шкірі навколо післяопераційної рани із розвитком у її центрі некрозу з вираженими перифокальними реактивними процесами у вигляді значного запалення та суттєвих порушень мікроциркуляції, з формуванням на 14-ту добу дрібних нервових волокон. У свою чергу, при використанні ТАP-блоку та методу комбінованої спінально-епідуральної аналгезії відмічено незначний периневральний набряк, фрагментації нервових волокон не виявлено, що свідчить про відсутність розвитку післяопераційної гіпералгезії. Застосування інфузії кетаміну сприяло незначному периневральному набряку та зменшенню післяопераційної гіпералгезії.

Вступ
Неадекватна аналгезія в ранній післяопераційний період погіршує перебіг і прогноз захворювання у цей час у дітей і підвищує рівень післяопераційних ускладнень та сприяє розвитку гіпералгезії. Гіпералгезія — це стан підвищеної чутливості до болю, який виникає внаслідок інтенсивної ноцицептивної стимуляції чи може бути індукований опіоїдними анальгетиками [1, 2, 4, 7]. Гіпералгезія реалізується переважно на рівні спинного мозку і асоціюється зі збільшенням інтенсивності болю та, відповідно, розвитком стрес-відповіді на біль, підвищенням ризику хронізації болю, розвитком толерантності до опіоїдів і потребою у підвищенні доз [3, 5, 8]. Для діагностики гіпералгезії стандартно проводять визначення больового порогу за допомогою монофіламентів фон Фрея (Von Frey monofilaments) в зоні післяопераційної рани, використовуючи монофіламенти у зростаючому порядку до найменшої сили тиску, що сприймається досліджуваним як больове відчуття [4, 6, 9].
Метою нашого дослідження було встановити морфологічні зміни в ділянці шкіри післяопераційної рани та особливості розвитку гіпералгезії після застосування в ранній післяопераційний період різних схем знеболення у дітей з онкологічною патологією.
Об’єкт і методи дослідження
Дослідження проведені у 47 дітей віком 13,4±2,4 року, прооперованих з приводу пухлин черевної порожнини — 24 (51%) пацієнти та пухлин заочеревинного простору — 23 (49%). Залежно від методики знеболення пацієнти були поділені на 4 групи: 1-ша група — 12 дітей, які одержували знеболення безперервною внутрішньовенною інфузією фентанілу; 2-га група — 10 дітей, у яких застосовували знеболення методом комбінованого блоку поперечного простору живота (transversus abdominis plane block — ТАР-блок) бупівакаїном; 3-тя група — 13 пацієнтів, у яких проводили знеболення методом комбінованої спінально-епідуральної аналгезії (КСЕА); та 4-та група — 12 дітей, які отримували знеболення безперервною внутрішньовенною постійною інфузією кетаміну [2–4]. Усім хворим проводили комплексне інтенсивне лікування: інфузійна та трансфузійна терапія, респіраторна підтримка апаратом «Hamillton C2» — режим ASV за параметрами (FiO2, 30%, PEEP 2 см H2O, PIP 15–20 см H2O), антибактеріальне лікування, посиндромна терапія. Пацієнту в ранній післяопераційний період визначали периметр мінімального больового порогу навколо післяопераційної рани. Проекцію лінії післяопераційної рани умовно розділяли на два рівні відрізки трьома точками, через які у 16 векторних напрямках, з кутом між ними 45°, за допомогою набору з 10 каліброваних монофіламентів фон Фрея здійснювали тиск на шкіру зі зростаючою силою від 4 г (39,216 мН) до 300 г (2941,176 мН) (Touch-Test Sensory Evaluator, North Coast Medical Inc., CA, USA), притискаючи монофіламенти у зростаючому порядку до поверхні шкіри під кутом 90°, доки останній не зігнеться, на 1–1,5 с. Між дослідженнями витримували адаптаційний інтервал 10 с. Механічний больовий поріг визначали як найменшу силу тиску, що спричинювала больову реакцію пацієнта (≥4 балів за поведінковою шкалою оцінки болю Behavioral Pain Scale). Больовий поріг вимірювали на поверхні навколо післяопераційної рани. На 3-тю, 7-му та 14-ту добу хворим виконували біопсію рани — брали фрагменти шкіри з прилеглими тканинами в ділянці рани, відступаючи від меж на 0,5 см. Забраний матеріал фіксувався 10% водним розчином нейтрального формаліну протягом 48 год, потім його промивали проточною водою, у подальшому проводили зневоднення у системі багатоатомних спиртів і заливали в парафін за стандартною схемою. Приготовані напівтонкі зрізи товщиною 7–8 мкм забарвлювали гематоксиліном і еозином (основний метод забарвлення гістологічних препаратів) для оцінки патологічних змін і реакцій тканин у процесі виникнення та загоєння ран (оцінка стану та склад тканин у краях і дні рани, наявність і характер патологічних та репаративних змін у ній), характеру порушень мікрогемоциркуляції. Також гістологічні препарати, виготовлені зі шматочків тканин, узятих на 14-ту добу експерименту, окрім традиційного методу забарвлення гематоксиліном та еозином, сріблили за методом Фута для визначення розвитку в тканинах у процесі загоєння ран дрібних нервових закінчень і патологічних змін. Мікроскопічне дослідження гістологічних препаратів проводили за допомогою світлового мікроскопа OLIMPUS BX 41 із застосуванням збільшення у 40, 100, 200 та 400 разів.
Результати та їх обговорення
У 1-й групі (12 пацієнтів) проводили знеболення безперервною внутрішньовенною інфузією фентанілу в дозі 10–20 мкг/кг/год (середня доза 14,7±1,4 мг/кг), 10 дітей 2-ї групи одержували знеболення методом комбінованого ТАР-блоку 0,375% розчином бупівакаїну. У групі ТAP-блоку після застосованого наркозу 10–20 мл 0,375% бупівакаїну було введено в нейрон-фасціальний простір поперечного м’яза живота в ділянці трикутника Petit з обох боків. Пункцію виконували голкою для спінальної анестезії G22 (B. Braun). Для візуалізації структур і контролю просування голки використовували конвексний датчик 4–6 МГц (Logiq 100, GE, USA) [9]. У 3-й групі (13 пацієнтів) застосовували знеболення методом КСЕА бупівакаїном 0,5% у дозі 0,3–0,4 мг/кг (середня доза 0,35±0,2 мг/кг). КСЕА-анестезію проводили за стандартною методикою на рівні сегмента LI. 4-ту групу, до складу якої входили 12 дітей, забезпечували знеболенням безперервною внутрішньовенною постійною інфузією кетаміну в дозі 0,1–0,5 мг/кг/год (середня доза 0,43±0,4 мг/кг/год) [2–4].
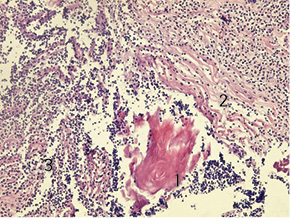
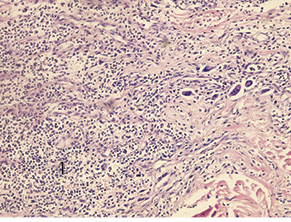
Через 3 доби після введення фентанілу у хворих 1-ї групи відзначали морфологічні зміни у тканинах, які були більш вираженими, ніж у пацієнтів інших груп. Зона пошкодження була поширеною, без чітких меж, із розвитком у її центрі некрозу (товщина шару некротизованих тканин становила до 5 мм), з вираженими перифокальними реактивними змінами у вигляді значного запалення (зона реактивних змін товщиною до 7 мм), мали місце суттєві порушення мікрогемоциркуляції. У дітей цієї групи визначалася рана з глибоким дефектом тканин шкіри на глибину до ¾ її об’єму. Краї рани були нерівні через навислі кінці потовщеного пласта епідермісу. Таке потовщення зумовлене проліферацією клітин епідермісу по краю рани та поблизу неї. Це свідчить про високу мітотичну активність клітин базального шару епідермісу, що безпосередньо прилягає до рани (у зоні шириною близько 1 мм). Пласт епідермісу в зоні ураження був із вираженими дистрофічними змінами у вигляді нерівномірного забарвлення ядер, їх балонної дистрофії, деякі епітеліоцити по самому краю перебували у стані некробіозу. Крайові відділи епідермісу дещо потовщені, із густішим розташуванням ядер і дистрофічними змінами епітеліоцитів. Стінки рани практично не визначалися, краї безпосередньо переходили у дно. Це зумовлено вибуханням збереженої сполучної тканини дерми та розширенням прилеглої гіподерми внаслідок контракції рани. Дно рани при цьому досить рівне, додатки шкіри в ділянці дна відсутні. Дерма під епітелієм складалася зі спрямованих у різних напрямках пучків колагенових та еластичних волокон. У власне дермі поза зоною запалення містилися додатки шкіри — волосяні фолікули, сальні та потові залози. Судини у дермі в зоні ураження навколо ранового каналу були паретично розширені, з вираженими дистрофічними змінами ендотелію, повнокровні, з крайовим стоянням лейкоцитів у них. Навколо додатків шкіри та периваскулярно визначалися невеликі скупчення одноядерних клітин — лімфоцитів і клітин моноцитарного ряду з наявністю поодиноких лейкоцитів. Структура прилеглої гіподерми була порушена через вогнища некрозу та значну запально-клітинну інфільтрацію. У дермі та гіподермі відзначали накопичення набрякової рідини як один із проявів розладів мікрогемоциркуляції з розволокненням колагенових і еластичних волокон власне дерми. У набряковій рідині також траплялися одноядерні клітини типу моноцитів крові, лімфоцитів, сегментоядерні лейкоцити у великій кількості (рис. 1).
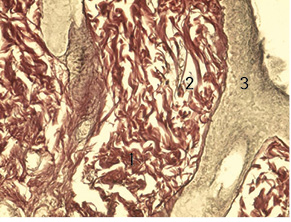
Також на 14-у добу у дітей 1-ї групи в зоні формування рубцевої тканини утворювалися дрібні нервові волокна, але в невеликій кількості. Виявлено виражений фіброз дерми з утворенням великої кількості колагенових волокон з набряком, їх розшаруванням. Зафіксовано значний периневральний набряк, фрагментацію окремих нервових волокон (рис. 2).
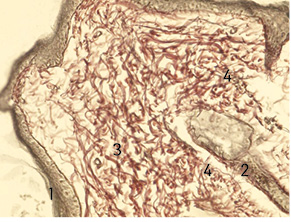
Таким чином, у 1-й групі дітей при застосуванні фентанілу в тканинах у ділянці рани визначалися найбільш виражені альтеративні та запальні зміни зі значними розладами мікрогемоциркуляції. У процесі загоєння рани утворюється майже повноцінний рубець, але з недостатнім розвитком нервових волокон і малою кількістю дериватів шкіри в ньому.
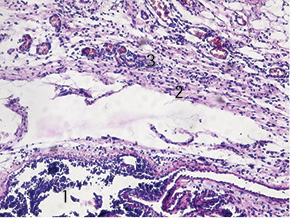
У дітей, у яких проводили знеболення методом комбінованого ТАР-блоку бупівакаїном, на 3-тю добу експерименту у тканинах виявлено рану з дефектом тканин шкіри на глибину до гіподерми. Її краї були рівні, утворені пластом епідермісу, що переходив на стінки рани. Стінки рани розташовані практично під кутом 90°, утворені тканинами власне шкіри. Дно рани було майже рівним. Зона пошкодження була тонкою, без чітких меж, із розвитком у її центрі некрозу з перифокальними реактивними змінами у вигляді помірного запалення та незначних порушень мікрогемоциркуляції. Товщина зони некрозу становила 0,1 мм, зона реактивних змін — до 2 мм. Епідерміс у зоні ураження також був з незначними дистрофічними змінами у вигляді нерівномірного забарвлення ядер, балонної дистрофії окремих ядер, деякі епітеліоцити по самому краю перебували у стані некробіозу. Крайові відділи епідермісу були дещо потовщені, із густішим розташуванням ядер і дистрофічними змінами епітеліоцитів. Дерма під епітелієм складалася зі спрямованих у різних напрямках пучків колагенових та еластичних волокон. У власне дермі містилися додатки шкіри — волосяні фолікули, сальні та потові залози. Розлади мікрогемоциркуляції були мало виражені порівняно з такими у хворих 1-ї експериментальної групи. Судини у дермі в зоні ураження були дещо розширені, з незначними дистрофічними змінами ендотелію, помірно повнокровні, з крайовим стоянням лейкоцитів у деяких із них. Навколо додатків шкіри та периваскулярно визначалися поодинокі одноядерні клітини — лімфоцити та клітини моноцитарного ряду з домішкою поодиноких лейкоцитів. Це пояснюється впливом бупівакаїну на мікроциркуляторне русло, що сприяло покращенню мікроциркуляції. Завдяки цьому у дермі та гіподермі відбувалося незначне накопичення набрякової рідини (на відміну від дітей 1-ї групи) з невеликим розволокненням колагенових і еластичних волокон власне дерми. У набряковій рідині також траплялися одноядерні клітини типу моноцитів крові, лімфоцитів, поодинокі сегментоядерні лейкоцити (рис. 3).
Також на 14-ту добу у дітей 2-ї групи в зоні формування рубцевої тканини відбувалося утворення дрібних нервових волокон у великій кількості. Відмічено виражений фіброз дерми з утворенням великої кількості колагенових волокон з незначним набряком, їх розшаруванням. Виявлено незначний периневральний набряк, фрагментації нервових волокон не спостерігали (рис. 4).
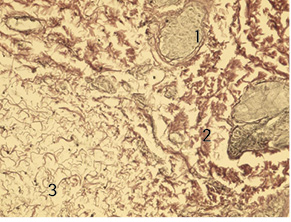
Таким чином, відзначені зміни свідчать про повне усунення запалення та загоєння рани з формуванням сполучнотканинного рубця, в якому відбуваються процеси ремоделювання. У 3-й групі дітей, які одержували знеболення методом КСЕА, у результаті купірування запалення утворюється повноцінний рубець з додатками шкіри без запальних змін і розладів мікрогемоциркуляції з формуванням великої кількості дрібних нервових волокон без вираженого набряку та їх фрагментації. Патологічні та репаративні зміни мали той самий характер, що в 2-й групі (ТАР-блок).
У 4-й групі хворих дітей (знеболення із застосуванням кетаміну) у тканинах визначалися зміни, подібні до змін на 3-тю добу у дітей 1-ї групи (введення фентанілу), але вони також були менш вираженими. На 3-тю добу від початку експерименту у дітей 4-ї групи також була рана із зоною запалення тканин глибиною на всю товщу дерми до гіподерми та м’язової тканини, однак вона була значно меншою порівняно із зоною запалення у хворих 1-ї групи (введення фентанілу). Її товщина становила 2–3 мм. У більш ранні терміни фіксували процеси проліферації, а саме розвиток грануляційної тканини з подальшим утворенням рубцевої тканини. Краї рани утворені потовщеним пластом епідермісу з підвищеною проліферацією клітин базального шару. Дно рани нерівне, припідняте за рахунок контракції рани та пошарово утворене вузьким шаром детриту (некротизована сполучна тканина дерми) та жировою клітковиною гіподерми. Зона некротизованих тканин тонка, відмежована демаркаційною лінією від зони реактивних змін у тканинах. Молода грануляційна тканина також вже утворилася до цього терміну. Вона практично не містила колагенових волокон, була інфільтрована сегментоядерними лейкоцитами та помірною кількістю лімфогістіоцитарних елементів, містила незначну кількість молодих фібробластів. У ній відзначали утворення великої кількості нових дрібних судин із розмноженням ендотеліальних клітин капілярів-ангіобластів, які спочатку утворювали клітинні тяжі, а потім з них формувалися судинні трубки, до яких поступала кров. У навколишні тканини з молодих новоутворених судин виходили формені елементи крові та набрякова рідина в незначній кількості. У гіподермі мала місце реактивна запальна інфільтрація. Клітинний склад інфільтрату переважно був представлений сегментоядерними нейтрофілами, серед яких визначалися невелика кількість лімфоцитів і клітини моноцитарного ряду (макрофаги, гігантські багатоядерні клітини сторонніх тіл). Судинна реакція була у вигляді помірного повнокров’я, набряку гіподерми та сітчастого шару дерми в зоні запалення. Також визначалися поодинокі пучки колагенових волокон щільної волокнистої оформленої сполучної тканини дерми з незначними дистрофічними змінами (рис. 5).
Також на 14-ту добу в зоні сформованої рубцевої тканини з великою кількістю колагенових волокон визначалися численні дрібні нервові закінчення без їх фрагментації, лише з незначним периневральним набряком (рис. 6).
Таким чином, зміни, що відбулися, свідчать про повне загоєння ран і купірування запалення з формуванням сполучнотканинного рубця, в якому відзначають процеси його ремоделювання. У 4-й групі хворих у результаті усунення запалення та загоєння рани також утворюється повноцінний рубець із додатками шкіри без запальних змін і розладів мікрогемоциркуляції.
Висновки
Застосування фентанілу у високих дозах (10–20 мкг/кг/добу) методом постійної інфузії для знеболення в ранній післяопераційний період у дітей може призводити до опіоїд-індукованої гіпералгезії, що супроводжується морфологічними змінами у шкірі навколо післяопераційної рани.
На 3-тю добу після введення фентанілу відзначали морфологічні зміни у тканинах. Зона пошкодження була дуже поширеною, без чітких меж, із розвитком у її центрі некрозу (товщина шару некротизованих тканин становила до 5 мм) з вираженими перифокальними реактивними змінами у вигляді значного запалення (зона реактивних змін товщиною до 7 мм), мали місце суттєві порушення мікрогемоциркуляції. У свою чергу, використання методів аналгезії у вигляді ТАP-блоку та методу КСЕА практично повністю нівелює ці зміни, а при застосуванні для знеболення кетаміну у тканинах визначалися морфологічні зміни, подібні тим, що відбувалися після введення фентанілу, але вони також були менш вираженими.
На 14-ту добу на фоні застосування фентанілу в зоні формування рубцевої тканини утворювалися дрібні нервові волокна. Зафіксовано виражений фіброз дерми з утворенням великої кількості колагенових волокон із набряком, їх розшаруванням. Виявлено значний периневральний набряк, фрагментацію окремих нервових волокон, а при використанні ТАP-блоку та методу КСЕА розвинувся невеликий периневральний набряк, фрагментації нервових волокон не відмічено, що свідчить про відсутність розвитку післяопераційної гіпералгезії. Застосування інфузії кетаміну сприяло незначному периневральному набряку та зменшенню післяопераційної гіпералгезії.
Список використаної літератури
1. Айзенберг В.Л., Ульрих Г.Э., Цыпин Л.Е., Заболотский Д.В. (2012) Регионарная анестезия в педиатрии. Синтез Бук, Спб., 304 с.
2. Кучин Ю.Л. (2013) Стрес-індукована гіпералгезія у пацієнтів з множинною травмою. Біль, знеболювання та інтенсивна терапія, 2(Д): 262–266.
3. Лесной И.И., Черний В.И., Белка К.Ю. (2012) Предупреждение развития хронического послеоперационного синдрома у хирургических больных. Український журнал екстримальної медицини ім. Г.О. Можаєва, 13(3): 26–32.
4. Потапов А.Л., Кобеляцкий Ю.Ю. (2011) Обезболивание после объемных открытых абдоминальных операций — опиаты или эпидуральная аналгезия? Біль, знеболювання і інтенсивна терапія, 4: 39–42.
5. Celerier E., Gonzalez J.R., Maldonado R. (2006) Opioid-induced hyperalgesia in a murine model of postoperative pain: role of nitric oxide generated from the inducible nitric oxide synthase. Anesthesiology, 104(3): 546–555.
6. Wilder-Smith O.H., Arendt-Nielsen L. (2006) Postoperative hyperalgesia: its clinical importance and relevance. Anesthesiology, 104(3): 601–607.
7. Lavand’homme P., De Kock M., Waterloos H. (2005) Intraoperative epidural analgesia combined with ketamine provides effective preventive analgesia in patients undergoing major digestive surgery. Anesthesiology, 103(4): 813–820.
8. Lee M., Silverman S., Hansen H., Patel V., Manchikanti L. (2012) A comprehensive review of opioid-induced hyperalgesia. Pain Physician, 4(2): 145–161.
Морфологическое обоснование выбора аналгезии с целью профилактики гипералгезии в послеоперационный период у детей, прооперированных по поводу опухолей брюшной полости
Резюме. В статье отображены морфологические изменения кожи в области послеоперационной раны. Выявлено, что применение фентанила в высоких дозах (10–20 мкг/кг/ч) методом постоянной инфузии для обезболивания в ранний послеоперационный период у детей, прооперированных по поводу опухолей брюшной полости, может приводить к опиоид-индуцированной гипералгезии, которая сопровождается морфологическими изменениями в коже вокруг послеоперационной раны с развитием в ее центре некроза с выраженными перифокальными реактивными процессами в виде значительного воспаления и существенных нарушений микроциркуляции, с формированием на 14-е сутки мелких нервных волокон. В свою очередь, при использовании ТАР-блока и метода комбинированной спинально-эпидуральной аналгезии определялся незначительный периневральный отек, фрагментации нервных волокон не отмечено, что свидетельствует об отсутствии развития послеоперационной гипералгезии. Применение инфузии кетамина способствовало незначительному периневральному отеку и уменьшению послеоперационной гипералгезии.
обезболивание, гипералгезия, биопсия кожи.
Адреса:
Дмитрієв Дмитро Валерійович
21050, Вінниця, вул. Грушевського, 21/15
Вінницький національний медичний
університет ім. М.І. Пирогова
Тел.: (067) 430-94-49, (043) 246-05-02
E-mail: respiratory@inbox.ru














Leave a comment