Методика визначення макроскопічного об’єму пухлини при плануванні модульованої за інтенсивністю радіотерапії пухлин голови та шиї
Солодянникова О.І.1, Мусаєва К.О.1, Кметюк Я.В.1, Сілаєва О.С.2
- 1Національний інститут раку, Київ
- 2Всеукраїнський центр радіохірургії, Клінічна лікарня «Феофанія» ДУС, Київ
Резюме. За останнє десятиріччя відмічено значний прогрес у галузі технологій променевої терапії. Підведення дози з високою геометричною точністю відбувається шляхом впровадження стереотаксичної радіотерапії, радіохірургії, модульованої за інтенсивністю радіотерапії, тривимірного планування брахітерапії. Ці технології потребують переоцінки стандартних методик оконтурювання цільового об’єму. Наразі визначення цільового об’єму ґрунтується на даних фізикального обстеження, комп’ютерної та магнітно-резонансної томографії. В останні роки в онкології впроваджено нові методи візуалізації пухлин. Візуалізаційні модальності, такі як позитронно-емісійна томографія, однофотонна емісійна томографія та магнітно-резонансна спектроскопія забезпечують візуалізацію біологічних характеристик пухлини, надають інформацію стосовно метаболізму, фізіології та молекулярної біології тканин пухлини. Так звана молекулярна та функціональна візуалізація доповнює анатомічні дані комп’ютерної та магнітно-резонансної томографії, що є потенційною перевагою: первинна пухлина може бути більш чітко ідентифікована, а оцінка істинних розмірів здатна змінити межі макроскопічного контура пухлини.

Променева терапія є однією з основних модальностей у лікуванні пацієнтів із пухлинами голови та шиї. Її можливості безперервно прогресують із накопиченням клінічних знань і технологічним розвитком. Від початку лікування на ортовольтних установках з’ясовано, що ерадикація пухлин можлива, проте, як наслідок такого лікування, виникають гострі та пізні ускладнення. Навіть після застосування глибокопроникної телетерапії (Cobalt-60), лінійних прискорювачів і двовимірного планування лікування терапевтична ефективність методу була не найвищою. Поєднання з бустом брахітерапії оптимізувало розподіл дози між пухлиною та навколишніми нормальними тканинами. Однак такий підхід все одно не був придатним при більшості пухлин голови та шиї через анатомічні, медичні та технічні чинники [1, 2].
За останнє десятиліття відбулися радикальні зрушення в лікуванні пухлин голови та шиї. Розроблено ефективну хіміотерапію при сквамозно-клітинних карциномах голови та шиї, яку все ширше застосовують одночасно з або після радіотерапії при лікуванні нерезектабельних хворих чи задля збереження структур гортані. Оскільки встановлено, що локальний контроль залежить від загальної тривалості лікування, розроблено схеми прискореного фракціонування для зниження репопуляції пухлинних клоногенів. Результати рандамізованого дослідження K.K. Fu та співавторів [3] показали покращення дворічного локорегіонарного контролю та безрецидивної виживаності при застосуванні методики прискореного фракціонування із подальшим відстроченим бустом порівняно зі стандартним фракціонуванням.
Досягнення в розробці комп’ютерних технологій і лінійних прискорювачів також значно вплинули на лікування пацієнтів із пухлинами голови та шиї через забезпечення можливості максимізувати дозу, одержувану пухлиною, та мінімізувати дозу поглинання прилеглими нормальними критичними структурами. Планування лікування, орієнтоване на істинне зображення, та багатопелюсткові коліматори набули широкого розповсюдження та надали можливість планувати тривимірну конформну радіотерапію (3D-CRT). Розробка інверсних систем планування та методик підведення випромінювання неоднорідної інтенсивності започаткувала нову еру модульованої за інтенсивністю радіотерапії (МІРТ), яка на сьогодні є еталоном лікування при пухлинах голови та шиї [2, 4, 5].
За даними досліджень, в яких порівнювали МІРТ та інші методики лікування, МІРТ виявилася клінічно виправданою при карциномах носоглотки, синоназальної ділянки, привушної слинної залози, мигдаликів, слизової оболонки щоки та ясен, щитоподібної залози, пухлин оболонок черепних нервів. МІРТ застосовують також при повторному лікуванні попередньо опромінених карцином голови та шиї завдяки можливості обмежувати променеве навантаження на навколишні нормальні тканини при збереженні прийнятної однорідності цільової дози [2, 5, 6]. Відносні та абсолютні дозиметричні показники на антропоморфних фантомах із численними детекторами продемонстрували високий відсоток збігів реально виміряного та обчисленого розподілу дози [7].
Порівняно з іншими методиками опромінювання МІРТ дозволяє значно зменшити (на 30–50%) прояви ранньої та пізньої токсичності [8]. Також відмічають зниження ступенів ксеростомії (І–ІІ) із позитивною післялікувальною динамікою через 6 міс. При МІРТ доза на іпси- та контралатеральну привушні слинні залози не перевищує 30 Гр та розподіляється не більше ніж на 50% об’єму органа. Досягається значне зниження дози на підщелепні слинні залози, а макроскопічний пухлинний об’єм, що не отримав запланованої терапевтичної дози, не перевищує 4% (менше 95% цільової дози) [2, 5, 9].
Точна візуалізація пухлинного вогнища є ключовим фактором в плануванні МІРТ усіх злоякісних процесів голови та шиї [6, 10, 11].
На сьогодні позитронна емісійна томографія із фтор-18-флуородезоксиглюкозою у поєднанні з комп’ютерною рентгенівською томографією (18-ФДГ ПЕТ/КТ) забезпечує найбільш точну та доступну інформацію про локальне та віддалене поширення пухлинного процесу для більшості найрозповсюдженіших типів злоякісних новоутворень [12–14].
Із впровадженням ПЕТ/КТ у планування радіотерапії виникла проблема визначення стандартів цієї процедури для забезпечення максимальної візуальної інформації, уникнення потенційних технічних помилок і включення всього обсягу пухлинної тканини до об’єму тканин, які отримають тумороцидну дозу [11, 13, 14].
Оптимальним є такий план радіотерапії, при якому достатня для стійкого локального контролю доза буде підведена до патологічного вогнища, тоді як критичні органи отримають найменшу можливу дозу опромінення. Для створення такого плану потенційно радикальної радіотерапії необхідне чітке визначення меж пухлини.
Традиційно для визначення макроскопічного об’єму пухлини (МПО) застосовують стандартні візуалізаційні модальності — КТ із внутрішньовенним контрастним підсиленням і магнітнорезонансну томографію. КТ-симулятори є обов’язковою структурною одиницею обладнання відділень променевої терапії. КТ-зображення забезпечують основну структурну інформацію для визначення об’ємів опромінення на основі даних про електронну щільність об’єкта, а також є підґрунтям обчислення тривимірного розподілу дози на робочих станціях планування лікування.
У процесі конвенційного тривимірного планування КТ-дані надсилають на робочу станцію для оконтурювання пухлини та нормальних структур. МПО є найважливішим параметром, від якого цілком залежать наступні кроки планування. Після оконтурювання МПО визначають клінічний цільовий об’єм (КЦО) опромінення, враховуючи біологічні особливості субклінічного розповсюдження конкретної пухлини поза межі макроскопічного об’єму. На основі КЦО визначають запланований цільовий об’єм (ЗЦО) опромінення, що враховує похибки фізіологічного зміщення органів (внутрішній цільовий об’єм), рухів пацієнта під час процедури (інтрафракційна варіабельність), укладання пацієнта для підведення кожної наступної разової дози (міжфракційна варіабельність) [1, 15, 16].
Клініко-патологічні дослідження післяопераційного матеріалу продемонстрували, що найбільш точну оцінку розповсюдження пухлинного процесу одержують при поєднанні даних структурної та функціональної візуалізації процесу [12, 17, 18]. Тобто застосування гібридної методики ПЕТ/КТ для найбільш точного оконтурювання цільових об’ємів дає можливість скористатися всіма перевагами досягнень сучасної МІРТ. Крім того, ПЕТ/КТ є не лише найточнішим інструментом планування МІРТ, а й чутливим методом для оцінки ефективності лікування (tumor response) [19, 20]. Не менш важливою є можливість оцінки ураження лімфовузлів із включенням дрібних метаболічно активних метастатично уражених лімфовузлів до МПО та залученням крупних, лише реактивних лімфовузлів [16].
Дослідженнями доцільності використання 18-ФДГ ПЕТ/КТ для планування радіотерапії встановлено, що метаболічна візуалізація покращує стандартизацію оконтурювання об’ємів та зменшує інтра- і міжекспертну варіативність [21]. При застосуванні 18-ФДГ ПЕТ/КТ-зображень досягається: спрощення процесів точної локалізації та розповсюдженості неопластичної тканини; підвищення точності визначення уражених лімфовузлів та/чи віддалених метастатичних вогнищ. Також зменшується обсяг опромінених здорових тканин за рахунок виключення із цільових об’ємів реактивно змінених тканин, особливо при оцінці резидуальної неопластичної тканини після попереднього хіміотерапевтичного чи хірургічного лікування [19]. У ході радіотерапії можливо адаптивно змінювати її курс залежно від біологічної відповіді неопластичної тканини на основі зміни стандартизованого рівня накопичення радіофармпрепарату метаболічно активною неопластичною тканиною, що відбувається під час курсу радіотерапії [6, 15, 19]. Вищезазначений показник має суттєве прогностичне значення [20].
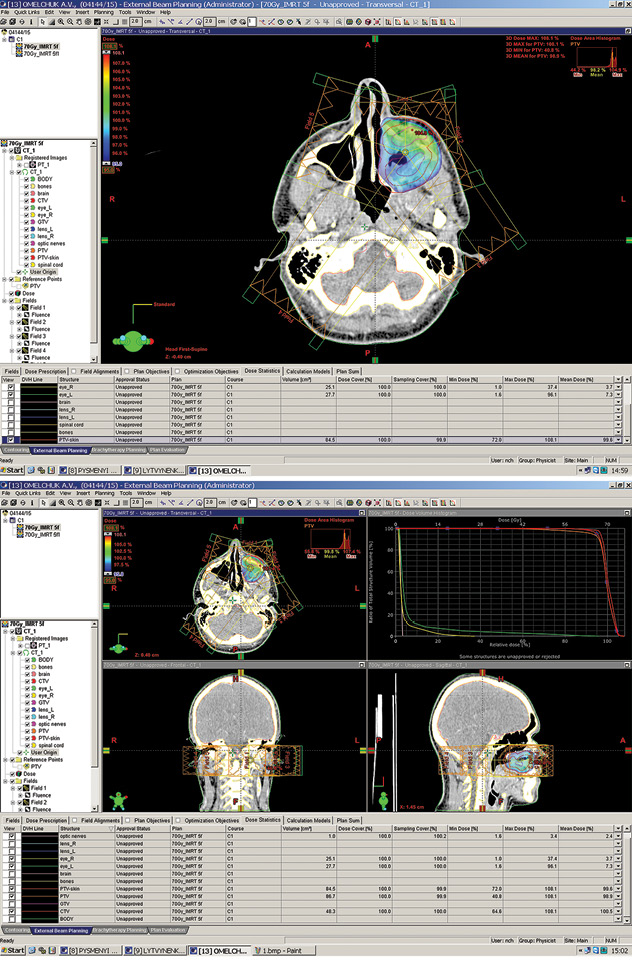
Як ілюстративний матеріал наводимо власний клінічний випадок ПЕТ/КТ-діагностики (рис. 1) та планування МІРТ (рис. 2). Так, у пацієнта з саркомою лівого максилярного синуса напівавтоматично визначали МПО як 40% SUVmax (максимальна інтенсивність стандартизованого значення накопичення): МПО + 0,5 см становить КЦО; КЦО + 0,5 см відповідає ЗЦО. У такому разі 92% ЗЦО отримає 95% дози, а доза на критичні органи (привушні слинні залози, спинний мозок, внутрішнє вухо, структури лівої орбіти) не перевищить толерантної (див. рис. 2).
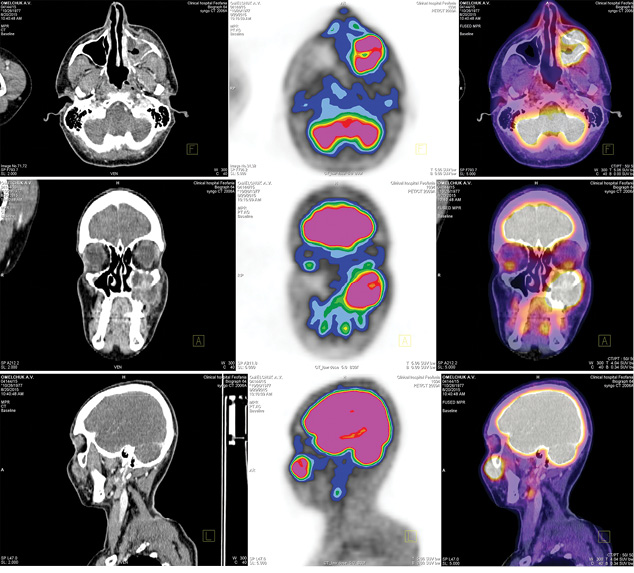
Як видно з рис. 1, ПЕТ/КТ виявила локальну розповсюдженість процесу, метаболічний об’єм пухлини. Відокремлено пухлинний процес від ретенційної гіпертрофії слизової оболонки. Визначено ураження солітарного регіонарного лімфовузла шиї зліва (рівень ІІа) та виключено віддалене системне метастазування.
Висновок
Таким чином, 18-ФДГ ПЕТ/КТ оптимізує променеве лікування пацієнтів із пухлинами голови та шиї, оскільки забезпечує одержання інформації про пухлинне мікросередовище на етапі стадіювання, протягом терапії та після неї, що відповідає принципам персоналізованої та адаптивної терапії.
Список використаної літератури
1. Burnet N.G., Thomas S.J., Burton K.E., Jefferies S.J. (2004) Defining the tumor and target volumes for radiotherapy. Cancer Imaging, 4: 153–161.
2. Merlotti A., Alterio D., Vigna-Taglianti R. et al. (2014) Technical guidelines for head and neck cancer IMRT on behalf of the Italian association of radiation oncology — head and neck working group. Radiat. Oncol., 9: 264.
3. Fu K.K., Pajak T.F., Trotti A. et al. (2000) A Radiation Therapy Oncology Group (RTOG) phase III randomized study to compare hyperfractionation and two variants of accelerated fractionation to standard fractionation radiotherapy for head and neck squamous cell carcinomas: first report of RTOG 9003. Int. J. Radiat. Oncol. Biol. Phys., 48(1): 7–16.
4. Sanderson R.J., Ironside J.A.D. (2002) Squamous cell carcinomas of the head and neck. BMJ: 822–827.
5. Chong L.M., Hunt M.A. IMRT for head and neck cancer: 193–217.
6. Gregoire V., Haustermans K., Geets X. et al. (2007) PET-based treatment planning in radiotherapy: a new standard? J. Nucl. Med., 48: 68S–77S.
7. Verellen D., Linthout N., van den Berge D. et al. (1997) Initial experience with intensity-modulated conformal radiation therapy for treatment of the head and neck region. Int. J. Radiat. Oncol. Biol. Phys., 39(1): 99–114.
8. Venkada M.G., Rawat S., Choudhury P. et al. (2012) A quantitative comparison of gross tumor volumes delineated on [18F]-FDG PET-CT scan and CECT scan in head and neck cancers. Indian J. Nucl. Med., 27(2): 95–100.
9. El-Bassiouni M., Ciernik I.F., Davis J.B. et al. (2007) [18FDG] PET-CT-based intensity-modulated radiotherapy treatment planning of head and neck cancer. Int. J. Radiat. Oncol. Biol. Phys., 286–293.
10. Ford E.C., Herman J., Yorke E., Wahl R.L. (2009) 18F-FDG PET/CT for image-guided and intensity-modulated radiotherapy. J. Nucl. Med., 50(10): 1655–1665.
11. Schinagl D.A.X, Kaanders J.H.A.M., Oyen W.J.G. (2006) From anatomical to biological target volumes: the role of PET in radiation treatment planning. Mini symposium: PET — THE FUTURE. Cancer Imaging: S107–S116.
12. Niyazi M., Landrock S., Elsner A. et al. (2013) Automated biological target volume delineation for radiotherapy treatment planning using FDG-PET/CT. Radiat. Oncol., 8: 180.
13. Kajitani C., Asakawa I., Uto F. et al. (2013) Efficacy of FDG-PET for defining gross tumor volume of head and neck cancer. J. Radiat. Res., 54: 671–678.
14. Fortin D., Basran P.S., Berrang T. et al. (2014) Deformable versus rigid registration of PET/CT images for radiation treatment planning of head and neck and lung cancer patients: a retrospective dosimetric comparison. Radiat. Oncol., 9: 50.
15. IAEA The Role of PET/CT in Radiation Treatment Planning for Cancer Patient Treatment. IAEA. Vienna: Austria, 2008: 33.
16. Grégoire V., Ang K., Budach W. et al. (2014) Delineation of the neck node levels for head and neck tumors: A 2013 update. DAHANCA, EORTC, HKNPCSG, NCIC CTG, NCRI, RTOG, TROG consensus guidelines. Radiother. Oncol., 110: 172–181.
17. Daisne J.-F., Duprez T., Weynand B. et al. (2004) Tumor volume in pharyngolaryngeal squamous cell carcinoma: comparison at CT, MR Imaging, and FDG PET and Validation with surgical specimen. Radiology, 233: 93–100.
18. Cavicchioli M., Lima E.N.P., Bitencourt A.G.V. et al. (2012) Definition of gross tumor volume with FDG-18F PET-CT in patients with head and neck cancer: comparison of different delineation methods. Appl. Cancer Res., 32(4): 102–105.
19. Bhatnagar P., Subesinghe M., Patel C. et al. (2013) Functional imaging for radiation treatment planning, response assessment, and adaptive therapy neck cancer. Radiographics, 33(7): 1909–1929.
20. Dominic A., Schinagl X., Oyen W.J., Kaanders J.H. (2011) Can FDG PET predict radiation treatment outcome in head and neck cancer? Results of a prospective study. Eur. J. Nucl. Med. Mol. Imaging, 38: 1449–1458.
21. Anderson C.M., Sun W., Buatti J.M. et al. (2014) Interobserver and intermodality variability in GTV delineation on simulation CT, FDG- PET, and MR images of head and neck cancer. Jacobs J. Radiat. Oncol., 1(1): 006.
Методика определения макроскопического объема опухоли при планировании модулированной по интенсивности радиотерапии опухолей головы и шеи
Резюме. За последнее десятилетие отмечен значительный прогресс в области технологий лучевой терапии. Подведение дозы с высокой геометрической точностью происходит посредством внедрения стереотаксической радиотерапии, радиохирургии, модулированной по интенсивности радиотерапии, трехмерного планирования брахитерапии. Указанные технологии требуют переоценки стандартных методик оконтуривания целевого объема. Сегодня определение целевого объема основано на данных физикального обследования, компьютерной и магнитно-резонансной томографии. В последнее время в онкологии все шире применяют новые методы визуализации опухоли. Визуализирующие модальности, такие как позитронно-эмиссионная томография, однофотонная эмиссионная томография и магнитно-резонансная спектроскопия обеспечивают визуализацию биологических характеристик опухоли, предоставляют информацию о метаболизме, физиологии и молекулярной биологии тканей опухоли. Так называемая молекулярная и функциональная визуализация существенно дополняет анатомические данные компьютерной и магнитно-резонансной томографии, что является потенциальным преимуществом: первичная опухоль может быть точно идентифицирована, а оценка истинных размеров способна изменить границы макроскопического контура опухоли.
ПЭТ/КТ, радиотерапия, опухоли головы и шеи.
Адреса:
Мусаєва Катерина Олександрівна
03680, Київ, вул. Академіка Заболотного, 21
Клінічна лікарня «Феофанія» ДУС
E-mail: kitlyboo@gmail.com














Leave a comment