Фактор переносу в імунотерапії експериментальної меланоми
Фільчаков Ф.В., Кукушкіна С.М., Шуміліна К.С., Льон Г.Д., Гріневич Ю.Я.
Резюме. У статті представлено експериментальні дані застосування фактора переносу (ФП) ксеногенного походження, специфічного до антигенів меланоми В16 (МВ16), для отримання якого був використаний спосіб внутрішньоочеревинної імунізації тварин-донорів (щурів) її клітинами з подальшим виділенням з екстракту сенсибілізованих лімфоцитів селезінки меланомаспецифічного ФП (ФП-С). На моделі пасивного метастазування МВ16 у мишей показано, що ФП-С при одноразовому профілактичному введенні (за 3 доби до внутрішньовенного перещеплення МВ16) відтворює протективний антиметастатичний ефект, який проявляється у зниженні частоти метастазування, зменшенні кількості та об’єму легеневих метастазів і високим індексом пригнічення метастазування. Імунотерапія мишей ФП-С, яку розпочинали на 3-тю добу після внутрішньовенного введення клітин МВ16, суттєво подовжувала тривалість життя тварин порівняно з контролем. Проте на моделі підшкірного росту МВ16 у мишей не виявлено впливу ФП-С на ріст пухлини та виживаність тварин, що вказує на доцільність використання ФП в ад’ювантному режимі. При визначенні імунотропних властивостей ФП у системі in vitro та in vivo встановлено, що ксеногенний ФП-С здатний переносити імунореактивність до антигенів МВ16 імунокомпетентним клітинам інтактних мишей. Таким чином, перенос пухлиноспецифічного імунітету за допомогою ФП є перспективним напрямом імунотерапії хворих на меланому шкіри. Застосування ФП-С у комплексному лікуванні цієї категорії хворих може стати одним зі шляхів підвищення його ефективності.
ВСТУП
Результати лікування хворих на меланому шкіри залишаються незадовільними через раннє метастазування, швидке прогресування і досить низьку чутливість пухлинних клітин до хіміопрепаратів. Інші терапевтичні підходи, що використовуються в лікуванні пацієнтів із меланомою шкіри, у тому числі й вакцинотерапія, дотепер не виявили клінічно значущих результатів [1, 2].
Разом із тим особливості клінічного перебігу меланоми шкіри, включаючи випадки спонтанної регресії пухлини та розвиток аутоімунних порушень, зокрема індукованих лікуванням, свідчать про залучення імунних механізмів у патогенез цього захворювання. Підтвердженням цього є численні результати оцінки активності меланомаспецифічних імунних реакцій у взаємозв’язку з ефективністю лікування. Така імунореактивність організму відповідає раніше сформульованим вимогам, що висуваються до протоколів біотерапії на основі імуно-опосередкованої деструкції розповсюджених солідних пухлин [2]. Зокрема, розробка і впровадження у клінічну практику високотехнологічних методів адоптивної клітинної імунотерапії, що засновані на переносі ex vivo ліній і клонів меланомаспецифічних цитотоксичних Т-лімфоцитів, дозволили отримати об’єктивну відповідь на лікування у 50–70% хворих на генералізовану меланому шкіри [3–5].
Іншим підходом до адоптивного переносу протипухлинного імунітету може бути використання фактора переносу (ФП), що виділений із лімфоцитів, сенсибілізованих до антигенів пухлини [6]. Активним компонентом ФП є низькомолекулярні трансферфакторні поліпептиди Т-клітинного походження, які здатні афінно зв’язуватися з антигеном. Продукція трансферфакторних поліпептидів рестриктована головним комплексом гістосумісності, але перенос клітинно-опосередкованої імунної відповіді за їх допомогою генетично не обмежений. У більшості випадків в імунотерапії онкологічних хворих застосовують препарати ФП, отримані з лейкоцитарної маси практично здорових людей. Такі препарати здатні підвищувати деякі показники клітинної ланки імунної системи, але не володіють доведеною пухлиноспецифічною активністю. Натомість дані наукової літератури свідчать, що ФП певної специфічності здатний індукувати у реципієнта формування клітинно-опосередкованих імунних реакцій проти пухлинних антигенів, у результаті чого досягається антиметастатичний ефект [7–10].
На нашу думку, отримання ксеногенного ФП, специфічного до антигенів меланоми шкіри, робить такий напрям досліджень перспективним для розробки нового, більш ефективного методу імунотерапії цієї категорії хворих.
Мета дослідження — експериментально обґрунтувати можливості підвищення ефективності лікування хворих на меланому шкіри шляхом переносу пухлиноспецифічної імунореактивності за допомогою ксеногенного ФП.
Об’єкт і методи дослідження
Експерименти проведено на 30 нелінійних щурах-самцях масою 100–120 г, 100 мишах лінії СВА масою 18–20 г розведення віварію Національного інституту раку та 385 мишах лінії C57BL/6 масою 18–20 г, отриманих із віварію Інституту молекулярної біології та генетики Національної академії наук України. Утримання тварин і робота з ними здійснювалися відповідно до загальноприйнятих міжнародних правил проведення досліджень на експериментальних тваринах. Дослідження схвалено Комісією з питань етики Національного інституту раку.
Дослідження проводили в експериментальній системі, в якій ФП, отриманий від тварин-донорів (у нашому випадку — щурів), мав ксеногенне походження відносно тварин-реципієнтів (у нашому випадку — мишей).
Для отримання меланомаспецифічного ФП (ФП-С) був використаний спосіб внутрішньоочеревинної імунізації тварин клітинами ксеногенної пухлини. Для цього щурам одноразово внутрішньоочеревинно вводили суспензію свіжовиділених клітин мишачої меланоми В16 (МВ16; 2•10 клітин на тварину в об’ємі 0,2 мл забуференого фізіологічного розчину — ЗФР). На 14-ту добу після імунізації з екстракту сенсибілізованих лімфоцитів селезінки щурів виділяли зразок ФП-С згідно з методом [11]. Зразок неспецифічного ФП (ФП-Н) отримували з пулу лімфоцитів селезінки інтактних щурів таким самим способом. В отриманих зразках ФП досліджували концентрацію білка за методом Бредфорда [12] та зберігали при −20 °С.
Для визначення протипухлинних та/або антиметастатичних властивостей зразків ФП проведено декілька серій експериментів:
1. Вивчення протективних ефектів ФП при його профілактичному застосуванні у мишей лінії С57BL/6 з МВ16 на моделі пасивного метастазування. Для цього інтактним мишам С57BL/6 дослідних груп за 3 доби до внутрішньовенного введення клітин МВ16 внутрішньоочеревинно вводили відповідний зразок ФП у дозі 200 пг на тварину в об’ємі 0,2 мл ЗФР, мишам контрольної групи — ЗФР в еквівалентному об’ємі. Антиметастатичний ефект оцінювали на 30-ту добу після перещеплення пухлини за показниками: частота метастазування (%), кількість метастазів (шт.), кількість метастазів (d≤0,5 мм) в аваскулярній фазі росту (%), об’єм метастазів (мм), індекс пригнічення метастазування (%). Вищезазначені показники вираховували, як описано [13].
2. Дослідження впливу зразків ФП при його терапевтичному застосуванні на ріст МВ16 та виживаність мишей лінії С57BL/6 на моделі підшкірного росту пухлини. Як експериментальну модель пухлинного процесу використали підшкірну трансплантацію клітин МВ16 у ділянку стегна мишей лінії С57BL/6. Імунотерапію проводили за двома схемами: у першому випадку її розпочинали через 2 доби після перещеплення МВ16, при цьому зразки ФП вводили внутрішньоочеревинно в дозі 200 пг на тварину 1 раз на тиждень (усього 4 ін’єкції); у другому випадку зразки ФП вводили в аналогічній дозі двічі на курс лікування (через 2 та 9 діб після перещеплення МВ16). Тварини контрольної групи отримували еквівалентну кількість ЗФР.
У мишей усіх груп проводили моніторинг росту пухлини за такими показниками: об’єм пухлини (мм), індекс гальмування росту пухлини (%), індекс росту пухлини, — розрахунок яких наведено [14]. Вплив зразків ФП на виживаність мишей лінії С57BL/6 із підшкірною МВ16 оцінювали за показником середньої тривалості життя (СТЖ).
3. Дослідження впливу зразків ФП при його терапевтичному застосуванні на виживаність мишей лінії С57BL/6 з МВ16 на моделі пасивного метастазування. Для цього мишам за 24 год до початку імунотерапії внутрішньовенно вводили клітини МВ16 (у кількості 0,5•10 клітин на тварину). Імунотерапію проводили за схемою: мишам дослідних груп внутрішньоочеревинно вводили зразок ФП у дозі 200 пг на тварину 1 раз на тиждень (всього 9 ін’єкцій); мишам контрольної групи вводили ЗФР. Виживаність тварин оцінювали за показником СТЖ.
4. Вивчення впливу зразків ФП при його терапевтичному застосуванні на ріст і розвиток легеневих метастазів у мишей лінії С57BL/6 з МВ16 на моделі пасивного метастазування, як описано вище. Імунотерапію розпочинали через 24 год після введення пухлинних клітин за схемою: мишам дослідних груп внутрішньоочеревинно вводили зразки ФП у дозі 200 пг на тварину 1 раз на тиждень (усього 3 ін’єкції); мишам контрольної групи за цією схемою вводили ЗФР. Антиметастатичний ефект оцінювали на 20-ту добу після перещеплення пухлини.
Дослідження впливу in vitro зразків ФП на відповідь лімфоцитів у змішаній культурі з клітинами МВ16 проводили на інтактних мишах ліній СВА та C57BL/6 з використанням зразків у концентрації від 10 пг/мл до 5 нг/мл.
Дослідження імунотропних ефектів ФП in vivo виконували на 3-тю та 7-му добу після одноразового внутрішньоочеревинного введення інтактним мишам C57BL/6 зразків ФП у дозі 200 пг на тварину.
Імунну відповідь у серіях експериментів in vitro та in vivo вивчали в цитотоксичному та проліферативному тестах і за рівнем апоптозу спленоцитів iз використанням методу проточної цитофлуориметрії [15]. Аналіз зразків проводили на проточному цитофлуориметрі FACScan («Becton Dickinson», США) за допомогою програми «Cell Quest». Для оцінки результатів розраховували цитотоксичний i проліферативний індекси (%) [13].
Статистичну обробку результатів проводили з використанням програм Excel (MS Office 2003, XP) та STATІSTІCA 6.0 (StatSoft Inc., США). Результати дослідження були перевірені на нормальність розподілу за допомогою критерію Шапіро — Уїлка. Для визначення вірогідності розбіжностей (р) між показниками у досліджуваних групах при нормальному розподілі значень застосовували t-критерій Стьюдента. Для значень, розподіл яких відрізнявся від нормального, використовували непараметричний критерій Манна — Уїтні [16]. Результати дослідження подано як M±m, де M — середнє арифметичне значення, m — його стандартна похибка. Розбіжності оцінювали як вірогідні при р<0,05.
РЕЗУЛЬТАТИ
Ефективність імунотерапії з використанням ФП ксеногенного походження, оцінювану за антиметастатичною та протипухлинною дією, досліджували при профілактичному або терапевтичному застосуванні у мишей лінії С57BL/6.
У першій серії експериментів вивчали протективні ефекти досліджуваних зразків ФП при їх профілактичному введенні мишам С57BL/6 на моделі пасивного метастазування МВ16 (за 72 год до внутрішньовенного перещеплення пухлинних клітин) (табл. 1).
Таблиця 1. Вплив попереднього застосування зразків ФП на пасивне метастазування МВ16 при внутрішньовенному введенні її клітин мишам лінії C57BL/6
| Групи тварин | Частота метастазування, % | Кількість метастазів, шт. | Кількість метастазів в аваскулярній фазі (d≤0,5 мм), % | Об’єм метастазів, мм | Індекс пригнічення метастазування, % |
| Контрольна (n=15) | 100,0 | 19,2±6,6 | 58,3±7,1 | 27,4±7,8 | – |
| ФП-Н (n=15) | 100,0 | 16,3±6,7 | 62,7±9,5 | 25,4±8,8 | 7,0 |
| ФП-С (n=15) | 66,7 | 4,6±2,2* | 51,2±17,1 | 4,2±2,9* | 85,0 |
*Розбіжності при порівнянні з аналогічним показником у контрольній групі статистично вірогідні (р<0,05); розбіжності при порівнянні з показником у групі ФП-Н статистично вірогідні (р<0,05).
Як свідчать дані табл. 1, на 30-ту добу після внутрішньовенного введення пухлинних клітин у контрольній групі та у мишей, що отримали ФП-Н, метастази МВ16 в легенях виявлені у 100,0% тварин. Водночас у групі тварин, яким попередньо вводили ФП-С, метастази в легенях виникли у 66,7% випадків. Кількість легеневих метастазів у мишей цієї групи вірогідно менша, ніж у тварин контрольної групи та особин iз попереднім введенням ФП-Н. Крім того, про активне формування протективного імунітету у мишей, що отримали ФП-С, може свідчити значне зменшення об’єму метастазів при порівнянні з відповідним показником як у тварин контрольної групи, так і особин з попереднім введенням ФП-Н. Разом iз тим на тлі профілактичного застосування ФП-С не відмічено збільшення кількості метастазів з малим розміром. Розбіжності в ефективності досліджуваних зразків ФП добре простежуються при порівнянні індексу пригнічення метастазування, який при попередньому введенні ФП-С становить 85,0%, а при застосуванні ФП-Н — тільки 7,0%.
Отже, результати профілактичного застосування ФП на моделі пасивного метастазування МВ16 у мишей лінії С57BL/6 свідчать про здатність ФП-С ксеногенного походження індукувати протективний ефект, на що вказують зниження частоти метастазування, зменшення кількості та об’єму метастазів і високий індекс пригнічення метастазування. Відсутність впливу ФП-С на кількість метастазів в аваскулярній фазі росту при генералізації процесу (30-та доба спостереження) може свідчити про необхідність застосування більш інтенсивного режиму імунотерапії для пролонгації отриманого ефекту або в комбінації з хіміотерапією [17].
У зв’язку з цим у наступних експериментах вивчали протипухлинні та антиметастатичні ефекти досліджуваних зразків ФП при їх терапевтичному застосуванні у мишей лінії C57BL/6 з МВ16.
Вплив імунотерапії на підшкірний ріст МВ16 у мишей C57BL/6 досліджували з використанням схем дворазового чи регулярного (4 рази впродовж періоду спостереження) введення зразків ФП (рис. 1). При дворазовому введенні ФП у першу декаду після перещеплення МВ16 спостерігається пригнічення її росту: на 11-ту добу при застосуванні ФП-Н індекс гальмування становить 44%, при ФП-С — 34%. У подальшому жоден зi зразків ФП не гальмує ріст МВ16, крім того, в термінальній фазі на тлі застосування ФП-Н може відбуватися стимуляція її росту.
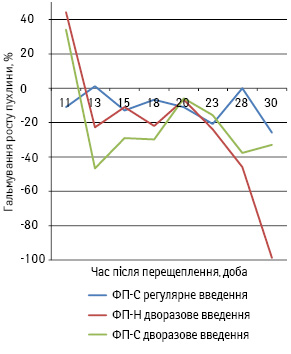
Для узагальнення протипухлинних ефектів імунотерапії з урахуванням їх динаміки, вираженості та тривалості розраховували індекс росту пухлини, який показав, що при застосованій схемі, незалежно від специфічності ФП, спостерігається стимуляція росту МВ16: індекс росту пухлини при застосуванні ФП-Н становить 1,4, а ФП-С — 1,3. Крім того, як свідчать дані рис. 1, регулярне введення ФП-С мишам лінії C57BL/6 з імплантованою під шкіру МВ16 також не призводить до гальмування її росту. Про це свідчить розрахований індекс росту пухлини, який становить 1,1. До цього можна додати, що за таких умов експерименту жоден із застосованих зразків ФП не має суттєвого впливу на СТЖ мишей лінії C57BL/6 з підшкірною МВ16.
Отже, при терапевтичному застосуванні ксеногенного ФП у мишей лінії С57BL/6 з імплантованою під шкіру МВ16 пригнічення росту пухлини відзначають лише на ранній стадії пухлинного процесу, надалі цей ефект зникає, що несприятливо позначається на загальній виживаності тварин. Такі результати вказують на необхідність максимального зменшення маси пухлини в організмі за допомогою основних методів протипухлинного лікування перед застосуванням імунотерапії. Автори [18, 19] також отримали результати, що свідчать про максимальну ефективність ФП за умов його застосування після видалення пухлини з організму.
У наступній серії експериментів вивчали протипухлинні ефекти при терапевтичному застосуванні ФП у мишей лінії С57BL/6 на моделі пасивного метастазування МВ16 (табл. 2).
Таблиця 2. Вплив терапевтичного введення зразків ФП на розвиток метастазів у легенях мишей лінії С57BL/6 на моделі пасивного метастазування МВ16
| Групи тварин | Частота метастазування, % | Кількість метастазів, шт. | Кількість метастазів в аваскулярній фазі (d≤0,5 мм), % | Об’єм метастазів, мм | Індекс пригнічення метастазування, % |
| Контрольна(n=15) | 100,0 | 22,0±5,1 | 74,0±14,4 | 6,3±2,9 | – |
| ФП-Н(n=15) | 100,0 | 36,1±12,8 | 51,6±10,8 | 15,8±7,3 | 150,0 |
| ФП-С(n=15) | 86,7 | 15,6±4,9 | 51,2±17,1 | 5,2±2,8 | 18,0 |
Як видно з даних, наведених у табл. 2, на 20-ту добу після внутрішньовенного перещеплення МВ16, в умовах введення ФП-С (3 ін’єкції) частота метастазування є дещо нижчою, ніж у контролі (відповідно 86,7 та 100,0%). Об’єм i кількість метастазів у легенях тварин цієї групи не відрізняються від аналогічних показників у контрольній групі. Застосування ФП-С призводить до зменшення в 1,5 раза кількості метастазів в аваскулярній фазі росту. Індекс пригнічення метастазування в цій групі становить 18,0%. Навпаки, введення ФП-Н в аналогічних умовах експерименту асоціюється з прогресуванням пухлинного процесу. Крім того, регулярне введення ФП-Н мишам лінії С57BL/6 (9 ін’єкцій) після внутрішньовенного перещеплення МВ16 не призводить до збільшення СТЖ тварин (39,8±4,1 доби проти 35,1±3,1 доби в контролі; р>0,05). Натомість ФП-С у цих умовах суттєво покращує виживаність мишей (СТЖ підвищується до 45,3±3,4 доби; р<0,05).
Отже, в умовах агресивної моделі пасивного метастазування МВ16 у мишей лінії С57BL/6 ФП-С ксеногенного походження не виявляє вираженого антиметастатичного ефекту при триразовому введенні. Проте триваліше (9 проти 3 ін’єкцій) застосування ФП-С вірогідно покращує виживаність таких тварин.
Таким чином, ФП-С ксеногенного походження чинить протективну дію, що виявляється у запобіганні або гальмуванні розвитку метастазів МВ16 при профілактичному застосуванні у мишей С57BL/6. Проте за умов уже розвиненої пухлини ця дія нівелюється. Ефективність терапевтичного застосування ксеногенного ФП-С залежить від кратності введення препарату, і лише за умов його тривалого регулярного введення покращується виживаність тварин. Такі терапевтичні ефекти застосування ксеногенного ФП-С припускають залучення опосередкованих механізмів, реалізація яких може бути зумовлена активацією протипухлинного імунного захисту організму. Для перевірки цього припущення було доцільним вивчити вплив різних зразків ксеногенного ФП на імунологічні показники мишей у системах in vitro та in vivo.
Імуноспецифічну дію зразків ФП стосовно антигенів меланоми визначали на основі індукції імунних реакцій до клітин МВ16 in vitro. У першій серії дослідів вивчали вплив зразків ФП на проліферацію та апоптоз лімфоцитів мишей лінії СВА або С57BL/6 у змішаній культурі з клітинами МВ16 (рис. 2).
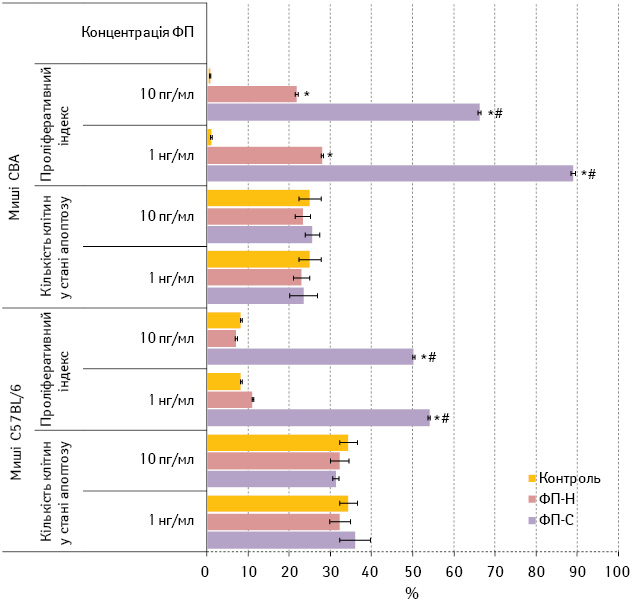
Рис. 2. Вплив in vitro зразків ФП на відповідь лімфоцитів селезінки інтактних мишей СВА та С57BL/6 у змішаній культурі з клітинами МВ16
Примітки: Контроль — змішана культура лімфоцитів і клітин МВ16;
* — розбіжності при порівнянні з показником у контролі тієї самої лінії мишей (р<0,05);
# — розбіжності при порівнянні з показником зразка ФП-Н відповідної концентрації, дослідженого в культурі лімфоцитів тієї самої лінії мишей (р<0,05)
Як видно з даних, наведених на рис. 2, ФП-С індукує більш інтенсивну проліферацію лімфоцитів мишей обох ліній порівняно з ФП-Н, і цей ефект є дозозалежним. Проте слід відзначити, що в присутності як пухлиноспецифічного, так і неспецифічного ФП проліферація лімфоцитів у змішаній культурі з клітинами МВ16 більш виражена у мишей лінії СВА, ніж у тварин С57BL/6. Рівень апоптозу лімфоцитів мишей обох ліній при культивуванні з клітинами МВ16 залишається незмінним незалежно від специфічності та концентрації зразка ФП.
ФП-С, на відміну від ФП-Н, ефективно індукує цитотоксичність несенсибілізованих лімфоцитів мишей СВА проти клітин МВ16 (рис. 3). Цей ефект не є дозозалежним. Водночас жоден із досліджуваних зразків ФП не впливає на цитотоксичність лімфоцитів мишей C57BL/6 у змішаній культурі з клітинами МВ16 in vitro.
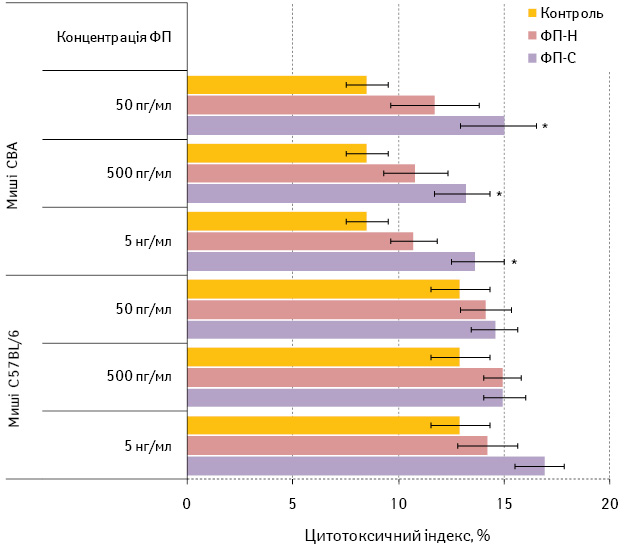
Рис. 3. Вплив in vitro зразків ФП на цитотоксичну активність лімфоцитів селезінки мишей ліній СВА та С57BL/6 у змішаній культурі з клітинами МВ16
Примітки: Контроль — змішана культура лімфоцитів і клітин МВ16;
* — розбіжності при порівнянні з показником у контролі тієї самої лінії мишей статистично вірогідні (р<0,05)
Отже, в системі in vitro ФП-С, на відміну від ФП-Н, індукує виражену проліферацію несенсибілізованих до антигенів меланоми лімфоцитів у відповідь на клітини МВ16, не впливаючи, як і ФП-Н, на їхній апоптоз. Інтенсивність цієї відповіді залежить від генотипу мишей. За даними цитотоксичного тесту, в якому визначається активність природних кілерів, ФП-С здатний переносити in vitro реактивність до клітин МВ16 несенсибілізованим лімфоцитам мишей лінії СВА, що підкреслює відомі ад’ювантні властивості ФП [20]. Відсутність такого ефекту у мишей С57BL/6 може свідчити, що в такій тест-системі in vitro не вдається повноцінно відтворити генерацію пухлиноспецифічних цитотоксичних Т-лімфоцитів, на які і діє ФП-С.
У наступній серії експериментів була досліджена здатність зразків ФП до переносу імунореактивності на антигени МВ16 несенсибілізованому реципієнту in vivo. Для цього інтактним мишам лінії С57BL/6 вводили досліджувані зразки ФП i вивчали на 3-тю та 7-му добу формування клітинно-опосередкованих імунних реакцій на антигени МВ16 (рис. 4).
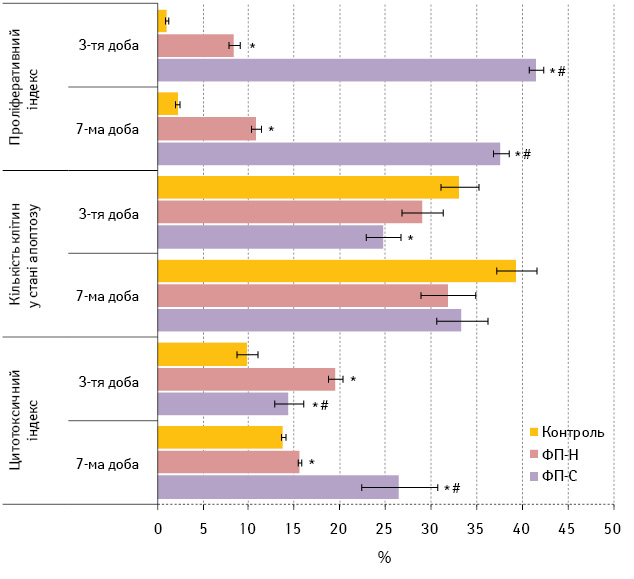
Рис. 4. Вплив in vivo зразків ФП на відповідь лімфоцитів селезінки інтактних мишей лінії С57BL/6 у змішаній культурі з клітинами МВ16
Примітки: Контроль — інтактні миші, яким не вводили зразки ФП;
* — розбіжності при порівнянні з показником у контрольній групі на відповідну добу дослідження статистично вірогідні (р<0,05);
# — розбіжності при порівнянні з показником у групі ФП-Н на відповідну добу дослідження статистично вірогідні (р<0,05)
Лімфоцити, отримані на 3-тю добу після введення мишам ФП-С, відповідають більш вираженою проліферацією на клітини МВ16, ніж лімфоцити, одержані після введення ФП-Н. Такий самий ефект спостерігається і на 7-му добу після введення зразків ФП. При цьому попереднє введення тваринам досліджуваних зразків ФП по-різному впливає на рівень апоптозу лімфоцитів у змішаній культурі з клітинами МВ16 in vitro. Так, у процесі культивування з клітинами МВ16 in vitro серед лімфоцитів, отриманих на 3-тю добу після введення ФП-С, суттєво зменшується їх частка в стані апоптозу. Реактивність лімфоцитів, одержаних на 7-му добу після введення будь-якого із досліджуваних зразків ФП, у цій тест-системі не змінюється.
В умовах цього експерименту зразки ФП незалежно від специфічності значно підвищують цитотоксичність лімфоцитів проти клітин МВ16, але динаміка формування цієї реактивності лімфоцитів в організмі тварин на тлі введення ФП різна. Зокрема, на 7-му добу після введення ФП-С цитотоксична активність лімфоцитів перевищує таку після застосування ФП-Н у ці строки.
Отже, зразки ксеногенного ФП здатні посилювати імунореактивність лімфоцитів мишей лінії С57ВL/6 проти клітин МВ16 при їх одноразовому внутрішньоочеревинному введенні, що підтверджує відомі ад’ювантні властивості ФП [20]. На нашу думку, більш виражені ефекти in vivo ФП-С можуть свідчити саме про перенос за його допомогою імунореактивності на антигени МВ16, що є принципово важливим висновком з огляду на його антиметастатичні властивості.
Таким чином, підсумовуючи отримані дані, можна стверджувати, що обраний нами підхід щодо можливості переносу пухлиноспецифічного імунітету за допомогою ФП є перспективним напрямом імунотерапії хворих зі злоякісними новоутвореннями і, зокрема, з меланомою шкіри. ФП-С ксеногенного походження здатний переносити реципієнту імунореактивність на антигени меланоми, ініціювати таким чином розвиток протипухлинної імунної відповіді організму та запобігати розвитку метастазів або гальмувати його. Проте досягнути ефективності такої імунотерапії можливо лише за умов її застосування в комплексі з основними методами протипухлинного лікування.
Список використаної літератури
1. Hodi F.S., O’Day S.J., McDermott D.F. et al. (2010) Improved survival with ipilimumab in patients with metastatic melanoma. N. Eng. J. Med., 363(8): 711–723.
2. Rosenberg S.A., Yang J.C., Restifo N.P. (2004) Cancer immunotherapy: moving beyond current vaccines. Nature Med., 10(9): 909–915.
3. Dadley M.E., Wunderlich J.R., Yang J.C. et al. (2005) Adoptive cell transfer therapy following non-myeloablative but lymphodepleting chemotherapy for the treatment of patients with refractory metastatic melanoma. J. Clin. Oncol., 23(10): 2346–2357.
4. Dadley M.E., Yang J.C., Sherry R. et al. (2008) Adoptive cell therapy for patients with metastatic melanoma: evaluation of intensive myeloablative chemoradiation preparative regimens. J. Clin. Oncol., 26(32): 5233–5239.
5. Besser M.J., Shapira-Frommer R., Treves A.J. et al. (2010) Clinical responses in a phase II study using adoptive transfer of short-term cultured tumor infiltration lymphocytes in metastatic melanoma patients. Clin. Cancer Res., 16(9): 2646–2655.
6. Гриневич Ю.А., Фильчаков Ф.В., Шумилина Е.С. и др. (2008) Фактор переноса: получение, биологическая характеристика, влияние на противоопухолевую резистентность организма. Специфічна імунотерапія в онкології: матеріали наук.-практ. конф. «Актуальні питання специфічної імунотерапії хворих на злоякісні новоутворення», Умань, 20–21 вересня 2007 р.; за ред. Ю.Я. Гріневича. Здоров’я, Київ: 293–328.
7. Pineda B., Estrada-Parra S., Pedraza-Medina B. et al. (2005) Interstitial transfer factor as adjuvant immunotherapy for experimental glioma. J. Exp. Clin. Cancer Res., 24(4): 575–583.
8. Franco-Molina M.A., Mendoza-Gamboa E., Zapata-Benavides P. et al. (2010) Antiangiogenic and antitumor effects of IMMUNEPOTENT CRP in murine melanoma. Immunopharmacol. Immunotoxicol., 32(4): 637–646.
9. Гриневич Ю.А., Фильчаков Ф.В., Шумилина Е.С. и др. (2009) Ксеногенный фактор переноса, специфичный мышиной карциноме легкого Льюис. Вопр. онкол., 55(5): 612–618.
10. Фильчаков Ф.В., Гриневич Ю.А., Шумилина Е.С., Лён А.Д. (2011) Ксеногенный карциномоспецифический фактор переноса в адъювантной иммунотерапии мышей С57BL/6 с гомологичной опухолью. Иммунология, 1: 21–23.
11. Деклар. пат. на кор. мод. № 16938, UA, МПК7 А 61К35/28. Спосіб отримання пухлиноспецифічного фактора переносу. Ін-т онкології АМН України (UA). З. № 200504315; заявл. 06.05.2005; опубл. 15.09.2006. Бюл. № 9.
12. Дарбре А. (ред.) (1989) Практическая химия белка (Пер.с англ.) Мир, Москва, 623 с.
13. Фільчаков Ф.В., Льон Г.Д., Шуміліна К.С. та ін. (2014) Імуноопосередковані механізми антиметастатичної дії карциномаспецифічного фактора переносу в умовах росту експериментальних пухлин у мишей C57BL/6. Клин. онкол., 2(14): 53–57.
14. Стуков А.Н., Саприн А.Н., В.С. Соломка и др. (2001) Индекс роста опухоли как интегральный критерий эффективности противоопухолевой терапии в эксперименте. Вопр. онкол., 47(5): 616–618.
15. Пинегин Б.В., Ярилин А.А., Симонова А.В. и др. (2001) Применение проточной цитометрии для оценки функциональной активности иммунной системы человека. Пособие для врачей-лаборантов, Москва, 53 с.
16. Лапач С.Н., Чубенко А.В., Бабич П.Н. (2001) Статистические методы в медико-биологических исследованиях с использованием Excel. Морион, Киев, 408 с.
17. Гриневич Ю.А., Фильчаков Ф.В., Шумилина Е.С. и др. (2014) Фактор переноса и проблема иммунопрофилактики метастазов злокачественных новообразований (обзор литературы и собственных исследований). Науковий журнал МОЗ України, 1(5): 118–127.
18. Prasad U., Jalaludin M.A., Rajadurai P. et al. (1996) Transfer factor with anti-EBV activity as an adjuvant therapy for nasopharyngeal carcinoma: A pilot study. Biotherapy, 9(1–3): 109–115.
19. Franco-Molina M.A., Mendoza-Gamboa E., Zapata-Benavides P. et al. (2008) IMMUNEPOTENT CRP (bovine dialyzable leukocyte extract) adjuvant immunotherapy: a phase I study in non-small cell lung cancer patients. Cytotherapy, 10(5): 490–496.
20. Lara H.H., Turrent L.I., Garza-Treviño E.N. et al. (2010) Clinical and immunological assessment in breast cancer patients receiving anticancer therapy and bovine dialyzable leukocyte extract as an adjuvant. Exp. Ther. Med., 1(3): 425–431.
Фактор переноса в иммунотерапии экспериментальной меланомы
Национальный институт рака, Киев
Резюме. В статье представлены экспериментальные данные применения фактора переноса (ФП) ксеногенного происхождения, специфического к меланоме В16 (МВ16), для получения которого был использован способ внутрибрюшинной иммунизации животных-доноров (крыс) ее клетками с последующим выделением из экстракта сенсибилизированных лимфоцитов селезенки меланомаспецифического ФП (ФП-С). На модели пассивного метастазирования МВ16 у мышей установлено, что ФП-С при однократном профилактическом введении (за 3 сут до внутривенной перевивки МВ16) воспроизводит протективный антиметастатический эффект, который проявляется в снижении частоты метастазирования, уменьшении количества и объема легочных метастазов и высоким индексом угнетения метастазирования. Иммунотерапия мышей с ФП-С, начатая на 3-й день после внутривенного введения клеток МВ16, существенно продлевала жизнь животных по сравнению с контролем. Однако на модели подкожного роста МВ16 у мышей не выявлено влияния ФП-С на рост опухоли и выживаемость животных, что указывает на целесообразность использования ФП в адъювантном режиме. При изучении иммунотропных свойств ФП в системе in vitro и in vivo установлено, что ксеногенный ФП-С способен переносить иммунореактивность к антигенам МВ16 иммунокомпетентным клеткам интактных мышей. Таким образом, перенос опухолеспецифического иммунитета с помощью ФП является перспективным направлением иммунотерапии больных меланомой кожи. Применение ФП-С в комплексном лечении этой категории больных может стать одним из путей повышения его эффективности.
меланома В16, ксеногенный опухолеспецифический фактор переноса, иммунотерапия, антиметастатическое действие, иммунотропные эффекты.
Адреса:
Фільчаков Феодосій Вікторович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 259-01-84
E-mail: labklimmun@i.ua















Leave a comment