Хіміоендокринотерапія при поширеному раку грудної залози
Резюме. Мета дослідження: порівняння ефективності різних схем паліативної терапії із застосуванням таблетованих форм препаратів у хворих на гормон-рецептор-позитивний Her-2/neu-негативний поширений рак грудної залози (РГЗ). У роботі надано результати лікування 96 пацієнток на поширений РГЗ, які були рандомізовані на три групи й отримували лікування виключно таблетованими формами препаратів. До першої групи (А) були залучені 33 хворі, у яких застосовували паліативну ендокринотерапію інгібітором ароматази анастрозолом по 1 мг щоденно. За один курс терапії в цій групі вважали проміжок часу в 21 день. До другої групи (С+Са) належали 31 пацієнтка, яким призначено терапію капецитабіном (2500 мг/м/добу з 8-го по 21-й день) з циклофосфамідом (100 мг щоденно з 1-го по 14-й день 21-денного циклу терапії). До третьої групи (С+А) увійшли 32 хворі, які одержували терапію капецитабіном (2500 мг/м/добу з 1-го по 14-й день 21-денного циклу) у поєднанні зі щоденним прийомом анастрозолу по 1 мг (одночасна хіміоендокринотерапія). Визначали тривалість безрецидивного періоду – час від початку лікування в рамках дослідження до виявлення перших ознак прогресування пухлинного процесу на фоні цитостатичної терапії (за методом Каплана — Мейєра) та токсичні прояви проведеного лікування. Середній вільний від прогресування період у пацієнток, які проходили хіміоендокринотерапію капецитабіном з анастрозолом (14,3±1,9 міс), більший за відповідний показник у групах хворих, яким призначено моноендокринотерапію анастрозолом (9,8±1,2 міс) або комбіновану терапію таблетованими формами цитостатиків — капецитабіном та циклофосфамідом (10,8±1,3 міс). Безрецидивна виживаність, визначена за методом Каплана — Мейєра, вища у пацієнток, які одержували комбіновану хіміоендокринотерапію капецитабіном й анастрозолом, порівняно з хворими, у яких застосовували лікування лише анастрозолом чи комбінацією капецитабіну з циклофосфамідом (р≤0,005). Частота побічних проявів у учасниць дослідження, які одержували різні види паліативної таблетованої терапії, була майже однаковою. Виникали токсичні прояви І–ІІ ступеня. Таблетовану паліативну хіміоендокринотерапію можна вважати опцією вибору терапії хворих на гормонозалежний Her-2/neu-негативний поширений РГЗ завдяки належній ефективності, сприятливому профілю токсичності та можливості тривалого амбулаторного застосування.
Резюме. Цель исследования: сравнение эффективности различных схем паллиативной терапии с применением таблетированных форм препаратов у больных гормон-рецептор-положительным Her-2/neu-отрицательным распространенным раком грудной железы (РГЖ). В работе представлены результаты лечения 96 пациенток с РГЖ, которые были рандомизированы в 3 группы и получали лечение исключительно таблетированными препаратами. В первую группу (А) вошли 33 больные, у которых применяли паллиативную эндокринотерапию ингибитором ароматазы анастрозолом по 1 мг ежедневно. В качестве одного курса терапии в этой группе считали промежуток времени в 21 день. Во вторую группу (С+Са) распределена 31 пациентка, которым назначена терапия капецитабином (2500 мг/м2/сут с 8-го по 21-й день) с циклофосфамидом (100 мг ежедневно с 1-го по 14-й день 21-дневного цикла терапии). К третьей группе (Са+А) принадлежали 32 больные, которые получали терапию капецитабином (2500 мг/м2/сут с 1-го по 14-й день 21 дня цикла) в сочетании с ежедневным приемом анастрозола по 1 мг. Определяли продолжительность свободного от прогрессирования периода — время от начала лечения в рамках исследования до выявления признаков прогрессирования опухолевого процесса на фоне проводимого лечения (по методу Каплана — Мейера) — и токсические проявления предложенной терапии. Средний период без прогрессирования заболевания у пациенток, принимавших комбинированную химиоэндокринотерапию капецитабином с анастрозолом (14,3±1,9 мес), больше соответствующего показателя в группах больных, получавших моноэндокринотерапию анастрозолом (9,8±1,2 мес) или комбинированную терапию таблетированными цитостатиками — капецитабином и циклофосфамидом (10,8±1,3 мес). Безрецидивная выживаемость, определенная по методу Каплана — Мейера, выше у пациенток, у которых применяли комбинированную химиоэндокринотерапию капецитабином с анастрозолом, по сравнению с больными, принимавшими анастрозол или комбинацию циклофосфамида с капецитабином (р≤0,005). Частота побочных эффектов у участниц исследования, получавших различные виды паллиативной таблетированной терапии, была почти одинаковой. Возникали побочные эффекты I–II степени токсичности. Паллиативная химиоэндокринотерапия таблетированными препаратами является целесообразной опцией лечения больных гормонозависимым Her-2/neu-отрицательным распространенным РГЖ благодаря достаточной эффективности, приемлемому профилю токсичности и возможности длительного амбулаторного применения.

ВВЕДЕНИЕ
Невзирая на успехи в диагностике и лечении больных раком грудной железы (РГЖ), а именно, увеличение количества пациентов с выявленными ранними, часто доклиническими формами злокачественных опухолей, а также повышение безрецидивной и общей выживаемости, проблема терапии при распростаренных формах рака остается не решенной. К распространенным формам РГЖ целесообразно относить метастатический РГЖ, при котором отдаленные метастазы выявлены при первичном установлении диагноза, метастазирующий РГЖ — при котором отдаленные метастазы появляются через какой-то период после окончания адъювантной терапии и местно-распространенный РГЖ с вовлечением в опухолевый процесс кожи, мягких тканей передней грудной стенки и/или надключичных лимфатических узлов. Лечение пациенток этих групп направлено, в первую очередь, на уменьшение опухолевой массы и улучшение качества жизни. Поэтому терапию таких категорий больных целесообразно проводить с учетом не только эффективности, но и токсичности, а также возможности длительного приема препаратов.
Вопрос о выборе оптимальной схемы паллиативного лечения является сложным и окончательно не решенным. Во-первых, это связано с тем, что арсенал цитостатических агентов, которые доказали свою эффективность в терапии больных с распространенными формами РГЖ, достаточно большой, и выбор того или иного препарата зависит от преимуществ и недостатков конкретной программы терапии у конкретной пациентки.
Во-вторых, пациентки с распространенным РГЖ часто имеют соматические нарушения, связанные с распространением опухолевого процесса, явлениями опухолевой интоксикации и другими осложнениями, а также сопутствующую патологию, что необходимо учитывать при назначении терапии. Следует принимать во внимание историю лечения каждой больной, так как часто пациентки уже получали цитостатическую терапию и могут иметь соматические нарушения, связанные с ранее проводимой терапией.
В-третьих, длительное лечение в условиях онкологических стационаров негативно сказывается на психоэмоциональном состоянии пациентов, становится одной из причин отказа от дальнейшей инфузионной цитостатической терапии. Больные, сознательные относительно собственного прогноза, пытаются провести больше времени в привычном окружении, в общении с родными и близкими, а не в онкологическом учреждении.
Среди программ паллиативного лечения при распространенных формах РГЖ, результативность которых доказана в многочисленных клинических исследованиях, определенное место занимают схемы с включением пероральных таблетированных форм цитостатиков, в частности капецитабина [1–4]. Последние имеют определенные преимущества по сравнению с инфузионными формами: отсутствие необходимости в госпитализации, более низкая гемато- и эметогенная токсичность, отсутствие полной алопеции [1–4]. Приведенные выше факты и доказанная клиническая эффективность этих препаратов делают их полноценными игроками на поле боя с распространенным РГЖ.
До недавнего времени пациенткам с гормон-рецептор-положительным распространенным РГЖ с целью паллиативной терапии было рекомендовано проводить последовательно или эндокринотерапию, или химиотерапию. Первой линией эндокринотерапии является применение селективных модуляторов эстрогеновых рецепторов, второй — использование ингибиторов ароматазы (ИА). Общепринятой является точка зрения, что при прогрессировании РГЖ на фоне применения препаратов первой линии эндокринотерапии возможен переход на вторую и последующие линии [5, 6]. Следует отметить, что, если селективные модуляторы эстрогеновых рецепторов непосредственно действуют на уровне мембран опухолевых клеток при наличии экспрессии рецепторов стероидных гормонов, то ИА — прямо не влияют на опухолевые клетки, а проявляют эффективность на уровне синтеза половых гормонов [6]. В связи с этим терапию ИА можно считать фоновой, она создает определенные условия для замедления роста опухолевых клеток или его остановки при отсутствии непосредственного воздействия на опухолевую клетку. Это утверждение привело к развитию нового направления в лечении пациентов с распространенным РГЖ, а именно химиоэндокринотерапии — одновременного назначения цитостатиков с ИА [7–9].
Объект и методы исследования
В клинике онкологии Национального медицинского университета им. А.А. Богомольца на базе Киевского городского клинического онкологического центра в 2012–2014 гг. проведено открытое рандомизированное проспективное клиническое исследование по изучению эффективности различных схем паллиативной терапии с применением таблетированных форм препаратов у больных гормон-рецептор-положительным Her-2/neu-отрицательным распространенным РГЖ.
Основной задачей исследования было установить непосредственную эффективность различных схем паллиативной таблетированной терапии больных с распространенными формами РГЖ. Определение эффективности лечения проводили на основе критериев системы RECIST [10] после 2-го, 4-го и 6-го курсов терапии, в дальнейшем — после каждого 3-го курса. Больные, у которых диагностировано прогрессирование опухолевого процесса (достижение end-point), прекращали участие в дальнейшем исследовании.
В исследование были вовлечены 96 больных с метастатическим, метастазирующим и местно-распространенным РГЖ в возрасте от 29 до 75 лет. Средний возраст участниц составлял 55,6±4,9 года.
У большинства пациенток — 81 (84,4%) — диагностирован метастазирующий РГЖ. Они получали лечение по поводу неметастатического РГЖ. На момент установления диагноза РГЖ у них были I–ІІІС стадия опухолевого процесса. Распределение больных по степени распространения ракового процесса на момент диагностирования РГЖ приведено в табл. 1.
Таблица 1. Распределение больных по стадиям опухолевого процесса на момент установления диагноза РГЖ
| Стадии опухолевого процесса | ||||||||||||
| ІT1N0M0 | ІІАT1N1M0, T2N0M0 | ІІВT2N1M0 | ІІІАT1–2N2M0, T3N1M0 | ІІІВT4N1–2M0 | ІІІСT1–3N3M0 | |||||||
| Количество больных | n | % | n | % | n | % | n | % | n | % | n | % |
| 10 | 12,3 | 24 | 29,6 | 32 | 39,5 | 8 | 9,9 | 5 | 6,2 | 2 | 2,5 | |
Адъювантное лечение эти пациентки получали согласно рекомендациям Сент-Галленского консенсуса, национальных клинических руководств и локальных клинических протоколов. Адъювантную полихимиотерапию (ПХТ) применяли у 71 (87,5%) больной; 9 (11,1%) пациенток с впервые диагностированным РГЖ T1–2N0M0 при отсутствии факторов плохого прогноза такого лечения не получали, 1 пациентка (42 лет) с ІІІА T2N2M0 стадией адъювантную ПХТ не проходила в связи с отказом от химиотерапии.
Эндокринную терапию тамоксифеном по 20 мг ежедневно в адъювантном режиме применяли у всех http://lipitoronline-generic.net/ 100% больных. Женщинам, которые на момент установления диагноза имели сохраненную менструальную функцию, проведено аблятивную эндокринотерапию, поэтому всех участниц исследования можно считать таковыми с менопаузальным статусом.
На фоне эндокринотерапии тамоксифеном или по окончании последней у больных возникло прогрессирование опухолевого процесса. Среднее время до прогрессирования с момента установления диагноза составило 38,9±6,8 мес. Следует отметить, что у 28 (34,6%) лиц прогрессирование возникло после прекращения приема тамоксифена, у 53 (65,4%) — на фоне приема этого препарата. В 9 (11,1%) случаях прогрессирование опухолевого процесса диагностировано более чем через 5 лет после комплексного лечения. Больных, у которых прогрессирование РГЖ возникло в течение первого года после окончания комплексной терапии, в исследовании не было.
Прогрессирование опухолевого процесса установлено с помощью объективных методов обследования: рентгенографии органов грудной полости (ОГП), ультрасонографии органов брюшной полости (ОБП) и регионарных лимфатических узлов и/или компьютерной томографии с внутривенным (в/в) контрастированием ОГП и ОБП и остеосцинтиграфии.
Обстоятельства, при которых выявлено прогрессирование РГЖ, были разными. При плановом обследовании метастатические очаги зафиксированы у 18 (22,2%) больных, которые на момент установления диагноза РГЖ жалоб не имели. В 5 (6,2%) случаях отмечено только повышение онкомаркера СА-15-3, которое не сопровождалось какими-либо клиническими проявлениями, после чего были назначены обследования, в результате которых подтверждено наличие метастатических очагов. Самостоятельно метастатическое поражение кожи и мягких тканей выявили 10 (12,3%) больных. У 15 (18,5%) пациентов возникли нарушения со стороны органов дыхания — кашель и/или одышка, после чего при обследовании выявлены метастатические очаги в легких и/или метастазы в плевре. С жалобами на сильную боль в костях за медицинской помощью обратилась 31 (38,3%) больная, у которых диагностировано метастатическое поражение костей скелета. Боль в правом подреберье была первым признаком прогрессирования опухолевого процесса у 2 (2,5%) пациентов, у которых при дообследовании выявлено метастатическое поражение печени.
Маркерные метастатические очаги выявлены у 65 (80,2%) больных с метастазирующим РГЖ. У 16 (19,7%) пациентов диагностирована только очаговая гиперфиксация в костях Tn-пертехнетата, характерная для метастатического поражения. В таких случаях прогрессированием опухолевого процесса считали сочетание изменений, выявленных при остеосцинтиграфии, и повышение в крови уровня онкомаркера CA15-3 по меньшей мере в два раза.
Из 65 пациентов с маркерными метастатическими очагами следует отдельно выделить подгруппу больных — 11 (16,9%) лиц — с метастатическим локорегионарным поражением кожи и мягких тканей в области передней грудной стенки, прооперированной грудной железы или кожных лоскутов при проведении до этого реконструкции грудной железы LD- или TRAM-лоскутом; других отдаленных метастатических очагов у них не было.
Часть пациентов (53 (65,4%)) получала паллиативную терапию по поводу метастазирующего РГЖ до включения в исследование. Из них только антрациклинсодержащие схемы ПХТ применяли у 21 (39,6%) больной, таксансодержащие — у 5 (9,4%) или антрациклин- и таксансодержащие режимы ПХТ — у 27 (51,0%) больных с определенной после проведенных 4 курсов терапии стабилизацией (согласно критериям системы RECIST) или прогрессированием опухолевого процесса.
В 10 (10,4%) случаях из нашего исследования распространенный РГЖ изначально установлен в IV стадии процесса с наличием отдаленных метастазов. Из них у 5 (50%) участниц метастатические очаги выявлены при проведении обследований, у 4 (40%) были жалобы на боль в костях (при проведении остеосцинтиграфии подтверждено наличие метастатического поражения костей), у 1 больной возникли метастазы в коже, которые были видны при осмотре, и метастатическое поражение в костях. Из этой группы 6 (60%) пациенток получали лечение по поводу метастатического РГЖ: 2 пациентки — антрациклинсодержащими схемами ПХТ, 3 — антрациклин- и таксансодержащими и 1 — только таксансодержащими режимами; у 4 (40%) больных не применяли терапии по поводу метастатического РГЖ до включения в исследование.
Местно-распространенный неоперабельный РГЖ диагностирован у 5 (5,2%) участниц с вовлечением в опухолевый процесс кожи и/или надключичных лимфатических узлов. 2 больные из этой группы до включения в исследование получали антрациклинсодержащую ПХТ без эффекта.
Все больные с момента включения в проводимое нами пилотное исследование (pilot study) никакой другой цитостатической терапии, не входящей в протокол, не получали.
Пациентки с метастазами в костях проходили терапию бисфосфонатами (памидроновая кислота по 90 мг в/в капельно 1 раз в 28 дней или золедроновая кислота по 4 мг в/в капельно 1 раз в 28 дней).
Критериями исключения из исследования были:
- клинические и/или рентгенологические признаки опухолевого поражения головного мозга;
- применение пероральных форм фторпиримидинов до начала исследования;
- ECOG статус 3–4, повышение в крови креатинина, мочевины, аланинаминотрансферазы, аспартатаминотрансферазы, билирубина более чем в 2,5 раза.
Характеристика больных (n=96), принявших участие в исследовании, приведена в табл. 2.
Таблица 2. Характеристика больных до рандомизации
| Характеристика | Количество больных | |
| n | % | |
| Возраст | ||
| До 50 лет | 31 | 32,3 |
| Старше 50 лет | 65 | 67,7 |
| Экспрессия ER, PR | ||
| Имеется | 96 | 100,0 |
| Отсутствует | 0 | 0 |
| Экспрессия белка Her-2/neu | ||
| Имеется | 0 | 0 |
| Отсутствует | 96 | 100,0 |
| Адъювантная терапия больных метастазирующим РГЖ | ||
| ПХТ | 71 | 74,0 |
| ПХТ не проводили | 10 | 16,0 |
| Тамоксифен | 81 | 84,4 |
| Предшествующая терапия больных распространенным РГЖ | ||
| Да | 61 | 63,5 |
| Нет | 35 | 36,5 |
| Терапия только с антрациклинами | 25 | 26,0 |
| Терапия с антрациклинами и таксанами | 30 | 31,3 |
| Терапия только с таксанами | 6 | 6,3 |
| Метастатические очаги | ||
| Мягкие ткани, лимфатические узлы | 36 | 37,5 |
| Кости | 54 | 56,3 |
| Печень | 14 | 14,6 |
| Легкие, плевра | 35 | 36,5 |
| Распределение больных по зонам метастатического поражения | ||
| Только кости | 19 | 19,8 |
| Только мягкие ткани, лимфатические узлы | 18 | 18,8 |
| Мягкие ткани, лимфатические узлы и кости | 12 | 12,5 |
| Только висцеральные органы | 19 | 19,8 |
| Висцеральные органы и мягкие ткани, лимфатические узлы, кости | 28 | 29,1 |
Методом адаптивной рандомизации с помощью конвертов участников разделили на три группы. В первую группу (А) вошли 33 (34,4%) больные, которым была назначена паллиативная эндокринотерапия ИА (анастрозол по 1 мг/сут). В качестве одного курса терапии в этой группе считали промежуток времени в 21 день.
Ко второй группе (С+Са) отнесена 31 (32,3%) пациентка, которым назначена терапия капецитабином (2500 мг/м/сут с 8-го по 21-й день) с циклофосфамидом (100 мг ежедневно с 1-го по 14-й день 21 дня цикла).
К третьей группе (Са+А) принадлежали 32 (33,3%) больные, у которых применяли терапию тегафуром (2500 мг/м/сут с 1-го по 14-й день 21 дня цикла) в сочетании с ежедневным приемом анастрозола по 1 мг.
Характеристика больных разных групп представлена в табл. 3.
Таблица 3. Характеристика больных исследуемых групп
| Характеристика | Группы больных | |||||
| А(n=33) |
С+Са (n=31) |
Са+А (n=32) |
||||
| n | % | n | % | n | % | |
| Возраст | ||||||
| До 50 лет | 10 | 30,3 | 8 | 25,8 | 13 | 40,6 |
| Старше 50 лет | 23 | 69,7 | 23 | 74,2 | 19 | 59,4 |
| Характеристика подгрупп распространенного РГЖ | ||||||
| Метастазирующий РГЖ | 30 | 90,9 | 30 | 96,8 | 21 | 65,6 |
| Метастатический РГЖ | 3 | 9,1 | 1 | 3,2 | 6 | 18,8 |
| Местно-распространенный РГЖ | 0 | 0 | 0 | 0 | 5 | 15,6 |
| Адъювантная ПХТ у больных метастазирующим РГЖ | ||||||
| Проводили | 23 | 69,7 | 28 | 93,5 | 20 | 62,5 |
| Не проводили | 7 | 21,2 | 2 | 6,5 | 1 | 3,1 |
| Терапия по поводу распространенного РГЖ | ||||||
| Проводили | 22 | 66,7 | 19 | 61,3 | 20 | 62,5 |
| Не проводили | 11 | 33,3 | 12 | 38,7 | 12 | 37,5 |
| Характеристика метастатического поражения | ||||||
| Только кости, мягкие ткани, лимфатические узлы | 15 | 45,5 | 10 | 32,3 | 18 | 56,2 |
| Кости, мягкие ткани, лимфатические узлы и/или только висцеральные органы | 18 | 54,5 | 21 | 67,7 | 14 | 43,8 |
Как свидетельствуют данные табл. 3, исследуемые группы были практически тождественными по характеристикам пациенток, за исключением того, что все больные с первичным местно-распространенным РГЖ попали в группу, которая получала капецитабин с анастрозолом. Но это отличие нивелировалось тем, что в группах применения монотерапии анастрозолом или комбинации капецитабина с циклофосфамидом было 9 больных (4 и 5 соответственно) с метастазирующим РГЖ и локорегионарным метастатическим поражением кожи и мягких тканей в области передней грудной стенки, прооперированной грудной железы или кожных лоскутов, у которых до этого была проведена реконструкция грудной железы LD- или TRAM-лоскутом. Других отдаленных метастатических очагов у этих пациенток не отмечено, поэтому их можно расценивать как тождественные по степени распространения опухолевого процесса больным первичным местно-распространенным неоперабельным РГЖ.
Перед каждым курсом терапии у больных проводили общий и биохимический анализ крови и определяли эметогенную токсичность лечения.
Для оценки ответа на применяемую терапию по RECIST-критериям у пациентов проводили инструментальные исследования по следующим протоколам.
После каждых 2 курсов терапии всем участницам назначали ультразвуковое исследование ОБП и регионарных лимфатических узлов, рентгенографию ОГП или компьютерную томографию ОГП и ОБП с в/в контрастированием.
Всем больным с метастазами в костях проводили остеосцинтиграфию каждые 4 курса терапии; у пациенток, у которых не было костных метастазов на момент включения в исследование, — каждые 6 мес.
У участниц, у которых не было маркерных метастатических очагов в начале лечения, ответ на проводимую терапию оценивали по показателю снижения маркера СА-15-3 в крови после проведения каждых 2 курсов терапии. Результат оценивали как частичную регрессию (ЧР) при снижении показателя на ≥30%, стабилизацию — при снижении <30%. При снижении уровня онкомаркера СА-15-3 к норме результат лечения рассматривали как полную регрессию (ПР) только при условии сочетания с отсутствием патологического накопления радиофармпрепарата (РФП) при проведении остеосцинтиграфии.
Оценивая результаты остеосцинтиграфии, в качестве ЧР принимали уменьшение накопления РФП ≥30%, ПР — отсутствие патологического накопления РФП, стабилизации опухолевого процесса — снижение процента патологического накопления РФП <30%.
Токсичность терапии определяли на основе National Cancer Institute Common Toxicity Criteria (NCI-CTC), version 3.0 [11].
Полученные данные проверяли на нормальность распределения и тождество дисперсий. Для оценки существенности различий между исследуемыми группами использовали критерий Стьюдента для множественных сравнений с поправкой Бонферрони.
Определяли продолжительность свободного от прогрессирования периода — время от начала лечения в рамках исследования до выявления признаков прогрессирования опухолевого процесса на фоне проводимой терапии. Выживаемость оценивали по методу Каплана — Мейера.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
По результатам проведенных исследований для оценки ответа опухолевого процесса на таблетированную цитостатическую терапию после 2-го курса установлено отсутствие прогрессирования. Токсических проявлений III–IV степени не выявлено. У всех участниц исследования терапия была продлена. Утверждать об эффективности лечения по результатам, полученным после 2 курсов, рано. Повторное обследование всех больных проводили после 4-го курса терапии. Прогрессирования не отмечено. Данные о доле ЧР и ПР, а также стабилизации злокачественного процесса представлены в табл. 4.
Таблица 4. Ответ на проводимое лечение больных РГЖ после 4-го курса терапии
| Группа больных | Стабилизация | ЧР | ПР | |||
| n | % | n | % | n | % | |
| А (n=33) | 8 | 24,2 | 23 | 69,7 | 2 | 6,1 |
| С+Са (n=31) | 9 | 29,0 | 16 | 51,6 | 6 | 19,4 |
| Са+A (n=32) | 6 | 18,8 | 17 | 53,1 | 9 | 28,1 |
Как свидетельствуют данные табл. 4, частота случаев стабилизации опухолевого процесса после 4 курсов проводимой терапии во всех исследуемых группах была практически одинаковой. Наиболее часто ЧР достигнута у больных, получавших монотерапию анастрозолом, но различия между представленными группами не достигли уровня статистической значимости.
Наибольший процент ПР отмечен flagyl medication у пациенток, принимавших капецитабин с анастрозолом (28,1%), что существенно превышало (≤0,05) соответствующий показатель в группе больных, получавших монотерапию анастрозолом (6,1%).
Одной из задач исследования было установить различия в ответе пациентов на проведенное паллиативное цитостатическое лечение в зависимости от того, получали ли они до момента включения в исследование другие программы паллиативной терапии или нет. Результаты представлены в табл. 5.
Таблица 5. Эффективность таблетированной цитостатической терапии у больных распространенным РГЖ разных групп
| RECIST | А (n=33) | С+Са (n=31) | Са+А (n=32) | |||
|
рretreated (n=22), n (%) |
treatment naive (n=11), n (%) |
рreatreated (n=19), n (%) |
treatment naive (n=12), n (%) |
рretreated (n=20), n (%) |
treatment naive (n=12), n (%) |
|
| Стабилизация | 4 (18,2) | 4 (36,4) | 3 (15,8) | 6 (50,0) | 4 (20,0) | 2 (16,7) |
| ЧР | 16 (72,7) | 7 (63,6) | 11 (57,9) | 5 (41,7) | 11 (55,0) | 6 (50,0) |
| ПР | 2 (9,1) | 0 (0) | 5 (26,3) | 1 (8,3) | 5 (25,0) | 4 (33,3) |
Pretreated — больные, получавшие паллиативную терапию по поводу РГЖ до включения в исследование; treatment naive — пациентки, не получавшие паллиативной терапии по поводу РГЖ до включения в исследование.
По данным табл. 5, существенных различий в ответе на проводимую терапию в различных группах больных не выявлено, в равной степени на нее отвечали пациентки из разных групп, независимо от того, получали они предшествующую паллиативную терапию по поводу распространенного РГЖ или нет. Отмечена тенденция к более частой ПР метастатических очагов у больных, у которых ранее не проводили терапии по поводу распространенного РГЖ и которые в исследовании получали лечение комбинацией капецитабин + анастрозол. Доля ПР метастатических очагов в этой группе пациенток достигла 33,3%, что значительно превышало соответствующий показатель в группах больных, не получавших противоопухолевого лечения при распространенном РГЖ до момента включения в исследование, а в рамках проведенного нами pilot study применяли монотерапию анастрозолом или комбинацию циклофосфамид + капецитабин (р≤0,05).
Больных, у которых зафиксировано прогрессирование опухолевого процесса, по данным проведенных обследований, исключали из исследования. Такой случай считали завершенным (end-point), схему лечения меняли, и пациентка продолжала терапию за пределами исследования.
Мы определили среднюю продолжительность периода без прогрессирования заболевания у пациенток разных групп, которая составила 11,5±1,4 мес. Установлено, что наибольшим этот период был у пациенток, применявших комбинированную терапию капецитабином с анастрозолом, — 14,3±1,9 мес (р≤0,05). У больных, получавших монотерапию анастрозолом, продолжительность среднего периода без прогрессирования достигла 9,8±1,2 мес, у испытуемых, принимавших комбинацию циклофосфамид + капецитабин, — 10,8±1,3 мес.
Анализ выживаемости без прогрессирования заболевания проводили по методу Каплана — Мейера. Установили, что безрецидивная выживаемость больных во всех исследуемых группах отличалась (р≤0,005). Наиболее длительный период без прогрессирования зафиксирован у больных, получавших капецитабин с анастрозолом. В 3 (9,4%) случаях из этой группы через 36 мес после начала лечения признаков прогрессирования болезни не выявлено; пациентки продолжают терапию (рисунок).
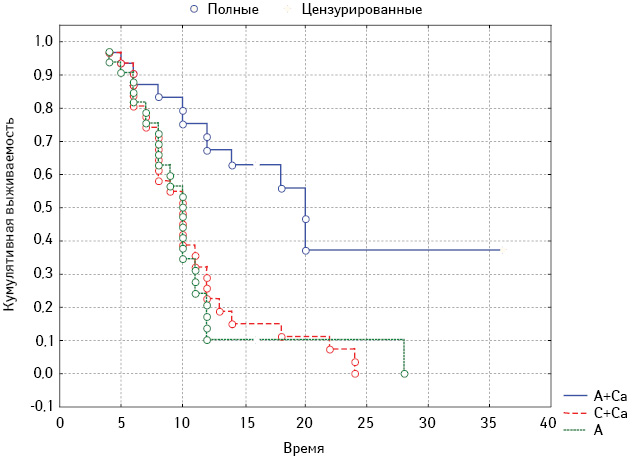 Рисунок. Выживаемость больных РГЖ по методу Каплана — Мейера
Рисунок. Выживаемость больных РГЖ по методу Каплана — Мейера
Одним из важных вопросов, требующих изучения, было определение побочных эффектов лечения (табл. 6). Среди осложнений химиоэндокринотерапии отмечены проявления гастроинтестинальной токсичности: тошнота, снижение аппетита, диарея; также больные жаловались на приливы и боль в мелких суставах. Пациенткам, которые принимали комбинацию капецитабин + циклофосфамид, ондансетрон по 8 мг per os рекомендовали принимать ежедневно в дни применения циклофосфамида, учитывая эметогенность последнего, и по необходимости — в дни приема капецитабина.
Таблица 6. Побочные эффекты таблетированной терапии по поводу РГЖ
| Группа больных | Побочные эффекты | |||||||||
| Тошнота | Снижение аппетита | Диарея | Приливы | Суставной синдром | ||||||
| n | % | n | % | n | % | n | % | n | % | |
| А (n=33) | 2 | 6,1 | 1 | 3,0 | 1 | 3,0 | 6 | 18,2 | 3 | 9,1 |
| С+Са (n=31) | 5 | 16,1 | 1 | 3,1 | 8 | 25,8 | 1 | 32,3 | 0 | − |
| Са+А (n=32) | 4 | 12,5 | 3 | 9,3 | 7 | 21,8 | 8 | 25,0 | 5 | 15,6 |
Следует отметить, что все проявления токсичности были I–II степени по шкале NCI-CTC. Токсических осложнений III степени в течение исследования не отмечено.
По данным, представленным в табл. 6, тошнота и диарея возникали чаще у больных, получавших комбинированную терапию циклофосфамидом с капецитабином и капецитабином с анастрозолом. Суставной синдром и приливы развивались в 9,1–25,0% случаев терапии анастрозолом.
У 6 (19,4%) больных, получавших лечение комбинацией циклофосфамида с капецитабином, и у 5 (15,6%) пациенток, которые применяли капецитабин + анастрозол, зафиксирован ладонно-подошвенный синдром.
В 17 (17,7%) случаях отмечены немотивированная повышенная утомляемость и общая слабость. Однако трудно установить, было ли это связано с токсическими проявлениями лечения или со степенью распространения опухолевого процесса.
В общем, побочные эффекты I–II степени возникли у 55 (57,3%) участниц. Среди больных, принимавших монотерапию анастрозолом, нежелательные явления отмечены у 13 (39,4%) лиц, у пациенток, получавших терапию комбинацией циклофосфамида и капецитабина, — в 15 (48,4%) случаях, а среди больных, применявших капецитабин с анастрозолом, — в 27 (84,4%). Высокая частота побочных эффектов на фоне химиоэндокринотерапии объяснима разным механизмом действия принимаемых препаратов. У пациенток отмечены нежелательные эффекты проводимой терапии, характерные как для капецитабина (диарея, ладонно-подошвенный синдром, тошнота), так и для ИА (приливы и суставной синдром). Следует подчеркнуть, что в целом переносимость лечения была удовлетворительной и не требовала изменений в жизни пациенток, что свидетельствует о том, что исследуемые режимы терапии имели схожий уровень токсичности и переносимости.
ОБСУЖДЕНИЕ
По данным литературы [1–4] известно, что таблетированные формы цитостатиков эффективно применяют в лечении пациенток с местно-распространенным, метастатическим и метастазирующим РГЖ. У больных гормонозависимым распространенным РГЖ использование эндокринотерапии также приводит к улучшению непосредственных результатов лечения [5, 6] с минимальными побочными эффектами.
Мы установили, что применение исключительно эндокринотерапии анастрозолом позволяет достичь почти годового периода без прогрессирования заболевания у пациенток с гормонозависимым Her-2/neu-отрицательным РГЖ. Аналогичные данные получены и в исследованиях других авторов [6, 11, 12]. В некоторых из них установлено, что применение ИА у пациенток с распространенным гормонозависимым Her-2/neu-отрицательным РГЖ, у которых было прогрессирование болезни на фоне приема тамоксифена, позволяет достичь периода без прогрессирования длительностью примерно 6 мес [12, 13]. В других работах [14, 15] продемонстрировано большую длительность периода до прогрессирования у этой группы пациенток на фоне эндокринотерапии ИА. В целом, во всех исследованиях указывается на то, что эндокринотерапия ИА является эффективной и малотоксичной опцией лечения по поводу РГЖ, которую можно проводить у больных в амбулаторных условиях [16].
Применение капецитабина в монотерапии и в комбинации с циклофосфамидом является приемлемым вариантом лечения больных метастатическим и метастазирующим РГЖ [3, 17]. Назначение этого терапевтического режима обеспечивает удовлетворительную переносимость лечения и продолжительность периода без прогрессирования почти до 1 года, согласно результатам исследований [17, 18]. Мы получили аналогичные данные в нашей работе: период до прогрессирования заболевания составил 10,0±1,2 мес, а побочные эффекты I–II степени возникли у 40,7% участниц. Уместно отметить, что токсических проявлений III–IV степени мы не отметили.
С целью улучшения результатов лечения больных распространенными формами РГЖ с 1970-х годов начали проводить исследования по изучению эффективности сочетания химио- и эндокринотерапии [19]. Проведены исследования по анализу эффективности моноэндокринотерапии и сочетания эндокринотерапии с цитостатиками у этой категории пациенток [20–23]. Получены противоречивые данные, а именно: в одних исследованиях указывали на положительную роль сочетания химиотерапии и гормонотерапии [20, 23, 24], в других — на отсутствие улучшения отдаленных результатов лечения [21, 22]. В ходе системного анализа полученных результатов установлено, что применение эндокринотерапии селективными модуляторами эстрогеновых рецепторов (тамоксифен) в сочетании с химиотерапией, по данным большинства клинических исследованиях, не привело к улучшению отдаленных результатов терапии [25, 26].
В последнее время начали il flagyl è un antibiotico появляться работы, посвященные комбинированной химиоэндокринотерапии с одновременным применением ИА (анастрозол или летрозол) со стандартными схемами ПХТ [7–9, 23, 29, 30]. Установлено наличие положительного эффекта от добавления ИА к ПХТ у больных местно-распространенным и метастатическим РГЖ. Планируя наше пилотное исследование, мы руководствовались тем, что ИА не будут конкурировать с цитостатиками на клеточном уровне (с учетом различных точек приложения), а системный эффект эндокринотерапии может быть полезным. Полученные нами результаты, которые можно сопоставить с данными других работ о целесообразности использования химиоэндокринотерапии с ИА у больных местно-распространенным, метастазирующим и метастатическим РГЖ, подтвердили наше предположение.
В данном пилотном исследовании установлено, что именно комбинация системной эндокринотерапии и цитостатиков имеет преимущества в применении перед монотерапией ИА и комбинированным приемом цитостатических агентов в виде стандартных схем ПХТ. Таким образом, химиоэндокринотерапия с сочетанием ИА и таблетированной формы цитостатика (в нашем исследовании — капецитабина) может быть обнадеживающей и целесообразной терапевтической опцией у пациенток с гормонозависимым Her-2/neu-отрицательным распространенным РГЖ для лечения в амбулаторных условиях.
ВЫВОДЫ
Проведенное исследование позволило сделать следующие выводы:
1. Наиболее эффективной среди исследованных исключительно пероральных программ лечения больных гормонозависимым Her-2/neu-отрицательным РГЖ являлась комбинация капецитабина с анастрозолом.
2. Продолжительность среднего безрецидивного периода у пациенток, принимавших комбинированную химиоэндокринотерапию капецитабином с анастрозолом (14,3±1,9 мес), больше соответствующего показателя в группах применения моноэндокринотерапии анастрозолом (9,8±1,2 мес) или комбинированной терапии таблетированными формами цитостатиков — капецитабином с циклофосфамидом (10,8±1,3 мес).
3. Безрецидивная выживаемость, определенная по методу Каплана — Мейера, выше у больных, получавших комбинированную химиоэндокринотерапию капецитабином с анастрозолом, по сравнению с принимавшими терапию анастрозолом или комбинацию циклофосфамида с капецитабином (р≤0,005).
4. Частота побочных эффектов у больных, получавших различные виды паллиативной таблетированной терапии, была почти одинаковой. Возникали побочные эффекты I–II степени токсичности.
5. Таблетированная паллиативная химиоэндокринотерапия является целесообразной опцией лечения больных гормонозависимым Her-2/neu-отрицательным РГЖ благодаря достаточной эффективности, приемлемому профилю токсичности и возможности длительного амбулаторного применения.
Список использованной литературы
1. Ershler W.B. (2006) Capecitabine monotherapy: safe and effective treatment for metastatic breast cancer. Oncologist, 11(4): 325–335.
2. Debled M., Madrangues N., Trainaud A. et al. (2009) First-Line Capecitabine monotherapy for slowly progression metastatic breast cancer. Do we need aggressive treatment? Oncology, 77: 318–327.
3. Reichardt P., von Minckwitz G., Thuss-Patienceet P.C. et al. (2003) Multicenter phase II study of oral capecitabine (Xeloda) in patients with metastatic breast cancer relapsing after treatment with a taxane-containing therapy. Ann. Oncol., 14(8): 1227–1233.
4. Kurt M., Aksoy S., Hayran M. et al. (2009) Retrospective analysis of capecitabine monotherapy in patients with metastatic breast cancer: a single center experience. Int. J. Hemat. Oncol., 1(19): 9–17.
5. Mouridsen H., Gershanovich M. (2003) The role of aromatase inhibitors in the treatment of metastatic breast cancer. Semin. Oncol., 4(14): 33–45.
6. Kadri A., Nuhad K.I. (2006) Aromatase inhibitors in breast cancer: an overview. Oncologist, 11(6): 553–562.
7. Bottini A., Generali D., Brizzi M.P. et al. (2006) Randomized phase II trial of letrozole and letrozole plus low-dose metronomic oral cyclophosphamide as primary systemic treatment in elderly breast cancer patients. J. Clin. Oncol., 24: 3623–3628. doi:10.1200/JCO.2005.04.5773.
8. Torrisi R., Dellapasqua S., Ghisini R. et al. (2009) Preoperative concurrent chemo- and endocrine therapy for women with large operable breast cancer expressing steroid hormone receptors. Breast, 17: 654–660.
9. Watanabe N. (2009) Concurrent administration of chemo-endocrine therapy for postmenopausal breast cancer patients. Breast cancer, 17(4): 247–253.
10. Eisenhauer E.A., Therasse P.T., Bogaerts J. et al. (2009) New response evaluation criteria in solid tumors: revised RECIST guideline. Eur. J. Cancer, 45: 228–247.
11. Cancer therapy evaluation program, common terminology criteria for adverse events, version 3.0. DCTD, NCI, NIH, DHHS 2003 (http://ctep.cancer.gov).
12. Kaufmann M., Bajetta E., Dirix L.Y. et al. (2000) Exemestane in superior to megestrol acetate after tamoxifen failure in postmenopausal women with advanced breast cancer: results of phase III randomized double-blind trial. J. Clin. Oncol., 18(7): 1399–1411.
13. McArthur H.L., Morns P.G. (2009) Aromatase Inhibitors strategies in metastatic breast cancer. Int. J. Women’s Health, 1: 67–72.
14. Nabholtz J.M., Buzdar A., Pollac M. et al. (2000) Anastrozole is superior to tamoxifen as first line therapy for advanced breast cancer in post menopausal women, result of a North American Multicenter Randomized Trial. J. Clin. Oncol., 18: 3758–3446.
15. Vergote I., Bonneterre J., Thürlimann B. et al. (2000) Randomised study of anastrozole versus tamoxifen as first-line therapy for advanced breast cancer in postmenopausal women. Eur. J. Cancer, 36(4): 84–85.
16. Buzdar A.U. (2003) Advances in endocrine treatment for postmenopausal women with metastatic and early breast cancer. Oncologist, 8(4): 335–341.
17. Tanaka M., Takamatsu Y., Anan K. et al. (2010) Oral combination chemotherapy with capecitabine and cyclophosphamide in patients with metastatic breast cancer: a phase II study. Anticancer drugs, 21: 453–458.
18. Schott A.F., Barlow W.E., Albain K.S. et al. (2012) Phase II trial of simple oral therapy with capecitabine and cyclophosphamide in patients with metastatic breast cancer: SWOG S0430. Oncologist, 17: 179–187.
19. Oberfield R.A., Cady B., Pazianos A.G. et al. (1979) Adrenalectomy-oophorectomy and combined chemotherapy for carcinoma of the breast with metastases. Surg. Gynecol. Obstet., 148: 881–886.
20. Australian and New Zealand Breast Cancer Trials Group (1986) A randomized trial in postmenopausal patients with advanced breast cancer comparing endocrine and cytotoxic therapy given sequentially or in combination. J. Clin. Oncol., 4: 186–193.
21. Bezwoda W.R., Derman D., De Moor N.G. et al. (1982) Treatment of metastatic breast cancer in estrogen receptor positive patients. A randomized trial comparing tamoxifen alone versus tamoxifen plus CMF. Cancer, 50: 2747–2750.
22. Kiang D.T., Gay J., Goldman A., Kennedy B.J. (1985) A randomized trial of chemotherapy and hormonal therapy in advanced breast cancer. N. Engl. J. Med., 313: 1241–1246.
23. Bedognetti D., Sertol M., Prozato P. et al. (2011) Concurent vs sequential adjuvant chemotherapy and hormone therapy in breast cancer: a multicenter randomized phase III trial. J. Natl. Cancer Inst., 103: 1529–1539.
24. Falkson G., Falkson H.C., Glidewell O. (1979) Improved remission rates and remission duration in young women with metastatic breast cancer following combined oophorectomy and chemotherapy: a study by cancer and leukemia group B. Cancer, 43: 2215–2222.
25. Kathleen I., Pritchard M.D. (2008) Combining endocrine agents with chemotherapy: which patients and what sequence? Cancer, 112(S3): 718–722.
26. Slege G.W., Hu P., Falkson G. et al. (2000) Comparison of chemotherapy with chemohormonal therapy as first line therapy for metastatic hormone sensitive breast cancer: an Eastern Cooperative Oncology Group Study. JCO, 18(2): 262–270.
27. Klijn J.G., Blamey R.W., Boccardo F. (2001) Combined tamoxifen and luteinizing hormone-releasing hormone (LHRH) agonist versus LHRH agonist alone in premenopausal advanced breast cancer: a meta-analysis of four randomized trials. JCO, 19(2): 343–353.
28. Moore H.C., Unger J.M., Phillips K. et al. (2014) Phase III trial (Prevention of Early Menopause Study [POEMS]-SWOG S0230) of LHRH analog during chemotherapy (CT) to reduce ovarian failure in early-stage, hormone receptor-negative breast cancer: An International Intergroup Trial of SWOG, IBCSG, ECOG, and CALGB (Alliance). J. Clin. Oncol., 32: 5–10.
29. Mohammadianpanah M., Ashour Y., Hoseini S. et al. (2011) The efficacy and safety of neoadjuvant chemotherapy +/- letrozole in postmenopausal women with locally advanced breast cancer: a randomized phase III clinical trials. Breast Cancer Res. Treat., 132(3): 853–861.
30. Watanabe N., Iwamoto T., Motoki T. et al. (2015) Neoadjuvant chemotherapy with or without the concurrent hormone therapy that has downregulated estrogen level in estrogen receptor positive breast cancer: NACED randomized multicenter phase II trial. J. Clin. Oncol., 33: abstr e11501.
Адрес:
Тимовская Юлиана Александровна
01601, Киев, ул. Верховинная, 69
Киевский городской клинический
онкологический центр
E-mail: timovska79@gmail.com














Leave a comment