Комбіноване лікування хворих на саркому м’яких тканин кінцівок і тулуба
Коровін С.І., Іванкова В.С., Остафійчук В.В., Палівець А.Ю., Кукушкіна М.М., Палій М.І.
Резюме. Саркоми м’яких тканин (СМТ) є відносно малорозповсюдженою патологією та становлять від 1,0 до 2,5% усіх злоякісних новоутворень у дорослих. Цей вид пухлин вирізняється несприятливим прогнозом і перебігом. Проаналізовано підсумки терапії хворих на СМТ ІІ–ІІІ стадії залежно від схем комбінованого лікування із поєднанням променевої терапії (ПТ) та радикальної хірургічної операції. Усі пацієнти були розподілені на 4 групи. До першої групи увійшли 53 хворих, які отримали лікування в обсязі передопераційної ПТ до сумарної вогнищевої дози (СВД) 40–45 Гр із подальшим хірургічним втручанням. Друга група — 75 хворих — курс передопераційної ПТ (СВД 30–35 Гр), хірургічне втручання з подальшим післяопераційним курсом ПТ на ділянку післяопераційного рубця у СВД 15–20 Гр. Третя група складалася із 95 пацієнтів, у яких лікування розпочинали з хірургічного етапу та продовжували післяопераційною ПТ на ділянку післяопераційного рубця (СВД 50–55 Гр). Четверта група — 60 хворих: курс передопераційної ПТ СВД 20 Гр при разовій вогнищевій дозі 5,0 Гр + радикальне видалення пухлини. Загальна 3-річна виживаність у першій групі становила 64,3%, другій — 69,2%, третій — 52,7%, четвертій — 66,8%. Локальний 3-річний контроль дорівнював відповідно 48,8; 46,3; 37,9 і 43,4%, а безметастатична 3-річна виживаність — 51,0; 61,6; 49,5 і 63,6% відповідно. Із вищезазначених даних випливає перевага режиму із використанням перед- та післяопераційної ПТ над іншими схемами лікування. Можна зробити висновок про перспективність поєднання перед- та післяопераційної ПТ при лікуванні хворих на СМТ.

Вступ
Саркоми м’яких тканин (СМТ) займають відносно малу частку в структурі онкопатології дорослої людини. За даними деяких авторів [1, 6], це 1,0–2,5% усіх злоякісних новоутворень дорослих. Досі питання ефективного лікування хворих із цією нозологічною формою не вирішено.
Методом вибору лікування при СМТ залишається хірургічний. Радикальне, абластичне видалення пухлини є найбільш важливим етапом терапії хворого. Основними принципами хірургічного методу при СМТ є футлярне видалення пухлини з шириною краю резекції здорових тканин від 1 см. Критерієм радикальності виконання операції є так звана методика виявлення залишкової резидуальної хвороби. Радикально виконаною операцію (R0) вважають, якщо у краях рани немає морфологічних ознак видаленої пухлини; умовно-радикальні (R1) втручання — це ті, після яких у краях резекції за допомогою мікроскопічних методів дослідження виявлено елементи пухлини; при нерадикальних і паліативних (R2) операціях у рані лишаються візуальні ознаки пухлини. Саме від радикальності проведення операції залежить подальший перебіг захворювання.
У багатьох випадках хірургу не вдається поєднати радикальність (R0) операції зі збереженням органа. Це зумовлює високий відсоток післяопераційних рецидивів.
Починаючи з 80-х років минулого століття, онкологи почали застосовувати комбінований підхід при СМТ [11]. Спочатку це було поєднання хірургічного лікування з променевою терапією (ПТ). Саме така комбінація покращила показники як локального контролю, так і загальної виживаності. Кількість рецидивів вдалося зменшити з 50 до 25% [13]. Безумовно, надалі виникло питання, в якій саме послідовності треба використовувати ці два методи.
Були проведені клінічні дослідження, які встановили перевагу передопераційної ПТ перед післяопераційною. Загальна виживаність у групі передопераційної терапії достовірно перевищувала аналогічний показник у пацієнтів іншої групи [5, 8–10]. Водночас застосування передопераційного опромінення суттєво збільшувало післяопераційні ускладнення [3]. Зрозуміло, що більшість хірургів надає перевагу методиці післяопераційної ПТ. За даними літератури, проведення передопераційного курсу опромінення є більш оптимальним при місцево-розповсюдженій формі СМТ або при пухлинах розміром >10 см, що, завдяки зменшенню їхнього обсягу, дає можливість збільшити частку органозберігаючих операцій [12].
У подальшому до схем лікування хворих на СМТ були залучені протоколи хіміотерапії, які також вплинули на віддалені результати радикальних операцій [2, 4, 7, 14].
У статті представлено ретроспективний аналіз нашого досвіду лікування хворих на СМТ із використанням різних комбінацій ПТ у поєднанні з оперативним лікуванням.
Об’єкт і методи дослідження
У дослідження включено 283 пацієнти із СМТ кінцівок і тулуба II–III стадії, що проходили лікування в Національному інституті раку в період з 2000 по 2011 р.
Критеріями включення пацієнтів у групи, аналізовані в дослідженні, були: вперше виявлена патогістологічно верифікована СМТ тулуба та кінцівок, хірургічне видалення пухлини R0–R1, відсутність клінічних ознак метастатичного ураження, вік більше 18 років, ECOG 0–1 бал.
Критерії виключення хворих: метастазування в інші органи, супутнє онкологічне захворювання, некомпенсовані захворювання або гострі стани, здатні вплинути на результати дослідження, виконане хірургічне лікування в обсязі R2.
План обстеження хворих:
- ультразвукове дослідження органів черевної порожнини та місця локалізації пухлини;
- рентгенографія органів грудної порожнини, за необхідності — магнітно-резонансна томографія місця ураження;
- товстоголкова або трепан-біопсія пухлини;
- лабораторні дослідження.
Хірургічний етап лікування включав радикальне й абластичне видалення пухлини, за можливості у фасціальному футлярі. Операцію виконували під загальною анестезією. Шви знімали на 12–14-ту добу на момент повного загоєння післяопераційної рани.
Сеанси дистанційної ПТ проводили на гамма-терапевтичних установках. Топометричну підготовку до планування лікування здійснювали на рентгенсимуляторах. У деяких випадках, залежно від локалізації пухлини, використовували свинцеві клиноподібні фільтри та свинцеві блоки. Більшість пацієнтів проходили курс дистанційної ПТ у Національному інституті раку. Хворі отримували сеанс дистанційної ПТ на гамма-терапевтичній установці «Тератрон Еліт 80» Со. Перед початком лікування пацієнту виконували топометричну підготовку на рентгенсимуляторі для визначення обсягу опромінення та критичних органів. На поверхню шкіри пацієнта під час проведення топометричної підготовки наносили контури поля опромінення. Форма поля залежала від локалізації та меж пухлини. Границі полів опромінення на 3–4 см перевищували розмір пухлини. При великих утвореннях поле опромінення включало до 10 см неуражених тканин у проксимальному та дистальному напрямку від границь пухлини. На другому етапі опромінення поле зменшували. При пухлинах, що локалізувалися на кінцівках, для зниження вірогідності розвитку променевих реакцій використовували додаткові косі поля опромінення. Для зменшення проявів фіброзу, контрактури м’язів і набряку з поля опромінення виключали до ⅓ окружності кінцівки. У випадку локалізації пухлини на передпліччі мінімальна ширина тканини, що не підлягає опроміненню, становила 2 см, на гомілці — 3 см, на стегні — до 4 см. У подальшому виконували фізико-радіобіологічні розрахунки для коректного підведення дози опромінення та визначення оптимальної кількості полів опромінення. До критичних органів належать органи та системи, які не потрібно опромінювати, а перевищення толерантних доз опромінення може спричинити порушення нормальної функції органа.
Залежно від терміну та режиму застосування ПТ хворих розподілили на 4 групи. У першу групу ввійшли 53 пацієнти: 29 (54,7%) чоловіків та 24 (45,3%) жінки, середній вік яких становив 50,3 року. У цій групі застосовували комбіноване лікування із використанням передопераційного курсу ПТ (40–45 Гр) із подальшим оперативним втручанням.
Друга група — 75 пацієнтів, з яких 30 (40,0%) чоловіків та 45 (60,0%) жінок, середній вік хворих становив 50,2 року. У цих пацієнтів застосовували комбінацію перед- (30–35 Гр) та післяопераційного (20–25 Гр) курсу ПТ.
До третьої групи належали 95 пацієнтів — 50 (52,6%) чоловіків та 45 (47,4%) жінок, середній вік яких становив 43,7 року. У цій групі лікування полягало в комбінуванні оперативного втручання із подальшим курсом післяопераційної ПТ (50–55 Гр).
У четверту групу ввійшли 60 пацієнтів, серед яких 31 (51,7%) чоловік та 29 (48,3%) жінок, середній вік хворих — 48,2 року. Проводили лікування в обсязі курсу передопераційної високофракційної ПТ (20 Гр) із подальшою операцією, яку виконували через 1–2 доби після закінчення курсу опромінення. Порівняльний аналіз пацієнтів дослідних груп подано в табл. 1.
Таблиця 1. Порівняльний аналіз досліджуваних груп
| Характеристики груп | Передопераційна ПТ (n=53), n (%) | Перед- + післяопераційна ПТ (n=75), n (%) | Післяопераційна ПТ (n=95), n (%) | Інтенсивна терапія (n=60), n (%) | |
| Стать | Чоловіки | 29 (54,7) | 30 (40,0) | 50 (52,6) | 31 (51,7) |
| Жінки | 24 (45,3) | 45 (60,0) | 45 (47,4) | 29 (48,3) | |
| Вік, років | 16–30 | 5 (9,4) | 13 (17,3) | 22 (23,2) | 9 (15,0) |
| 31–50 | 18 (34,0) | 21 (28,0) | 39 (41,0) | 23 (38,3) | |
| >50 | 30 (56,6) | 41 (54,7) | 34 (35,8) | 28 (46,7) | |
| Середній | 50,3±11,4 | 50,2±13,9 | 43,7±13,8 | 48,2±12,4 | |
| Розмірпухлини, см | <10 | 25 (47,2) | 36 (48,0) | 63 (66,3) | 30 (50,0) |
| >10 | 28 (52,8) | 39 (52,0) | 32 (33,7) | 30 (50,0) | |
| Градація G | G1–2 | 12 (22,6) | 15 (20,0) | 19 (20,0) | 22 (36,7) |
| G2–3 | 41 (77,4) | 60 (80,0) | 76 (80,0) | 38 (63,3) | |
| Підтипи СМТ | Ангіосаркома | 7 (13,2) | 10 (13,3) | 7 (7,4) | 11 (18,3) |
| Фіброзна гістіоцитома | 12 (22,6) | 18 (24,0) | 13 (13,7) | 4 (6,7) | |
| Лейоміосаркома | 5 (9,4) | 9 (12,0) | 15 (15,8) | 12 (20,0) | |
| Ліпосаркома | 5 (9,4) | 12 (16,0) | 11 (11,5) | 10 (16,7) | |
| Мезенхімома | 4 (7,5) | 8 (10,7) | 10 (10,5) | 7 (11,7) | |
| Міксосаркома | 2 (3,9) | 2 (2,7) | 1 (1,1) | 1 (1,7) | |
| Нейросаркома | 6 (11,3) | 6 (8,0) | 15 (15,8) | 3 (5,0) | |
| Рабдоміосаркома | 8 (15,0) | 9 (12,0) | 12 (12,6) | 6 (10,0) | |
| Некласифікована саркома | 1 (1,9) | 0 | 1 (1,1) | 3 (5,0) | |
| Плеоморфна саркома | 1 (1,9) | 0 | 2 (2,1) | 1 (1,7) | |
| Синовіальна саркома | 2 (3,9) | 1 (1,3) | 4 (4,2) | 0 | |
| Фібросаркома | 0 | 0 | 4 (4,2) | 2 (3,3) | |
| Нижні кінцівки | Стегно | 33 (62,3) | 46 (61,3) | 44 (46,3) | 24 (40,0) |
| Гомілка та стопа | 6 (11,3) | 8 (10,7) | 16 (16,8) | 12 (20,0) | |
| Тулуб | Черевна стінка та здухвина | 3 (5,7) | 2 (2,7) | 6 (6,4) | 2 (3,3) |
| Грудна стінка та спина | 0 | 4 (5,3) | 8 (8,4) | 5 (8,3) | |
| Верхні кінцівки | Кисть та передпліччя | 6 (11,3) | 8 (10,7) | 9 (9,5) | 7 (11,7) |
| Плече | 5 (9,4) | 7 (9,3) | 12 (12,6) | 10 (16,7) | |
При проведенні курсів ПТ відмічали післяпроменеві реакції, оцінювані за системою RTOG (табл. 2).
Таблиця 2. Променеві реакції в досліджуваних групах
| Променеві реакції | Передопераційна ПТ (n=53), n (%) | Перед- + післяопераційна ПТ (n=75), n (%) | Післяопераційна ПТ (n=95), n (%) | Інтенсивна терапія (n=60), n (%) |
| Сухий епідерміт | 46 (86,8) | 31 (41,3) | 75 (78,9) | 19 (31,7) |
| Епіляція | 53 (100,0) | 75 (100,0) | 95 (100,0) | 60 (100,0) |
| Слабовиражена еритема | 53 (100,0) | 75 (100,0) | 95 (100,0) | 60 (100,0) |
| Острівковий вологий епідерміт | 6 (11,3) | 22 (29,3) | 33 (34,7) | 4 (6,7) |
| Помірний набряк | 26 (49,1) | 38 (50,7) | 72 (75,8) | 6 (10,0) |
Результати та їх обговорення
Ускладнення, пов’язані з використанням ПТ, які ми спостерігали в дослідних групах, наведено в табл. 3. Відмічено недостовірну тенденцію в бік підвищення відсотка післяопераційних ускладнень у групах застосування ПТ у передопераційному режимі.
Таблиця 3. Післяпроменеві ускладнення післяопераційної рани в досліджуваних групах (оцінка RTOG)
| Післяпроменеві ускладнення післяопераційної рани | Передопераційна ПТ (n=53), n (%) | Перед- + післяопераційна ПТ (n=75), n (%) | Післяопераційна ПТ (n=95), n (%) | Інтенсивна терапія (n=60), n (%) |
| Загальна кількість ускладнень, % | 30,2±6,3 | 25,4±5,0 | 15,8±3,7 | 25,0±5,6 |
| Крайовий некроз | 16 (30,2) | 19 (25,3) | 15 (15,8) | 15 (25,0) |
| Розходження швів | 10 (18,9) | 9 (12,0) | 8 (8,4) | 9 (15,0) |
| Нагноєння | 10 (18,9) | 9 (12,0) | 8 (8,4) | 9 (15,0) |
Безпосередні результати лікування оцінено лише в 2 групах, де були застосовані передопераційні курси ПТ. При оцінці цих даних групу із використанням високофракційної передопераційної терапії не було включено в зв’язку із малим терміном від закінчення ПТ до оперативного втручання, що становив 1–2 доби. Оцінку проводили за системою RECIST 1.1. Отримані результати представлено в табл. 4. Варто відмітити незначну і статистично не достовірну перевагу в групі хворих, що отримали ПТ лише перед хірургічним лікуванням.
Таблиця 4. Оцінка безпосередніх результатів лікування в групах із використанням передопераційного курсу ПТ за критеріями RECIST
| RECIST 1.1 |
Передопераційна ПТ (n=53), n (%) |
Перед- + післяопераційна ПТ (n=75), n (%) |
| Прогресія СМТ | 13 (24,5) | 18 (24,0) |
| Регресія СМТ | 6 (11,3) | 7 (9,3) |
| Стабілізація | 34 (64,2) | 50 (66,7) |
Для оцінки віддалених результатів лікування у всіх групах ми провели порівняльний аналіз таких показників, як загальна 3-річна виживаність, локальний 3-річний контроль і безметастатична 3-річна виживаність.
У першій групі показник загальної виживаності становив 64,3±6,5%, локального контролю — 48,8±6,8%, безметастатичної виживаності — 51,0±6,8%. У другій групі загальна виживаність досягла 69,2±5,3%, локальний контроль — 46,3±5,7%, безметастатична виживаність — 61,6±5,6%. У третій групі пацієнтів загальна виживаність становила 52,7±5,1%, локальний контроль — 37,9±4,9%, безметастатична виживаність — 49,5±5,1%. У четвертій групі аналогічні показники становили 66,8±6,0; 43,4±6,3 та 63,6±6,2% відповідно. Порівняльний аналіз отриманих результатів наведено в табл. 5. Статистично значущу різницю зафіксовано лише щодо одного показника у двох групах — загальної виживаності у другій та третій групах (p<0,05). Динамічний аналіз
змін усіх показників протягом спостереження продемонстровано на рис. 1–3.
Таблиця 5. Аналіз 3-річної виживаності пацієнтів у досліджуваних групах
| Показник | Передопераційна ПТ (n=53) | Перед- + післяопераційна ПТ (n=75) | Післяопераційна ПТ (n=95) | Інтенсивна терапія (n=60) |
| Загальна виживаність, % | 64,3±6,5 | 69,2±5,3 | 52,7±5,1 | 66,8±6,0 |
| Локальний контроль, % | 48,8±6,8 | 46,3±5,7 | 37,9±4,9 | 43,4±6,3 |
| Безметастатична виживаність, % | 51,0±6,8 | 61,6±5,6 | 49,5±5,1 | 63,6±6,2 |
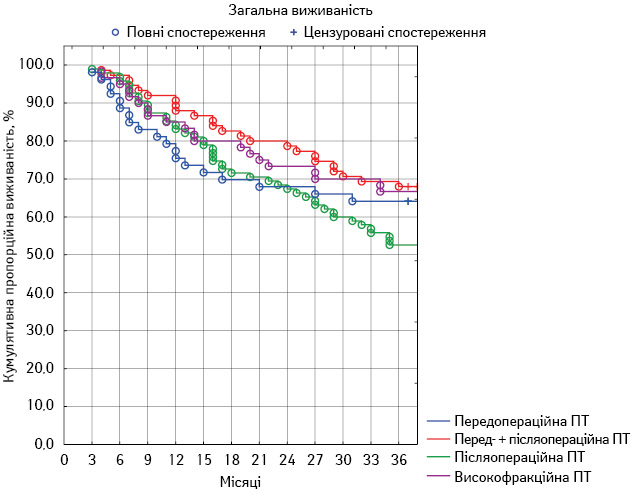 Рис. 1. Загальна 3-річна виживаність пацієнтів у досліджуваних групах
Рис. 1. Загальна 3-річна виживаність пацієнтів у досліджуваних групах
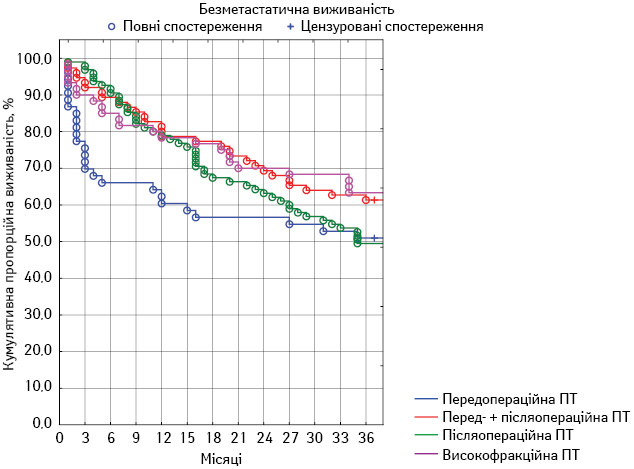 Рис. 2. Безметастатична 3-річна виживаність пацієнтів у досліджуваних групах
Рис. 2. Безметастатична 3-річна виживаність пацієнтів у досліджуваних групах
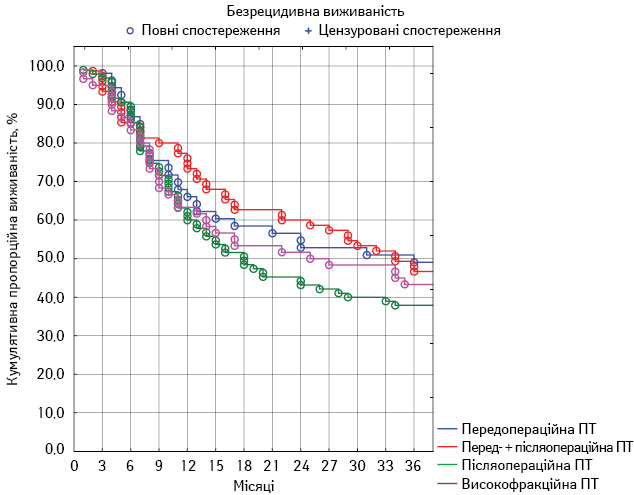 Рис. 3. Локальний 3-річний контроль пацієнтів у досліджуваних групах
Рис. 3. Локальний 3-річний контроль пацієнтів у досліджуваних групах
Висновки
Порівняльний аналіз безпосередніх і віддалених результатів лікування дозволив нам зробити такі висновки:
- застосування зазначених комбінацій і курсових доз ПТ не призводить до суттєвих ускладнень;
- лікування виявилося ефективнішим у групах хворих із передопераційними етапами ПТ. Проте достовірно визначити різницю вдалося лише в одному випадку. При порівнянні загальної 3-річної виживаності пацієнтів другої та третьої груп встановлено достовірну (p<0,05) перевагу на 16,5%.
Список використаної літератури
1. Шугабейкер П.Х., Малауэр М.М. (1996) Хирургия сарком мягких тканей. Медицина, Москва, 440 с.
2. Bedi M., King D.M., Shivakoti M. et al. (2013) Prognostic variables in patients with primary soft tissue sarcoma of the extremity and trunk treated with neoadjuvant radiotherapy or neoadjuvant sequential chemoradiotherapy. Radiat. Oncol., 8: 60.
3. O’Sullivan B., Davis A.M., Turcotte R. et al. (2002) Preoperative versus postoperative radiotherapy in soft-tissue sarcoma of the limbs: a randomised trial Lancet, 359(9325): 2235–41.
4. Cesne A., Ouali M., Leahy M.G. et al. (2014) Doxorubicin-based adjuvant chemotherapy in soft tissue sarcoma: pooled analysis of two STBSG-EORTC phase III clinical trials. Ann. Oncol., 25(12): 2425–32.
5. Cheng E., Dusenbery K., Winters M. et al. (1996) Soft tissue sarcomas: preoperative versus postoperative radiotherapy. J. Surg. Oncol., 61: 90–99.
6. Holland J.F., Frei E. (2003) Cancer Medicine. BC Decker Inc., London, 2699 p.
7. Look Hong N.J., Hornicek F.J., Harmon D.C. et al. (2013) Neoadjuvant chemoradiotherapy for patients with high-risk extremity and truncal sarcomas: a 10 year single institution retrospective study. Eur. J. Cancer, 49(4): 875–883.
8. Pollack A., Zagars G., Goswitz M. et al. (1998) Preoperative vs. postoperative radiotherapy in the treatment of soft tissue sarcomas: a matter of presentation. Int. J. Radiat. Oncol. Biol. Phys., 42: 563.
9. Robinson M.H., Keus R.B., Shasha D., Harrison L.B. (1998) Current controversies in cancer. Is preoperative radiotherapy superior to postoperative radiotherapy in the treatment of soft tissue sarcomas? Eur. J. Cancer, 34(9): 1309–1316.
10. Roberge D., Skamene T., Nahal A. et al. (2010) Radiological and pathological response following preoperative radiotherapy for softtissue sarcoma. Radiother. Oncol., 97: 404–407.
11. Sampath S., Schultheiss T.E., Hitchcock Y.J. et al. (2011) Preoperative versus postoperative radiotherapy in soft tissue sarcoma: multi-institutional analysis of 821 patients. J. Radiat. Oncol. Biol. Phys., 81(2): 498–505.
12. Suit H.D., Mankin H.J., Wood W.C. et al. (1988) Treatment of the patient with stage M0 soft tissue sarcoma. J. Clin. Oncol., 6(5): 854–862.
13. Strander H., Turesson I., Cavallin-Stеhl E. (2003) A systematic overview of radiation therapy effects in soft tissue sarcomas. Acta Oncol., 42(5–6): 516–531.
14. Tierney J.F., Mosseri V., Stewart’ L.A., Souhami R.L. (1995) Adjuvant chemotherapy for soft-tissue sarcoma: review and meta-analysis of the published results of randomised clinical trials. Br. J. Cancer, 72(2): 469–475.
Комбинированное лечение больных саркомой мягких тканей конечностей и туловища
Национальный институт рака, Киев
Резюме. Саркомы мягких тканей (СМТ) являются относительно малораспространенной патологией и составляют 1,0–2,5% всех злокачественных новообразований у взрослых. Данный вид опухолей отличается плохим прогнозом и течением. Проанализированы итоги терапии больных СМТ II–ІІІ стадии в зависимости от схем комбинированного лечения — лучевой терапии (ЛТ) и радикальной хирургической операции. Все пациенты разделены на 4 группы. Первую группу составили 53 больных, получивших лечение в объеме предоперационной ЛТ в суммарной очаговой дозе (СОД) 40–45 Гр с последующим хирургическим вмешательством. Вторая группа — 75 пациентов — курс предоперационной ЛТ (СОД 30–35 Гр) + хирургическое вмешательство с последующим послеоперационным курсом ЛТ на область послеоперационного рубца в СОД 15–20 Гр. Третья группа состояла из 95 пациентов, у которых лечение начинали с хирургического этапа и продолжали послеоперационной ЛТ на область послеоперационного рубца (СОД 50–55 Гр). Четвертая группа — 60 больных: курс предоперационной ЛТ в СОД 20 Гр при разовой очаговой дозе 5,0 Гр + радикальное удаление опухоли. Общая 3-летняя выживаемость в первой группе составила 64,3%, второй — 69,2%, третьей — 52,7%, четвертой — 66,8%. Локальный 3-летний контроль — соответственно 48,8; 46,3; 37,9 и 43,4%, а безметастатическая 3-летняя выживаемость — 51,0; 61,6; 49,5 и 63,6% соответственно. Из вышеупомянутых данных следует преимущество режима с использованием пред- и послеоперационной ЛТ над другими схемами лечения. Можно сделать вывод о перспективности сочетания пред- и послеоперационной ЛТ при терапии больных СМТ.
саркома мягких тканей, хирургическое лечение, лучевая терапия.
Адреса:
Остафійчук Василь Васильович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 257-99-46
E-mail: lugnik2007@gmail.com














Leave a comment