Вплив феромагнітних наночастинок заліза та їх композитів на ріст і метастазування карциноми легені Льюїс та солідної карциноми Ерліха
Мосієнко В.С.1, Кущевська Н.Ф.2, Шляховенко В.О.1, Бурлака А.П.1, Куртсеїтов Л.К.3, Карнаушенко О.В.1, Вербиненко А.В.1
- 1Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 2Відкритий міжнародний університет розвитку людини «Україна», Київ
- 3Головний військово-медичний клінічний ордена Червоної Зірки центр «Головний військовий клінічний госпіталь» МО України, Київ
Резюме. У роботі досліджували вплив феромагнітних наночастинок оксиду заліза (ФНОЗ), фероцену та лактоферину на перещеплену карциному легені Льюїс і солідну карциному Ерліха, рівень прооксидантних та оксидантних систем тканин організму методом ЕПР-спектроскопії (ЕПР — електронний парамагнітний резонанс) та загальне метилування ДНК злоякісних клітин. У терапевтичних дослідах показано, що найбільш ефективними стосовно цих штамів є ФНОЗ і фероцен, введені в низьких дозах від 2 до 10 мкг/мишу в комбінації з аскорбіновою кислотою. Середня тривалість життя мишей з карциномою легені Льюїс та солідною карциномою Ерліха була статистично достовірно більшою, ніж у контрольній групі (р<0,05). Метастазування в легені мишей зменшувалося за кількістю та об’ємом у дослідних групах на 80,0 і 60,0% та 92,5 і 87,3% відповідно порівняно з контролем. Затримка росту первинної перещепленої карциноми легені Льюїс і солідної карциноми Ерліха становила 15–20% порівняно з контрольними групами мишей. За даними ЕПР-спектроскопії, ФНОЗ і фероцен здатні змінювати окисний фенотип пухлинних клітин і паренхіматозних органів, підвищувати рівень активності цитохрому Р450 та зменшувати продукування NO-радикалів у мітохондріях клітин при їх курсовому введенні в низьких дозах. У дослідах на перещеплених штамах карциноми легені Льюїс і солідній карциномі Ерліха встановлено значний протипухлинний і антиметастатичний ефект, який, вірогідно, пов’язаний не з цитотоксичним, а з циторегулювальним впливом наночастинок заліза на ріст злоякісних клітин.

Останнім часом у зв’язку з бурхливим розвитком і впровадженням нанотехнологій у народному господарстві в біології та медицині почали інтенсивно досліджувати наночастинки різного походження [1, 2]. Застосування нанотехнологій відкриває можливості отримання оригінальних фармакологічних препаратів і підвищення ефективності лікування при багатьох хронічних захворюваннях, у тому числі й при пухлинній хворобі [3–5]. Вчені з Національного інституту здоров’я США (US National Institute of Health) вважають, що лікарські засоби, отримані за допомогою нанотехнологій, будуть ефективні в лікуванні хворих з різними формами онкологічної патології, на різних стадіях при мінімізації побічних ефектів [6].
На сьогодні найбільш поширеними наноматеріалами з унікальними властивостями є металеві наночастинки, які утворюють нанокластери заліза, золота, срібла, міді та інших металів. Серед них слід відмітити магнітоактивні наночастинки оксиду заліза, які можуть швидко проникати через мембрани клітин і гематоенцефалічний бар’єр, ініціювати утворення реактивних сполук кисню (кисневий стрес) та запалення, що здатні пошкоджувати органели чи ДНК клітин, задіяних у процесі їх поділу, призводити до апоптозу або зупиняти цей процес [7–10, 16]. Оксидативний стрес може активувати шляхи внутрішньоклітинної передачі сигналів, включаючи фактор NF-kB.
Залізо — це мікроелемент, функцію якого в організмі важко переоцінити. Воно є обов’язковим компонентом багатьох гемових структур — гемоглобіну, міоглобіну, каталази та має декілька негемових сполук — трансферин, феритин, гемосидерин, дегідрогенази та ін. [11]. В організмі чоловіка заліза міститься близько 50 мг/кг маси тіла, жінки — 40 мг/кг, що становить <4 г заліза у всьому організмі, яке розподіляється серед депонованого, транспортного і гемоглобінового залізовмісних ферментів у різних тканинах. Депонування заліза відбувається у вигляді феритину та гемосидерину здебільшого в макрофагах печінки, селезінки та еритробластах кісткового мозку. Феритин є основним білком, який депонує залізо в нетоксичній і фізіологічно доступній формі. Транспортне залізо циркулює в кровоносній системі у складі трансферину в об’ємі до 4 мг, а найбільші запаси заліза знаходяться у вигляді гему (Fe + протопорфірин), що становить 2,5 г. Усі три рівні сполук заліза в організмі перебувають у стійкій рівновазі між собою впродовж усього життя.
Всмоктування заліза відбувається в основному у дванадцятипалій кишці та проксимальному відділі тонкої кишки [12]. З їжею в середньому в організм надходить від 15 до 20 мг заліза, але адсорбується лише 1–2 мг/добу. Таку саму кількість заліза організм втрачає щодня з калом, сечею та іншими біологічними виділеннями [11, 13]. В їжі залізо перебуває здебільшого в окисному стані Fe3O4 і входить до складу білків, солей та органічних кислот. У шлунку під дією соляної кислоти відбувається часткова іонізація заліза з утворенням його закисної двовалентної форми Fe. Тільки у цій формі залізо всмоктується в кишечнику.
Наночастинки оксиду заліза можуть блокувати реплікацію ДНК при поділі клітин і викликати її метилування, що призводить до змін функціонування генів [14]. Під дією феромагнітних наночастинок оксиду заліза (ФНОЗ) може утворюватися пероксид водню, який є рушієм генерування високореактивних гідроксильних радикалів [15].
Сучасні дослідження ФНОЗ можуть дати поштовх до створення високоефективних лікарських засобів з різними фармакологічними властивостями та розвитку конвергентних технологій стосовно синергетичної комбінації нано-, біо- та інформаційних технологій.
Метою роботи було вивчення протипухлинної та антиметастатичної дії наночастинок заліза, а також загального метилування ДНК у солідних і лейкозних клітинах за умов блокування синтезу поліамінів.
Об’єкт і методи досліджень
В експерименті використано 200 мишей ліній С57Вl/6, DBA та CDF1 обох статей масою 17–25 г, розведених у віварії Інституту експериментальної патології, онкології і радіобіології (ІЄПОР) ім. Р.Є. Кавецького НАН України. Усі досліди проводили відповідно до вимог регіонального комітету з етики роботи з лабораторними тваринами. Дослідження виконували згідно з принципами Європейської конвенції про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей.
Після 2-тижневого карантину тваринам за стандартними методами перещеплювали карциному легені Льюїс (3LL) внутрішньом’язово в стегно задньої лапки в кількості 500 тис. клітин у 0,2 мл стерильного фізіологічного розчину. Солідну карциному Ерліха перещеплювали підшкірно в правий бік по 5 млн клітин у 0,2 мл фізіологічного розчину. Усі пухлинні штами були отримані з клітинного банку ліній тканин людини і тварин ІЕПОР ім. Р.Є. Кавецького НАН України.
ФНОЗ були опрацьовані Н.Ф. Кущевською [15] за оригінальною методикою у співвідношенні 40% Fe2O3 / 60% Fe3O4. ФНОЗ мають вигляд ультрадисперсного порошку сірого кольору неправильної форми, нерозчинні у воді та спирті. Растрова й електронна мікроскопія показали, що ФНОЗ — це неорганічні нанорозмірні частинки заліза розміром 5–70 нм магнетиту (Fe3O4) та маггеміту (Fe2O3), які мають суперпарамагнітні властивості та можуть впливати на спін-ґраткову, Т1 та спін-спінову, Т2 релаксацію навколишніх рідин. За даними рентгеноструктурного аналізу, ФНОЗ у вищезгаданому співвідношенні близькі до ферану. Показник LD50 ФНОЗ, визначений за методом Кербера, становив 8,41 г/кг маси тіла тварин.
Застосовували аскорбінову кислоту С6Н8О6 — офіцинальний лікарський препарат виробництва ПАТ «Київський вітамінний завод».
Лактоферин — один з основних білків грудного молока, отриманий РУП «Науково-практичний центр НАН Білорусі з тваринництва» разом з Інститутом біології гена РАН генно-інженерним методом із подальшою очисткою на рідинному хроматографі середнього тиску AKTA FPLC system (Amersham Pharmacia).
Фероцен Fe (C5H5)2 — виробництва компанії «Sigma» (США).
Фулерен С60 — у 100 мл розчину міститься 0,0002 мг гідратованого фулерену С60. Розробник і виробник: Інститут фізіологічно активних сполук (Україна).
Протипухлинні та антиметастатичні властивості оцінювали за об’ємом первинної перещепленої пухлини 3LL та солідної карциноми Ерліха, кількістю та об’ємом метастазів у легенях, а також середньою тривалістю життя (СТЖ) піддослідних тварин порівняно з мишами контрольної групи. Вплив ФНОЗ на активність FS-білків N-2 мітохондрій, цитохрому Р450, генерування супероксидних та NO-радикалів у пухлині, печінці, нирках і нейтрофілах периферичної крові досліджували у мишей з карциномою легені Льюїс методом ЕПР-спектрометрії (ЕПР — електронний парамагнітний резонанс), використовуючи технології спінових уловлювачів за допомогою комп’ютеризованого радіоспектрометра ЕПР РЕ-1307 [17].
Визначення впливу ФНОЗ на рівень тотального метилування ДНК пухлинних клітин здійснювали за допомогою набору Methyl Flash Methylated DNA Quantification Kit (Colometrie, США) відповідно до рекомендацій фірми-виробника. Вимірювання оптичної густини проводили на приладі «Synergy» при довжині хвилі 450 нм.
Основні результати досліджень оцінювали, використовуючи t-критерій Стьюдента. Статистична значущість прийнята при р<0,05.
Результати та їх обговорення
Для визначення ефективних доз ФНОЗ, які впливають на ріст і метастазування солідної карциноми Льюїс, пухлину перещепили мишам-самицям лінії С57 Вl/6 за вищезгаданою методикою. Тваринам дослідних груп ФНОЗ у 0,3 мл дистильованої води, вводили перорально щоденно в дозі 10 мкг/мишу (1-ша група) та 2 мкг/мишу (2-га група) в кількості 10 введень, починаючи з 2-ї доби після перещеплення пухлини. Контрольній групі мишей вводили в такому самому режимі дистильовану воду. На 23-тю добу після перещеплення пухлини мишей під наркозом забивали і підраховували кількість метастазів у легенях. У 1-й групі тварин кількість метастазів та їх об’єм були меншими на 80,0 та 64,0%, а в другій — на 92,5 та 87,3% відповідно порівняно з контрольною групою (р<0,05) (рис. 1, 2). Об’єм первинної перещепленої карциноми легені Льюїс у піддослідних 1-ї та 2-ї групи становив 382,2±132 та 366,1±125 мм відповідно, у контрольній — 430,6±143 мм, тобто ФНОЗ на 12 та 15% затримували ріст первинної перещепленої пухлини (р>0,05).
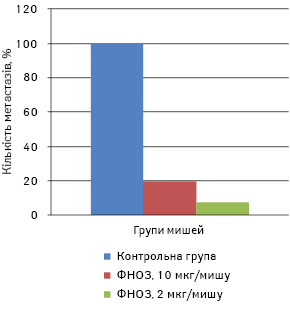
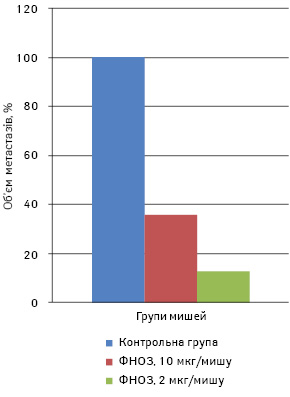
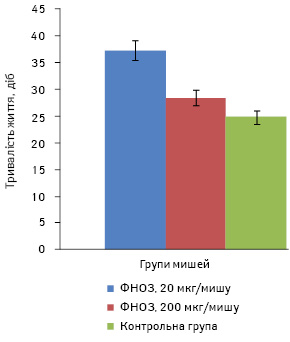
У наступному досліді ФНОЗ вводили мишам-самицям перорально в дозі 20 та 200 мкг/мишу в кількості 12 введень, починаючи з 2-ї доби після перещеплення карциноми легені Льюїс. СТЖ становила 37,5±6,5 доби в 1-й групі та 28,4±3,6 доби — у 2-й порівняно з контрольною групою мишей, які прожили 24,8±3,8 доби (рис. 3). Отже, ФНОЗ у 1-й групі мишей статистично достовірно подовжують їх СТЖ (р<0,05) та затримують ріст первинної перещепленої пухлини на 15%.
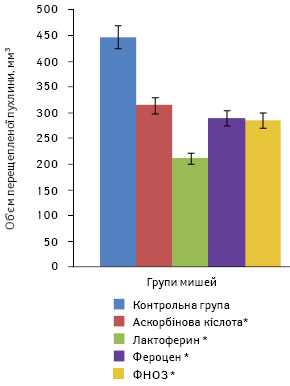
У ще одному експерименті в порівняльному досліді вивчали протипухлинний та антиметастатичний вплив ФНОЗ (пероральне введення), фероцену та лактоферину (вводили в черевну порожнину в дозі 0,2 мл) в різних дозах — 10; 2 та 200 мкг/мишу відповідно на фоні введених у черевну порожнину 2 мг/мишу аскорбінової кислоти в 0,2 мл стерильного фізіологічного розчину хлориду натрію. Наночастинки різних сполук заліза вводили наступної доби після перещеплення карциноми легені Льюїс. Лікування проводили 3 курсами щоденно з перервами 3 доби, усього 18 введень.
Первинні пухлини з’явилися на 13-ту добу після їхнього перещеплення. Об’єм пухлин у групі мишей, які отримували ФНОЗ, становив у середньому 285,6±37,6 мм, у групі тварин, яким вводили фероцен, — 289,3±55,0 мм, лактоферин — 212,0±29,1 мм. У контрольних групах мишей, які отримували аскорбінову кислоту, обсяг первинної пухлини досяг 314,5±49,0 мм, у тих, яким вводили фізіологічний розчин, — 447,3±107,0 мм (рис. 4). Тенденцію гальмування росту первинної перещепленої пухлини відзначали до 27-ї доби, її об’єм був на 10–15% меншим порівняно з пухлинами у тварин контрольних груп.
Щодо кількості метастазів та їх об’єму в легенях мишей, то найменшими ці показники були в групі, в якій отримували фероцен, і становили відповідно 5,3±1,0 шт. і 16,3±1,7 мм. Найбільша кількість метастазів була в групі мишей, які отримували лактоферин, і становила 20,3±3,7 шт. при об’ємі 45,6±19,6 мм. У групі мишей, яким вводили ФНОЗ на фоні аскорбінової кислоти, ці показники виявилися меншими і становили 17,5±4,8 шт. та 32,4±17,6 ммвідповідно. У контрольній групі тварин, які отримували аскорбінову кислоту, кількість та об’єм метастазів сягали 25,4±7,3 шт. і 57,8±21,5 ммвідповідно, а в групі, в якій вводили лише фізіологічний розчин, зазначені показники становили 23,7±8,5 шт. та 52,3±20,7 мм (рис. 5, 6).
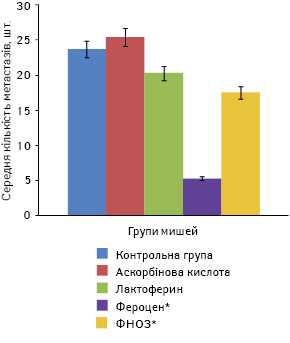
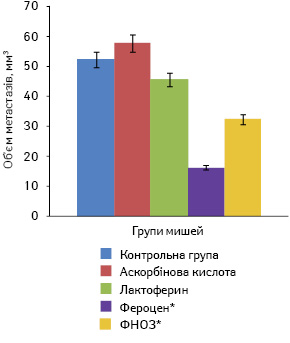
За даними ЕПР-спектроскопії, вплив наночастинок заліза у складі різних сполук на окисний фенотип клітин, підвищення рівня генерування супероксидних радикалів і продукування NO у клітинах пухлин, паренхіматозних органів і нейтрофілів крові найбільшим був при застосуванні фероцену та ФНОЗ. У тварин, які отримували лактоферин, вищезазначені показники ЕПР-спектроскопії блокувалися введенням його у високих дозах (200 мкг/мишу). Можливо, через це спостерігали низький ефект лактоферину. При аналізі результатів експерименту виявилося, що в антиметастатичній дії цих сполук значно більшу роль відіграє доза, ніж спосіб введення, їх хімічна будова чи комбінація з аскорбіновою кислотою.
Приріст загальної маси мишей найбільшим був у групах, які отримували фероцен і ФНОЗ, а найменшим — у контрольних групах і групі тварин, яким вводили лактоферин, що свідчить про нетоксичність наночастинок заліза в досліджуваних дозах.
У наступному досліді вивчали вплив комбінації аскорбінова кислота (2 мг/мишу) + композит ФНОЗ (5 мкг/мишу + поліетиленгліколь 20 мг/мишу), введеної перорально в об’ємі 0,3 мл дистильованої води, на ріст солідної карциноми Ерліха, перещепленої 18 нелінійним мишам-самицям за вищезазначеною схемою. У 1-й групі мишам вводили в черевну порожнину аскорбінову кислоту в 0,2 мл стерильного фізіологічного розчину, а через 30 хв — перорально композит наночастинок заліза в 0,3 мл дистильованої води. Лікування мишей починали з наступної доби після перещеплення карциноми Ерліха, щоденно, курс становив 12 введень.
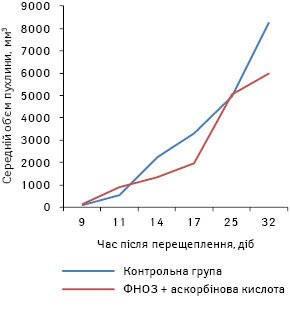
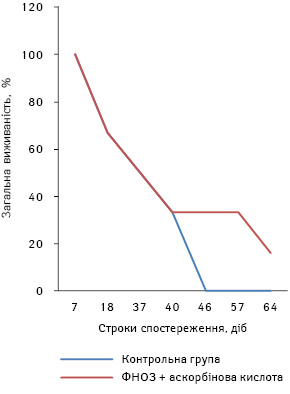
При аналізі результатів виявлено, що пухлини в дослідній групі мишей з’явилися на 2 доби пізніше, ніж у контрольній групі, а темп їх росту був повільнішим. Середній розмір пухлин на 32-гу добу виявився набагато меншим (р<0,05) порівняно з контролем (рис. 7). Динаміку виживаності мишей продемонстровано на рис. 8. Відсоток виживаності в контрольній групі тварин був нижчим, ніж у дослідній. СТЖ мишей дослідної групи була на 40% більшою (р<0,05) порівняно з відповідним показником у контрольній групі мишей.
Дослідження впливу наночастинок оксиду заліза на рівень загального метилування ДНК пухлинних клітин здійснювали за вищеописаною методикою. Зміни загального метилування ДНК лімфолейкозних клітин L1210 та клітин карциноми легені Льюїс виявилися у групах мишей різними і в більшості випадків не збігалися з протилейкозним, протипухлинним та антиметастатичним ефектом.
Найвищим рівень метилування ДНК клітин карциноми легені Льюїс був у групі мишей, які отримували аскорбінову кислоту. У цій групі відзначали стимуляцію первинної перещепленої карциноми і метастазів у легенях, а тотальне метилування було навіть більшим, ніж у пухлинних клітинах у групі контролю. У групі тварин, які отримували фероцен, виражений протипухлинний і антиметастатичний ефект збігався з підвищеним рівнем загального метилування ДНК клітин карциноми легені Льюїс (р<0,05). У групі мишей, які отримували ФНОЗ, протипухлинний і антиметастатичний ефект був високим, майже таким самим, як при лікуванні фероценом, а загальне метилування достовірно відрізнялося від цього показника групи фероцену. Найнижчим рівень загального метилування ДНК був у групі мишей, які отримували лактоферин, хоча кількість метастазів та їхній об’єм був на рівні відповідних показників у контрольній групі.
Рівень загального метилування ДНК у мишей з лімфолейкозом L1210 не збігався з протилейкозним ефектом. Найнижчим цей рівень був у групі мишей, які отримували ФНОЗ і ФНОЗ + фулерен С60, а СТЖ у цих групах виявилася найбільшою і становила 19,9±1,3 та 18,5±1,2 доби. Найменша тривалість життя (13,6±1,2 доби) була у групі мишей, які отримували лише фулерен, а загальне метилування ДНК лейкозних клітин було на рівні контролю (рис. 9).
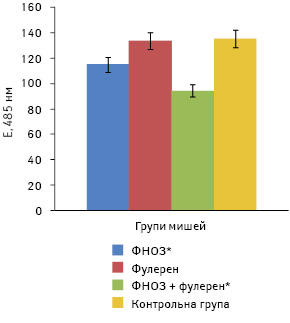
Отже, рівень загального метилування ДНК злоякісних клітин виявився неоднозначним у різних дослідах і на різних штамах пухлинного росту та навряд чи може бути маркером при визначенні протипухлинної активності, впливу на ріст метастазів або прогнозу.
Щодо загального, чи тотального, метилування, то воно являє собою хімічну, мобільну модифікацію генів, що здійснюється за участю ферментів, які транспортують метильні СН3-групи, що контролюють епігеномні успадкування та експресію генів ДНК [18]. Метилування цитозину в ДНК клітин є ключовим фактором, який забезпечує стійкість і захист геному від шкідливого впливу зовнішнього середовища [19]. Метилування не змінює послідовність ДНК, а лише модифікує відповідні нуклеотиди [20]. Ферментативне метилування залишків цитозину в ДНК вважають одним із важливих механізмів епігеномної регуляції в процесі старіння організму. Старіння поступово супроводжується втратою метильних груп цитозину ДНК клітин у тканинах різних органів [21]. Профіль метилування ДНК і мутації успадковуються організмом та в процесі онтогенезу поступово змінюються. Деметилування ДНК призводить до прискорення мутації генів, супроводжується скороченням теломерів і зміною геному. Штучно викликане деметилування спричиняє також передчасне старіння організму. Підвищений рівень радіації, стресові фактори (хімічні та фізичні) можуть призвести до гіпер- або гіпометилування певних послідовностей ДНК генів [19, 22].
Згідно з сучасними уявленнями захист ДНК клітин від кисневого стресу (активних форм кисню) реалізується комплексом захисних ферментів (родина глутатіонпероксидаз, супероксиддисмутаз, каталази, пероксидази), неферментативних низькомолекулярних антиоксидантів; конформаційними змінами самого хроматину, зумовленого метилуванням ДНК; а також ацетилюванням гістонових білків. Разом з тим загальне метилування ДНК є поліфункціональним процесом, який має важливе значення у конформаційних змінах ДНК, активації рухомих елементів геному та ініціації геномної нестабільності [18, 19]. Процес метилування ДНК відіграє активну роль у формуванні генетичного поліморфізму та еволюції геному, спрямованого на зниження чутливості ДНК клітин до оксидативного стресу.
Таким чином, за допомогою активного цілеспрямованого метилування ДНК можна впливати на процеси диференціювання клітин, розвиток і формування їх фенотипових особливостей, що відкриває широкі можливості у сфері нано- і біотехнологій. Обґрунтований вплив на рівні епігеномних механізмів допоможе усунути порушення, викликані екзогенними факторами, індукувати експресію «мовчазних» генів і нормалізувати функцію клітин.
Висновки
При застосуванні ФНОЗ, фероцену та лактоферину в мишей із карциномою легені Льюїс і карциномою Ерліха найбільшою протипухлинною активністю стосовно первинної перещепленої пухлини, метастазів і тривалості життя характеризувалися низькі дози (від 2 до 10 мкг/мишу) при пероральному та парентеральному введенні.
Методом ЕПР-спектроскопії показано, що наночастинки заліза впливають на швидкість переносу електронів по електронно-транспортному ланцюгу мітохондрій клітин пухлини та сприяють нормалізації окисного фосфорилювання, підвищують активність цитохрому Р450 і знижують рівень ендогенного NO у пухлинних клітинах.
Протипухлинна та антиметастатична активність ФНОЗ і фероцену не відповідає показнику рівня загального метилування ДНК злоякісних пухлин, тому, вірогідно, останній не може бути маркером протипухлинного ефекту чи прогнозування тривалості життя.
Отримана позитивна протипухлинна та антиметастатична дія наночастинок заліза в терапевтичних дозах при карциномі 3LL і солідній карциномі Ерліха дає підстави стверджувати про перспективність таких досліджень, пов’язаних із циторегулювальними механізмами впливу наночастинок заліза на злоякісні клітини.
Список використаної літератури
1. Чекман І.С. (2011) Нанофармакологія. К.: Задруга: 424.
2. Наумовец А.Г., Андронати С.А., Барьяхтар В.Г. и др. (2013) Наноразмерные системы: строение, свойства, технологии (НАНСИЕ, 2013). Тезисы IV Междунар. науч. конф. Киев: 578.
3. Sahoo S.K., Parveen S., Panda J.J. (2007) The present and future of nanotechnology in human health care. Nanomedicine, 3(1): 20–31.
4. Шимановский Н.Я. (2009) Нанотехнологии в современной фармакологии. Междунар. мед. журн., 1: 131–135.
5. Кущевская Н.Ф. (2006) Наноразмерные порошки ферромагнетиков, полученных термическим способом, и возможные пути биомедицинского назначения. Порошк. метал., 7/8: 116–121.
6. Рыбалкина М. (2005) Нанотехнология для всех. Большое — в малом. М.: Nanotechnology News Network, 444.
7. Борисевич В.Б., Каплуненко В.Г. (2010) Наноматеріали в біології. Основи нановетеринарії, Київ, Авіцена, 415.
8. Swierstra T., Boenink M., Wolhout B. et al. (2009) Converging technologics, shifting bounclaries. Nanoethics, 3: 213–216.
9. Ferrari M. (2005) Cancer nanotechnology opportunities and challenges. Nat. Rev. Cancer, 3: 161–171.
10. Мосієнко В.С., Кущевська Н.Ф., Бурлака А.П. та ін. (2012) Фізико-хімічні, фармако-токсикологічні та протипухлинні властивості феромагнітних наночастинок заліза (Експериментальні дослідження). Онкологія, 14(1): 13–18.
11. Valco M., Rhodes C.J., Moncol J. et al. (2006) Free radicals metalls and antioxidants in oxidative strees induced cancer. Chem. Biol. Interact., 1: 1–40.
12. Паласиос С. (2013) Пероральные препараты двухвалентного и трехвалентного железа для лечения железодефицита: клинический обзор. Здоровье женщины, 7(83): 16–19.
13. Головач І.Ю. (2014) Сучасні можливості диференціальної діагностики залізодефіцитних анемій у лікарській практиці. Ліки України, 9: 22–26.
14. Дорошенко В.М., Рєезніиченко Л.С., Дибкова С.М. та ін. (2014) Протианемічна активність субстанції наночастинок заліза за умов перорального введення щурам. Фармакологія. та лікарська токсикологія, 39(3): 12–-19.
15. Waldman W.J., Kristovich R., Knigt D. et al. (2007) Inflammatory properties of iron-containing carbon nanoparticles. Chem. Res. Tocsicol., 8: 1149–1154.
16. Lane D.P. (1992) Cancer p53 guardian of the genome. Nature, 638: 15–16.
17. Бурлака А.П., Сидорик Е.П. (2014) Редоксзависимые сигнальные молекулы в механизмах опухолевого процесса. Киев, Наукова думка, 255.
18. Lee T., Thai J., Meyers B. (2010) Concervation and divergence in eukaryotic DNA metylation. Proceedinds of the National Academy of Sciences of the USA, 107(20): 9027–9028.
19. Берестяная А.Н. (2014) Метилирование как важнейший механизм епигенетической регуляции у эукариотов. Успехи совр. биол., 134(4): 363–376.
20. Wiswanathan C., Zhu J. (2009) RNA-directed DNA methyiation and demethylation in plants. Sci China Ser. C: Life Sci., 52(4): 331–343.
21. Вайсерман А.Н. (2011) Эпигенетическая эпидемиология ассоциированных с возрастом заболеваний. Здоровье Украины, 6(46): 69–75.
22. Wang W.S., Pan Y.J., Zhao X.O. et al. (2011) Drought-induced site-specific DNA methylation and its association with drought tolerance in rice (Oryza sativa L.). J. Exp. Bot., 62(6): 1951–1960.
Влияние ферромагнитных наночастиц железа и их композитов на рост и метастазирование карциномы легкого Льюис и солидной карциномы Эрлиха
Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, Киев
Открытый международный университет развития человека «Украина», Киев
Главный военно-медицинский клинический центр «Главный военный клинический госпиталь», Киев
Резюме. В работе исследовали влияние ферромагнитных наночастиц оксида железа (ФНОЖ), ферроцена и лактоферрина на перевивную карциному легкого Льюис и солидную карциному Эрлиха, уровень прооксидантных и оксидантных систем тканей организма методом ЭПР-спектроскопии (ЭПР — электронный парамагнитный резонанс) и общее метилирование ДНК злокачественных клеток. В терапевтических исследованиях показано, что наиболее эффективными оказались ФНОЖ и ферроцен, которые вводили в низких дозах от 2 до10 мкг/мышь в комбинации с аскорбиновой кислотой. Средняя продолжительность жизни мышей с карциномой легкого Льюис и солидной карциномой Эрлиха была статистически значимо большей (р<0,05) по сравнению с контрольной группой. Метастазирование в легкие в опытных группах мышей по количеству и объему было соответственно на 80,0 и 60,0% и 92,5 и 87,3% меньшим, чем в контроле. ФНОЖ задерживали рост первичной перевивной карциномы легкого Льюис и солидной карциномы Эрлиха на 15–20% по сравнению с контрольными животными. По данным ЭПР-спектроскопии, ФНОЖ и ферроцен могут изменять окислительный фенотип опухолевых клеток и паренхиматозных органов, повышать уровень цитохрома Р450 и уменьшать продуцирование NO-радикалов в митохондриях клеток при их курсовом введении в низких дозах. В опытах на перевивных штаммах карциномы легкого Льюис и солидной карциномы Эрлиха получен значительный противоопухолевый и антиметастатический эффект, который, очевидно, связан не с цитотоксическим, а с циторегулирующим влиянием наночастиц железа на рост злокачественных клеток.
противоопухолевые свойства, ферромагнитные наночастицы оксида железа, карцинома легкого Льюис, метилирование ДНК, ЭПР-спектроскопия.
Адреса:
Мосієнко Володимир Сергійович
03022, Київ, вул. Васильківська, 45
Інститут експериментальної патології,
онкології і радіобіології ім. Р.Є. Кавецького НАН України
Тел.: (044) 259-91-95
E-mail: fialka@onconet.kiev.ua














Leave a comment