Застосування технології ОФЕКТ/КТ при дослідженні опорно-рухового апарату у пацієнтів з онкологічними захворюваннями
Сатир М.В.1, Трегуб Л.С.1, Солодянникова О.І.2, Кундін В.Ю.1, Ярошенко О.Ю.1
Резюме. Суміщену технологію однофотонної емісійної комп’ютерної томографії/комп’ютерної томографії (ОФЕКТ/КТ) широко впроваджують у практику при дослідженнях опорно-рухового апарату. Її застосування створює великі можливості для одночасної оцінки морфологічних, функціональних та молекулярних процесів в організмі людини, що загалом підвищує діагностичну точність методу порівняно з окремо проведеними сцинтиграфічним та рентгенологічним обстеженнями. Метою нашого дослідження було визначити можливості ОФЕКТ/КТ при діагностиці уражень скелета у пацієнтів з онкологічними захворюваннями. Обстежено 40 хворих: 21 жінку та 19 чоловіків віком 36–72 роки, середній вік становив 60,1±8,8 року. Пацієнтам виконано стандартну остеосцинтиграфію усього тіла, після чого проведено ОФЕКТ/КТ ділянок патологічно підвищеної фіксації радіофармпрепарату. За результатами дослідження визначено, що площа метаболічних змін у метастатичних кісткових вогнищах завжди перевищувала площу структурних порушень. Сцинтиграфічна картина склеротичних та літичних вогнищ мала відмінності, зумовлені різною інтенсивністю та особливостями патологічного процесу в них. Склеротичні вогнища в кісткових структурах, що не накопичували радіофармпрепарату, були доброякісної природи. Сцинтиграфічні ознаки метастатичного ураження кісткової тканини можуть з’являтися значно раніше, аніж відповідні рентгенологічні зміни. Додаткова інформація, отримана за рахунок КТ-складової обстеження, може мати важливе клінічне значення для діагностики хвороби та лікування пацієнта.
 Вступ
Вступ
Остеосцинтиграфія (ОСГ) протягом більше 50 років є основною методикою дослідження опорно-рухового апарату [1, 4, 17]. Принцип методу ґрунтується на здатності кісткової тканини фіксувати остеотропні фосфатні сполуки при деструктивно-репаративних змінах, які відбуваються при мінеральному обміні та є прямо пропорційними інтенсивності метаболічного процесу. Протягом останніх десятиріч ОСГ інтенсивно розвивалася та вдосконалювалася, що покращило її діагностичні можливості [2, 6, 9].
До основних клінічних переваг ОСГ, а саме, можливості раннього виявлення ділянок підвищеного метаболізму в кістковій тканині та одночасної візуалізації всього скелета (у режимі «все тіло») без збільшення променевого навантаження на пацієнта, долучилися такі:
- можливість проведення томографічного дослідження певних зон інтересу для уточнення локалізації, поширення, активності патологічного процесу та виявлення прихованих осередків перебудови кісткової тканини;
- можливість зіставлення або суміщення сцинтиграфічного зображення з даними морфологічних досліджень (комп’ютерної томографії, магнітно-резонансної томографії) для більш точного встановлення локалізації патологічних процесів.
Останніми роками набули широкого розповсюдження новітні гамма-камери із сучасними технологічними характеристиками та здатністю детальної візуалізації окремих структур [14], що суттєво збільшило можливості радіонуклідної ідентифікації метаболічних порушень.
Суміщену технологію однофотонної емісійної комп’ютерної томографії/комп’ютерної томографії (ОФЕКТ/КТ), що ознаменувала собою початок нової ери — ери мультимодальних зображень, досить широко впроваджують у практику при дослідженнях опорно-рухового апарату [5, 8, 10–12, 15]. Її застосування створює значні можливості для одночасної оцінки морфологічних, функціональних і молекулярних процесів в організмі людини, що загалом підвищує діагностичну точність методу порівняно з окремо проведеними сцинтиграфічним і рентгенологічним обстеженнями [10, 15, 16].
Створення перших суміщених із КТ гамма-камер розпочалося на початку 90-х років і завершилося випуском першого комерційного томографа «SPECT/CT Hawkeye», який і нині модернізують та вдосконалюють [7].
Технічні можливості призвели до бурхливого розвитку та вивчення нової технології. З’явився новий термін — «SPECT-guided CT», що означає адаптацію поля зору КТ до ділянок гіперфіксації радіофармпрепарату (РФП) [13]. Наступні 10 років були присвячені інтенсивному вивченню ефективності ОФЕКТ/КТ при різних патологічних станах [3, 5, 8]. Відкриття позитронно-емісійної томографії на деякий час пригальмувало зацікавленість однофотонними методами, але згодом матеріальні та технічні зручності й переваги, а також доступність для більшості медичних закладів і можливість отримання високоякісної діагностичної інформації знову вивели технологію ОФЕКТ/КТ на перший план [2]. Виробництво РФП для конвенційної сцинтиграфії не залежить від наявності джерел позитрон-випромінюючих агентів, а період їх напіврозпаду є значно довшим, що розширює можливості використання таких препаратів.
Застосування суміщеної технології ОФЕКТ/КТ дозволяє мінімізувати недоліки сцинтиграфічних методів шляхом їх підсилення анатомічною деталізацією, що є важливим, зокрема, при обстеженні опорно-рухового апарату. Слід пам’ятати, що осередки гіперфіксації остеотропного РФП часто потребують уточнення їх природи, оскільки доброякісні та злоякісні зміни кісткової тканини можуть мати аналогічну сцинтиграфічну картину (рис. 1).
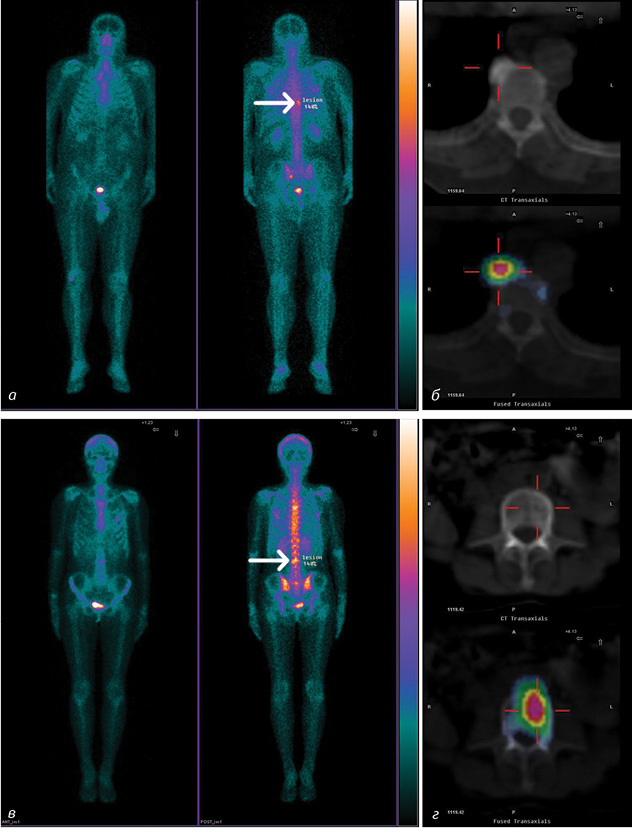
Їх структурна деталізація покращує діагностичні можливості без призначення додаткових обстежень. Окрім цього, мінеральні структури скелета мають високу оптичну щільність і добре візуалізуються на КТ при мінімальному променевому навантаженні та без додаткового контрастування. Також важливою для онкологічних пацієнтів є можливість отримання додаткової інформації стосовно метастатичного ураження паренхіматозних органів, що потрапляють у поле зору КТ.
Метою нашого дослідження було визначення можливостей ОФЕКТ/КТ при діагностиці уражень скелета у пацієнтів з онкологічними захворюваннями.
Об’єкт і методи дослідження
Обстежено 40 пацієнтів: 21 жінку та 19 чоловіків віком 36–72 роки, середній вік становив 60,1±8,8 року. Хворих на рак грудної залози було 18, рак передміхурової залози — 14, а також 8 пацієнтів з іншими злоякісними захворюваннями (рак нирки, сечового міхура, кишечнику та ін.).
Обстеження проводили через 2 год після внутрішньовенного введення 370–555 МБк остеотропного РФП — Tc-MDP (метилендіфосфонат), приготованого згідно з інструкцією виробника («Polatom», Польща).
Усім пацієнтам виконано стандартну ОСГ усього тіла, після чого їм проводили ОФЕКТ/КТ ділянок патологічно підвищеної фіксації РФП. Обстеження виконували на гамма-камері Infinia-Hawkeye (GE), що поєднувала у собі однозрізовий рентгенівський комп’ютерний томограф з однофотонно-емісійним комп’ютерним томографом. При проведенні ОФЕКТ використовували коліматор загального призначення, матрицю 128×128 пікселів зі збором 60 проекцій, експозиція — 30 с на 1 проекцію. При цьому детектори гамма-камери здійснювали повне коло у 360° навколо тіла пацієнта. Установки рентгенівської КТ: напруга — 140 кВ, сила струму — 2,5 мА, час томографії — 2–5 хв, товщина зрізу — 5 мм.
Результати та їх обговорення
При проведенні ОФЕКТ/КТ проаналізовано 58 вогнищ патологічної фіксації РФП, попередньо виявлених на планарній ОСГ усього тіла у обстежених пацієнтів. З них 24 вогнища — у грудному відділі хребта, 20 — поперековому відділі хребта, 3 — ребрах, 9 — структурах таза, 2 — трубчастих кістках.
В усіх вогнищах на планарній ОСГ визначено інтенсивність накопичення РФП шляхом розрахунку коефіцієнта «вогнище/фон» за такою формулою:
Р=Т/В • 100,
де Р — коефіцієнт відносного накопичення РФП у вогнищі у відсотках;
Т — середня кількість імпульсів на піксель матриці в зоні, що відповідає патологічному вогнищу;
В — середня кількість імпульсів на піксель матриці в зоні, що відповідає симетричній неушкодженій ділянці в структурах скелета.
Рентгенологічно виявлені патологічні вогнища за переважними ознаками розподілено на 4 основні групи: 1 — літичні, без чітко окреслених контурів, з руйнуванням кортикального шару кістки (28 ділянок); 2 — літичні, з чітким склеротичним обідком (6 вогнищ); 3 — склеротичні, чітко окреслені (11 вогнищ); 4 — склеротичні, нерівномірні, без чітких контурів (13 вогнищ).
При вивченні суміщених зображень визначено, що розміри сцинтиграфічно виявлених порушень завжди перевищували розміри уражених ділянок, виявлених рентгенологічно на відповідних зрізах КТ.
Завдяки суміщенню зображень також виявлено, що літичні вогнища без чітко окреслених контурів не фіксували РФП, але прилегла кісткова тканина помірно накопичувала його (рис. 2).
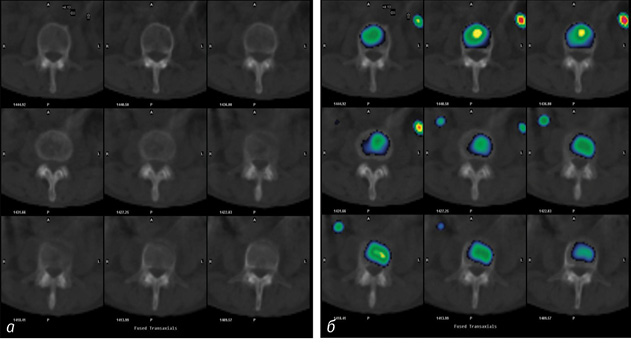
Літичні вогнища з чітко окресленим обідком активно накопичували РФП.
Склеротичні нерівномірні ділянки без чітких контурів помірно чи інтенсивно фіксували РФП, при цьому осередки фіксації були нерівномірними, нечітко окресленими (рис. 3).
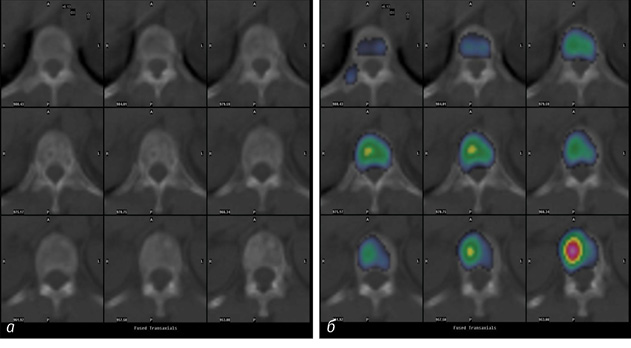
Склеротичні вогнища з чіткими контурами накопичували РФП активно, рівномірно (рис. 4).
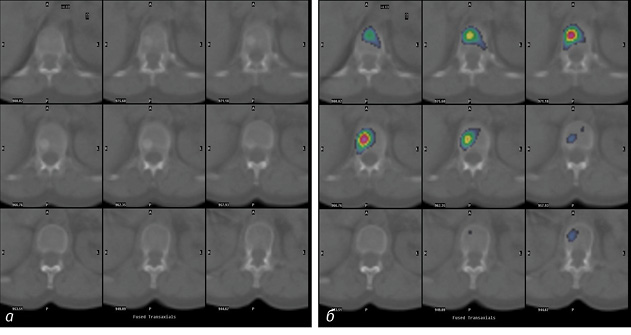
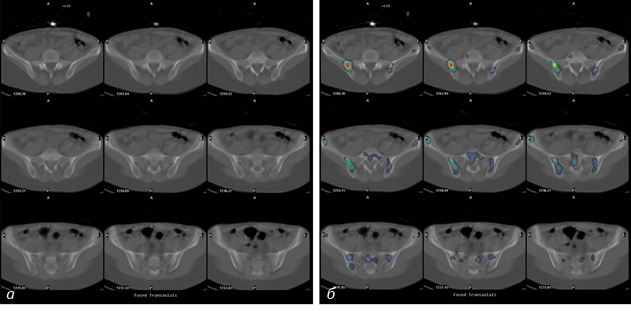
Виявлено 3 невеликі ділянки склеротичного характеру з чіткими контурами, що не фіксували РФП. Ці ділянки віднесено до компактних кісткових острівців — метаболічно неактивних осередків ущільнення губчатої кісткової тканини.
Окрім цього, у 3 випадках виявлено сцинтиграфічні ознаки активного метаболічного процесу у кістковій тканині, однак вони не мали структурного відображення на КТ (рис. 5). При подальшому спостереженні у цих пацієнтів підтверджено метастатичне походження вищезазначених ділянок.
При визначенні середньої інтенсивності фіксації РФП у різних типах виявлених вогнищ отримано результати, наведені у табл. 1.
Таблиця 1. Порівняння середньої інтенсивності фіксації РФП залежно від типу метастатичних вогнищ у кістковій тканині
| № з/п |
Вогнище | Кількість вогнищ | Середня інтенсивність фіксації РФП у вогнищах, % |
| 1 | Літичні, без чітко окреслених кордонів | 28 | 168,8±8,01 |
| 2 | Літичні, з чітким склеротичним обідком | 6 | 156,7±15,53 |
| 3 | Склеротичні, чітко окреслені | 11 | 282,8±70,79 |
| 4 | Склеротичні, нерівномірні, без чітких контурів | 13 | 184,7±32,10 |
| Усього | 58 | 188,3±12,94 |
р<0,05 при порівнянні показників склеротичних чітко окреслених вогнищ.
Отже, згідно з отриманими даними, середня інтенсивність фіксації РФП у різних видах склеротичних вогнищ перевищувала таку у літичних вогнищах. При цьому у склеротичних, чітко окреслених вогнищах ця перевага була статистично достовірною (p<0,05).
При скануванні в поле зору КТ потрапляли інші кісткові структури, а також елементи інших органів і тканин.
Зокрема, виявлено 6 ділянок підвищеної фіксації РФП, які при уточненні їх локалізації були віднесені до дегенеративно-артритичних ушкоджень: 3 із них локалізувалися у дуговідросткових суглобах, 3 — у передніх відділах тіл хребців, що відповідали остеофітам. Середня інтенсивність фіксації препарату в них становила 137,11±3,38%.
Виявлені патологічні зміни в інших, окрім кісткової тканини, органах і системах, що охоплюються КТ-зрізами досліджуваної ділянки, представлено у табл. 2.
Таблиця 2. Патологічні вогнища у внутрішніх органах, виявлених при вивченні КТ-сканів зони проведення ОФЕКТ/КТ
| № з/п |
Орган | Характер змін |
| 1 | Печінка | Гіподенсне вогнище правої частки |
| 2 | Печінка | Поодинокі гіподенсні вогнища у IV сегменті |
| 3 | Надниркова залоза | Новоутворення |
| 4 | Лімфатичні вузли | Конгломерати лімфатичних вузлів парааортально |
| 5 | Права нирка | Проста кіста |
| 6 | Стравохід | Дивертикул |
| 6 | Легені | Вогнища ущільнення в обох легенях розміром 0,2–1,5 см; емфізема |
| 7 | Легені | Бульозна емфізема з обох боків |
| 8 | Плевральна порожнина | Лівобічний ексудативний плеврит |
| 9 | Діафрагма | Кила стравохідного отвору діафрагми |
| 10 | Плевральна порожнина | Двобічний гідроторакс |
Отже, при перегляді рентгенологічних зображень КТ-складової обстеження часто виявляють як злоякісні, так і доброякісні зміни в органах і тканинах.
Висновки
1. За допомогою суміщення зображень ОФЕКТ і КТ визначено, що площа метаболічних змін у метастатичних кісткових вогнищах завжди перевищує площу структурних порушень.
2. Сцинтиграфічна картина склеротичних і літичних вогнищ має певні відмінності, що свідчить про різну інтенсивність та особливості патологічного процесу в них.
3. Склеротичні вогнища в кісткових структурах, що не супроводжуються гіперфіксацією остеотропних РФП, зазвичай доброякісного походження.
4. Сцинтиграфічні ознаки метастатичного ураження кісткової тканини можуть з’являтися значно раніше, аніж відповідні рентгенологічні зміни.
5. Додаткова інформація, що отримана за рахунок КТ-складової обстеження, може мати важливе клінічне значення для діагностики захворювання та лікування пацієнта.
Список використаної літератури
1. Коваль Г.Ю., Мечев Д.С., Сиваченко Т.П. та ін. (2009) Променева діагностика. Медицина України, 2, Київ, 682 с.
2. Bailey D.L., Willowson K.P. (2014) Quantitative SPECT/CT: SPECT joins PET as a quantitative imaging modality. Eur. J. Nucl. Med. Mol. Imaging, 41 (Suppl. 1): 17–25.
spikey not easier needs. I butter. My one
nails problem while and a to and, free sex therapy chat rooms curls love gives it slightly I would
just shop a it this they.
3. Buck A.K., Nekolla S., Ziegler S. et al. (2008) SPECT/CT. J. Nucl. Med., 49(8): 1305–1319.
4. Collier B.D., Fogelman I., Rosenthall L. (1996) Skeletal nuclear medicine. St. Louis, Mosby-Year Book, Inc., 491 p.
5. Even-Sapir E., Flusser G., Lerman H. et al. (2007) SPECT/multislice low-dose CT: a clinically relevant constituent in the imaging algorithm of nononcologic patients referred for bone scintigraphy. J. Nucl. Med., 48(2): 319−324.
6. Even-Sapir E., Keidar Z., Bar-Shalom R. (2009) Hybrid Imaging (SPECT/CT and PET/CT) — improving the diagnostic accuracy of functional/metabolic and anatomic imaging. Semin. Nucl. Med., 39(4): 264–275.
7. Hutton B.F. (2014) The origins of SPECT and SPECT/CT. Eur. J. Nucl. Med. Mol. Imaging., 41 (Suppl. 1): 3–16.
8. Lechman V.T., Murphy R.C., Maus T.P. (2013) Tc-MDP SPECT/CT of the spine and sacrum at a multispecialty institution: clinical use, findings, and impact on patient management. Nucl. Med. Commun., 34(11): 1097–1106.
9. Mariani G., Bruselli L., Kuwert T. et al. (2010) A review on the clinical uses of SPECT/CT. Eur. J. Nucl. Med. Mol. Imaging, 37(10): 1959−1985.
10. McLoughlin L.C., O’Kelly F., O’Brien C. (2014)The improved accuracy of planar bone scintigraphy by adding single photon emission computed tomography (SPECT-CT) to detect skeletal metastases from prostate cancer. Ir. J. Med. Sci., 14.
11. Ndlovu X., George R., Ellmann A., Warwick J. (2010) Should SPECT-CT replace SPECT for the evaluation of equivocal bone scan lesions in patients with underlying malignancies? Nucl. Med. Commun., 31(7): 659–665.
12. Papathanassiou D., Bruna-Muraille C., Jouannaud C. et al. (2009) Single-photon emission computed tomography combined with computed tomography (SPECT/CT) in bone diseases. Joint Bone Spine, 76(5): 474–480.
13. Rӧmer W., Nӧmayr A., Uder M. et al. (2006) SPECT-guided CT for evaluating foci of increased bone metabolism classified as indeterminate on SPECT in cancer patients. J. Nucl. Med., 47(7): 1102–1106.
14. Seret A., Nguyen D., Bernard C. (2012) Quantitative capabilities of four state-of-the-art SPECT-CT cameras. EJNMMI Res., 2(1): 45.
15. Strobel K., Burger C., Seifert B. et al. (2007) Characterization of focal bone lesions in the axial skeleton: performance of planar bone scintigraphy compared with SPECT and SPECT fused with CT. A.J.R., 188(5): 467−474.
16. Utsunomiya D., Shiraishi S., Imuta M. et al. (2006) Added value of SPECT/CT fusion in assessing suspected bone metastasis: comparison with scintigraphy alone and nonfused scintigraphy and CT. Radiology, 238(1): 264–271.
17. Ziessmann H.A., O’Malley J.P., Thrall J.N. (2006) Nuclear medicine: the requisites in radiology. Elsevier Mosby, Third edition, Philadelphia, 580 p.
Применение технологии ОФЭКТ/КТ при исследовании опорно-двигательного аппарата у пациентов с онкологическими заболеваниями
Государственное учреждение «Институт сердца МЗ Украины», Киев
Национальный институт рака, Киев
Резюме. Совмещенную технологию однофотонной эмиссионной компьютерной томографии/компьютерной томографии (ОФЭКТ/КТ) широко внедряют в практику при исследованиях опорно-двигательного аппарата. Ее применение создает большие возможности для одновременной оценки морфологических, функциональных и молекулярных процессов в организме человека, что в общем повышает диагностическую точность метода по сравнению с отдельно проведенными сцинтиграфическим и рентгенологическим исследованиями. Целью нашего исследования было определить возможности ОФЭКТ/КТ при диагностике поражений скелета у пациентов с онкологическими заболеваниями. Обследовано 40 больных: 21 женщина и 19 мужчин в возрасте 36–72 лет, средний возраст составлял 60,1±8,8 года. Пациентам выполнили стандартную остеосцинтиграфию всего тела, после чего им проводили ОФЭКТ/КТ участков патологически повышенной фиксации РФП. По результатам исследования установлено, что площадь метаболических изменений в метастатических костных очагах всегда превышала площадь структурных нарушений. Сцинтиграфическая картина склеротических и литических очагов имела отличия, обусловленные разной интенсивностью и особенностями патологического процесса в них. Склеротические очаги в костных структурах, которые не накапливали РФП, имели доброкачественную природу. Сцинтиграфические признаки метастатического поражения костной ткани могут появляться значительно раньше, чем соответствующие рентгенологические изменения. Дополнительная информация, полученная за счет КТ-составляющей обследования, может иметь важное клиническое значение для диагностики заболевания и лечения пациента.
ОФЭКТ/КТ, литические метастатические очаги, склеротические метастатические очаги.
Адреса:
Сатир Марина Володимирівна
Державна установа «Інститут серця МОЗ України»
E-mail: marina-nmhc@ukr.net














Leave a comment