Вміст ДНК у ядрах клітин аденокарцином товстої кишки та експресія Bcl-2 і p53
Грабовий О.М.1, Антонюк С.О.1, Сільченко В.П.2, Воробєй Є.А. 1, Савчин Т.М.1
- 1Національний інститут раку, Київ
- 2Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
Резюме. Проведені дослідження 88 аденокарцином і доброякісних новоутворень товстої кишки продемонстрували, що ці пухлини мають широкий спектр частоти експресії Bcl-2 та p53, причому їхній рівень відрізняється і змінюється залежно від G та вмісту ДНК в ядрах клітин. Збільшення кількості ДНК в ядрах пухлинних клітин супроводжується підвищенням рівня кореляції з експресією Bcl-2 та p53. Наявність експресії Bcl-2 призводить до більш значного, ніж p53, підвищення вмісту ДНК в ядрах клітин аденокарцином товстої кишки. Визначення експресії Bcl-2 та p53 як самостійної ознаки аденокарциноми товстої кишки є малоінформативним, однак значущим — як складової багатофакторної оцінки стану ядер клітин пухлини, пов’язаного, відповідно, з їхнім проліферативним потенціалом.
 На сьогодні отримано значну кількість даних, що демонструють зв’язок між вмістом ДНК у ядрах пухлинних клітин (плоїдністю) та властивостями пухлини, перш за все її злоякісним потенціалом [1, 15, 17, 26]. Відомості щодо кількості ДНК у ядрах клітин і прогнозу при колоректальному раку (КРР) дали підґрунтя для формування уявлення про важливість цього показника, який сам по собі не є абсолютним через мінливість зазначеного явища [2]. Зміна кількості ДНК у ядрах клітин аденокарцином товстої кишки (АКТК) є типовим явищем [1, 9, 13], пов’язаним із хромосомною нестабільністю (порушенням механізмів мітозу), яка реалізується в поліплоїдії та анеуплоїдії [13]. Разом з тим модифікація вмісту ДНК у ядрі асоціюється з синтезом останньої і, відповідно, рівень мітотичної активності у пухлині також буде впливати на її кількість [3]. Крім того, логічно припустити, що порушення апоптозу, виживання та збільшення частки у складі пухлини полі- та анеуплоїдних клітин також може вплинути на збільшення вмісту ДНК у клітинах АКТК. Серед значної кількості відомих маркерів, які відображають процеси апоптозу в пухлинах, найбільш дослідженим є білок р53 [22, 33]. Основна функція р53 полягає у тому, що він є посередником клітинної відповіді на низку стресових впливів, у тому числі й пошкодження ДНК та гіперпроліферацію [34, 35]. Мутації гена ТР53 та/або гіперекспресія протеїну р53 вважаються найбільш загальною подією при КРР, як і при багатьох видах інших новоутворень [7, 22], супроводжуються підвищенням виживання клітин ККР, сприяють розвитку геномної нестабільності [22, 29]. Мутації гена ТР53 виявляють у 30–50% пухлин КРР [6, 7, 20, 31]. Але варто зауважити, що мутації, які зачіпають різні домени гена, призводять до різних змін функції білка р53, що позначається на явищі апоптозу в пухлині [31]. Слід вказати, що при імуногістохімічному визначенні гіперекспресія р53 є частішою, ніж мутації ТР53 [6, 7, 20]. Р53-пухлини зазвичай не проявляють ознак MSI та не несуть K-ras мутацій [31], мають високу кореляцію із втратою гетерозиготності клітинами пухлини [8]. Частота мутації ТР53 та/або гіперекспресія протеїну р53 корелює зі ступенем дедиференціювання (G) КРР, що стало одним із приводів до розгляду цього фактора як прогностичного [16, 21, 24, 28, 31]. Однак розбіжності та неоднозначність даних на сьогодні роблять неможливим використання цього порушення як незалежного предиктора [6, 19, 30, 31]. Важливу роль у регуляції апоптозу відіграє також білок Bcl-2, який виступає його інгібітором, контролюючи проникність мітохондріальної мембрани [12, 25]. Bcl-2 належить до сім’ї, яка у ссавців включає 15 протеїнів, що сприяють апоптозу чи попереджують його. За нормальних умов білок Bcl-2, як правило, експресується лише у нижній половині крипт товстої кишки, що відповідає зосередженню стовбурових клітин, де Bcl-2, як вважають, захищає їх від апоптозу [8, 12]. Більшість аденом товстої кишки характеризуються високою експресією Bcl-2 на всій протяжності залозистоподібних утворень [12], доки не відбудеться малігнізація епітелію [10]. Припускають, що надмірна експресія Bcl-2 може сприяти переходу гіперплазії епітелію в аденому. Підвищена експресія Bcl-2 пов’язана з ранніми стадіями канцерогенезу [12] і є більш вираженою в клітинах КРР, ніж у нормальному епітелії, але менш вираженою, ніж в аденомі [10, 14]. У багатьох спостереженнях виявили зворотну залежність між гіперекспресією Bcl-2 і р53 [14, 22]. Експресію Bcl-2 у низькодиференційованих кластерах ракових клітин розглядають як вірогідний фактор злоякісності КРР [11]. Що стосується кореляції між експресією Bcl-2 і прогнозом перебігу КРР, то результати різних спостережень виявилися неоднозначними [12, 23, 25, 27]. Слід зауважити, що Bcl-2 не єдиний ген сімейства, який визначає патологію апоптозу клітин КРР. Антиапоптотичні білки bcl-XL і mcl-1, проапоптотичний Bak можуть відігравати більш значущу роль у розвитку КРР, ніж Bcl-2 [8, 18]. Мета роботи — встановити особливості експресії Bcl-2 і p53 серед клітин епітеліальних пухлин товстої кишки з різним вмістом ДНК у ядрах.
На сьогодні отримано значну кількість даних, що демонструють зв’язок між вмістом ДНК у ядрах пухлинних клітин (плоїдністю) та властивостями пухлини, перш за все її злоякісним потенціалом [1, 15, 17, 26]. Відомості щодо кількості ДНК у ядрах клітин і прогнозу при колоректальному раку (КРР) дали підґрунтя для формування уявлення про важливість цього показника, який сам по собі не є абсолютним через мінливість зазначеного явища [2]. Зміна кількості ДНК у ядрах клітин аденокарцином товстої кишки (АКТК) є типовим явищем [1, 9, 13], пов’язаним із хромосомною нестабільністю (порушенням механізмів мітозу), яка реалізується в поліплоїдії та анеуплоїдії [13]. Разом з тим модифікація вмісту ДНК у ядрі асоціюється з синтезом останньої і, відповідно, рівень мітотичної активності у пухлині також буде впливати на її кількість [3]. Крім того, логічно припустити, що порушення апоптозу, виживання та збільшення частки у складі пухлини полі- та анеуплоїдних клітин також може вплинути на збільшення вмісту ДНК у клітинах АКТК. Серед значної кількості відомих маркерів, які відображають процеси апоптозу в пухлинах, найбільш дослідженим є білок р53 [22, 33]. Основна функція р53 полягає у тому, що він є посередником клітинної відповіді на низку стресових впливів, у тому числі й пошкодження ДНК та гіперпроліферацію [34, 35]. Мутації гена ТР53 та/або гіперекспресія протеїну р53 вважаються найбільш загальною подією при КРР, як і при багатьох видах інших новоутворень [7, 22], супроводжуються підвищенням виживання клітин ККР, сприяють розвитку геномної нестабільності [22, 29]. Мутації гена ТР53 виявляють у 30–50% пухлин КРР [6, 7, 20, 31]. Але варто зауважити, що мутації, які зачіпають різні домени гена, призводять до різних змін функції білка р53, що позначається на явищі апоптозу в пухлині [31]. Слід вказати, що при імуногістохімічному визначенні гіперекспресія р53 є частішою, ніж мутації ТР53 [6, 7, 20]. Р53-пухлини зазвичай не проявляють ознак MSI та не несуть K-ras мутацій [31], мають високу кореляцію із втратою гетерозиготності клітинами пухлини [8]. Частота мутації ТР53 та/або гіперекспресія протеїну р53 корелює зі ступенем дедиференціювання (G) КРР, що стало одним із приводів до розгляду цього фактора як прогностичного [16, 21, 24, 28, 31]. Однак розбіжності та неоднозначність даних на сьогодні роблять неможливим використання цього порушення як незалежного предиктора [6, 19, 30, 31]. Важливу роль у регуляції апоптозу відіграє також білок Bcl-2, який виступає його інгібітором, контролюючи проникність мітохондріальної мембрани [12, 25]. Bcl-2 належить до сім’ї, яка у ссавців включає 15 протеїнів, що сприяють апоптозу чи попереджують його. За нормальних умов білок Bcl-2, як правило, експресується лише у нижній половині крипт товстої кишки, що відповідає зосередженню стовбурових клітин, де Bcl-2, як вважають, захищає їх від апоптозу [8, 12]. Більшість аденом товстої кишки характеризуються високою експресією Bcl-2 на всій протяжності залозистоподібних утворень [12], доки не відбудеться малігнізація епітелію [10]. Припускають, що надмірна експресія Bcl-2 може сприяти переходу гіперплазії епітелію в аденому. Підвищена експресія Bcl-2 пов’язана з ранніми стадіями канцерогенезу [12] і є більш вираженою в клітинах КРР, ніж у нормальному епітелії, але менш вираженою, ніж в аденомі [10, 14]. У багатьох спостереженнях виявили зворотну залежність між гіперекспресією Bcl-2 і р53 [14, 22]. Експресію Bcl-2 у низькодиференційованих кластерах ракових клітин розглядають як вірогідний фактор злоякісності КРР [11]. Що стосується кореляції між експресією Bcl-2 і прогнозом перебігу КРР, то результати різних спостережень виявилися неоднозначними [12, 23, 25, 27]. Слід зауважити, що Bcl-2 не єдиний ген сімейства, який визначає патологію апоптозу клітин КРР. Антиапоптотичні білки bcl-XL і mcl-1, проапоптотичний Bak можуть відігравати більш значущу роль у розвитку КРР, ніж Bcl-2 [8, 18]. Мета роботи — встановити особливості експресії Bcl-2 і p53 серед клітин епітеліальних пухлин товстої кишки з різним вмістом ДНК у ядрах.
Об’єкт і методи дослідження
Дослідження проведено на матеріалі біопсій або вилученому при оперативному втручанні матеріалі у 88 пацієнтів з аденокарциномами та доброякісними новоутвореннями, серед яких були: поліпи та аденоми (В) — 14; аденокарциноми G1 (G1) — 24; аденокарциноми G2 (G2) — 42; аденокарциноми G3 (G3) — 8. Гістологічне типування новоутворень проведено з використанням рутинного забарвлення. Отриманий матеріал фіксували в забуференому 10% формаліні з pH 7,4 та ущільнювали у парафін із застосуванням гістіопроцесора Histos-5 (Milestone, Італія). Із парафінових блоків виготовляли гістологічні зрізи товщиною 5 мкм за допомогою мікротома Microm НМ325 (Thermo Scientific, Німеччина). Зрізи забарвлювали гематоксиліном і еозином та азур-ІІ-еозином для загальної оцінки пухлини, галоціанін-хромовим галуном за Ейнарсоном (pH 1,62, 37 °С, 24 год) для виявлення вмісту нуклеїнових кислот у клітинах [4, 5]. Для кожного випадку частину зрізів обробляли РНКазою (Macherey-Nagel GmbH & Co. KG, Німеччина) для екстракції РНК [4]. Імуногістохімічну реакцію проводили з моноклональним мишачим антитілом проти Bcl-2 онкопротеїну людини (Dako, Данія) та з моноклональним мишачим антитілом проти р53 протеїну (Dako, Данія) у відповідності з протоколом виробника з використанням системи детекції EnVision™ Flex (Dako, Данія). Зрізи дофарбовували гематоксиліном Gill. Як позитивний контроль використовували тканинні зразки з визначеною позитивною реактивністю, а для негативного контролю проводили процедуру без застосування первинних антитіл. Отримані препарати вивчали та фотографували за допомогою мікроскопа Nikon Eclipse 80i з камерою DS-5SMc/L2 за стандартизованих умов, а зображення (збільшення мікроскопа ×400, 1280 × 960 пікселів RGB) обробляли із застосуванням системи аналізу ImageJ 1,46. На зображеннях з препаратів, забарвлених галоціанін-хромовим галуном, у 60 клітинах кожної пухлини визначали: площу перетину ядра клітини (Narea), інтегративну оптичну щільність ядра клітини (NIntDen) та вміст у ньому ДНК. Для оцінки вмісту ДНК у ядрах пухлинних клітин за одиницю взяли їхній вміст у ядрах лімфоцитів [1]. Клітини кожної пухлини ранжирували за вмістом ДНК в ядрі. Отриману послідовність поділили на ранги із кроком, що дорівнював середньому вмісту ДНК у ядрах лімфоцитів: Р1 — до 1, Р2 — 1–2, Р3 — 2–3 і т.д. Враховуючи те, що клітини з рангом Р5 і більше становили <5%, а більшість середніх значень їхніх параметрів, що визначалися, мали р>0,05, їх звели в один ранг Р6+. Для кожного рангу визначали середні розміри ядра [2]. Для кожної пухлини при виявленні експресії Bcl-2 і p53 клітини ранжирували за розмірами ядра у відповідності з параметрами, визначеними на препаратах, де виявляли ДНК. У межах кожного рангу визначали абсолютну кількість клітин, середні значення Narea, NIntDen, ДНК і відсоток клітин, ядра яких експресують Bcl-2 чи p53. За середнім вмістом ДНК у ядрах клітини пухлин поділили на 3 підгрупи: D — середній вміст ДНК у ядрах <1,2, D+ — 1,2–2,5, T+ — >2,5 [1]. Статистичний аналіз проводили з використанням програмного забезпечення IBM SPSS Statistics 22. Для кореляційного аналізу використовували метод рангової кореляції за Спірманом, оскільки більшість досліджуваних показників не відповідали нормальному закону розподілу. Для перевірки на нормальність проводили одновибірковий тест Колмогорова — Смірнова.
Результати та їх обговорення
Проведені спостереження показали, що середнє значення вмісту ДНК у ядрах клітин досліджених АКТК коливається від 1,86 (G3) до 2,33 (G1) з явною тенденцією до зменшення у послідовності від G1 до G3 (рис. 1). При цьому відзначають статистично достовірні відмінності між В (2,01±1,12) і G1 (2,33±1,06) (р<0,05), а відмінності між різними G не є достовірними (р>0,05).
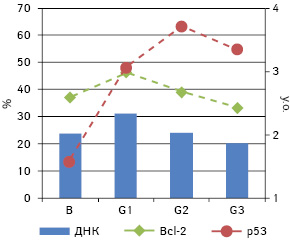
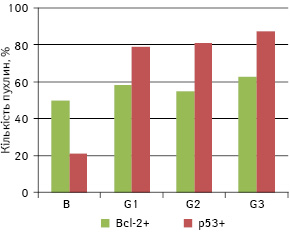
У пухлинах, що були досліджені, у 55,7% випадків виявили експресію в їхніх клітинах Bcl-2, а в 71,6% — p53. Проведений кореляційний аналіз для всієї вибірки показав пряму пропорційну залежність між ступенем дедиференціювання (G) та частотою експресії пухлинними клітинами p53 (ρ=0,365, p<0,01), а також між частотою експресії Bcl-2 та p53 (ρ=0,212, p<0,05) (див. рис. 1). Окрім цього, виявлено кореляцію між відсотком пухлин, що експресують p53, та ступенем анаплазії пухлини, проте вважати її достовірною можна тільки для G1 та G2 (рис. 2). У міру зростання рівня анаплазії відзначають збільшення частки пухлин, що експресують p53. Подібної залежності щодо Bcl-2 не простежують.
Проведений аналіз не виявив взаємозв’язку між частотою експресії Bcl-2 і р53 у пухлинних клітинах і середнім вмістом ДНК у їхніх ядрах у цілому. Тому наступним кроком стало встановлення наявності кореляції між зазначеними параметрами окремо у різних за плоїдністю пухлинах. У досліджуваній вибірці пухлини підгрупи D становили 15,9% (n=14), D+ — 51,1% (n=45) і T+ — 33% (n=29). Для D аналіз не дав статистично достовірних результатів через малу кількість випадків. Проте кореляційний аналіз для двох інших підгруп продемонстрував існування зв’язку: між середнім вмістом ДНК в ядрах і частотою експресії p53 (ρ=0,313, p<0,05) — для D+, а також між середнім вмістом ДНК в ядрах і частотою експресії Bcl-2 — для підгрупи T+ (ρ=0,416, p<0,05) (рис. 3). Для підгрупи D+, крім цього, зберігається кореляція між ступенем дедиференціювання та відсотком клітин, що експресують p53. Логічним було б припущення, що ця залежність визначається, в першу чергу, не стільки плоїдністю, скільки фенотипом пухлини, адже для пухлин із фенотипом Bcl-2 навряд буде існувати залежність між вмістом ДНК і рівнем експресії даного маркера та навпаки.
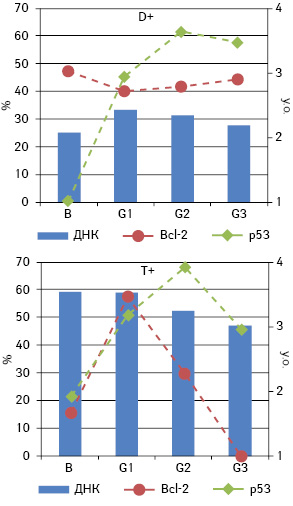
Для пухлин із фенотипом p53+/Bcl-2 не виявлено кореляційних зв’язків із вмістом ДНК у ядрах пухлинних клітин як у цілому для фенотипової групи, так і для різних за вмістом ДНК підгруп. Це наштовхує на думку про вторинне значення p53 порівняно з Bcl-2 для зв’язку з кількістю ДНК в ядрі. Отже, кореляції, виявлені у підгрупах, слід визначати насамперед за частотою експресії Bcl-2, а точніше, наявністю чи відсутністю останньої у певній підгрупі. Проведений аналіз для фенотипу Bcl-2+ окремо для трьох підгруп показав кореляційну залежність для T+ між середнім вмістом ДНК у ядрі та частотою експресії Bcl-2 (ρ=0,518, p<0,05) (рис. 4). Для підгрупи D+ простежується негативна кореляція між частотою експресії Bcl-2 та ступенем дедиференціювання (ρ=−0,517, p<0,01). Щодо фенотипу Bcl-2−, як і припускали, вміст ДНК корелює з частотою експресії p53 у другій та третій підгрупах (ρ=0,533 і ρ=0,630 відповідно; p<0,05) (рис. 5).
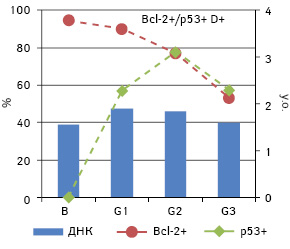
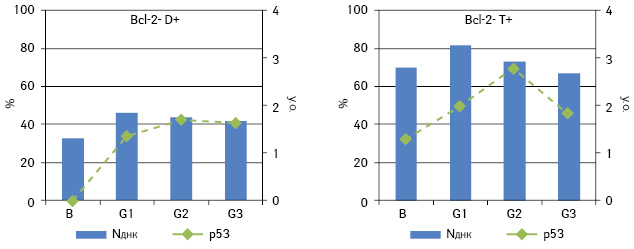
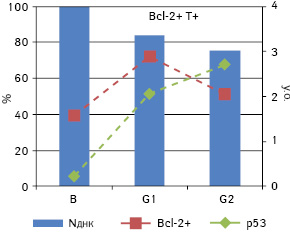
Найчисельнішою фенотиповою групою в цьому дослідженні за двома маркерами є група Bcl-2+/p53+ — 40 (45,5%) випадків. Кореляційний аналіз зазначеного фенотипу для кожної підгрупи за плоїдністю показав існування залежності середнього вмісту ДНК в ядрах від ступеня дедиференціювання пухлини та його кореляцію з частотою експресії Bcl-2 (ρ=−0,459 і ρ=−0,494 відповідно; p<0,05) (рис. 6).
Таким чином, проведені дослідження показали, що епітеліальні пухлини товстої кишки мають широкий спектр частоти експресії Bcl-2 та p53, причому її рівень відрізняється і змінюється залежно від G та вмісту ДНК. Зростання останнього, у свою чергу, певною мірою залежить від наявності зазначених протеїнів. При цьому експресія Bcl-2 призводить до більш значного, ніж p53, збільшення вмісту ДНК в ядрах клітин АКТК. Для АКТК, яким не притаманна гіперплоїдія та які можна віднести до таких, що розвиваються за рахунок мікросателітарної нестабільності чи за епігенетичним механізмом, наявність експресії Bcl-2 та/або p53 практично не призводить до підвищення вмісту ДНК у ядрах їх клітин. Для пухлин, які проявляють ознаки поліплоїдії, що пов’язують з хромосомною нестабільністю, характерна кореляція між вмістом ДНК і відносною кількістю клітин, що експресують ці маркери (див. рис. 3). Слід зазначити, що наявність або відсутність експресії Bcl-2 та p53 у клітинах АКТК у цілому достовірно не відрізняється в пухлинах різного ступеня G (див. рис. 2) і не пов’язана з пухлинною прогресією, а визначається патогенетичним механізмом її виникнення [3, 13, 17, 32]. Разом з тим у міру підвищення ступеня анаплазії у пухлинах після періоду росту відбувається зменшення частки клітин, що експресують Bcl-2 та p53 (див. рис. 1). Це можна розглядати як свідчення зміни різноманітного клітинного складу новоутворення при пухлинному прогресуванні, яке призводить до появи клітин домінуючого фенотипу. Останні, втрачаючи низку ознак, притаманних клітинам вихідної тканини, зберігають високу життєздатність і визначають подальший перебіг пухлинного процесу.
Висновки
АКТК мають широкий спектр частоти експресії Bcl-2 та p53, причому її рівень відрізняється і змінюється залежно від G та вмісту ДНК у ядрах клітин. Збільшення вмісту ДНК у ядрах клітин пухлини супроводжується підвищенням рівня кореляції з експресією Bcl-2 та p53. Наявність експресії Bcl-2 призводить до більш значного, ніж p53, збільшення кількості ДНК у ядрах клітин АКТК. Визначення експресії Bcl-2 та p53 як самостійної ознаки АКТК є малоінформативним, однак значущим — як складової багатофакторної оцінки стану ядер клітин пухлини, пов’язаного, відповідно, з їхнім проліферативним потенціалом.
Список використаної літератури
1. Автандилов Г.Г. (2006) Диагностическая медицинская плоидометрия. Медицина, Москва, 192 c.
2. Грабовий О.М., Антонюк С.А., Воробєй Є.А. (2013) Вміст нуклеїнових кислот у ядрах клітин епітеліальних пухлин товстої кишки. Укр. морфол. альманах, 11 (1): 73–76.
3. Грабовий О.М., Антонюк С.А., Воробєй Є.А. (2013) Мітотична активність та вміст нуклеїнових кислот у ядрах клітин епітеліальних пухлин товстої кишки. Патологія, 2 (28): 13–16.
4. Лупа Х. (1980) Основы гистохимии (Пер. с немец.). Мир, Москва, 344 с.
5. Ташке К. (1980) Введение в количественную цитогистологическую морфологию (Пер. с рум.). Изд. акад. соц. Респ. Румынии, 192 с.
6. Akkiprik M., Ataizi-Celikel C., Dusunceli F. et al. (2007) Clinical significance of p53, K-ras and DCC gene alterations in the stage I–II colorectal cancers. J. Gastrointestin. Liver. Dis., 16(1): 11–17.
7. Bazan V., Migliavacca M., Tubiolo C. et al. (2002) Have p53 gene mutations and protein expression a different biological significance in colorectal cancer. J. Cell. Physiol., 191(2): 237–246.
8. Bolocan A., Ion D., Ciocan D., Paduraru D.N. (2012) Prognostic and predictive factors in colorectal cancer. Chirurgia (Bucur), 107(5): 555–563.
9. Compton C.C., Fielding L.P., Burgart L.J. et al. (2000) Prognostic factors in colorectal cancer. Arch. Pathol. Lab. Med., 124: 979–994.
10. Flohil C., Janssen P., Bosman F. (1996) Expression of Bcl-2 protein in hyperplastic polyps, adenomas, and carcinomas of the colon. J. Pathol., 178(4): 393–407.
11. Gordon M., Margolin K., Talpaz M. et al. (2001) Phase I safety and pharmacokinetic study of recombinant human anti-vascular endothelial growth factor in patients with advanced cancer. J. Clin. Oncol., 19(3): 843–850.
12. Guzińska-Ustymowicz K., Pryczynicz A., Kemona A. et al. (2009) Correlation between proliferation markers: PCNA, Ki-67, MCM-2 and antiapoptotic protein Bcl-2 in colorectal cancer. Anticancer Res., 29(8): 3049–3052.
13. Hadjihannas M.V., Brückner M., Jerchow B. et al. (2006) Aberrant Wnt/β-catenin signaling can induce chromosomal instability in colon cancer. PNAS, 103(28): 10747–10752.
14. Hawkins N., Lees J., Hargrave R. et al. (1997) Pathological and genetic correlates of apoptosis in the progression of colorectal neoplasia. Tumor Biol., 18(3): 146–156.
15. Hixon C., Furlong J., Silbergleit A. (1995) Flow cytometry in colon cancer: does flow cytometric cell cycle analysis help predict for short-term recurrence in patients with colorectal carcinoma? J. Natl. Med. Assoc., 87 (11): 803–806.
16. Hsieh J., Lin S., Chang M. et al. (2005) APC, K-ras, and p53 gene mutations in colorectal cancer patients: correlation to clinicopathologic features and postoperative surveillance. Am. Surg., 71(4): 336–343. 17. Kørner H. (2009) Microsatellite instability and DNA ploidy in colorectal cancer. Cancer, 115 (Issue 2): 271–282.
18. Krajewska M., Moss S.F., Krajewski S. et al. (1996) Elevated expression of Bcl-X and reduced bak in primary colorectal adenocarcinomas. Cancer Res., 15: 2422.
19. Kulendran M., Stebbing J., Marks C. et al. (2011) Predictive and prognostic factors in colorectal cancer: a personalized approach. Cancers (Basel), 29: 1622–1638.
20. Lopez-Crapez E., Bibeau F., Thézenas S. et al. (2005) p53 status and response to radiotherapy in rectal cancer: a prospective multilevel analysis. Br. J. Cancer, 20: 2114–2121.
21. Lumachi F., Orlando R., Marino F. et al. (2012) Expression of p53 and Ki-67 as prognostic factors for survival of men with colorectal cancer. Anticancer Res., 32(9): 3965–3967.
22. Meek D. (2009) Tumour suppression by p53: a role for the DNA damage response. Nat. Rev. Cancer, 9: 714–723.
23. Ogino S., Nosho K., Kirkner G. et al. (2009) PIK3CA mutation is associated with poor prognosis among patients with curatively resected colon cancer. Am. Soc. Clin. Oncol., 32(14): 1477–1484.
24. Oshima C., Iriya K., Forones N. (2005) Ki-67 as a prognostic marker in colorectal cancer but not in gastric cancer. Neoplasma, 52(5): 420–424.
25. Paradiso A., Simone G., Petroni S. et al. (2000) Thymidilate synthase and p53 primary tumour expression as predictive factors for advanced colorectal cancer patients. Br. J. Cancer, 82(3): 560–567.
26. Park S.U., Choi E.S., Jang Y.S. et al. (2011) Effects of chromosomal polyploidy on survival of colon cancer cells. Korean J. Gastroenterol., 57(3): 150–157.
27. Pereira H., Silva S., Juliao R. et al. (1997) Prognostic markers for colorectal cancer: expression of p53 and Bcl-2. World J. Surg., 21(2): 210–213.
28. Petrişor O., Giuşca E., Sajin M. et al. (2008) Ki-67, p53 and Bcl-2 analysis in colonic versus rectal adenocarcinoma. Rom. J. Morph. Embryol., 49(2): 163–171.
29. Porcelli B., Frosi B., Arezzini L. et al. (2001)Expression of p185 and p53 in benign and malignant colorectal lesions. Histochem. J., 33: 51–57.
30. Russo A., Bazan V., Iacopetta B. et al. (2005) The TP53 colorectal cancer international collaborative study on the prognostic and predictive significance of p53 mutation: influence of tumor site, type of mutation, and adjuvant treatment. J. Clin. Oncol., 23(30): 7518–7528.
31. Samowitz W., Curtin K., Ma K. et al. (2002) Prognostic significance of p53 mutations in colon cancer at the population level. Int. J. Cancer, 99: 597–602.
32. Sinicrope F., Sargent D. (2009) Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J. Clin. Oncol., 28(20): 3219–3226.
33. Sousa W., Rodrigues L., Silva J. et al. (2012) Immunohistochemical evaluation of p53 and Ki-67 proteins in colorectal adenomas. Arq. Gastroenterol., 49(1): 35–40.
34. Toledo F., Wahl M. (2006) Regulating the p53 pathway: in vitro hypotheses, in vivo veritas. Nature Rev. Cancer, 6: 909–923.
35. Vousden K., Lane D. (2007) p53 in health and disease. Nature Rev. Mol. Cell. Biol., 8: 275–283.
Содержание ДНК в ядрах клеток аденокарцином толстой кишки и экспрессия Bcl-2 и p53
Национальный институт рака, Киев Национальная медицинская академия последипломного образования имени П.Л. Шупика, Киев
Резюме. Проведенные исследования 88 аденокарцином и доброкачественных новообразований толстой кишки показали, что эти опухоли имеют широкий спектр частоты экспрессии Bcl-2 и p53, причем ее уровень отличается и меняется в зависимости от G и содержания ДНК в ядрах клеток. Увеличение количества ДНК в ядрах опухолевых клеток сопровождается повышением уровня корреляции с экспрессией Bcl-2 и p53. Наличие экспрессии Bcl-2 приводит к более значительному, чем p53, повышению содержания ДНК в ядрах клеток аденокарцином толстой кишки. Определение экспрессии Bcl-2 и p53 в качестве самостоятельного признака аденокарциномы толстой кишки является малоинформативным, однако значимым — как составляющего многофакторной оценки состояния ядер клеток опухоли, связанного, соответственно, с их пролиферативным потенциалом.
аденокарцинома толстой кишки, ДНК, Bcl-2, p53.
Адреса: Грабовий Олександр Миколайович 03022, Київ, вул. Ломоносова, 33/43 Національний інститут раку E-mail: agrabovoy@yandex.ru














Leave a comment