Обзор эффективности и профиля безопасности применения эрлотиниба (Тарцева®) у пациентов c немелкоклеточным раком легкого и раком поджелудочной железы
Дайджест
Эрлотиниб (Тарцева®) является ингибитором тирозинкиназы рецепторов эпидермального фактора роста HER1/EGFR (human epidermal growth factor receptor 1/epidermal growth factor receptor). HER1/EGFR экспрессируется на поверхности как нормальных, так и опухолевых клеток. Благодаря блокированию нисходящей передачи сигнала пролиферация клеток прекращается и индуцируется смерть клетки путем естественного апоптоза. В результате применения эрлотиниба угнетается рост опухоли, ее инвазия в ткани, метастазирование, повышается чувствительность к цитостатикам [1].
Эрлотиниб показан для применения при немелкоклеточном раке легкого (НМКРЛ) и раке поджелудочной железы (РПЖ). Эрлотиниб показан:
- в качестве I линии терапии у пациентов с местно-распространенным или метастатическим НМКРЛ с EGFR-активирующими мутациями;
- как поддерживающее лечение в режиме монотерапии местно-распространенного или метастатического НМКРЛ при отсутствии прогрессирования заболевания после 4 курсов стандартной химиотерапии I линии на основе препаратов платины;
- для лечения больных местно-распространенным или метастатическим НМКРЛ, независимо от статуса пациента относительно наличия EGFR-мутации, после неэффективной одной или более схем химиотерапии;
- при метастатическом РПЖ в комбинации с гемцитабином.
Эффективность и профиль безопасности эрлотиниба для обеих локализаций хорошо изучены на основании результатов ряда клинических исследований. Далее будут рассмотрены данные клинических исследований применения эрлотиниба при НМКРЛ и РПЖ.
Эффективность и профиль безопасности эрлотиниба при НМКРЛ
Согласно данным мировой статистики, рак легкого остается сегодня наиболее распространенным злокачественным новообразованием (1,6 млн новых случаев ежегодно) после немеланомного рака кожи и ведущей причиной онкологической смертности (1,4 млн случаев ежегодно) [2]. В последние годы рак легкого в Украине занимает 1-е место в структуре онкологической заболеваемости и смертности среди мужчин [3]. По гистологической структуре различают немелкоклеточную и мелкоклеточную формы. При этом НМКРЛ аккумулирует 80–85% в структуре заболеваемости раком легкого [4]. У большинства пациентов НМКРЛ диагностируют на поздних стадиях течения заболевания [5].
Сегодня широкое применение у пациентов с НМКРЛ в качестве I линии химиотерапии нашли комбинированные платиносодержащие схемы. Однако результаты последних клинических исследований свидетельствуют в пользу того, что современная химиотерапия достигла определенного пика терапевтических возможностей без тенденции к дальнейшему повышению эффективности [6]. Кроме того, после проведения I линии терапии значительная часть пациентов (до 50%) не получает дальнейшего лечения ввиду быстрого ухудшения состояния и развития симптомов. Существует необходимость использования более эффективных подходов к І линии терапии пациентов с НМКРЛ [7].
Новые возможности в этом контексте предлагает применение таргетной терапии, направленной на определенные молекулы-мишени, являющиеся триггерами опухолевого процесса. Установление целевой популяции пациентов с помощью скрининга имеет огромное значение для успешного лечения с помощью таргетных препаратов.
Одной из таких мишеней, задействованных в развитии злокачественных новообразований некоторых локализаций, является семейство рецепторов эпидермального фактора роста (epidermal growth factor receptor — EGFR), представляющих собой трансмембранные тирозинкиназы. Определенные мутации в генах, кодирующих EGFR (делеция экзона 19 или точечная мутация L858R в 21-м экзоне), связаны с постоянной активацией рецептора и стимулированием процессов митоза, что приводит к нарушению регуляции клеточного цикла, усилению пролиферации опухолевых клеток, росту и метастазированию опухоли. Данную мутацию при НМКРЛ отмечают примерно у 10% представителей европейской популяции и у 30% пациентов в странах Азии [8]. Таким образом, прицельное воздействие на EGFR является перспективным подходом к лечению пациентов с НМКРЛ. При этом больные, у которых выявлены упомянутые мутации, лучше отвечают на терапию с применением ингибиторов тирозинкиназы EGFR по сравнению с пациентами, у которых мутации не выявлены [8–11].
Эрлотиниб в качестве I линии терапии у пациентов с НМКРЛ в поздних стадиях с подтвержденным наличием активирующих мутаций EGFR
Эффективность и профиль безопасности применения эрлотиниба в качестве I линии терапии у пациентов с НМКРЛ с активирующими мутациями EGFR, изучены в ходе ряда клинических исследований. Одними из наиболее показательных из них являются открытое рандомизированное клиническое исследование III фазы OPTIMAL (CTONC0802), в котором принимали участие пациенты азиатской популяции [12], и открытое рандомизированное клиническое исследование III фазы EURTAC (European Randomised Trial of Tarceva vs. Chemotherapy), в котором участвовали больные европейской популяции [13]. Целью названных исследований было сравнение эффективности ингибиторов тирозинкиназы и стандартной химиотерапии в I линии лечения при местно-распространенном НМКРЛ с активирующими EGFR-мутациями.
OPTIMAL — многоцентровое рандомизированное открытое клиническое исследование ІІІ фазы (рис. 1).
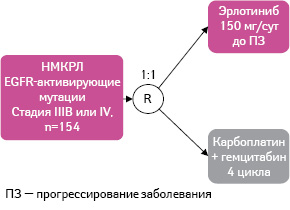 Рис. 1. Дизайн исследования OPTIMAL
Рис. 1. Дизайн исследования OPTIMALДанные из: Zhou C., Wu Y.L., Chen G. et al., 2011 [12]
В исследование OPTIMAL включали пациентов с гистологически подтвержденным поздним или рецидивирующим НМКРЛ (IIIB или IV стадии) с наличием активирующей мутации EGFR [12]. Пациентам первой группы (n=82) назначен эрлотиниб перорально в дозе 150 мг 1 раз в сутки до прогрессирования заболевания, второй (n=72) — карбоплатин и гемцитабин (4 цикла: гемцитабин 1000 мг/м2 в 1-й и 8-й дни + карбоплатин AUC 5 в 1-й день).
В качестве первичной конечной точки клинического исследования определена выживаемость без прогрессирования заболевания, а вторичными — общая выживаемость, ответ на терапию, период до прогрессирования опухолевого процесса, качество жизни, анализ биомаркеров заболевания и профиль безопасности.
Согласно результатам исследования, опубликованным в 2012 г., лечение эрлотинибом в качестве I линии терапии ассоциировано со статистически достоверно более длительной выживаемостью без прогрессирования по сравнению с химиотерапией (p<0,0001) [15]. Так, медиана выживаемости без прогрессирования при применении эрлотиниба составила 13,7 мес, а аналогичный показатель для больных, получавших комбинацию карбоплатин + гемцитабин, — 4,6 мес (рис. 2).
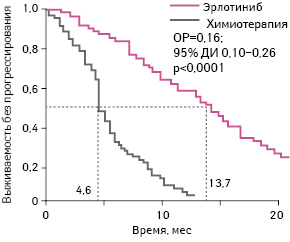
Адаптировано из: Chen G., Feng J., Zhou C. et al., 2013 [12]
Общая выживаемость пациентов, принимавших эрлотиниб, у которых применяли химиотерапию в качестве II линии лечения, статистически не отличалась от аналогичного показателя в группе комбинации карбоплатин + гемцитабин, в которой впоследствии назначали ингибиторы тирозинкиназы EGFR (ОР 1,08; 95% ДИ 0,61–1,91; p=0,80) и составила 30,4–31,4 мес (рис. 3).
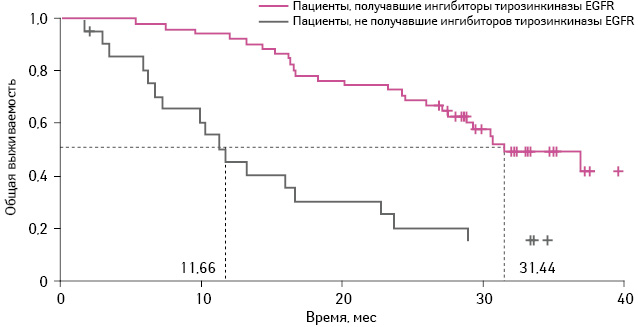
Адаптировано из: Zhou C., Wu Y.L., Liu X. et al., 2012 [13]
При этом медиана общей выживаемости в группе пациентов, получавших карбоплатин и гемцитабин, принимавших в качестве II линии терапии ингибиторы тирозинкиназы EGFR, была статистически достоверно выше по сравнению с теми, кто не получал таковых (31,4 мес против 11,7 мес соответственно).
Кроме того, общая выживаемость пациентов, которые получали только ингибиторы тирозинкиназы EGFR (включая несколько курсов лечения), была значительно выше по сравнению с пациентами, у которых применяли только химиотерапию (20,7 и 11,7 мес соответственно). Также данный показатель у пациентов, которые получали и ингибиторы тирозинкиназы EGFR, и химиотерапию, был выше по сравнению с больными, у которых применяли только химиотерапию (30,4 и 11,7 мес соответственно) (рис. 4).
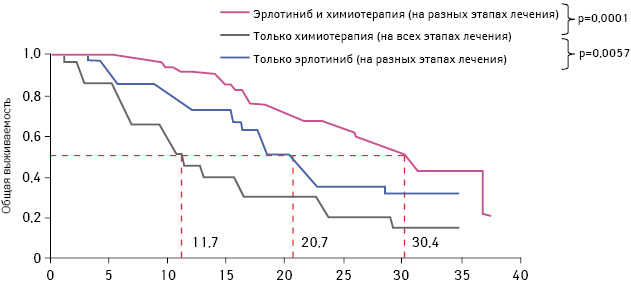
Адаптировано из: Zhou C., Wu Y.L., Liu X., 2012 [13]
Результаты дополнительного анализа общей выживаемости после терапии, проведенной по завершении данного этапа исследования, показывают, что эрлотиниб является важным фактором повышения выживаемости пациентов с мутациями EGFR при НМКРЛ. Отсутствие статистически достоверного различия показателей общей выживаемости в исследовании OPTIMAL, по мнению его авторов, связано с высоким уровнем перехода с терапии карбоплатином и гемцитабином на ингибиторы тирозинкиназы EGFR в качестве II линии терапии. Однако статистически достоверно показано, что выживаемость без прогрессирования, качество жизни и переносимость терапии эрлотинибом превышали соответствующие показатели в группе карбоплатин + гемцитабин.
Аналогичные положительные результаты применения эрлотиниба получены в ходе другого исследования — EURTAC, в котором принимали участие пациенты, принадлежащие к европейской популяции [14].
EURTAC является многоцентровым открытым рандомизированным клиническим исследованием III фазы, в котором проводили сравнение эффективности и профиля безопасности эрлотиниба и химиотерапии на основе препарата платины в качестве I линии терапии пациентов европейской популяции с НМКРЛ в поздних стадиях с подтвержденными активирующими мутациями EGFR.
В ходе исследования 174 пациента рандомизировали на 2 группы (n=86 и n=87; 1 пациент выбыл из исследования), в которых применяли соответственно эрлотиниб по 150 мг/сут или стандартную внутривенную химиотерапию 3-недельным циклом с добавлением цисплатина (75 мг/м2 в 1-е сутки) с доцетакселом (75 мг/м2 в 1-е сутки) или гемцитабином (1250 мг/м2 в 1-е и 8-е сутки); пациентам, которым противопоказан цисплатин, назначали карбоплатин (AUC 6 с доцетакселом 75 мг/м2 или AUC 5 с гемцитабином 1000 мг/м2). В качестве первичной конечной точки определена выживаемость без прогрессирования заболевания.
Анализ результатов исследования показал, что медиана выживаемости без прогрессирования заболевания у пациентов, получавших эрлотиниб, составила 10,4 мес по сравнению с 5,4 мес у больных, которым была назначена химиотерапия (ОР 0,34; 95% ДИ 0,23–0,49; р<0,001) (рис. 5) [16].
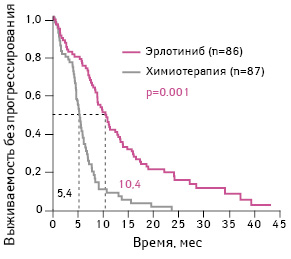
Адаптировано из: Khozin S., Blumenthal G.M., Jiang X. et al., 2014 [16]
Наиболее распространенными побочными реакциями III и IV степени у пациентов, применявших эрлотиниб, были сыпь (у 13%) III степени и повышение уровня аминотрансферазы (у 2%) III степени (рис. 6).
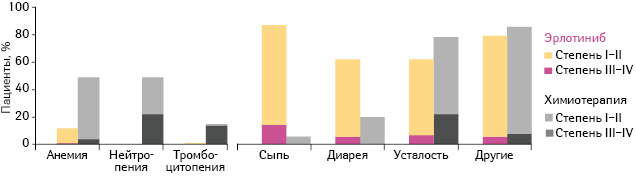
Адаптировано из: Rosell R., Carcereny E., Gervais R. et al., 2012 [14]
В группе стандартной химиотерапии наиболее частыми побочными эффектами III и IV степени были нейтропения (в 22% случаев) и анемия (у 4% пациентов) III степени. Повышения частоты пневмонита в группе эрлотиниба не отмечали. Только у 5 (6%) пациентов, получавших эрлотиниб, зарегистрировано наличие тяжелых нежелательных явлений по сравнению с 16 (20%) пациентами, получавшими химиотерапию. Пациенты, применявшие эрлотиниб, переносили лечение лучше, чем больные, которым назначали химиотерапию. Наиболее частыми побочными реакциями в группе эрлотиниба были кожная сыпь и диарея, которые в большинстве случаев имели легкую или среднюю степень тяжести. Тяжелые побочные реакции, связанные с терапией, в группе эрлотиниба встречались реже, чем в группе химиотерапии.
Таким образом, применение эрлотиниба следует рассматривать как один из стандартных методов I линии терапии у пациентов с НМКРЛ в поздних стадиях с подтвержденными активирующими мутациями EGFR вне зависимости от их популяционной принадлежности.
Эрлотиниб в качестве поддерживающей терапии при НМКРЛ
Длительность I линии химиотерапии местно-распространенного НМКРЛ, как правило, ограничивается 5–6 циклами. При этом последующая поддерживающая терапия может замедлить прогрессирование заболевания и увеличить продолжительность жизни пациента. В плацебо-контролируемом клиническом исследовании III фазы, получившем название SATURN BO18192 (Sequential Tarceva in Unresectable NSCLC), изучали эффективность и профиль безопасности применения эрлотиниба в качестве поддерживающей терапии у пациентов с непрогрессировавшим заболеванием после I линии платиносодержащего дублета химиотерапии [17] (рис. 7).
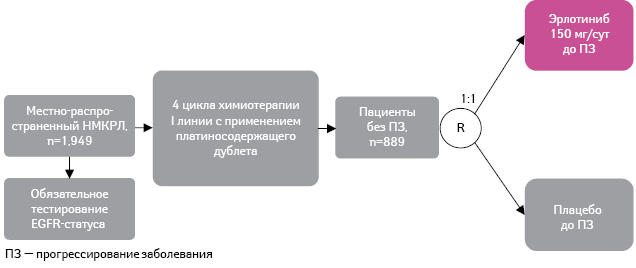
Данные из: Cappuzzo F., Ciuleanu T., Stelmakh L. et al., 2009 [17]
В ходе исследования 889 пациентов распределили в 2 группы: больные первой получали эрлотиниб (150 мг/сут; n=438), второй — плацебо (n=451) до прогрессирования заболевания или фиксации неприемлемого уровня токсичности лечения. Пациенты были стратифицированы по стадии, общего состояния по шкале ECOG (Eastern Cooperative Oncology Group), режиму химиотерапии, истории курения и проживанию в определенном географическом регионе.
В качестве первичных конечных точек выбраны выживаемость без прогрессирования заболевания у всех анализируемых пациентов (рис. 8–11).
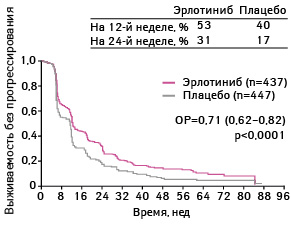
Адаптировано из: Cappuzzo F., Ciuleanu T., Stelmakh L. et al., 2009 [17]
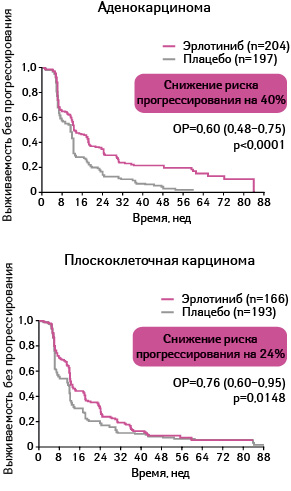
Адаптировано из: Cappuzzo F., Ciuleanu T., Stelmakh L. et al., 2009 [17]
Адаптировано из: Cappuzzo F., Ciuleanu T., Stelmakh L. et al., 2009 [17]
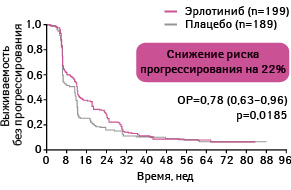
Адаптировано из: Cappuzzo F., Ciuleanu T., Stelmakh L. et al., 2009 [17]
Выживаемости без прогрессирования была статистически достоверно больше у пациентов, применявших эрлотиниб, по сравнению с группой плацебо. Так, медиана выживаемости без прогрессирования в группе, получавшей эрлотиниб, составила 12,3 нед, а в группе плацебо — 11,1 нед (ОР 0,71; 95% ДИ 0,62–0,82; р<0,0001).
Кроме того, выживаемость без прогрессирования заболевания варьировала у различных подгрупп пациентов (рис. 12).
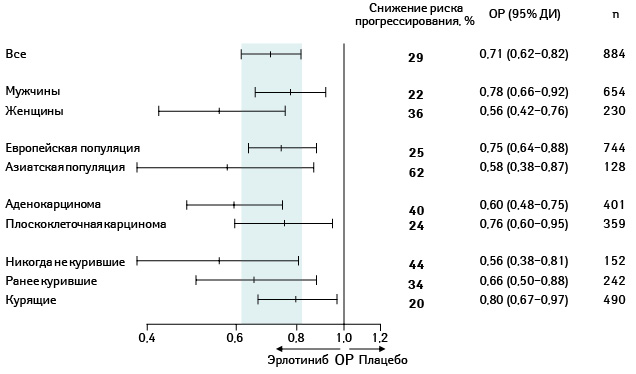
Адаптировано из: Cappuzzo F., Ciuleanu T., Stelmakh L. et al., 2009 [17]
Наиболее распространенными побочными явлениями III степени и выше были сыпь (у 9% больных в группе, получавшей эрлотиниб, по сравнению с отсутствием таковой больных в группе плацебо) и диарея (у 2% пациентов в группе, получавшей эрлотиниб, по сравнению с отсутствием таковой в группе плацебо).
Таким образом, поддерживающая терапия эрлотинибом у пациентов с НМКРЛ хорошо переносится и статистически достоверно повышает выживаемость без прогрессирования заболевания по сравнению с плацебо.
Терапия эрлотинибом у пациентов НМКРЛ в поздних стадиях
Для пациентов с НМКРЛ в поздних стадиях химиотерапия предполагает уменьшение выраженности симптомов и умеренное повышение выживаемости. При этом медиана времени до прогрессирования заболевания, как правило, составляет 3–5 мес. II линия химиотерапии доцетакселом может увеличить выживаемость после лечения на основе препаратов платины при НМКРЛ [18, 19]. Тем не менее в настоящее время нет понимания роли III линии химиотерапии. Отсутствие результата при проведении III линии химиотерапии продемонстрировано E. Massarelli и соавторами [20], которые в своей работе достигли 2% ответа на терапию и медианы выживаемости пациентов — 4 мес. F.A. Shepherd и соавторы [23] показали, что у пациентов, получавших доцетаксел после неудачи 2 или более режимов химиотерапии, выживаемость была идентична таковой больных, у которых проводили поддерживающую терапию.
Новые возможности в этом контексте может предложить применение эрлотиниба. Группа ученых из Национального институт рака Канады (National Cancer Institute of Canada Clinical Trials Group — NCIC CTG) провела клиническое исследование BR.21 для сравнения эффективности и профиля безопасности применения эрлотиниба с плацебо после неудачи нескольких линий стандартной химиотерапии НМКРЛ [21].
BR.21 является рандомизированным плацебо-контролируемым двойным слепым клиническим исследованием ІІІ фазы (рис. 13).

Данные из: Shepherd F.A., Rodrigues Pereira J., Ciuleanu T. et al., 2005 [23]
В исследовании принимали участие пациенты с НМКРЛ в IIIB или IV стадии, ранее получавшие 1 или 2 режима химиотерапии. Больные были рандомизированы в соотношении примерно 2:1 в 2 группы: пациенты из первой получали перорально эрлотиниб 150 мг/сут, из второй — плацебо. В качестве первичной конечной точки выбрано общую выживаемость.
Медиана общей выживаемости в группе эрлотиниба составила 6,7 мес, а в группе плацебо — 4,7 мес (ОР 0,70; 95% ДИ 0,58–0,85; p<0,001) (рис. 14–16).
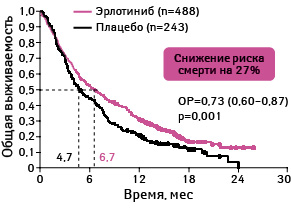
Адаптировано из: Shepherd F.A., Rodrigues Pereira J., Ciuleanu T. et al., 2005 [23]
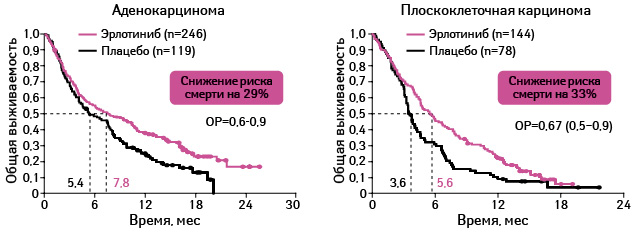
Адаптировано из: Clark G.M., 2008 [21]
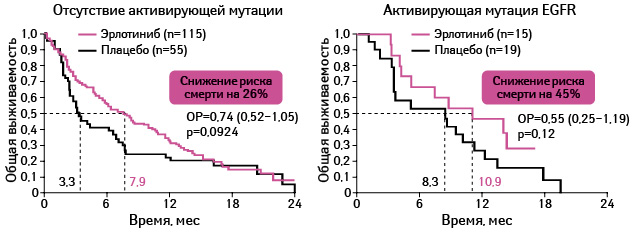
Адаптировано из: Zhu C.-Q., Santos G. da C., Ding K. et al., 2008 [22]
В данном плацебо-контролируемом исследовании доказано, что применение эрлотиниба обеспечивает клинически значимое повышение выживаемости. Выживаемость в этом исследовании была больше по сравнению с аналогичным исследованием с применением гефитиниба, невзирая на сопоставимый уровень ответа на лечение в обоих исследованиях [22].
Применение эрлотиниба оказывает положительное влияние на выживаемость почти во всех подгруппах участников исследования (см. рис. 15, 16).
В данном исследовании статистически достоверно у большего количества пациентов в группе эрлотиниба по сравнению с группой плацебо зарегистрировано уменьшение выраженности одышки, боли и кашля. Анализ качества жизни показал, что минимизация выраженности симптомов также была связана со значительным улучшением физической функции.
Таким образом, применение эрлотиниба у пациентов, ранее получавших лечение при НМКРЛ, продлевает жизнь и уменьшает выраженность симптомов по сравнению с плацебо. Терапия с применением эрлотиниба открывает новые возможности для лечения больных с прогрессированием заболевания после приема доцетаксела или тех, кому противопоказана II линия.
Терапия пациентов с НМКРЛ и метастазами в головном мозгу
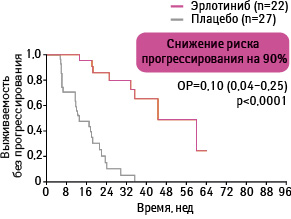
Примерно у 20–40% пациентов с НМКРЛ развиваются метастазы в головном мозгу [25, 26]. Лечение пациентов с метастазами данной локализации при НМКРЛ включает применение лучевой терапии на головном мозгу (ЛТГМ), стереотаксическую радиохирургию, хирургическое удаление или комбинацию упомянутых подходов. Медиана продолжительности жизни после ЛТГМ и обычно составляет 3–6 мес [27–31]. Известно, что эрлотиниб, являясь низкомолекулярным соединением, способен проникать через гематоэнцефалический барьер [32, 33]. Основано предположение о том, что применение эрлотиниба в сочетании с ЛТГМ может усилить терапевтический эффект путем целевого воздействия на опухолевые клетки в головном мозгу. С целью изучить целесообразность применения данного подхода проведено проспективное многоцентровое клиническое исследование II фазы по применению эрлотиниба в сочетании с ЛТГМ у пациентов с метастазами в головном мозгу при НМКРЛ [35]. В исследовании приняли участие 40 пациентов с подтвержденным наличием метастазов в головном мозгу (рис. 17). В ходе исследования все пациенты в течение 6 дней получали эрлотиниб 150 мг/сут, затем на протяжении 2 нед — лучевую терапию (5 дней в неделю по 2,5 Гр/сут, суммарная очаговая доза 35 Гр) совместно с эрлотинибом 150 мг/сут. Потом пациенты применяли эрлотиниб 150 мг/сут до прогрессирования заболевания.

Данные из: Welsh J.W., Komaki R., Amini A. et al., 2013 [34]
Медиана возраста пациентов составила 59 лет (29–77 лет). Медиана количества метастазов — 3 (1–6) и медиана лучевой нагрузки — 18 Гр (15–22 Гр). 21 пациент до включения в исследование получал химиотерапию, в основном комбинациями цисплатин + доцетаксел или карбоплатин + паклитаксел. Два пациента получили пеметрексед.
6-месячная, 1-годичная и 2-летняя общая выживаемость составили 68; 50 и 24% соответственно (рис. 18). Медиана общей выживаемости — 11,8 мес (95% ДИ 7,4–19,1 мес). 6-месячные, 1-годичные и 2-летние кумулятивные темпы прогрессирования заболевания в центральную нервную систему (ЦНС) составили 13; 30 и 40% соответственно. 6-месячная, 1-годичная и 2-летняя выживаемость без прогрессирования заболевания в ЦНС достигла 63; 38 и 20% соответственно, а медиана выживаемости без прогрессирования в ЦНС — 8 мес.
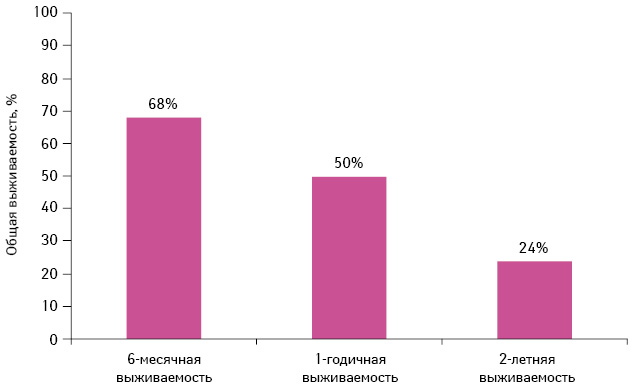
Адаптировано из: Welsh J.W., Komaki R., Amini A. et al., 2013 [34]
В период между 3–6 мес частота ответа относительно ЦНС составила: 31% — полный ответ (n=11), 56% — частичный ответ (n=20), 6% — смешанный (полный и частичный) ответ (n=2), 6% — прогрессирование заболевания (n=2) и 3% — стабилизация заболевания (n=1). При этом общий уровень ответа достиг 86%. Медиана выживаемости была сопоставимой у больных с 3 и более (12,2 мес) и с 4 или более поражениями (11,5 мес; p=0,638), а медиана общей выживаемости составила 11,8 мес.
Следует отметить, что 3-месячный уровень ответа ЦНС (полный и частичный) составил 89% у пациентов с подтвержденными EGFR-мутациями по сравнению с 63% у больных без мутаций EGFR. Уровни полного, частичного, смешанного ответа, стабилизации и прогрессирования заболеванием составляли 33; 56; 0; 0 и 11% соответственно у пациентов с EGFR-мутациями и 12,5; 50,0; 12,5; 12,5 и 0% соответственно у пациентов без мутаций EGFR.
В зависимости от EGFR-статуса также различались медианы общей выживаемости: 9,3 мес — для пациентов без мутаций EGFR и 19,1 мес — для больных с мутациями EGFR (<95% ДИ 10,5 мес).
Приведенные результаты многоцентрового клинического исследования II фазы показывают, что применение ЛТГМ в сочетании с эрлотинибом у пациентов с метастазами в головном мозгу при НМКРЛ позволяет достичь повышения общей выживаемости по сравнению с историческими данными, особенно для пациентов с EGFR-мутациями [30, 31]. Также интересным представляется тот факт, что распространенность EGFR-мутаций в этой группе больных значительно выше, чем в целом в популяции пациентов с НМКРЛ. Так, согласно данным литературы частота мутаций EGFR составляет приблизительно 10–15% среди больных НМКРЛ [35], тогда как в группе пациентов с НМКРЛ и метастазами в головном мозгу этот показатель достигает 50%.
Таким образом, эрлотиниб и лучевая терапия в качестве начального лечения больных НМКРЛ с метастазами в головном мозгу являются хорошо переносимой комбинацией, а длительность жизни пациентов в этом исследовании превысила ожидаемую по сравнению с исторической контрольной группой, особенно у пациентов с EGFR-мутациями.
Применение эрлотиниба у пациентов с РПЖ
Прогноз для пациентов с местно-распространенным РПЖ остается неблагоприятным, а поиск новых схем лечения более актуальным. Далее будут приведены результаты исследования РА.3, которое стало основанием для разрешения применения эрлотиниба в комбинации с гемцитабином у пациентов с метастатическим РПЖ, не получавших ранее химиотерапии [36]. В данном многоцентровом рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании III фазы приняли участие 521 пациент с гистологически и цитологически подтвержденной нерезектабельной местно-распространенной или метастатической аденокарциномой поджелудочной железы (рис. 19). Пациенты рандомизированы в 2 группы: участники первой получали эрлотиниб + гемцитабин (n=261), второй — гемцитабин + плацебо (n=260). Эрлотиниб назначали в дозе 100 мг/сут. В качестве первичной конечной точки выбрана общая выживаемость, вторичных — ответ на лечение, длительность ответа, выживаемость без прогрессирования заболевания (табл. 1).
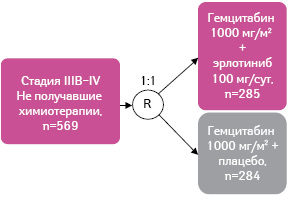
Данные из: Senderowicz A.M., Johnson J.R., Sridhara R. et al., 2007 [36]
Таблица 1. Исследование РА.3: анализ эффективности терапии в различных подгруппах пациентов
| Характеристики пациентов |
Снижение риска смерти, % |
| Эрлотиниб + гемцитабин vs плацебо + гемцитабин | –18 |
| Метастатический процесс | –23 |
| PS 0–1 | –11 |
| PS ≥2 | –39 |
| EGFR негативный статус | –29 |
| EGFR позитивный статус | –24 |
Адаптировано из: Senderowicz A.M., Johnson J.R., Sridhara R. et al., 2007 [34]
Медиана общей выживаемости в группе, получавшей эрлотиниб, составила 6,4 мес, а в группе плацебо — 6,0 мес (p=0,03) (рис. 20).
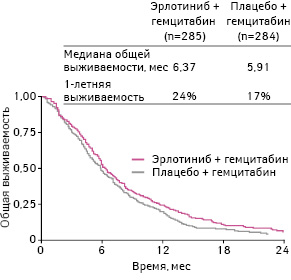
Адаптировано из: Senderowicz A.M., Johnson J.R., Sridhara R. et al., 2007 [36]
Интерес представляет также анализ общей выживаемости пациентов в зависимости от развития у них одного из распространенных побочных эффектов при применении эрлотиниба — сыпи (рис. 21). В данном исследовании у пациентов с РПЖ зарегистрировано, что развитие сыпи ≤I степени не связано с повышением выживаемости пациентов, получавших
эрлотиниб, и напротив, для больных, у которых возникла сыпь ≥II степени, такая корреляция присутствует и является статистически достоверной. Таким образом, наличие у пациентов, применявших эрлотиниб, сыпи ≥II степени является предиктором более высокой общей выживаемости по сравнению с остальными.
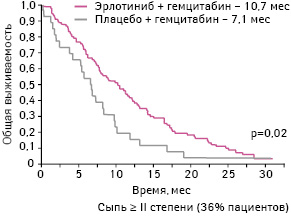
Адаптировано из: Senderowicz A.M., Johnson J.R., Sridhara R. et al., 2007 [36]
Анализ профиля безопасности применения эрлотиниба в комбинации с гемцитабином по сравнению с сочетанием гемцитабин + плацебо показал, что в группе пациентов, получавших эрлотиниб, отмечали несколько большую частоту тяжелых побочных эффектов (≥III степени), включая сыпь, диарею и др.
В этом исследовании применение комбинации эрлотиниба и гемцитабина позволило достичь повышения общей выживаемости у пациентов с неоперабельным местно-распространенным или метастатическим РПЖ по сравнению с приемом только гемцитабина. Увеличение выживаемости сопровождалось повышением выживаемости без прогрессирования заболевания, при этом уровень общего ответа на лечение и его продолжительность не отличались между группами. Таким образом, данная комбинация дает новую возможность для повышения выживаемости пациентов с местно-распространенным, неоперабельным или метастатическим РПЖ.
Оптимизация дозы эрлотиниба при развитии сыпи различной степени тяжести
Как упоминалось ранее, сыпь является одним из наиболее распространенных побочных эффектов при применении эрлотиниба, играя при этом роль предиктора более высокой выживаемости по сравнению с показателями у тех пациентов, у которых это нежелательное явление не развивается. Тем не менее возникновение сыпи, особенно ее тяжелых форм, снижает качество жизни пациентов и в случае отсутствия необходимой терапии может стать причиной отмены препарата. Поэтому целесообразно рассмотреть, какие формы сыпи могут развиваться при применении эрлотиниба, какое лечение необходимо проводить для купирования этого побочного эффекта и как это влияет на схему приема эрлотиниба.
Наиболее распространенными дерматологическими заболеваниями, связанными с применением эрлотиниба, являются угревая сыпь, сухость кожи и паронихия. Так как данные заболевания, как правило, не вызваны инфекцией, для их лечения целесообразно применять стероиды и смягчающие средства. Однако, если поражение кожи не поддается лечению, может присоединиться вторичная инфекция, для устранения которой подойдут антибиотики, например, миноциклин будет актуален при сыпи II степени. Для лечения дерматологических заболеваний, связанных с приемом эрлотиниба, показаны мощные стероиды для местного применения, например бетаметазона бутират, дексаметазона пропионат, клобетазола пропионат, дифлоразона диацетат. Также рекомендуется применять специальные смягчающие средства, в том числе с целью профилактики развития сыпи.
Важным вопросом в этом контексте является принятие решения об отмене препарата или изменении его дозы. Учеными разработана схема, основанная на результатах предыдущих исследований применения эрлотиниба [22, 37, 38], в которой приведены рекомендации относительно коррекции дозы эрлотиниба в зависимости от выраженности сыпи [39] (табл. 2).
Таблица 2. Рекомендации относительно изменений дозировки эрлотиниба после появления кожных изменений при НМКРЛ
| Степень I | Степень II | Степень III | Степень IV |
| Продолжать прием 150 мг | Продолжать прием 150 мг; если состояние пациента продолжает ухудшаться даже после симптоматической терапии (например стероидами), рассмотреть возможность снижения дозы до 100 мг | Снизить дозу до 50 мг; если улучшений нет, несмотря на более мощную симптоматическую терапию, рассмотреть временное прекращение лечения; если токсичность снижается до II степени тяжести, можно возобновить прием 100 мг | Прекратить лечение навсегда |
Таким образом, применение эрлотиниба как в качестве монотерапии, так и в комбинации с другими препаратами или методами лечения позволяет значительно расширить возможности терапии пациентов с НМКРЛ и РПЖ в различных стадиях течения заболевания, что способствует повышению общей выживаемости и выживаемости без прогрессирования наряду с приемлемым профилем безопасности.
Список использованной литературы
1. Arteaga C. (2003) Тargeting HER1/EGFR: for molecular approach to cancer therapy. Semin. Oncol., 30: 3–14.
2. Ferlay J., Shin H.R., Bray F. et al. (2010) Estimates of worldwide burden of cancer in 2008. GLOBOCAN 2008. Int. J. Cancer, 127: 2893–2917.
3. Рак в Україні, 2012–2013. Захворюваність, смертність, показники діяльності онкологічної служби (2014) Бюл. Нац. канцер-реєстру, 15. За ред. І.Б. Щепотіна. Київ: 36.
4. Peters S., Adjiei A., Grindelli C. et al. (2012) Metastatic non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 23: 56–59.
5. Spira A., Ettinger D.S. (2004) Multidisciplinary management of lung cancer. N. Engl. J. Med., 350(4): 379–392.
6. Breathnach O.S., Freidlin B., Conley B. et al. (2001) Twenty-two years of phase III trials for patients with advanced non-small-cell lung cancer: sobering results. J. Clin. Oncol., 19: 1734–1742.
7. Stinchcombe T.E., Socinski M.A. (2009) Treatment paradigms for advanced stage non-small cell lung cancer in the era of multiple lines of therapy. J. Thoracic. Oncol., 4: 243–50.
8. Rosell R., Molina M.A., Serrano M.J. (2012) EGFR mutations in circulating tumour DNA. Lancet Oncol., 13: 239–246.
9. Cappuzzo F., Ciuleanu T., Stelmakh L. et al. (2010) Erlotinib as maintenance treatment in advanced non-small-cell lung cancer: a multicentre, randomised, placebo-controlled phase 3 study. Lancet Oncol., 11: 521–529.
10. Maemondo M., Inoue A., Kobayashi K. et al. (2010) Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N. Engl. J. Med., 362: 2380–2388.
11. Mitsudomi T., Morita S., Yatabe Y. et al. (2010) Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol., 11(2): 121–128.
12. Chen G., Feng J., Zhou C. et al. (2013) Quality of life (QoL) analyses from OPTIMAL (CTONG-0802), a phase III, randomised, open-label study of first-line erlotinib versus chemotherapy in patients with advanced EGFR mutation-positive non-small-cell lung cancer (NSCLC). Ann. Oncol.: 1–7.
13. Zhou C., Wu Y.L., Liu X. et al. (2012) Preliminary overall survival (OS) results from optimal (CTONG0802), a phase III trial of erlotinib (E) versus carboplatin plus gemcitabine (GC) as first-line treatment for chinese patients with EGFR mutation-positive advanced non-small cell lung cancer (NSCLC). J. Clin. Oncol., 30 (suppl; abstr 7520).
14. Rosell R., Carcereny E., Gervais R. et al. (2012) Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol., 13(3): 239–46.
15. Zhou C., Wu Y.L., Liu X. et al. (2012) Overall survival (OS) results from OPTIMAL (CTONG0802), a phase III trial of erlotinib (E) versus carboplatin plus gemcitabine (GC) as first-line treatment for Chinese patients with EGFR mutation-positive advanced non-small cell lung cancer (NSCLC). J. Clin. Oncol., 30: 7520.
16. Khozin S., Blumenthal G.M., Jiang X. et al. (2014) US Food and Drug Administration Approval Summary: Erlotinib for the first-line treatment of metastatic non-small cell lung cancer with epidermal growth factor receptor exon 19 deletions or exon 21 (L858R) substitution mutations. Оncologist, 19(7): 774–779.
17. Cappuzzo F., Ciuleanu T., Stelmakh L. et al. (2009) SATURN: A double-blind, randomized, phase III study of maintenance erlotinib versus placebo following nonprogression with first-line platinum-based chemotherapy in patients with advanced NSCLC. J. Clin. Oncol., 27: 15 s (suppl; abstr 8001).
18. Shepherd F.A., Dancey J., Ramlau R. et al. (2000) Prospective randomized trial of docetaxel versus best supportive care in patients with non-small-cell lung cancer previously treated with platinum-based chemotherapy. J. Clin. Oncol., 18(10): 2095–2103.
19. Fossella F.V., DeVore R., Kerr R.N. et al. (2000) Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. J. Clin. Oncol., 18(12): 2354–2362.
20. Massarelli E., Andre F., Liu D. et al. (2003) A retrospective analysis of the outcome of patients who have received two prior chemotherapy regimens including platinum and docetaxel for recurrent non-small-cell lung cancer. Lung Cancer, 39(1): 55–61.
21. Clark G.M. (2008) Prognostic factors versus predictive factors: Examples from a clinical trial of erlotinib. Mol. Oncol.: 406–412.
22. Zhu C.-Q., Santos G. da C., Ding K. (2008) Role of KRAS and EGFR As Biomarkers of Response to Erlotinib in National Cancer Institute of Canada Clinical Trials Group Study BR.21. J. Clin. Oncol., 26 (36): 4268–75.
23. Shepherd F.A., Rodrigues Pereira J., Ciuleanu T. et al. (2005) Erlotinib in previously treated non-small-cell lung cancer. N. Engl. J. Med., 353(2): 123–132.
24. Thatcher N., Chang A., Parikh P. et al. (2005) Results of a Phase III placebo-controlled study (ISEL) of gefitinib (IRESSA) plus best supportive care (BSC) in patients with advanced non-small-cell lung cancer (NSCLC) who had received 1 or 2 prior chemotherapy regimens. In: Proceedings of the 96th Annual Meeting of the American Association for Cancer Research, Anaheim, Calif., April 16–20, 4.
25. Mujoomdar A., Austin J.H., Malhotra R. et al. (2007) Clinical predictors of metastatic disease to the brain from non-small cell lung carcinoma: primary tumor size, cell type, and lymph node metastases. Radiology, 242: 882–888.
26. Barnholtz-Sloan J.S., Sloan A.E., Davis F.G. et al. (2004) Incidence proportions of brain metastases in patients diagnosed (1973 to 2001) in the Metropolitan Detroit Cancer Surveillance System. J. Clin. Oncol., 22: 2865–2872.
27. Verger E., Gil M., Yaya R. et al. (2005) Temozolomide and concomitant whole brain radiotherapy in patients with brain metastases: a phase II randomized trial. Int. J. Radiat. Oncol. Biol. Phys., 61: 185–191.
28. Sperduto P.W., Berkey B., Gaspar L.E. et al. (2008) A new prognostic index and comparison to three other indices for patients with brain metastases: an analysis of 1,960 patients in the RTOG Database. Int. J. Radiat. Oncol. Biol. Phys., 70: 510–514.
29. Gaspar L., Scott C., Rotman M. et al. (1997) Recursive partitioning analysis (RPA) of prognostic factors in three Radiation Therapy Oncology Group (RTOG) brain metastases trials. Int. J. Radiat. Oncol. Biol. Phys., 37: 745–751.
30. Knisely J.P., Berkey B., Chakravarti A. et al. (2008) A phase III study of conventional radiation therapy plus thalidomide versus conventional radiation therapy for multiple brain metastases (RTOG 0118). Int. J. Radiat. Oncol. Biol. Phys., 71: 79–86.
31. McHaffie D.R., Chabot P., Dagnault A. et al. (2011) Safety and feasibility of motexafin gadolinium administration with whole brain radiation therapy and stereotactic radiosurgery boost in the treatment of ≤6 brain metastases: a multi-institutional phase II trial. J. Neurooncol., 105: 301–308.
32. Togashi Y., Masago K., Fukudo M. et al. (2010) Cerebrospinal fluid concentration of erlotinib and its active metabolite OSI-420 in patients with central nervous system metastases of non-small cell lung cancer. J. Thorac. Oncol., 5: 950–955.
33. Weber B., Winterdahl M., Memon A. et al. (2011) Erlotinib accumulation in brain metastases from non-small cell lung cancer: visualization by positron emission tomography in a patient harboring a mutation in the epidermal growth factor receptor. J. Thorac. Oncol., 6: 1287–1289.
34. Welsh J.W., Komaki R., Amini A. et al. (2013) Phase II trial of erlotinib plus concurrent whole-brain radiation therapy for patients with brain metastases from non-small-cell lung cancer. J. Clin. Oncol., 31(7): 895–902.
35. Roberts P.J., Stinchcombe T.E., Der C.J. et al. (2010) Personalized medicine in non-small-cell lung cancer: is KRAS a useful marker in selecting patients for epidermal growth factor receptor-targeted therapy? J. Clin. Oncol., 28: 4769–4777.
36. Senderowicz A.M., Johnson J.R., Sridhara R. et al. (2007) Erlotinib/gemcitabine for first-line treatment of locally advanced or metastatic adenocarcinoma of the pancreas. Oncology (Williston Park, NY), 21(14): 1696–706.
37. Kubota K., Nishiwaki Y., Tamura T. et al. (2008) Efficacy and safety of erlotinib monotherapy for Japanese patients with advanced non-small cell lung cancer: a phase II study. J. Thorac. Oncol., 3: 1439–1445.
38. Takahashi T., Yamamoto N., Nukiwa T. et al. (2010) Phase II study of erlotinib in Japanese patients with advanced non-small cell lung cancer. Anticancer Res., 30: 557–563.
39. Kiyohara Y., Yamazaki N., Kishi A. (2013) Erlotinib-related skin toxicities: treatment strategies in patients with metastatic non-small cell lung cancer. J. Am. Acad. Dermatol., 69(3): 463–472.














Leave a comment