Вплив декскетопрофену й алкалоїдів опію на деякі показники, які характеризують стан клітинної ланки імунної системи при периопераційному знеболюванні в онкохірургії
Лесной И.И., Сидор Р.І., Стаховский А.Э., Климчук Л.В., Храновская Н.Н., Скачкова О.В., Ушаков С.В. , Медведев А.В., Музыка Н.И., Катриченко М.А. , Кабанчук Ю.В.
Резюме. У статті наводяться результати дослідження впливу периопераційного знеболювання анальгетиками — сумішшю алкалоїдів опію і декскетопрофеном на деякі показники, які характеризують стан клітинної ланки імунної системи у хворих на рак нирки, яким проведено нефректомію чи резекцію нирки. Встановлено, що при застосуванні декскетопрофену післяопераційна імуносупресія має менш виражений характер порівняно з використанням алкалоїдів опію, що проявляється більш високим рівнем IFN-γ-продукуючих Т-клітин, збільшенням кількості натуральних кілерних клітин і підвищенням їх цитотоксичної активності.
Резюме. В статье приводятся результаты исследования влияния периоперационного обезболивания анальгетиками — смесью алкалоидов опия и декскетопрофеном на некоторые показатели, характеризующие состояние клеточного звена иммунной системы у больных раком почки, которым выполнена нефрэктомия или резекция почки. Установлено, что при применении декскетопрофена послеоперационная иммуносупрессия носит менее выраженный характер, чем при использовании алкалоидов опия, что проявляется более высоким уровнем IFN-γпродуцирующих Т-клеток, увеличением количества натуральных киллерных клеток и повышением их цитотоксической активности.

Основной причиной смерти при онкологической патологии является развитие метастазов или рецидив после основного лечения [1]. При этом одним из решающих факторов выступает состояние иммунной системы больного [1, 2]. Известно, что иммунная система пациентов онкологического профиля находится в состоянии супрессии вследствие основного заболевания, психологического стресса, химио- и лучевой терапии, а также непосредственно хирургического вмешательства [3–6]. Удаление первичной опухоли неизбежно ведет к диссеминации опухолевых клеток по кровеносным и лимфатическим сосудам. Тяжелая дисрегуляция функций иммунной системы может способствовать развитию послеоперационных осложнений, в том числе нарушению заживления раны и развитию инфекционных осложнений.
Периоперационные факторы, такие как хирургическая травма, боль, анестезия, гипоксия, гипотензия, гипотермия, гипергликемия и гемотрансфузия оказывают существенное негативное влияние на иммунную систему прооперированных больных. Они влияют в первую очередь на клеточный иммунный ответ, угнетая активность натуральных киллерных клеток (НКК) и цитотоксических Т-лимфоцитов (ЦТЛ), которые являются важными эффекторами в противоопухолевом иммунитете [7, 8]. Эти факторы могут способствовать угнетению миграции лимфоцитов, вызывать апоптоз клеток иммунной системы, а также индуцировать супрессорные иммунные клетки, такие как CD4+ регуляторные Т-клетки, опухолеассоциированные макрофаги (ТАМs) и супрессорные клетки миелоидного происхождения (MDSCs), которые способствуют возникновению рецидива и метастазированию опухоли после операции [9, 10].
Вместе с тем следует отметить, что вклад анальгетиков в развитие иммуносупрессии в периоперационный период у больных онкологического профиля является объектом активных дискуссий. Большинство исследователей считают, что анальгетики могут нарушать функцию иммунной системы как за счет прямого воздействия на иммунокомпетентные клетки, так и непрямого — через модуляцию нейрогуморальной стресс-реакции [6, 11], хотя остальные не поддерживают такую точку зрения [12]. Наиболее изучено влияние опиоидных анальгетиков. Опиоиды, особенно морфин, обладают противовоспалительной активностью и способны вызывать угнетение иммунного ответа. Влияние морфина опосредуется за счет его связывания с μ-опиоидными рецепторами, которые принадлежат к семейству рецепторов, сопряженных с G-белком (G-protein coupled receptors) на клетках иммунной системы (моноцитах, нейтрофилах, макрофагах, Т- и В- клетках) [13–15], в частности через μ3-рецепторы [16]. Применение морфина снижает активность нейтрофилов и макрофагов, угнетает функцию ЦТЛ и НКК [15, 17], а также экспрессию IL-2, IFN-γ Т-клетками [18, 19]. Кроме этого, морфин может усиливать процессы ангиогенеза и пролиферацию опухолевых клеток, что иногда способствует развитию метастазов [20]. Это может приводить как к значительному ухудшению ближайших результатов хирургического лечения, так и к неблагоприятным отдаленным последствиям. Поэтому применение морфина по возможности следует ограничивать у больных с нарушенной иммунной системой, в частности со злокачественными новообразованиями [21].
Констатируется, что оптимизация методов анестезии и периоперационной анальгезии, направленная на уменьшение выраженности хирургически индуцированной иммуносупрессии, может снизить риск развития метастазов и опухолевого прогрессирования у больных онкологического профиля, а также уменьшить количество послеоперационных осложнений.
В последнее время в качестве альтернативы опиоидным анальгетикам усиленный интерес вызывают нестероидные противовоспалительные препараты (НПВП). Последние могут снижать риск развития опухоли за счет торможения активности циклооксигеназы-2 (ЦОГ-2) [22] — энзима, который отвечает за синтез различных простагландинов. Установлено, что простагландины, в частности простагландин Е2 (PGE2), играют ключевую роль в ускорении пролиферации опухолевой ткани, а также вовлечены в развитие опухолеассоциированной иммуносупрессии. Результаты многих исследований продемонстрировали, что НПВП также обладают способностью усиливать апоптоз опухолевых клеток и тормозить ангиогенез [22, 23]. Вместе с тем влияние НПВП, применяемых в периоперационный период, на состояние иммунной системы пациентов с онкологической патологией мало изучено.
С учетом вышеизложенного целью нашего исследования было изучить влияние периоперационного обезболивания анальгетиками — смесью алкалоидов опия и декскетопрофеном — на некоторые показатели, характеризующие состояние клеточного звена иммунной системы у больных раком почки.
Объект и методы исследования
Исследование проведено в научно-исследовательском отделении анестезиологии и интенсивной терапии совместно с научно-исследовательским отделением пластической и восстановительной онкоурологии научно-исследовательской лаборатории экспериментальной онкологии Национального института рака за период с 01.01.2013 по 01.12.2013. Письменное согласие на участие в исследовании получено у каждого пациента. В исследование включено 42 больных почечно-клеточным раком, у которых выполнена нефрэктомия или резекция почки. Критериями включения в исследование были: возраст больного не старше 65 лет, отсутствие выраженной сердечно-сосудистой патологии (инфаркт миокарда, гипертоническая болезнь III степени, нарушение мозгового кровообращения в анамнезе), известной аллергической реакции на декскетопрофен, почечной недостаточности.
Больных проспективно рандомизировали в две группы. В группе О (n=21)у пациентов для премедикации вечером и утром перед операцией применяли Омнопон (комбинация морфин + наркотин + папаверин + кодеин + тебаин) 2% 1 мл внутримышечно, который продолжали вводить для послеоперационного обезболивания в дозе 1 мл 4 раза в сутки. В группу Д (n=21) были включены больные, у которых для премедикации вечером и утром применяли декскетопрофен в дозе 50 мг внутримышечно. Для послеоперационного обезболивания продолжали введение декскетопрофена в дозе 50 мг внутривенно 3 раза в сутки.
Обезболивание выполнено в условиях общей ингаляционной анестезии севофлураном по методике низкого потока. Анестезию дополняли эпидуральной анальгезией ропивакаином 0,2% (болюсное введение 20 мг с последующим продленным введением со скоростью 6–8 мл/ч). Анальгезия ропивакаином 0,2% 6–8 мл/ч продолжена в послеоперационный период в обеих группах.
По основным клиническим критериям, объему операции, гендерному и возрастному признакам группы больных репрезентативны. Средний возраст больных в группе О составил 57±10,2 года (52–61 год), а в группе Д — 49±9,7 года (46–51 год), соотношение мужчин и женщин в группе О составило 9:12, а в группе Д — 8:13 (р>0,05). Соотношение объема оперативного вмешательства резекции почки и нефрэктомии в группе О составило 12:9, в группе Д — 11:10 (р>0,05).
Оценку интенсивности боли после операции проводили по визуально-аналоговой 10-балльной шкале каждые 4 ч. При недостаточном обезболивании (>4 баллов при движении) пациентам в обеих группах дополнительно вводили смесь алкалоидов опия 2% 1 мл внутримышечно.
У всех больных проводили забор образцов крови за сутки до начала исследования: до премедикации (1-й этап), непосредственно перед началом операции при поступлении в операционную (2-й этап), в конце операции (3-й этап) и через 3 дня после оперативного вмешательства (4-й этап).
Исследование субпопуляционного состава лимфоцитов периферической крови проводили путем фенотипирования лимфоцитов, которое включало определение экспрессии маркеров клеточной принадлежности: СD3+ (Т-лимфоциты), CD4+ (Т-хелперы, Тх), CD8+ (ЦТЛ), CD16+ (НКК). Анализ выполняли с помощью метода прямой иммунофлюоресценции с использованием моноклональных антител к соответствующим поверхностным маркерам (анти-CD3 (FITC), анти-CD4 (FITC), анти-CD8 (FITC), анти-CD16 (PE), «Bekman Coulter», США). В качестве изотипического контроля применяли моноклональные антитела, специфичные к IgG1/IgG2 (FITC). При цитометрическом исследовании контрольную пробу использовали для выделения негативного по флюоресценции лимфоцитарного гейта. В цитометрические пробирки вносили по 20 мкл соответствующих антител и по 100 мкл гепаринизированной крови (при количестве лейкоцитов в крови 2,0–9,4•10клеток/мл). Образцы перемешивали и инкубировали в темноте в течение 30 мин при температуре 20–25 °С. Для лизиса эритроцитов в каждую пробирку добавляли по 2 мл лизирующего раствора, перемешивали и инкубировали в темноте в течение 10 мин при температуре 20–25 °С. Лейкоциты осаждали центрифугированием при 1000 об./мин в течение 10 мин. Осадок клеток отмывали в 2 мл забуференного физиологического раствора (ЗФР) путем центрифугирования при 1000 об./мин на протяжении 10 мин. Затем к осадку добавляли по 400 мкл ЗФР и проводили анализ образцов на проточном цитофлуориметре FACSCalibur («Becton Dickinson», США) с помощью программы CellQuest-PRO («Becton Dickinson», США).
Для определения внутриклеточной продукции ІFN-γ Т-лимфоцитами использовали мононуклеары периферической крови, выделенные в градиенте плотности фикол-верографина (ρ=1,076–1,078). Клетки культивировали в концентрации 1•10/мл в полной культуральной среде RPMI-1640 (с добавлением 10% эмбриональной телячьей сыворотки и IL-2). На 7-е сутки к клеткам добавляли форболмиристат ацетат для индукции синтеза цитокинов в лимфоцитах в концентрации 20 и 3 мкг/мл иономицина, инкубировали 5 ч при 37 °С и 5% СО2, затем отмывали путем центрифугирования, фиксировали 4% параформальдегидом и пермеабилизировали мембрану 0,1% раствором сапонина. Далее клетки метили с помощью моноклональных антител к поверхностному маркеру СD3 (FITC) и внутриклеточному IFN-γ (PE), как описано выше, и проводили оценку количества СD3+IFN-γ+ клеток на проточном цитофлуориметре FACSCalibur («Becton Dickinson», США) с помощью программы CellQuest-PRO («Becton Dickinson», США).
Для оценки цитотоксической активности (ЦА) в качестве клеток-эффекторов использовали мононуклеары периферической крови, выделенные в градиенте плотности фикол-верографин (ρ=1,076–1,078), а в качестве клеток-мишеней — клетки опухолевой линии К-562 (не экспрессируют МНС І класса) на 2-е сутки после пересева (предоставленная банком клеточных линий из тканей человека и животных Института экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины). Клетки К-562 отмывали в 2 мл ЗФР при 1000–1500 об./мин в течение 5 мин. Затем оценивали их жизнеспособность по окрашиванию раствором 0,1% трипанового синего. Жизнеспособность клеток была не менее 90%. Затем подсчитывали количество клеток-мишеней в камере Горяева и доводили концентрацию клеток до 0,2•10/мл полной культуральной средой RPMI-1640.
Для каждого отдельного исследования использовали 2 пробирки: в контрольную вносили только клетки-мишени, в опытной смешивали клетки-мишени и клетки-эффекторы в соотношении 20:1. Пробы инкубировали в объеме 200 мкл полной культуральной среды RPMI-1640 в течение 24 ч при 37 °С и 5% СО2. После инкубации клеточную суспензию переносили в цитометрические пробирки, добавляли интеркалирующий краситель флюорохром пропидий йодид (PI) в концентрации 2,5 мг/мл. Анализ образцов проводили на проточном цитофлуориметре FACSCalibur («Becton Dickinson», США) с помощью программы CellQuest-PRO («Becton Dickinson», США). ЦА определяли как разницу между количеством мертвых клеток-мишеней в опытной и контрольной пробирках.
Статистическую обработку полученных результатов проводили с помощью программного обеспечения «STATISTICA 8.0» (StatSoft.Inc., 2008). Оценку распределения непрерывных данных в группах проводили с построением диаграмм распределения, а также по критерию Колмогорова — Смирнова. При ненормальном распределении данных сравнение между группами проводили, используя непараметрические методы оценки. Сопоставление количественных показателей между группами выполняли с использованием критерия Манна — Уитни, качественных — двустороннего критерия Фишера. Статистически значимыми считали различия при вероятности ошибки 1-го рода <5% (р<0,05).
Результаты и их обсуждение
При проведении исследования 6 больных в группе О и 4 — в группе Д исключены из анализа в связи с невозможностью забора образцов периферической крови для иммунологического изучения на всех этапах.
При оценке адекватности обезболивания установлено, что средняя интенсивность боли через 12 ч после операции у больных группы О составила 3,6±0,9 балла, группы Д — 3,4±1,1 балла (р=0,5799; Mann — Whitney U-test). Через сутки после операции средняя интенсивность боли при движении в группе О достигла 4,1±1,1 балла, а в группе Д — 3,5±0,9 балла (р=0,0245). Среднесуточная доза комбинации морфина, наркотина, папаверина, кодеина, табеина у пациентов в группе О составила 60 мг, и ни у одного из них не требовалось дополнительного введения анальгетиков. В группе Д ни у одного больного не было необходимости в дополнительном введении опиоидных анальгетиков.
Наши дальнейшие исследования были сфокусированы на изучении влияния периоперационного обезболивания анальгетиками разных групп (алкалоиды опия и декскетопрофен) на состояние клеточного звена иммунной системы у больных раком почки. В частности, оценивали влияние препаратов на количественные показатели субпопуляционного состава и ЦА лимфоцитов периферической крови прооперированных больных.
Одной из наших задач было установить изменения показателей иммунной системы после введения анальгетиков, то есть еще до начала хирургического вмешательства. При оценке количественных изменений популяции CD3+-лимфоцитов отмечали уменьшение их абсолютного количества (рис. 1). Так, у больных группы О на 2-ом этапе исследования количество Т-лимфоцитов уменьшилось на 20,3% по сравнению со значением до премедикации (р<0,05), тогда как в группе Д такое снижение составляло 10% и не было статистически значимым.
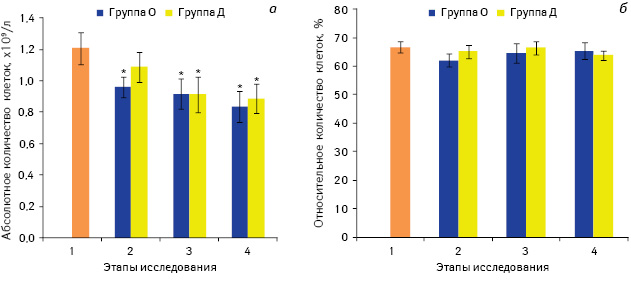
Примечание: *р<0,05 по сравнению со значением до введения препаратов (1-й этап)
Т-клетки составляют большую часть лимфоцитов периферической крови (70–80%), осуществляют как регуляторные, так и эффекторные функции: CD4+ Т-лимфоциты (Т-хелперы, Тх) участвуют в регуляции иммунного ответа; цитотоксические CD8+ Т-лимфоциты, в свою очередь, способны распознавать антигены в комплексе с молекулами МНС І и реализуют киллинг трансформированных клеток, являясь основными эффекторами специфического противоопухолевого иммунного ответа [24, 25].
В некоторых исследованиях показано, что опиоиды способны усиливать апоптоз Т-клеток in vitro через взаимодействие с μ-опиоидными рецепторами, экспрессия которых повышается при активации Т-лимфоцитов [26, 27]. В нашем исследовании уменьшение их количества перед началом операции в группе О можно расценивать как следствие влияния алкалоидов опия, что свидетельствует об иммуносупрессивном эффекте этого препарата.
Следует отметить, что изменения в количестве Т-клеток после премедикации препаратом, содержащим морфин и другие опиоиды, происходило в основном за счет уменьшения количества CD4+ Т-лимфоцитов, абсолютное количество которых сократилось на 25% по сравнению со значением до премедикации (р<0,05) (рис. 2), в то время как изменения в субпопуляции CD8+ Т-лимфоцитов после введения вышеуказанного лекарственного средства были незначительными (рис. 3). Негативное влияние опиоидов на CD4+ клетки продемонстрировано и в некоторых других исследованиях, в которых отмечено значительное сокращение количества Тх у больных онкологического профиля с хронической болью, которые принимали морфин в высоких дозах [28].
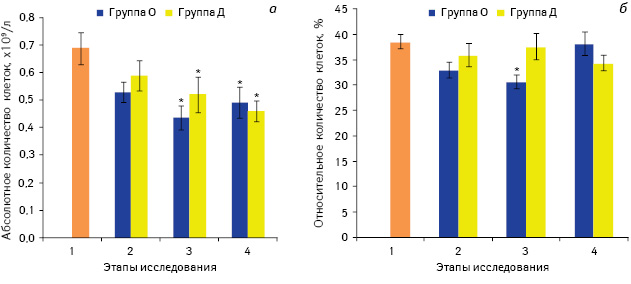
Примечание *р<0,05 по сравнению со значением до введения препаратов (1-й этап)
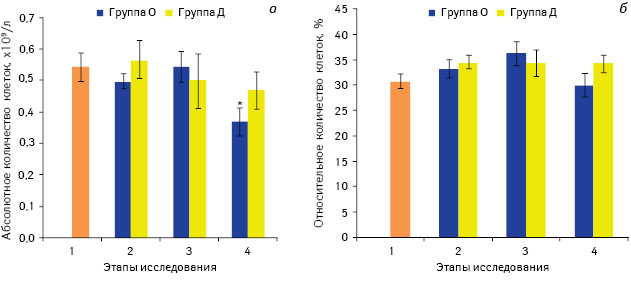
Примечание: *р<0,05 по сравнению со значением до введения препаратов (1-й этап)
На сегодня также известно, что влияние опиоидов на Тх1 и Тх2 клетки имеет разнонаправленный характер. Так, опиаты повышают продукцию IL-4, который способствует дифференциации СD4+ клеток в Тх2 и усиливают на них экспрессию μ-опиоидных рецепторов, повышая чувствительность Тх2 к опиоидным пептидам [18, 29]. С другой стороны, опиоиды способны угнетать пролиферацию Тх1 и снижать экспрессию INF-γ как в Тх1 [18], так и в ЦТЛ [27].
INF-γ является одним из ключевых цитокинов в противоопухолевом иммунном ответе. Он способствует развитию Тх1-зависимого иммунного ответа, усиливает активность ЦТЛ, антигенпрезентирующих клеток и синтез других провоспалительных цитокинов, повышает экспрессию МНС І на опухолевых клетках [30].
Таким образом, опиоидные пептиды могут способствовать смещению цитокинового баланса в сторону развития иммунного ответа по Тх2-типу, угнетая тем самым клеточный иммунный ответ. Исходя из этого, мы провели оценку продукции INF-γ Т-лимфоцитами периферической крови больных раком почки в динамике периоперационного периода (рис. 4).
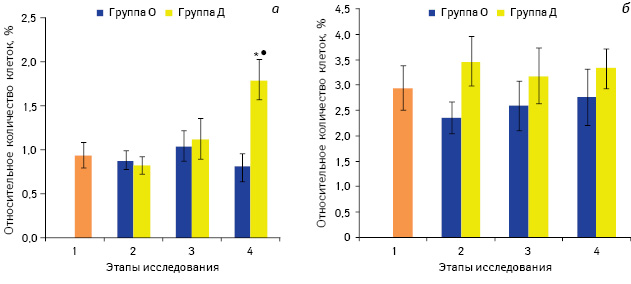
Примечание: *р<0,05 по сравнению со значением до введения препаратов (1-й этап); •р<0,05 по сравнению со значением в группе О
Спонтанная секреция INF-γ Т-лимфоцитами в обеих группах практически не изменялась после премедикации и после хирургического вмешательства, тогда как на 3-и сутки после операции в группе Д отмечали значительное увеличение количества INF-γ-продуцирующих Т-клеток — до 1,79±0,26% (рис. 4, а), что было в 2,2 раза выше соответствующего значения у больных в группе О (р<0,05). Также при применении декскетопрофена, в отличие от смеси алкалоидов опия, проявлялась тенденция к незначительному повышению показателей стимулированной секреции IFN-γ CD3+ лимфоцитами. Возможно, существенное возрастание количества IFN-γ+ CD3+ клеток на 4-м этапе исследования связано со способностью декскетопрофена ингибировать синтез PGE2, который вовлечен в формирование опухолеассоциированной иммуносупрессии. Одним из эффектов PGE2 на клетки иммунной системы является угнетение экспрессии цитокинов Тх1-профиля, в том числе и INF-γ [31, 32]. Можно предположить, что декскетопрофен нивелирует негативное влияние PGE2 на секрецию INF-γ Т-клетками и, соответственно, на развитие клеточного иммунного ответа.
В настоящее время НКК рассматривают как отдельный класс лимфоцитов, которые являются одними из основных компонентов врожденного клеточного иммунитета. Функцией этих клеток в иммунной системе является обнаружение и уничтожение чужеродных или трансформированных клеток, в том числе опухолевых с низким уровнем экспрессии молекул MHC I на своей поверхности, недоступных для действия ЦТЛ [33].
В нашем исследовании установлено, что опиоидный анальгетик, который является комбинацией морфина, наркотина, папаверина, кодеина, тебаина, оказывает более выраженное влияние на количество и функциональную активность НКК по сравнению с декскетопрофеном (рис. 5). Абсолютное количество СD16+ лимфоцитов у больных в группе О на 3-и сутки после операции уменьшено на 52%, а относительное — на 29% по сравнению с 1-м этапом исследования (р<0,05). В то же время у больных в группе Д относительное количество СD16+ клеток на 3-и сутки после операции практически не отличалось от исходного значения, а абсолютное количество хоть и уменьшалось, но все же в 1,5 раза превышало соответствующее значение у пациентов в группе О (р<0,05).

Примечание: *р<0,05 по сравнению со значением до введения препаратов (1-й этап); •р<0,05 по сравнению со значением в группе О
Сокращение количества НКК у больных в группе О сопровождалось также значительным угнетением их ЦА. Так, ЦА НКК еще до операции снизилась с 28,4±3,2 до 20,5±2,9% после использования смеси алкалоидов опия в премедикации (р<0,05), в то время как при применении декскетопрофена ЦА снизилась незначительно и составляла 26,3±3,0%. На последующих этапах существенное снижение ЦА происходило у больных обеих групп и было более выражено в группе О. Так, на 3-и сутки после операции ЦА лимфоцитов у больных в группе Д была в 1,6 раза выше, чем в группе О (р<0,05).
Сохранение функции одного из основных эффекторов противоопухолевой защиты — НКК — при применении НПВП может иметь принципиальное значение в периоперационном обезболивании у пациентов онкологического профиля. Выраженное угнетение функциональной активности НКК в периоперационный период может значительно нарушать механизмы противоопухолевой защиты [34, 35]. В других исследованиях выявлено значительную корреляционную зависимость между активностью НКК в послеоперационный период и прогнозом развития метастазов [36]. Важность поддержания высокой функциональной активности НКК в противоопухолевой защите организма подтверждается в исследованиях других авторов при использовании некоторых иных анальгетиков.
Так, в исследовании [37] показано, что у животных с опухолью при использовании фентанила значительно ухудшалась функция НКК и увеличивалось количество метастазов в легких по сравнению с кетамином и клонидином. Сходные результаты, свидетельствующие о негативном влиянии анальгетиков на функции НКК, получены при сравнении эффективности морфина и трамадола у больных раком тела матки [38].
Заключение
Применение опиоидного анальгетика — комбинации морфин + наркотин + папаверин + кодеин + тебаин — способствует уменьшению количества Т-клеток и снижению ЦА НКК у больных раком почки еще до начала хирургического вмешательства, в то время как при обезболивании НПВП декскетопрофеном эти показатели практически не изменяются. При применении декскетопрофена послеоперационная иммуносупрессия носит менее выраженный характер, чем при использовании смеси алкалоидов опия, что проявляется более высоким уровнем IFN-γ-продуцирующих Т-клеток, НКК и их ЦА. Принимая во внимание то, что клеточное звено иммунной системы играет основную роль в реализации противоопухолевого иммунного ответа, обеспечивая общую противоопухолевую резистентность организма, представляется перспективным использование декскетопрофена в качестве альтернативы опиоидным анальгетикам при периоперационном обезболивании у пациентов онкологического профиля.
Список использованной литературы
1. Dunn G., Old L., Schreiber R. (2004) The immunobiology of cancer іmmunosurveillance and immunoediting. Immunity, 21: 137–148.
2. Kurosawa S. (2012) Anesthesia in patients with cancer disorders. Curr. Opin. Anesthesiol., 25: 376–384.
3. Kurosawa S., Kato M. (2008) Anesthetics, immune cells, and immune responses. J. Anesth., 22: 263–277.
4. Michael D., Brigitte V. (2004) Surgical trauma: hyperinflammation versus immunosuppression? Langenbecks Arch. Surg., 389: 475–484
5. Shimaoka M., Hosotsubo K., Sugimoto M. et al. (1998) The influence of surgical stress on T cells: enhancement of early phase lymphocyte activation. Anesth. Analg., 87: 1431– 5.
6. Гриневич Ю.А., Барабой В.А. (2010) Новообразовательный процесс и стрессовая патология. К: Логос, 155 с.
7. Meiler S. (2006) Long-term outcome after anesthesia and surgery: remarks on the biology of a newly emerging principle in perioperative care. Anesthesiol. Clin., 24: 255–278.
8. Homburger J., Meiler S. (2006) Anesthesia drugs, immunity, and long-term outcome. Curr. Opin. Anesthesiol., 19: 423–428.
9. Kusmartsev S., Gabrilovich D. (2006) Immature myeloid cells and cancer-associated immune suppression. Cancer Immunol. Immunother., 51: 293–8.
10. Serafini P., De Santo C., Marigo I. et al. (2004) Derangement of immune responses by myeloid suppressor cells. Cancer Immunol. Immunother., 53: 64–72.
11. Page G.G. (2005) Surgery-induced immunosuppression and postoperative pain management. AACN Clin., 16: 302– 9.
12. Procopio M.A., Rassias A.J., DeLeo J.A. et al. (2001) The in vivo effects of general and epidural anesthesia on human immune function. Anesth. Analg., 93: 460– 5.
13. Al-Hasani R., Bruchas M. (2011) Molecular mechanisms of opioid receptor dependent signaling and behavior. Anesthesiol., 115: 1363–1381.
14. Martin J., Koodie L., Krishnan A. et al. (2010) Chronic morphine administration delays wound healing by inhibiting immune cell recruitment to the wound site. Am. J. Pathol., 176: 786–799.
15. Yuan F., Xiaozhou H., Yilin Y. (2012) Current research on opioid receptor function. Curr. Drug Targets, 13(2): 230–246.
16. Welters I., Menzebach A., Goumon Y. et al. (2000) Morphine suppresses complement receptor expression, phagocytosis, and respiratory burst in neutrophils by a nitric oxide and µ3 oipate receptor-dependent mechanism. J. Neuroimmunol., 111: 139–145.
17. Mojadadi S., Jamali A., Khansarinejad B. et al. (2009) Acute morphine administration reduces cell-mediated immunity and induces reactivation of latent herpes simplex virus type 1 in BALB/c mice. Cell. Mol. Immunol., 6: 111–116.
18. Bӧrner C., Warnick B., Smida M. et al. (2011) Mechanisms of opioid-mediated inhibition of human T cell receptor signaling. J. Immunol., 183: 882–889.
19. Wang J., Barke R., Charboneau R. et al. (2003) Morphine negatively regulates interferon-gamma promoter activity in activated murine T cells through two distinct cyclic AMP-dependent pathways. J. Biol. Chem., 278: 37622–37631.
20. Bӧrner C., Kraus J., Bedini A. et al. (2008) T-cell receptor/CD28-mediated activation of human T lymphocytes induces expression of functional µ-opioid receptors. Mol. Pharmacol., 74: 496–504.
21. Sacerdote P. (2008) Opioid-induced immunosuppression. Curr. Opin. Support. Palliat. Care, 2: 14–18.
22. Sjodahl R. (2001) Nonsteroidal anti-inflammatory drugs and the gastrointestinal tract. Extent, mode, and dose dependence of anticancer effects. Am. J. Med., 110(1A): 66–69.
23. González-Pérez А., Luis A., Rodríguez G. (2003) Effects of non-steroidal anti- inflammatory drugs on cancer sites other than the colon and rectum: a meta-analysis. BMC Cancer, 3: 28.
24. Бережная Н.М., Чехун В.Ф. (2005) Иммунология злокачественного роста. К: Наукова думка: 125–128.
25. Murphy K. (2012) Janeway’s Immunobiology. Garland Science, 8 ed.
26. Kurosawa Sh., Kato M. (2008) Anesthetics, immune cells, and immune responses. J. Anesth., 22: 263–277.
27. Mizota T., Tsujikawa H., Shoda T. (2013) Dual modulation of the T-cell receptor-activated signal transduction pathway by morphine in human T lymphocytes. J. Anesth., 27: 80–87.
28. Hashiguchi S., Morisaki H., Kotake Y., Takeda J. (2005) Effects of morphine and its metabolites on immune function in advanced cancer patients. J. Clin. Anesthesia, 17: 575–580.
29. Бережная Н.М. (2013) Семейства интерлейкинов. Биология и онкогенез. К.: Наукова думка, 576 с.
30. Munegowda M., Xua S., Freywaldb A. et al. (2012) CD4+Th2 cells function alike effector Tr1 and Th1 cells through the deletion of a single cytokine IL-6 and IL-10 gene. Mol. Immunol., 51: 143–149.
31. Jiang J. Dingledine R. (2013) Prostaglandin receptor EP2 in the crosshairs of anti-inflammation, anti-cancer, and neuroprotection. Trends Pharmacol. Sci., 34(7): 413–423.
32. Возианов А.Ф., Бутенко А.К., Зак К.П. (1998) Цитокины. Биологические и противоопухолевые свойства. К.: Наукова думка, 316 с.
33. Зак К.Л., Киндзельский Л.П., Бутенко А.К. (1992) Большие гранулосодержащие лимфоциты в патологии. К.: Наукова думка, 164 с.
34. Stresstips.com article – physical effects of stress on the body, KEITH HILLMAN, 188(7): 7884p.
35. Shakhar G., Ben-Eliyahu S. (2003) Potential prophylactic measures against postoperative immunosuppression: Could they reduce recurrence rates in oncological patients? Ann. Surg. Oncol., 10(8): 972–92.
36. Page G.G., Ben-Eliyahu S. (2002) Indomethacin attenuates the immunosuppressive and tumor-promoting effects of surgery. J. Pain, 3: 301–8.
37. Gutkin D., Shurin M. (2014) Clinical evaluation of systemic and local immune responses in cancer: time for integration. Cancer Immunol. Immunother., 63(1): 45–57.
38. Forget P., Collet V., Lavand’homme P., de M. Kock (2010) Does analgesia and condition influence immunity after surgery? Effects of fentanyl, ketamine and clonidine on natural killer activity at different ages. Eur. J. Anaesthesiol., 27: 233–240.
39. Sacerdote P., Bianchi M., Gaspani L. et al. (2000) The effects of tramadol and morphine on immune responses and pain after surgery in cancer patients. Anesth. Analg., 90(6): 1411–1414.
Адрес:
Лесной Иван Иванович
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака
E-mail: woodmanivan@yahoo.com














Leave a comment