Порівняльна оцінка протипухлинної ефективності алогенних та ксеногенних вакцин, модифікованих за допомогою білоквмісних метаболітів B. subtilis B-7025
Кузьменко О.П., Діденко Г.В. , Шпак Є.Г., Потебня Г.П.
Резюме. Проведено порівняльні дослідження протипухлинної ефективності алогенних і ксеногенних вакцин на тваринах з карциномою легені Льюїс. Показано високу ефективність ксеногенних вакцин, створених на основі курячих ембріональних білків, що проявилася достовірним гальмуванням росту первинної пухлини (на 50–90%) і віддаленого метастазування карциноми легені Льюїс. Протипухлинний ефект відзначали як в умовах хірургічного видалення пухлини, так і без оперативного втручання. Ці результати суттєво відрізнялися від даних, отриманих при застосуванні алогенних вакцин, виготовлених на основі таких самих ад’ювантів та пухлиноасоційованих антигенів, які викликали значний антиметастатичний ефект лише за умови видалення первинної пухлини. Одним із можливих механізмів протипухлинної дії вакцин, створених на основі ембріональних білків, є індукція протипухлинних антитілозалежних реакцій лімфоцитів та макрофагів — аутологічна сироватка крові вакцинованих тварин вірогідно підвищує (на 50–100%) цитотоксичність клітин-ефекторів.

Вступ
На сьогодні проблема лікування хворих зі злоякісними новоутвореннями залишається актуальною, що зумовлено як високою захворюваністю, так і недостатньою ефективністю терапії. Причина криється у тому, що традиційні методи лікування (хірургія, променева та хіміотерапія) майже досягли межі свого розвитку та за останні десятиріччя суттєво не покращили показники виживаності пацієнтів онкологічного профілю. Іншим суттєвим чинником гальмування ефективності традиційної протипухлинної терапії є природна або набута лікарська резистентність пухлинних клітин. Можливо, це і зумовило зростання інтересу дослідників до методів біотерапії, зокрема імунотерапії, хворих на рак [1–3]. Одним із перспективних підходів до вирішення цієї проблеми є застосування протипухлинних вакцин, виготовлених на основі пухлиноасоційованих антигенів (ПАА), дія яких ґрунтується на формуванні специфічних реакцій протипухлинного імунітету [4, 5]. Але більшість ПАА мають низьку імуногенність, що зумовлює необхідність пошуку різноманітних шляхів її підвищення. Одним із них є посилення імунної відповіді на ПАА за рахунок їх модифікації продуктами мікробного синтезу [3, 6, 7]. Іншим способом підвищення імуногенності протипухлинних вакцин є використання ксеногенного матеріалу. Перспективними в такому разі є ембріональні білки. Відомо, що вони містять ділянки, гомологічні таким, що входять до складу пухлинних білків [8]. Використання антигенної подібності ракових та ембріональних тканин може стати багатообіцяльним напрямом для розробки ефективних підходів до імунотерапії пухлинної хвороби [9]. Тому основною метою цих досліджень була порівняльна оцінка протипухлинної ефективності алогенних та ксеногенних вакцин на основі білоквмісних метаболітів (БМ) B. subtilis В-7025 в експерименті.
Об’єкт і методи дослідження
Досліди проводили на 110 мишах-самцях лінії С57В1/6 віком 2 міс, масою тіла 18–20 г. Як модельну пухлину використовували метастазуючу карциному легені Льюїс (КЛЛ). Тварин одержали із розплідника віварію Інституту експериментальної патології, онкології та радіобіології ім. Р.Є. Кавецького НАН України. Усі дослідження на тваринах здійснювали відповідно до вимог регіонального Комітету з етики роботи з піддослідними тваринами та з додержанням правил роботи з лабораторними тваринами (Закон України «Про захист тварин від жорстокого поводження» від 21.02.2006 № 3447-1V, ст. 26).
Досліджували протипухлинну активність вакцин, створених на основі курячих ембріональних білків (КЕБ) 7-ї доби гестації, та БМ B. subtilis В-7025 з молекулярною масою 18,5 та 70 кДа як ад’ювантів (ксеновакцина). Протипухлинну ефективність їх застосування порівнювали з традиційними протипухлинними вакцинами, виготовленими за допомогою зазначених ад’ювантів на основі гомологічних клітин КЛЛ (алогенна вакцина). Вакцини застосовували як самостійно, так і в комбінації з хірургічним видаленням пухлини (ХВП). Пухлинні клітини перещеплювали в стопу тварин із розрахунку 105 клітин/тварину за стандартною методикою. На 18-ту добу після перещеплення, коли первинна пухлина становила 0,6±0,2 см в діаметрі, проводили оперативне видалення стопи з пухлиною під етамінал-натрієвим наркозом (40 мг/кг). Сформовані такі групи: 1 — контроль пухлинного росту; 2 — алогенна вакцина (КЛЛ + БМ 18,5 кДа); 3 — алогенна вакцина (КЛЛ + БМ 70 кДа); 4 — ксеногенна вакцина (КЕБ + БМ 18,5 кДа); 5 — ксеногенна вакцина (КЕБ + БМ 70 кДа); 6 — ХВП; 7 — ХВП + алогенна вакцина (КЛЛ + БМ 18,5 кДа); 8 — ХВП + алогенна вакцина (КЛЛ + БМ 70 кДа); 9 — ХВП + ксеногенна вакцина (КЕБ + БМ 18,5 кДа); 10 — ХВП + ксеногенна вакцина (КЕБ + БМ 70 кДа). Вакцинацію тварин проводили тричі: через 1; 3 та 7 діб після ХВП. Миші 2–5-ї груп (без ХВП) у відповідний термін одержували вакцину в аналогічному введенні. КЕБ, отримані методом ЕДТА-екстракції [10], та вакцини, виготовлені на їх основі (ксеногенні), вводили підшкірно (концентрація білка 0,3 мг/мл, по 0,3 мл/тварину на 1 ін’єкцію) [11]. Вакцини на основі клітин КЛЛ (алогенні) готували з розрахунку 106 клітин на 0,3 мг/мл розчину відповідного метаболіту B. subtilis В-7025 і вводили по 0,3 мл/тварину на 1 ін’єкцію [12]. Концентрація білка була такою самою, як і в першому випадку.
Протипухлинний ефект досліджуваних вакцин оцінювали на 34-ту добу після перещеплення пухлини за масою первинної пухлини, індексом гальмування маси первинної пухлини та кількістю метастазів у легенях тварин.
Дослідження змін імунної системи у тварин із застосуванням алогенних та ксеногенних вакцин проводили на момент забою (34-та доба після перещеплення). Реактивність сироваток крові досліджували за допомогою імуноферментного аналізу (ІФА) як проти білків, одержаних з гомологічної пухлини (КЛЛ), так і проти КЕБ. Отримані результати виражали в умовних оптичних одиницях (ум.опт.од). Визначали пряму цитотоксичну активність (ЦТА) та антитілозалежну цитотоксичну активність (АЗЦА) лімфоцитів крові та перитонеальних макрофагів у МТТ-тесті з використанням мікроплейтфотометра «Лаботек» (Латвія) при довжині хвилі 545 та 630 нм відповідно [8]. Вплив застосованих ксеногенних та алогенних вакцин на ЦТА та АЗЦА лімфоцитів і макрофагів оцінювали за цитологічним індексом (ЦІ) та індексом потенціювання (ІП) [13].
Результати експериментальних досліджень опрацьовували з використанням пакетів програм Origin 7.5 та Statistica 6.0 (критерії Стьюдента — Фішера та χ).
Результати та їх обговорення
На рис. 1 представлено дані про вплив застосованих вакцин на масу первинної пухлини КЛЛ. Використання всіх досліджуваних вакцин супроводжувалося вірогідним гальмуванням пухлинного росту порівняно з контрольними мишами. При цьому ефект від введення ксеновакцини не тільки не поступався, але й перевищував результат застосування алогенної вакцини. Слід зазначити, що вірогідною (р<0,05) була й різниця між застосуванням бактеріальних ад’ювантів — кращі результати були притаманні саме вакцинам, виготовленим за допомогою БМ із молекулярною масою 70 кДа. Подібні закономірності зафіксовано й при аналізі результатів метастазування в легені у неоперованих мишей (рис. 2, а): ксеногенні вакцини вірогідно знижували частоту метастазування — від 100% у контрольній групі до 37,5 та 30% — у дослідних групах, якщо вакцини містили БМ B. subtilis В-7025 18,5 та 70 кДа (р<0,05). Аналогічні показники для алогенних вакцин значно поступалися і становили 100 та 66,7%. В оперованих мишей (рис. 2, б) відзначали дещо іншу картину, а саме — не виявлено суттєвої різниці між використанням алогенних та ксеногенних вакцин.
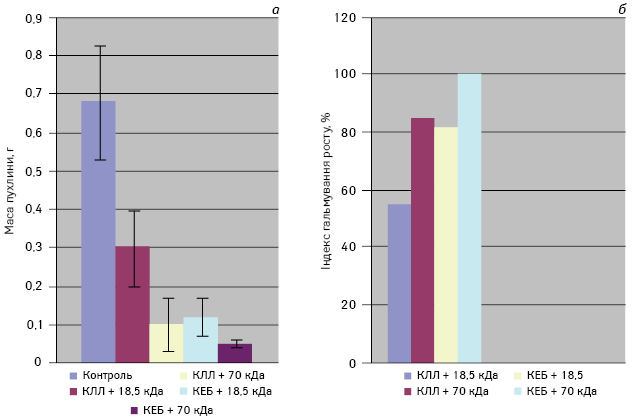
Слід підкреслити, що застосування всіх досліджуваних вакцин після видалення первинної пухлини сприяло значному підвищенню протипухлинної ефективності порівняно з даними тільки оперованих мишей (див. рис. 2, б). При цьому найнижчу частоту метастазування (12,5%) відмічали у тварин із ХВП та застосуванням ксеновакцини з БМ B. subtilis В-7025 (70 кДа), але цей ефект статистично не відрізнявся від застосування аутовакцини (20 та 22,2%; р>0,05). Порівнюючи результати, одержані при введенні вакцин без ХВП або з ХВП, легко помітити різницю в протипухлинній ефективності між алогенними та ксеногенними вакцинами (рис. 2). Так, ХВП сприяло зростанню протиметастатичної ефективності алогенної вакцини — частота метастазування знижувалася зі 100 та 66,7% до 20 та 22,2% (з БМ 18,5 та 70 кДа відповідно; p<0,05) — і практично не впливало на аналогічні показники при введенні ксеновакцин з БМ 18,5 та 70 кДа (37,5 та 30% проти 40 та 12,5% відповідно). Ці дані підтверджуються і результатами, одержаними іншими авторами [14–16], які показали, що ксеновакцини можуть бути ефективними навіть за наявності в організмі значної пухлинної маси, тоді як звичайні аутологічні та алогенні вакцини здатні до індукції повноцінної протипухлинної відповіді лише після видалення первинної пухлини.
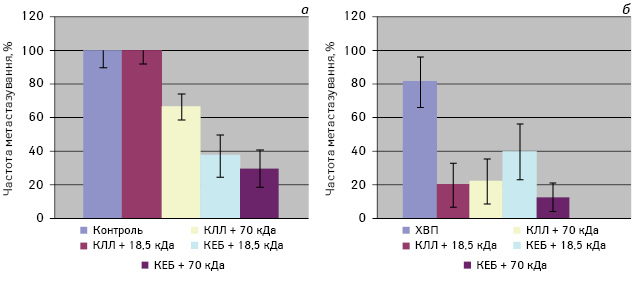
При аналізі даних про середню кількість метастазів КЛЛ після введення різних вакцин можна відмітити, що у неоперованих мишей (рис. 3, а) застосування ксеногенних та алогенних вакцин призводило до суттєвого зменшення кількості метастазів порівняно з контролем (р≤0,05). Щодо оперованих мишей (рис. 3, б), то саме видалення пухлини супроводжувалося значним зменшенням кількості метастазів (3,6±0,8) порівняно з неоперованими тваринами (34,1±7,9) (р<0,05). При введенні ксеногенних вакцин у оперованих мишей реєстрували вірогідне зменшення кількості метастазів порівняно з неоперованими особинами, які також отримували ксеновакцину (p<0,05). Відзначено тенденцію (р≤0,05) до зменшення кількості метастазів також при застосуванні аутовакцини, модифікованої за допомогою БМ 18,5 кДа (1,1±1,0).
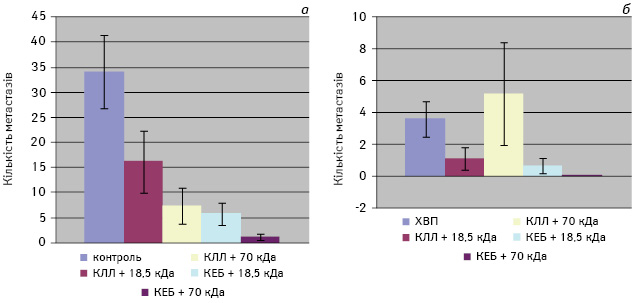
Таким чином, аналіз результатів дослідження дозволяє зробити висновок про високу ефективність ксеногенних вакцин, модифікованих БМ B. subtilis B-7025 18,5 та 70 кДа, а саме — вірогідним гальмуванням як об’єму первинної пухлини, так і віддаленого метастазування КЛЛ. Подібний ефект досягався як в умовах ХВП, так і без проведення операції. Це відрізняло дію ксеногенних вакцин від алогенних, які викликали значну протиметастатичну дію лише за умови видалення первинної пухлини.
Отже, застосування ксеновакцин на основі КЕБ 7-ї доби гестації, модифікованих БМ B. subtilis В-7025 (18,5 та 70 кДа), призводило до значного гальмування пухлинного процесу (особливо метастатичного) у мишей із КЛЛ. Важливо відмітити, що введення вакцин починали тоді, коли первинна пухлина досягала 5–8 мм в діаметрі (18-та доба після перещеплення). Найбільш виражений протипухлинний ефект фіксували при комбінованому проведенні ХВП та подальшої вакцинації. Але слід підкреслити і досить високі результати протипухлинної ефективності використаних ксеногенних вакцин на основі КЕБ, навіть без видалення первинної пухлини, коли застосування алогенних вакцин на основі ПАА було недостатньо ефективним. Важливим, на наш погляд, було й те, що використання ксеногенних вакцин значно поліпшувало результати терапії порівняно з основним методом лікування в онкології — ХВП. Одним із можливих механізмів зазначеного нами протипухлинного ефекту вакцинації могла бути активація ЦТА лімфоцитів та макрофагів.
Реактивність сироваток крові мишей досліджували за допомогою ІФА на 34-ту добу після прищеплення КЛЛ, як проти білків, одержаних з клітин гомологічної пухлини, так і проти КЕБ (табл. 1). У всіх дослідних мишей з перещепленою КЛЛ рівень антитіл до КЛЛ вірогідно перевищував такий у інтактних тварин (р≤0,05). При цьому достовірно підвищений порівняно з контрольною групою рівень антитіл на антигени КЛЛ зареєстровано в оперованих та неоперованих мишей, які одержували алогенну вакцину на основі клітин КЛЛ та БМ 18,5 кДа, а також у групі неоперованих тварин, яким вводили ксеновакцину на основі КЕБ, модифіковану БМ 70 кДа. Слід відзначити, що в оперованих мишей із КЛЛ, яким вводили алогенні вакцини, створені на основі клітин КЛЛ, відзначали високий рівень антитіл до КЕБ, що може бути пояснено гомологічною подібністю антигенів КЛЛ до КЕБ. На користь цього припущення свідчить і те, що у мишей, яким вводили аналогічні вакцини після ХВП (відсутність антигенного осередку), також відзначали високу перехресну реактивність до КЕБ при дослідженні сироваток крові методом ІФА.
Таблиця 1. ІФА сироваток крові (титр 1:20) у оперованих та неоперованих мишей проти антигенів КЛЛ та КЕБ при застосуванні алогенних та ксеногенних вакцин, модифікованих
за допомогою метаболітів B. subtilis B-7025 з молекулярною масою 18,5 та 70 кДа
| Група тварин | ІФА сироваток крові проти антигенів КЛЛ у вакцинованих мишей із КЛЛ, ум.опт.од. | ІФА сироваток крові проти антигенів КЕБ у вакцинованих мишей із КЛЛ, ум.опт.од. |
| Контроль | 0,63±0,04 | 1.89±0,11 |
| ХВП | 0,68±0,07 | 1,39±0,15* |
| КЛЛ + 18,5 кДа | 0,80±0,02* | 2,68±0,06* |
| КЛЛ + 70 кДа | 0.66±0,01 | 2,23±0,12* |
| КЕБ + 18,5 кДа | 0,67±0,04 | 1,83±0.14 |
| КЕБ + 70 кДа | 0,87±0,44* | 1,8±0,12 |
| ХВП + (КЛЛ + 18,5 кДа) | 0,83±0,03* | 2,17±0,14 |
| ХВП + (КЛЛ + 70 кДа) | 0,68±0,05 | 2,29±0,08* |
| ХВП + (КЕБ +18,5 кДа) | 0,62±0,03 | 1,29±0,11* |
| ХВП + (КЕБ + 70 кДа) | 0,61±0,05 | 1,38±0,07 |
| Інтактні миші | 0,49±0,02** | 1,55±0,04 |
*р<0,05 порівняно з контролем; **р<0,05 порівняно з групами, у яких застосовували алогенну вакцину.
Дослідження у відповідний термін протипухлинної ЦТА лімфоцитів (клітини-мішені — КЛЛ) показало її вірогідне підвищення порівняно з контролем (табл. 2) у неоперованих мишей, які одержували ксеновакцину на основі (КЕБ + 70 кДа) 36,03±1,26 та 24,84±0,64%; p<0,05). Слід підкреслити, що цей ефект перевищував досягнутий внаслідок застосування алогенних вакцин, виготовлених із клітин КЛЛ. У оперованих мишей навпаки, на відміну від решти вакцинованих мишей, використання ксеновакцини (КЕБ + 70 кДа) не сприяло зростанню ЦТЛ (23,26±3,80%). У цьому випадку підвищення ЦТА лімфоцитів спостерігалося у мишей, яким вводили ксеновакцину, модифіковану за допомогою БМ 18,5 кДа (35,72±2,73%). Визначення АЗЦА лімфоцитів показало (див. табл. 2), що додавання аутологічної сироватки крові призводило до підвищення показників у всіх вакцинованих тварин, окрім групи мишей, які отримували алогенну вакцину на основі клітин КЛЛ, модифіковану БМ В. subtilis B-7025 18,5 кДа. Вона збігається зі слабким антиметастатичним ефектом даної вакцини — зменшенням кількості метастазів лише в 2 рази порівняно з контролем і відсутністю суттєвого впливу на частоту виникнення метастазів.
Таблиця 2. Протипухлинна ЦТА лімфоцитів у оперованих і неоперованих мишей із КЛЛ після застосування алогенних і ксеногенних вакцин, модифікованих за допомогою метаболітів B. subtilis B-7025 із молекулярною масою 18,5 та 70 кДа
| Група тварин | ЦТА лімфоцитів, ЦІ, % | АЗЦА лімфоцитів, ЦІ, % | Потенціювання сироваткою ЦТА лімфоцитів, ІП, % |
| Контроль | 24,84±0,64 | 24,26±0,35 | −2,32 |
| ХВП | 26,25±4,54 | 34,31±2,58* | 30,70 |
| КЛЛ + 18,5 кДа | 28,51±5,64 | 29,81±3,81 | 4,56 |
| КЛЛ + 70,0 кДа | 27,19±0,93 | 42,42±2,69* | 35,90 |
| КЕБ + 18,5 кДа | 29,09±3,51 | 46,25±3,66* | 59,01 |
| КЕБ + 70 кДа | 36,03±1,26* | 46,36±1,27* | 28,67 |
| ХВП + (КЛЛ + 18,5 кДа) | 33,26±0,96* | 40,04±1,62* | 20,38 |
| ХВП + (КЛЛ + 70 кДа) | 33,78±2,38* | 44,84±1,62* | 32,75 |
| ХВП + (КЕБ + 18,5 кДа) | 35,72±2,73* | 46,73±4,30* | 30,84 |
| ХВП + (КЕБ + 70 кДа) | 23,26±3,80 | 43,36±2,29* | 86,40 |
*р<0,05 порівняно з контролем.
У цілому, можна відмітити той факт, що АЗЦА лімфоцитів мишей, які одержували ксеновакцини, не поступалася показникам у мишей, яким ввели алогенні вакцини. Більш того, оцінка впливу аутологічних сироваток крові мишей на ЦТА лімфоцитів за ІП показала найбільш значне зростання потенціюючого впливу саме при застосуванні ксеногенних вакцин на основі ембріональних білків курки. У неоперованих мишей вищим був ІП, якщо для виготовлення ксеновакцини використовували БМ В. subtilis B-7025 18,5 кДа (59,01%), а при ХВП — БМ В. subtilis B-7025 70 кДа (86,40%). Якщо ж вакцини готували з клітин гомологічної пухлини (алогенні), то при ХВП і без нього переваги відзначено при використанні БМ В. subtilis B-7025 70 кДа. Механізми такого ефекту потребують подальшого вивчення.
При аналізі даних про ЦТА перитонеальних макрофагів було з’ясовано, що використання деяких із досліджених вакцин призводить до її підвищення (табл. 3). Так, без ХВП вірогідне підвищення цього показника спостерігали при застосуванні алогенних та ксеногенних вакцин, модифікованих за допомогою БМ 18,5 кДа (45,72±3,60 і 44,50±1,58% проти 25,73±1,19% у контролі; p<0,05). При ХВП — найбільші значення ЦТА макрофагів відмічали при застосуванні ксеновакцини (КЕБ + 70,0 кДа) (42,47±1,67%; p<0,05). Цікаво, що введення алогенної та ксеногенної вакцин, виготовлених із застосуванням БМ 18,5 кДа після ХВП майже не впливало на ЦТА макрофагів. Однак у цьому випадку відбувалася значна стимуляція АЗЦА макрофагів при додаванні аутологічної сироватки крові (ІП=46,02 та 64,78%). Слід підкреслити, що потенціювання сироваткою крові ЦТА макрофагів відбувалося у всіх вакцинованих мишей із ХВП, тоді як у групі невакцинованих мишей із ХВП та в контролі пухлинного росту проходила негативна реакція (ІП=−20,53 і −38,95%). Введення досліджуваних вакцин без видалення пухлини, як правило, також призводило до негативного впливу аутологічної сироватки крові на ЦТА макрофагів; особливо це стосувалося алогенних вакцин, модифікованих БМ 18,5% (ІП=−41,33%). Саме в цій групі мишей сироватка крові сприяла найменшим змінам ЦТА лімфоцитів (див. табл. 2). Отримані дані опосередковано можуть вказувати на те, що в сироватці крові неоперованих мишей накопичуються специфічні антитіла, які блокують поверхневі білки пухлинних клітин-мішеней. Крім того, слід підкреслити переваги в протипухлинній ефективності ксеногенної вакцини на основі КЕБ над алогенною вакциною, особливо в схемах без ХВП. Цю закономірність відзначали і при застосуванні після ХВП ксеновакцин на основі КЕБ, модифікованих БМ 70 кДа.
Таблиця 3. Протипухлинна ЦТА перитонеальних макрофагів у оперованих і неоперованих мишей із КЛЛ після застосування алогенних і ксеногенних вакцин, модифікованих за допомогою метаболітів B. subtilis B-7025 із молекулярною масою 18,5 та 70 кДа
| Група тварин | ЦТА макрофагів, ЦІ, % | АЗЦА макрофагів, ЦІ, % |
Потенціювання сироваткою ЦТА макрофагів, ІП, % |
| Контроль | 25,73±1,19 | 15,71±2,35 | −38,95 |
| ХВП | 29,68±2,28 | 23,58±1,60 | −20,53 |
| КЛЛ + 18,5 кДа | 45,72±3,60* | 26,82±3,70* | −41,33 |
| КЛЛ + 70,0 кДа | 29,17±1,53 | 26,31±1,20* | −9,78 |
| КЕБ + 18,5 кДа | 44,50±1,58* | 39,42±2,91* | −11,43 |
| КЕБ + 70 кДа | 35,76±2,11 | 38,92±2,71* | 8,84 |
| ХВП + (КЛЛ + 18,5 кДа) | 26,02±1,30 | 37,99±1,81* | 46,02 |
| ХВП + (КЛЛ + 70,0 кДа) | 29,18±4,40 | 34,54±0,80* | 18,37 |
| ХВП + (КЕБ + 18,5 кДа) | 25,08±2,75 | 41,32±2,09* | 64,78 |
| ХВП + (КЕБ + 70,0 кДа) | 42,47±1,67* | 52,71±2,73* | 19,43 |
*р<0,05 порівняно з контролем.
Висновки
1. Показано високу ефективність ксеногенних вакцин, створених на основі КЕБ, а саме — вірогідне гальмування об’єму первинної пухлини (на 50–90%) та метастазування КЛЛ. Подібний ефект відзначали як у тварин з хірургічно видаленою пухлиною, так і без оперативного втручання. Це відрізняло дію цих вакцин від алогенних, створених за допомогою аналогічних ад’ювантів на основі ПАА, які викликали значний антиметастатичний ефект лише за умови видалення первинної пухлини.
2. Встановлено, що одним з основних механізмів протипухлинної дії вакцин, створених на основі ксеногенних ембріональних білків, є індукція протипухлинних антитілозалежних реакцій лімфоцитів та макрофагів — аутологічна сироватка крові вакцинованих тварин вірогідно підвищує (на 50–100%) цитотоксичність клітин-ефекторів.
Список використаної літератури
1. Van de Velde A.L., Berneman Z.N., Van Tendeloo V.F. (2008) Immunotherapy of hematological malignancies using dendritic cells. Bull. Cancer, 95: 320–326.
2. Cheever M.A. (2008) Twelve immunotherapy drugs that could cure cancers. Immunol. Rev., 222: 357–368.
3. Ялкут С.И., Потебня Г.П. (2010) Биотерапия опухолей. Киев: 472.
4. Sundstedt A., Celander M., Hedlund G. (2008) Combining tumor-targeted superantigens with interferon-alpha results in synergistic anti-tumor effects. Int. Immunopharmacol., 8(3): 442–52.
5. Galsky M., Eisenberger M., Moore-Cooper S. et al. (2008) Phase I trial of the prostate-specific membrane antigen-directed immunoconjugate MLN2704 in patients with progressive metastatic castration-resistant prostate cancer. J. Clin. Oncol., 26(13): 2147–2154.
6. Potebnya G.P. (2006) Cancer autovaccine (CAV) — new specific active antitumor agent. Science and Innovation., (4): 26–7.
7. Затула Д.Г., Семерников В.А. (1986) Иммунология перекрестно реагирующих антигенов микроорганизмов и клеток бластом. К.: 220.
8. Эренпрейс Я.Г. (1982) Эмбриональные свойства опухолевых клеток: факты и гипотезы. Эксперим. онкол., 4(6): 13–18.
9. Диденко Г.В, Кузьменко А.П, Шпак Е.Г. и др. (2011) Противоопухолевая и иммуномодулирующая активность вакцин на основе эмбриональных куриных белков. Мат. 12 з’їзду онкологів України 21–22 вересня 2011, Судак. Клин. онкол., 11(8): 215.
10. Діденко Г.В. (2008) Розробка протипухлинних аутовакцин на основі білоквмісних метаболітів B. subtilis B-7025 та їх вплив на окремі реакції протипухлинного імунітету (експериментальні дослідження) Автореф. дис… канд біол наук. К.: 19.
11. Потебня Г.П., Танасієнко О.А., Черемшенко Н.Л та ін. Патент України № 57869 (UA). Спосіб одержання протипухлинної аутовакцини; Заявка № 2001064158 від 15.06.2001; Опубл. 15.07.2003; Бюл. № 7.
12. Потебня Г.П, Діденко Г.В, Кузьменко О.П та ін. Патент на корисну модель № 77647 (UA). Спосіб одержання протипухлинної вакцини. Заявка № u2012 08724 від 16.07.2012; Опубл. 25.02.2013, Бюл. № 4.
13. Дворщенко О.С, Діденко Г.В, Чередарчук О.І. та ін. (2007) Моделювання ксеногенних клітинних систем на твердих фазах з використанням пухлиноасоційованих та ембріональних антигенів і їх застосування в протипухлинній терапії. Мат. міжнародної конференції «Сучасні проблеми біології, екології та хімії», 29 березня–01квітня 2007 р., Запоріжжя: 500–503.
14. Hawkins W.G, Gold J.S., Dyall R. et al. (2000) Immunization with DNA coding for gp100 results in CD4 T-cell independent antitumor immunity. Surgery, 128: 273–80.
15. Alexander A.N., Huelsmeyer M.K., Mitzey A. et al. (2006) Development of an allogeneic whole-cell tumor vaccine expressing xenogeneic gp100 and its implementation in a phase II clinical trial in canine patients with malignant melanoma. Cancer Immunol. Immunother., 55: 433–42.
16. Disis M.L., Shiota F.M., Cheever M.A. (1998) Human HER2/neu protein immunization circumvents tolerance to rat neu: a vaccine strategy for «self» tumor antigens. Immunol., 93: 192–9.
Сравнительная оценка противоопухолевой эффективности аллогенных и ксеногенных вакцин, модифицированных с помощью белоксодержащих метаболитов B. subtilis B-7025
Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, Киев
Резюме. Проведены сравнительные исследования противоопухолевой эффективности аллогенных и ксеногенных вакцин на животных с карциномой легких Льюис. Показана высокая эффективность ксеногенных вакцин, созданных на основе куриных эмбриональных белков, которая проявилась в достоверном торможении роста первичной опухоли (на 50–90%) и отдаленного метастазирования карциномы легких Льюис. Противоопухолевый эффект отмечали как в условиях хирургического удаления опухоли, так и без оперативного вмешательства. Эти результаты существенно отличались от данных, полученных при использовании аллогенных вакцин, изготовленных на основе таких же адъювантов и опухолеассоциированных антигенов, которые обладали выраженным антиметастатическим эффектом только в условиях хирургического удаления первичной опухоли. Одним из возможных механизмов противоопухолевого действия вакцин, созданных на основе ксеногенных эмбриональных белков, является индукция противоопухолевых антителозависимых реакций лимфоцитов и макрофагов — аутологичная сыворотка крови вакцинированных животных достоверно повышает (на 50–100%) цитотоксичность клеток-эффекторов.
ксеногенные и аллогенные вакцины, противоопухолевая эффективность, иммунологическая реактивность.
Адреса:
Кузьменко Олександр Петрович
03022, Київ, вул. Васильківська, 45
Інститут експериментальної патології,
онкології і радіобіології ім. Р.Є. Кавецького
НАМН України
E-mail: kuzmen.aleks@mail.ru














Leave a comment