Вміст нуклеїнових кислот в ядрах клітин уротеліального раку сечового міхура
Грабовой А.Н.1, Великошапко С.Д.2
Резюме. У клітинах уротеліального раку сечового міхура (УРСМ) у міру зниження ступеня диференціювання підвищується середній вміст ДНК в ядрах. Однак серед пухлин різного ступеня анаплазії є ди- і поліплоїдні, що свідчить про різні патогенетичні механізми їх розвитку і робить неправомірним використання цього показника як самостійного критерію для уточнення ступеня диференціювання і прогнозу. Разом з тим вміст ДНК в ядрах клітин і клітинний склад можуть бути важливими компонентами при багатофакторній оцінці властивостей і прогнозу при УРСМ. Невідповідність розмірів ядер клітин вмісту в них ДНК, а також зниження відносного вмісту РНК в ядрах клітин УРСМ можуть бути непрямими показниками життєздатності пухлинних клітин і виділення їх морфофункціональних типів, здатних до подальшого розвитку. Наявність прямої залежності між вмістом нуклеїнових кислот в ядрі клітин УРСМ і його розмірами дає можливість використовувати цей показник для непрямого визначення плоїдності клітин на рутинних дослідженнях, без застосування складних методів забарвлення та устаткування.
Резюме. В клетках уротелиального рака мочевого пузыря (УРМП) по мере снижения степени дифференцировки возрастает среднее содержание ДНК в ядрах. Однако среди опухолей разной степени анаплазии имеются ди- и полиплоидные, что свидетельствует о разных патогенетических механизмах их развития и делает неправомерным использование этого показателя как самостоятельного критерия для уточнения степени дифференцировки и прогноза заболевания. Вместе с тем содержание ДНК в ядрах клеток и клеточный состав могут быть важными компонентами при многофакторной оценке свойств и прогноза при УРМП. Несоответствие размеров ядер клеток УРМП содержанию в них ДНК, а также снижение относительного содержания РНК в ядрах клеток УРМП могут выступать как непрямые показатели жизнеспособности опухолевых клеток и выделения их морфофункциональных типов, способных к дальнейшему развитию. Наличие прямой зависимости между содержанием нуклеиновых кислот в ядре клеток УРМП и его размерами предоставляет возможность использовать данный показатель для непрямого определения плоидности клеток при рутинных исследованиях, без применения сложных методов окраски и оборудования.

В настоящее время выбор метода лечения уротелиального рака мочевого пузыря (УРМП) базируется на его принадлежности к определенной классификационной категории по системе TNM и G. Эти признаки являются ведущими, так как определяют распространение злокачественного процесса и позволяют косвенно судить о его вероятной агрессивности [2, 8, 22]. УРМП представляет собой опухоль, обладающую высокой способностью как к рецидиву, так и прогрессированию после проведенного лечения. В большинстве случаев (70–80%) переходно-клеточный рак диагностируют в неинвазивных стадиях. 30–85% «поверхностного» рака рецидивируют после проведенного лечения, причем 10–30% впоследствии прогрессируют в инвазивные и метастатические карциномы. Остальные 20–30% УРМП характеризуются инфильтративным ростом уже на стадии выявления заболевания [4, 8]. Вместе с тем отдаленные результаты лечения больных, принадлежащих к одним и тем же классификационным подгруппам и получавших одинаковое лечение, существенно различаются. То есть для полноценного прогнозирования при УРМП, помимо стадии, степени дифференцировки, гистологического варианта, требуется дополнительная информация о свойствах опухоли, характеризующая биологическую агрессивность и клиническое поведение новообразования [8, 11, 22].
Интерес к состоянию ядер опухолевых клеток имеет вековую историю, что обосновано данными генетических и молекулярных исследований. УРМП в этом отношении не стал исключением — морфологии ядер его клеток, плоидности, повреждениям генома посвящено огромное количество работ.
Оценка изменений количества ДНК в ядрах клеток УРМП, связанных с развитием анеу- и полиплоидии, дала основание ряду авторов рассматривать их как прогностический фактор, коррелирующий с вероятностью рецидива и выживаемостью [1, 20, 22, 25, 26 и др.], хотя многие исследователи не разделяют эту точку зрения [15, 19].
Сформировавшееся сегодня однозначное представление о патогенетической значимости изменения количества ДНК (анеу-/полиплоидия) в ядрах опухолевых клеток УРМП тем не менее не привело к широкому использованию этого показателя в клинической практике. Это можно рассматривать как косвенное указание на недостаточную достоверность данного критерия в качестве независимого для индивидуального прогноза у конкретного пациента при УРМП. Вполне закономерно, что это стало толчком для комплексной оценки изменений содержания ДНК в клетках УРМП в сочетании с другими признаками [7, 19]. Однако на сегодня
гетерогенность клеточного состава УРМП по содержанию ДНК в ядрах как таковую не оценивали, не определяли свойства и роль отдельных сегментов клеточного спектра в развитии опухоли и ее клинической значимости.
Цель работы — выявить особенности содержания нуклеиновых кислот (НК)в ядрах клеток УРМП разной степени дифференцировки.
Объект и методы исследования
Исследования проведены на материале, полученном от 66 пациентов с УРМП при резекции стенки мочевого пузыря или трансуретральной резекции. Гистологическое типирование опухолей выполняли с использованием рутинной (гематоксилин и эозин) окраски. В исследуемую группу включены новообразования разной степени дедифференцировки: G1 — 24, G2 — 17, G3 — 19, G4 — 6 случаев.
Полученный материал фиксировали в 10% формалине и уплотняли в парафин с использованием аппарата АТ-4м (Мариупольский завод технологического оборудования). Из полученных блоков изготовляли гистологические срезы толщиной 5 мкм с помощью микротома Microm НМ325 (Thermo Scientific, Германия), которые окрашивали гематоксилином и эозином, галлоцианин-хромовыми квасцами по Эйнарсону (pH 1,62; 37 °С; 24 ч) для определения содержания НК в клетках [3, 5].
Для каждого случая часть срезов обрабатывали РНК-азой (MACHEREY-NAGEL GmbH & Co. KG, Германия) для экстракции РНК [3]. Полученные препараты изучали и фотографировали с помощью микроскопа Olympus BX51 с камерой Olympus (SP-500UZ) при стандартизированных условиях. На полученных изображениях с препаратов, окрашенных галлоцианин-хромовыми квасцами (увеличение микроскопа ×400, 2816 × 2112 pixels RGB), в 100 клетках каждой опухоли с помощью компьютерной системы анализа изображений ImageJ 1,46 определяли: площадь сечения ядра клетки (Narea), интегральную оптическую плотность ядра клетки (NIntDen), а также вычисляли объем ядра (NV) и содержание в нем суммарного количества НК (NНК) и ДНК (NДНК) по формулам:
NV= ¾•Narea•√(Narea/π) (1)
NНК (NДНК)= NIntDen•¾•Narea •√(Narea/π) (2)
В качестве исходной точки для оценки содержания НК в ядрах опухолевых клеток использовали показатели, принятые за единицу, характерные для ядер лимфоцитов (2с), которые находились в строме опухоли [1]. Клетки каждой отдельной опухоли были ранжированы по содержанию ДНК в ядре. Полученная последовательность разделена на ранги с шагом, который равняется среднему содержанию ДНК в ядрах лимфоцитов: Р1 — <1, Р2 — 1–2, Р3 — 2–3 и т.д.
Клетки каждой отдельной опухоли при окраске на НК были ранжированы по Narea/NV. Полученная последовательность разделена на ранги по средним значениям Narea/NV, которые были определены для рангов по содержанию ДНК. В пределах каждого ранга рассчитывали абсолютное количество клеток, средние значения Narea, NIntDen, NV, NДНК или NНК. Содержание РНК в ядрах клеток определяли как разницу между NНК и NДНК для каждой пары рангов. Полученные цифровые данные обрабатывали стандартными статистическими методами.
Результаты и их обсуждение
Проведенные исследования показали, что клетки УРМП по содержанию ДНК могут быть разделены на ранги от Р1 до Р7. В опухолях также выявляли клетки, которые по данному показателю относились к более высоким рангам. Однако количество таких клеток было незначительно, что не позволяло выделить их в самостоятельный ранг для проведения статистического анализа. В этих клетках часто возникали такие явления, как кариопикноз, набухание ядер и лизис хроматина, что являлось причиной большой вариабельности значений исследуемых признаков.
Среднее содержание ДНК в ядрах клеток УРМП статистически достоверно увеличивается (р<0,05) по мере снижения степени дифференцировки опухоли: G1 — 2,07±0,01; G2 — 2,83±0,03; G3 — 3,06±0,03; G4 — 3,94±0,07 (рис. 1.).
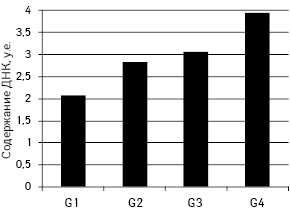
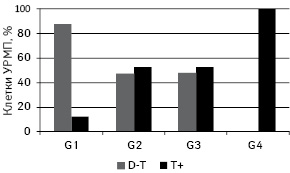
Среднее значение содержания ДНК в ядрах изученных опухолей позволяет разделить их на 3 группы: D — диплоидные — среднее содержание ДНК в ядрах <1,2; D-Т — среднее содержание ДНК в ядрах 1,2–2,5; а также Т+ — тетра- и гиперплоидные — среднее содержание ДНК >2,5. В исследуемой выборке присутствовали опухоли групп D-Т и Т+ и отсутствовали опухоли группы D. Отмечали тенденцию к преобладанию Т+ опухолей над D-Т по мере повышения степени анаплазии. Так, при G1 их соотношение составляло 87,5 к 12,5% в пользу D-Т, при G2 и G3 — 47,1 к 52,9% и 47,4 к 52,6% в пользу Т+, а среди G4 опухоли D-Т отсутствовали (рис. 2.).
Клеточный состав УРМП по содержанию ДНК проявляет определенную зависимость от уровня анаплазии (рис. 3.). В целом, с повышением степени дедифференцировки регистрируют как смещение клеточного спектра в сторону увеличения количества клеток с повышенным содержанием ДНК, так и возрастание клеточной гетерогенности.

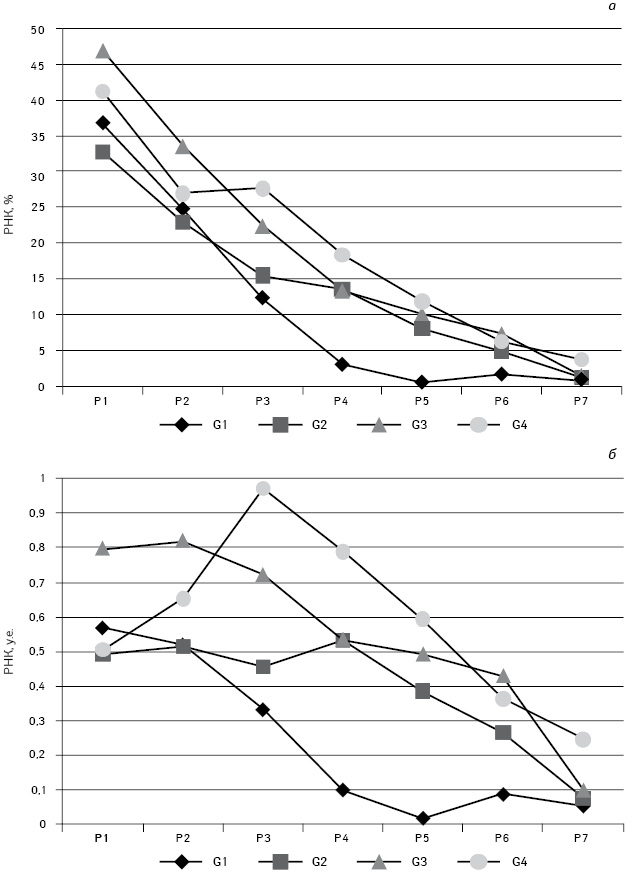
Содержание РНК в ядрах опухолевых клеток по мере увеличения количества ДНК достоверно возрастает только в опухолях G4 в сегменте рангов Р1–Р3, а при остальных G проявляет отчетливую тенденцию к снижению после ранга Р2 (рис. 4.). При этом, независимо от степени анаплазии, отмечается относительное уменьшение содержания ядерной РНК. Вместе с тем существует некоторая тенденция к увеличению абсолютного количества РНК по мере снижения степени дифференцировки опухоли.
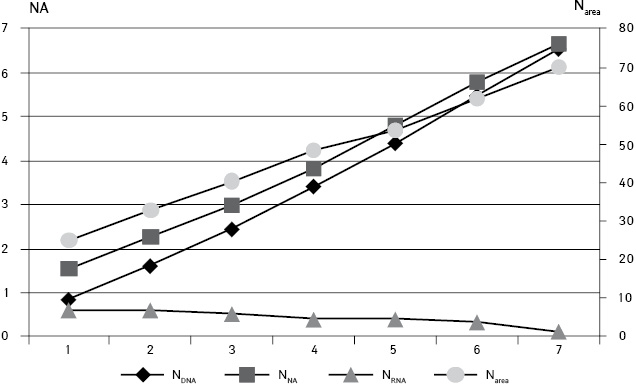
Сопоставление показателей содержания ДНК, НК и размера ядер опухолей (Narea, NV) показало (рис. 5), что прямая зависимость между ними сохраняется до ранга Р6 (коэффициент корреляции 0,97). В клетках, которые относились к более высоким рангам, это соотношение нарушается, что связано как с их незначительным количеством, так и изменчивостью, ассоциированной с частыми явлениями микариопикноза или, наоборот, с набуханием ядра и лизисом хроматина. Такие клетки имеют ядра с площадью сечения более 70 мкм и объем более 450 мкм.
Следует отметить, что кариопикноз и хроматолиз развиваются и в некотором количестве клеток более низких рангов. При этом такие клетки характеризуются, соответственно, меньшим или большим размером ядер в ряду ранжирования по количеству ДНК.
Полученная зависимость между содержанием НК (кратное 2с) и размерами ядер клеток опухоли позволила вывести ее математический эквивалент, выражающийся уравнением:
NДНК = 0,0016•Narea (3)
Сопоставление результатов эмпирического и непрямого (расчетного) определения содержания ДНК в клетках УРМП показало, что уровень совпадения зависит от количества измеренных клеток. Так, в опухолях степени дифференцировки G1 и G3, в которых было наибольшее количество измеренных клеток (G1 — 1275; G3 — 948), значения либо полностью совпадают, либо расхождение не выходит за границы стандартного отклонения (±0,2), показатель отмечают до ранга Р6 включительно. В образованиях степени G2 количество клеток составляет 859, при этом совпадение прослеживается до Р3 включительно. В случае наименьшего количества измеренных клеток (280) — при степени дифференцировки G4 совпадение регистрируют всего лишь до ранга Р2 включительно.
Таким образом, результаты проведенных исследований свидетельствуют, что УРМП является гетерогенным новообразованием, что обусловлено (наряду с другими признаками) разнообразием клеточного спектра по содержанию ДНК в ядрах опухолевых клеток. В целом, УРМП проявляет тенденцию к повышению содержания ДНК в ядрах клеток по мере нарастания анаплазии. Однако в состав разных групп по степени дифференцировки УРМП входят опухоли с разным средним содержанием ДНК (D-Т и Т+), что, надо полагать, связано с различными патогенетическими механизмами их возникновения [10, 17, 18, 21].
Полученные нами данные вступают в противоречие с утверждением, что для неинвазивных УРМП характерны микросомальная нестабильность (microsatellite instability — MSI) или эпигенетические повреждения, а для инвазивных — хромосомная нестабильность и эпигенетические повреждения [6, 9, 16]. В связи с вариабельностью, значительным перекрытием диапазонов значений в разных группах опухолей количество ДНК (плоидность) клеток опухоли не может выступать в качестве достаточно достоверного критерия как для уточнения степени дифференцировки, так и независимого прогноза.
Определенный интерес привлекает к себе зависимость между клеточным спектром УРМП по содержанию ДНК в ядрах клеток и степенью анаплазии опухоли. Однако учитывая, что количество ДНК непосредственно связано с ее синтезом (соответственно, с митотической активностью) и выживаемостью клеток (апоптозом), эти признаки следует оценивать в комплексе, что подтверждается исследованием связей некоторых показателей, отражающих эти процессы [12, 13, 16, 23, 28].
При этом особый интерес, по нашему мнению, представляют такие признаки, как митотическая активность, явления апоптоза и его нарушения среди различных сегментов клеточного спектра опухоли. Привлекает внимание также то, что в ранжированном ряду клеток опухоли по содержанию ДНК в ядрах присутствует значительное количество клеток с размерами ядра, не адекватными содержанию НК (пикноз, хроматолиз), что позволяет предполагать их нежизнеспособность.
Снижение в ядрах клеток относительного содержания РНК опухоли по мере увеличения количества ДНК свидетельствует о том, что дополнительная ДНК не является функционально активной. При этом прослеживается такая тенденция: со снижением степени дифференцировки опухоли УРМП увеличивается содержание РНК в ядре, что, вероятно, связано с изменением представительства в опухоли жизнеспособных клеток [14, 24, 27].
Выявленная зависимость между размером ядра опухолевой клетки и содержанием в нем ДНК, а также математическое описание этой зависимости дают возможность определять плоидность опухоли УРМП при рутинной гистологической окраске — при условии, что количество измеренных клеток будет не меньше 300.
Выводы
В УРМП по мере снижения степени дифференцировки повышаются средние показатели содержания ДНК в ядрах клеток. Однако среди опухолей разной степени анаплазии имеются ди- и полиплоидные, что свидетельствует о разных патогенетических механизмах их развития и делает неправомерным использование этого показателя как самостоятельного критерия для уточнения степени дифференцировки и прогноза. Вместе с тем содержание ДНК в ядрах клеток и клеточный состав могут быть важными компонентами при многофакторной оценке свойств и прогноза при переходно-клеточном раке мочевого пузыря.
Несоответствие размеров ядер клеток содержанию в них ДНК, а также уменьшение относительного содержания РНК в ядрах клеток УРМП могут выступать как непрямые показатели жизнеспособности опухолевых клеток и выделения их морфофункциональных типов, способных к дальнейшему развитию.
Существование прямой зависимости между содержанием НК в ядре клеток УРМП и его размерами предоставляет возможность использовать данный показатель для непрямого определения плоидности клеток на рутинных исследованиях, без применения сложных методов окраски и оборудования.
Список использованной литературы
1. Автандилов Г.Г. (2006) Диагностическая медицинская плоидометрия. М.: Медицина, 192 с.
2. Андреева Ю.Ю., Франк Г.А., Данилова Н.В. и др. (2012) Опухоли мочевыделительной системы и мужских половых органов. Морфологическая диагностика и генетика: Руководство для врачей. М.: Практическая медицина, 218 с.
3. Лупа Х. (1980) Основы гистохимии. (Пер. с немец.). М.: Мир, 344 с.
4. Полищук Л.А., Телегеева П.Г., Стаховский А.Э. и др. (2010) Новые специфичные молекулярные диагностические маркеры при онкоурологических заболеваниях. Лабораторна діагностика, 4 (54): 46–51.
5. Ташке К. (1980) Введение в количественную цитогистологическую морфологию. (Пер. с рум.). М.: Из. Акад. Соц. Респ. Румынии., 192 с.
6. Bakhoum S.F., Compton D.A. (2012) Chromosomal instability and cancer: a complex relationship with therapeutic potential. J. Clin. Invest., 122(4):1138–43.
7. Bol M.G., Baak J.P., van Diermen B. et al. (2003) Proliferation markers and DNA content analysis in urinary bladder TaT1 urothelial cell carcinomas: identification of subgroups with low and high stage progression risks. J. Clin. Pathol., 56(6): 447–452.
8. Bolenz C., Lotan Y. (2010) Translational research in bladder cancer. Cancer Biology & Therapy, 10(5): 407–415.
9. Bonberg N., Taeger D., Gawrych K. et al. (2013) Chromosomal instability and bladder cancer: the UroVysionTM test in the UroScreen study. BJU International., 112 (4): E372–E382.
10. Castillo-Martin M., Domingo-Domenech J., Karni-Schmidt O. et al. (2010) Molecular pathways of urothelial development and bladder tumorigenesis. Urol. Oncol., 28(4): 401–8.
11. Cheng L., Zhang S., MacLennan G.T. et al. (2011) Bladder cancer: translating molecular genetic insights into clinical practice. Hum. Pathol., 42(4): 455–81.
12. Cina S.J., Lancaster-Weiss K.J., Lecksell K., Epstein J.I. (2001) Correlation of Ki-67 and p53 with the new World Health Organization/International Society of Urological Pathology Classification System for Urothelial Neoplasia. Arch. Pathol. Lab. Med., 125(5): 646–51.
13. Cordon-Cardo C. (2008) Molecular alterations associated with bladder cancer initiation and progression. Scand. J. Urol. Nephrol. Suppl., 218: 154–65.
14. Davoli T., de Lange T. (2011) The Causes and Consequences of Polyploidy in Normal Development and Cancer. Rev. Cell Dev. Biol., 27: 585–610.
15. Dwivedi U.S., Kumar A., Das S.K. et al. (2009) Relook TURBT in superficial bladder cancer: its importance and its correlation with the tumor ploidy. Urol. Oncol., 27(5): 54–519.
16. Florl A.R., Schulz W. A. (2008) Chromosomal instability in bladder cancer. Arch. Toxicol., 82 (3): 173–182.
17. Han H., Wolff E.M., Liang G. (2012) Epigenetic alterations in bladder cancer and their potential clinical implications. Adv. Urol., Article ID 546917. 11 p.
18. Knowles M.A. (2008) Molecular pathogenesis of bladder cancer. Int. J. Clin. Oncol., 13(4): 287–97.
19. Kyroudi-Voulgari A., Kouloukoussa M., Simigiatos C. et al. (2005) DNA ploidy and immunomarking of bladder urothelial tumors before and after intravesical bacillus Calmette-Guérin treatment. Anal. Quant. Cytol. Histol., 27(1): 52–60.
20. Loughman N.T., Lin B.P., Dent O.F., Newland R.C. (2003) DNA ploidy of bladder cancer using bladder biopsy supernate specimens. Anal. Quant. Cytol. Histol., 25(3): 146–158.
21. Minal V., Mandhani А., Mittal R.D., Mittal В. (2005) Microsatellite instability as prognostic marker in bladder tumors: a clinical significance. BMC Urol., 5: 1–7.
22. Netto G.J. (2012) Molecular biomarkers in urothelial carcinoma of the bladder: are we there yet? Nature Reviews. Urology, 9(1): 41–51.
23. Oliveira P.A., Palmeira C., Colaço A. et al. (2006) DNA content analysis, expression of Ki-67 and p53 in rat urothelial lesions induced by N-butyl-N-(4-hydroxybutyl) nitrosamine and treated with mitomycin C and bacillus Calmette-Guérin. Anticancer Res., 26(4B): 2995–3004.
24. Poon R.Y.C. (2010) Polyploidization and Cancer. Advances in Experimental Medicine and Biology, 676: 151 p.
25. Puntoni M., Zanardi S., Branchi D. et al. (2007) Prognostic effect of DNA aneuploidy from bladder washings in superficial bladder cancer. Cancer Epidemiol. Biomarkers Prev., 16(5): 979–983.
26. Ramos D., Ruiz A., Morell L. et al. (2004) Prognostic value of morphometry in low grade papillary urothelial bladder neoplasms. Anal. Quant. Cytol. Histol., 26: 285–294.
27. Torres E.M., Sokolsky T., Tucker C.M. et al. (2007) Effects of aneuploidy on cellular physiology and cell division in haploid yeast. Science, 317: 916–924.
28. Türkölmez K., Baltaci S., Bedük Y. et al. (2002) DNA ploidy and S-phase fraction as predictive factors of response and outcome following neoadjuvant methotrexate, vinblastine, epirubicin and cisplatin (M-VEC) chemotherapy for invasive bladder cancer. Scand. J. Urol. Nephrol., 36(1): 46–51.
Адрес:
Грабовой Александр Николаевич
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака
E-mail: agrabovoy@yandex.ru














Leave a comment