Прогнозування перебігу раку грудної залози шляхом визначення гена інтерсектину ITSN2
Сивак Л.А.1, Крячок І.А.1, Губарева Г.О.1, Лялькін С.А.1, Майданевич Н.М.1, Аскольський А.В.1, Кропивко С.В. 2, Криклива В.О.1, Лаврик Г.В.1, Новохацька О.В. 2, Циба Л.А.2, Риндич А.В.2
Резюме. З урахуванням клінічної та генетичної гетерогенності раку грудної залози на сьогодні однією з основних проблем є прогнозування перебігу захворювання. Виявлення складних мереж білкових взаємодій, вивчення особливостей експресії гена в зразках пухлини і розвиток технологій профілювання експресії генів ITSN2 можуть бути незалежним прогностичним фактором відсутності рецидивів захворювання.

Однією з основних проблем на шляху до прогресу в діагностиці та лікуванні хворих на рак грудної залози (РГЗ) є висока клінічна і генетична гетерогенність цього захворювання. Значного удосконалення як у діагностиці, так і у вивченні перебігу РГЗ досягнуто за останні декілька років завдяки розвитку технологій профілювання експресії генів.
В експериментах з аналізу експресії генів за допомогою мікрочипів встановлено, що ген інтерсектину-2 (ITSN2) є одним з небагатьох генів, рівень експресії якого суттєво відрізняється у зразках пухлин хворих на РГЗ, у яких виникали рецидиви хвороби, та пацієнтів із РГЗ, що залишалися здоровими після радикального видалення пухлини та хіміотерапії (ХТ) з використанням схеми CMF (циклофосфамід, метотрексат і флуороурацил) [1]. Високий рівень експресії ITSN2 корелював із відсутністю у хворих зі злоякісними пухлинами грудної залози (ЗПГЗ) віддалених метастазів протягом довгого періоду. Крім того, встановлено, що співвідношення експресії лише двох генів, ITSN2 та CXCL9, може бути незалежним прогностичним фактором відсутності рецидивів хвороби.
ITSN2 є представником родини інтерсектинів (ITSN1 та ITSN2). Інтерсектини — білки, які функціонують як адаптори, збираючи білкові комплекси при клатрин-опосередкованому ендоцитозі, а також беруть участь у внутрішньоклітинній передачі сигналу та перебудовах актинового цитоскелета [2]. ITSN2 має подібну до ITSN1 доменну структуру.
Нещодавно описано, що ендоцитоз впливає на сигнальні шляхи, що призводять до проліферації клітин ссавців, а його порушення може спричиняти гіперпроліферацію та злоякісну трансформацію [3].
Гіперекспресія ITSN1 була достатньою для злоякісної трансформації фібробластів гризунів і призводила до активації кіназ JNK та ERK [4].
Водночас підвищений рівень експресії ITSN2 у зразках тканин ЗПГЗ корелював з відсутністю рецидивів та сприятливим прогнозом. Це може свідчити про існування специфічних функцій обох інтерсектинів у клітинних процесах, пов’язаних із канцерогенезом, та вказує на необхідність їх визначення для з’ясування ролі інтерсектинів в ініціації та прогресуванні злоякісних захворювань.
Виявлення складних мереж білкових взаємодій ITSN2 та вивчення особливостей експресії гена, що його кодує, в нормі та в зразках тканин ЗПГЗ дасть можливість розширити знання про участь адапторних білків у клітинних процесах, у ході розвитку пухлин та визначенні ролі ITSN2 як прогностичного онкомаркера.
В останні роки з’явилися роботи, в яких показано існування пухлиноасоційованих альтернативно-сплайсованих ізоформ білків і виявлено зв’язок між пошкодженням сайтів альтернативного сплайсингу та канцерогенезом.
Крім того, встановлено, що власне процес альтернативного сплайсингу, включно з його трансфакторами, може бути потенційною мішенню для генної терапії злоякісних новоутворень. Детальний аналіз експресії ізоформ ITSN1 та ITSN2 у тканинах пухлин не проводили.
Раніше виявлено до 17 подій альтернативного сплайсингу первинного транскрипту та вивчено експресію ізоформ ITSN1 у нормі та при деяких патологічних станах. Відомо також про існування до 6 ізоформ ITSN2. На нашу думку, отримання та поєднання даних про експресію альтернативно-сплайсованих ізоформ ITSN2 у різних підтипах РГЗ та особливостей взаємодій ITSN2 з білками дозволить встановити можливу роль окремих ізоформ ITSN2 під час формування та розвитку цих пухлин.
Тому нами вивчено взаємозв’язок між рівнем експресії гена ITSN2 і морфологічним варіантом, рецепторним типом, поширеністю первинного процесу (стадія захворювання) та результатами лікування хворих на РГЗ.
Об’єкт і методи дослідження
У дослідження включено 84 жінки, хворих на РГЗ, віком від 32 до 74 років. Середній вік становив 49,0±7,5 року.
Усім пацієнткам до залучення в дослідження проводили стандартне обстеження з метою визначення стадії захворювання та морфологічної будови пухлини з обов’язковим встановленням її рецепторного статусу, ступеня диференціювання і проліферативного індексу (імуногістохімічне дослідження). Рівень експресії гена ITSN2 у клітинах пухлини визначали методом полімеразної ланцюгової реакції (ПЛР) в Інституті молекулярної біології і генетики НАН України.
Створення плазмідних конструкцій. кДНК-послідовності, що відповідають фрагменту α-спірального регіону та С2-домену ITSN2, одержували за допомогою ПЛР, використовуючи кДНК ITSN2, люб’язно надану доктором С. де ла Луна (Dr. S. de la Luna) із Центру досліджень геномної регуляції (Centre for Genomic Regulation), Барселона, Іспанія, та праймери:
ITSN2-S For 5՛ AGA AGC TTC AAG AAG AGG AGC C 3՛
ITSN2-S Rev 5՛ AGC TCG AGC AAC TCA AGA TGA A 3՛
ITSN2-L For 5՛ GAG AAT TCC AGC GAT GAG CCT G 3՛
ITSN2-L Rev 5՛ CGC TCG AGG AAA TCA TCT GGT G 3՛
ПЛР проводили в 50 мкл суміші, яка містила 0,4 мкМ кожного специфічного праймера, 1,5 мM MgCl2, 0,2 мM dNTP кожного типу, 1,5 од. суміші ферментів High Fidelity PCR Enzyme Mix («Fermentas», Литва) і відповідний буфер. Ампліфікацію здійснювали за таких умов: денатурація — 94 °С протягом 40 с (у першому циклі — 2 хв); реасоціація з відповідними праймерами — 1 хв, елонгація — 72 °С, протягом 1 хв 35 циклів, на заключному етапі при 72 °С — 7 хв. Продукти реакцій розділяли в 1,5% агарозному гелі та очищали за допомогою набору реактивів Silica Bead DNA Gel Extraction Kit («Fermentas», Литва). Одержані продукти ПЛР клонували за сайтами HindIII, XhoI та EcoRI, XhoI у вектор для експресії в бактеріальних клітинах pET-28b («Novagen», США). Усі конструкції перевіряли сиквенуванням.
Експресiя рекомбiнантних бiлкiв у культурi клiтин E. coli та їх очищення. Трансформованi одержаними конструкцiями клiтини E. coli штаму BL21 (DE3) pLysЕ висiвали на чашку та iнкубували протягом ночі при температурі 37 °C до появи окремих колонiй. Колонiю iнокулювали в 5 мл рiдкого LB з вiдповiдним антибiотиком та iнкубували впродовж ночі при iнтенсивному перемiшуваннi зi швидкiстю 220–250 об./хв. До 100 мл середовища 2xYTA додавали 1 мл клiтинної суспензiї та iнкубували до досягнення суспензiєю оптичної густини OD600 = 0,6. Для iндукцiї експресiї рекомбiнантного бiлка до клiтин додавали розчин ізопропілтіо-D-галактозид (IПТГ) до кiнцевої концентрацiї 1 мМ та iнкубували протягом 4–5 год при температурі 37 °C, після чого центрифугували при 6000 g протягом 15 хв. Для очистки рекомбiнантних 6xHis-злитих бiлкiв клiтини лізували в 5 мл буфера з 8 М сечовини, 100 мМ NaH2PO4, 10 мМ трис-HCl pH 8,0 та центрифугували при 14000 g протягом 20–30 хв при температурі 20 °C.
Для очищення рекомбiнантних бiлкiв використовували систему «QIAexpress» («Quiagen», Великобританiя), яка базується на застосуванні нiкельнiтрилотриоцтової кислоти (Ni-NTA). 1 мл 50% розчину суспензiї Ni-NTA-агарози в буферi для лiзису додавали до 5 мл освiтленого лiзату та перемiшували при температурі 4 °C протягом 4 год. Пiсля iнкубацiї сумiш центрифугували при 3000 g протягом 10 хв при кiмнатнiй температурi та двiчi промивали 10 мл буферного розчину (8 М сечовини, 100 мМ NaH2PO4, 10 мМ трис-HCl pH 6,3). Зв’язаний бiлок елюювали 5 мл буфера для елюцiї (8 М сечовини, 100 мМ NaH2PO4, 10 мМ трис-HCl, pH 5,9, 250 мМ iмiдазолу). Елюйований бiлок дiалiзували проти 5 л буферного розчину PBS (phosphate-buffered saline) упродовж 24 год при температурі 4 °C, двiчі змiнюючи буфер. Концентрацiю бiлка визначали за Бредфордом [13].
Отримання полiклональних антитiл. Для отримання полiклональних антитiл кролiв лiнiї «шиншила» 6-мiсячного вiку iмунiзували 4 рази iн’єкцiями уздовж хребта. Для першої iмунiзацiї використовували 200 мкг очищеного рекомбiнантного білка в 1 мл 50% розчину повного ад’юванта Фрейнда в PBS. Другу i третю iмунiзацiю проводили з iнтервалом 4 тиж, використовуючи 200 мкг бiлка в 1 мл 50% розчину неповного ад’юванта Фрейнда в PBS. Останню пiдсилювальну iмунiзацiю кролiв проводили 200 мкг антигену в 500 мкл PBS без ад’юванта. Титр специфiчних антитiл у сироватцi кровi iмунiзованих кролiв визначали за методом ELISA. Для цього в лунки 96-лункових планшетiв вносили по 0,5 мкг антигену в 100 мкл PBS, iнкубували 1 год при температурі 37 °C, вiдмивали лунки вiд залишку антигену, що не зв’язався, двома об’ємами PBS та блокували неспецифiчну сорбцiю пластику додаванням 200 мкл 0,1% розчину Tвiн-20 в PBS з подальшою iнкубацiєю при температурі 37 °C протягом 1 год. Сироватку кровi iмунiзованих кролiв вносили у розведенні 1:102–1:107. Як негативний контроль використовували сироватку крові неiмунiзованих кролiв і неспецифiчний антиген (0,5 мкг альбуміну бичачої сироватки (БСА) в 100 мкл PBS на лунку). Планшети тричi вiдмивали PBS з 0,1% розчином Tвiн-20 та iнкубували 1 год з вторинними антитiлами кози проти IgG кроля, кон’югованими з пероксидазою хрону («Promega», США), у розведеннi 1:104. Потiм лунки 3 рази вiдмивали PBS вiд залишку антитiл, що не зв’язалися, i проводили колориметричну реакцiю з використанням субстрату пероксидази хрону — ABTS (2,2՛-азин-бiс-[3-бензотіазолiн-6-сульфокислота]), який додавали в цитратному буферi (50 мМ Na3C6H5O7, рН=5,5), в концентрацiї 1 мг/мл. Iнтенсивнiсть забарвлення продуктiв реакцiї вимiрювали за допомогою фотометра «Anthos 2000» («Anthos Labled Instruments», Великобританiя).
Отримання препаратів РНК. Зразки пухлин і тканин, які оточують пухлину (післяопераційний матеріал хворих на РГЗ), заморожували в рідкому азоті та зберігали при температурі −80 °С. Тотальну РНК виділяли з 0,2–0,4 г тканини гуанідинізотіоціанатним методом за допомогою реагента TriReagent («Sigma») згідно з рекомендаціями виробника та зберігали при температурі −80 °С. Якість РНК контролювали спектрофотометрично та за допомогою електрофорезу у боратному буфері за денатуруючих умов.
Синтез кДНК на препараті тотальної РНК. У реакційну суміш загальним об’ємом 20 мкл вносили 2 мкг тотальної РНК, праймер (Oligo dT15) в кількості 100 мкМ, 4 мкл 5-кратного буфера, 2 мкл 10 мМ dNTP, 0,5 мкл інгібітора РНКази (40 од./мкл), 1 мкл зворотної транскриптази RevertAid H Minus M-MuLV (Fermentas). Денатурацію РНК проводили при температурі 65 °С протягом 10 хв. Синтез РНК здійснювали при температурі 42 °С упродовж 1 год.
ПЛР. ПЛР виконували з використанням однієї пари праймерiв і TaqMan зонду. Реакцію проводили в 25 мкл суміші, яка містила 0,2 мкМ кожного специфічного праймера та 0,1 мкМ TaqMan зонду, 1,5 мМ МgCl2, 0,2 мМ dNTP, 2,5 од. Taq ДНК-полімерази «Fermentas» і відповідний буфер. Амплiфiкацiю здійснювали за таких умов: денатурація — 94 °С протягом 15 с (у першому циклі — 2 хв); температура реасоцiацiї праймерiв — 57 °С, час реасоцiацiї праймерiв і синтезу об’єднували — 1 хв, 60 циклів. ПЛР проводили на приладі iQ5 «BioRad».
Праймери, які використовували для ПЛР:
TBP:
For. TBP 634-654
GTGCCCGAAACGCCGAATATA
TaqMan зонд 655-676
(FAM) ATCCCAAGCGGT(BHQ1)TTGCTGCGGT PO4
Rev. TBP 708-688
CCGTGGTTCGTGGCTCTCTTA
ITSN2-S:
For. ITSN2-S 3798-3821
CGTTAAGATGACGACAGACTCAGA
TaqMan зонд 3820-3844
(FAM) CAGCACACCACT(BHQ1)GTTGACTTGGATC PO4
Rev. ITSN2-S 3866-3845
ATTGTGTCCAGGGTTTGCAGAT
ITSN2-L:
For. ITSN2-L 4324-4345
CGCTACCCACTGCTCATCAGAA
TaqMan зонд 4362-4385
(FAM)CCCGGAGAGCCAT(BHQ1)GCAGACCATTC PO4
Rev. ITSN2-L 4382-4403
AGGGCCAGCTTTAGGGAGGAAT
Позиції нуклеотидів для праймерів відповідають кДНК TBP, довгої та короткої ізоформ ITSN2 людини (реєстраційні номери в нуклеотидній базі даних GenBank NM_006277, NM_147152 та NM_001172085.1 відповідно).
Для обчислення результатів ПЛР використовували формулу
Exp = Etarget−Ct(target)/Eref−Ct(ref),
де Etarget — ефективність ПЛР досліджуваного гена;
Eref — ефективність ПЛР референтного гена;
Ct(target) — середнє значення циклів досліджуваного гена;
Ct(ref) — середнє значення циклів референтного гена.
Статистичну обробку отриманих даних проводили з використанням пакета прикладної статистичної програми «Statistica 8.0». Визначали співвідношення рівня експресії ізоформ гена ІTSN2 з рецепторним типом і ступенем інвазії РГЗ, наявністю метастазів (стадія захворювання) та перебігом пухлинного процесу.
Результати та їх обговорення
Створення поліклональних антитіл, специфічних до довгої та короткої ізоформ ITSN2. Одними з основних функцій адапторних білків є участь у формуванні макромолекулярних комплексів і забезпечення зв’язку між сигнальними мережами клітини. Адапторні білки родини ITSN (ITSN1 та ІTSN2) — мультидоменні, що дозволяє їм взаємодіяти з великою кількістю білків-партнерів. Понад 30 партнерів ITSN1 беруть участь у різних клітинних процесах, тоді як на сьогодні відомо лише 4 білки, які взаємодіють з ITSN2. Хоча ITSN2 має високий рівень гомології з ITSN1, незначні відмінності в послідовності амінокислотних залишків можуть суттєво змінити його властивості як платформи для асоціації інших білків.
Для того, щоб вивчити взаємодії ITSN2 з білками, визначити особливості його функціонування та проаналізувати експресію ITSN2 у тканинах пухлин, необхідно одержати специфічні для ITSN2 антитіла, здатні розрізняти ITSN1 та ITSN2. Для цього створено рекомбiнантнi конструкцiї для експресiї в клітинах прокарiотів, які містили кДНК, що кодують фрагмент α-спірального регіону (CCR) та С2-домен ITSN2, злиті з 6xHis-tag у векторі pET-28b. Їх вибрали як антигени для створення ITSN2-специфічних антитіл через їхню низьку гомологію до ITSN1 та високу імуногенність.
Результати останніх досліджень показують, що ендоцитоз впливає на різні внутрішньоклітинні сигнальні процеси, зокрема на сигнальні шляхи, що призводять до проліферації клітин ссавців. Найбільш дослідженим прикладом такого впливу є інтерналізація рецепторних тирозинкіназ, яка є необхідною як для передачі сигналу, так і для інактивації рецептора [3]. Тому порушення ендоцитозу можуть призводити до гіперпроліферації та злоякісної трансформації. Дійсно, продемонстровано, що ITSN1 регулює убіквітинування та інтерналізацію рецептора епідермального фактора росту (EGFR) [6] і, можливо, є ключовим регулятором як ендоцитозу, так і внутрішньоклітинних сигнальних шляхів. Відомо, що ITSN1 взаємодіє з багатьма білками, важливими для інтерналізації рецепторів, такими як динамін, синаптоянін, Cbl, N-WASP, ендофілін [7–9]. Також показано, що пригнічення експресії ITSN1 за допомогою shRNA та sіRNA призводить до активації апоптозу в ендотеліальних клітинах та нейронах [10, 11]. Залишається нез’ясованим, чи відіграє подібну роль у клітинах ITSN2.
Аналіз експресії гена ITSN2 у зразках пухлин пацієнтів із РГЗ методом вестерн-блот. Щоб дослідити експресію гена ITSN2 на рівні білка для приготування тканинних екстрактів, використано зразки РГЗ. Концентрація білка в отриманих екстрактах варіювала від 0,2 до 4 мкг/мкл. Для вестерн-блот-аналізу відібрано препарати з концентрацією білка щонайменше 0,7 мкг/мкл.
На рис. 1 представлено результати кількісної оцінки вмісту довгої та короткої ізоформ ITSN2 у досліджуваних зразках РГЗ. Найнижчий рівень експресії гена ITSN2 (сумарна кількість довгої та короткої ізоформ) виявлено у зразку РГЗ із прогностично несприятливим рецепторним типом ER(–) PR(–) HER2/neu(+). Відносна кількість ITSN у цьому препараті РГЗ становила 19% від максимальної (див. рис. 1, а). Найвищі рівні експресії зафіксовано для зразків РГЗ з рецепторним статусом ER(+) PR(–) HER2/neu(–).
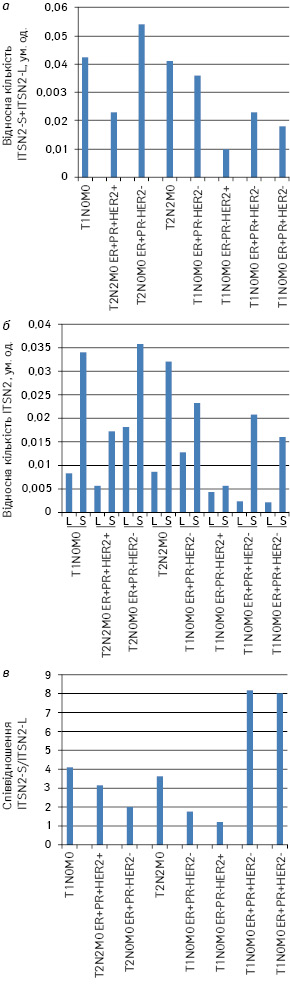
Відомо, що експресія ізоформ деяких білків асоційована зі злоякісними новоутвореннями. Ми перевірили співвідношення ізоформ ITSN2 у досліджуваних зразках РГЗ (див. рис. 1, в). Відношення кількості короткої ізоформи ITSN2 до кількості довгої варіювало від 1,2 до 7,9. При цьому найбільший відносний вміст довгої ізоформи виявлено у зразку РГЗ із прогностично несприятливим рецепторним статусом ER(–) PR(–) HER2/neu(+). Відношення ITSN2-S до ITSN2-L становило 1,2. Найменше довгої ізоформи виявлено в зразках ЗПГЗ із прогностично сприятливим рецепторним типом ER(+) PR(+) HER2/neu(–). Відношення ITSN2-S до ITSN2-L наближається до 8. На жаль, якість лізатів зразків РГЗ та, відповідно, вестерн-блотів не дозволяла з високою достовірністю визначити інтенсивність сигналів на імуноблотах, тому аналіз експресії гена ITSN2 вирішили надалі проводити за допомогою кількісної зворотно-транскриптазної ПЛР (ЗТ-ПЛР) у реальному часі.
Аналіз експресії ITSN2 у зразках пухлин грудної залози методом кількісної ЗТ-ПЛР. Для аналізу експресії гена ITSN2 методом кількісної ЗТ-ПЛР у реальному часі ми підібрали праймери та TaqMan зонди, специфічні до короткої та довгої ізоформи ITSN2. Праймери та зонди відповідали вимогам проведення ПЛР у реальному часі, довжина продуктів ПЛР для ITSN2-S та ITSN2-L становила 69 та 80 п.н. відповідно. TaqMan зонди містили флуоресцентну мітку FAM та гасник BHQ1. Для нормалізації результатів ПЛР вибрано ген «домашнього господарства» ТВР, для якого показано відносно стабільний рівень експресії в різних нормальних тканинах та пухлинах, у тому числі й РГЗ [12, 13].
З 0,2 г хірургічно видалених зразків РГЗ та навколишніх тканин виділяли РНК за допомогою реагента TriReagent («Sigma») та перевіряли її інтактність електрофорезом у агарозному гелі. кДНК синтезували із 2 мкг тотальної РНК. Кількісну ЗТ-ПЛР проводили у трьох повторах.
Загальний рівень експресії короткої та довгої ізоформ ITSN2 у зразках РГЗ із рецепторним типом ЕR(+) PR(+) HER2/neu(–) становив 0,94–32,12 ум.од. (у середньому — 9,32 ум.од.). У препаратах РГЗ з рецепторним типом ЕR(–) PR(–) HER2/neu(–) він сягав 0,7–6,71 ум.од. (у середньому — 3,95 ум.од.).
У всіх проаналізованих зразках РГЗ із рецепторним статусом ER(+) PR(+) HER2/neu(–) у пацієнтів без метастазів у лімфовузлах вміст короткої форми мРНК ITSN2 у 4–30 разів перевищував кількість довгої форми.
Навпаки, у проаналізованих зразках РГЗ із рецепторним типом ЕR(–) PR(–) HER2/neu(–/+) співвідношення ITSN2-S і ITSN2-L у середньому становило 1,96. У двох зразках РГЗ вміст довгої ізоформи перевищував кількість короткої ізоформи ITSN2.
Середній вміст короткої та довгої ізоформ у зразках РГЗ із рецепторним статусом ER(+) PR(+) HER2/neu(–/+) у хворих без метастазів становив 6,13 та 0,6 ум.од. відповідно, а в препаратах ЗПГЗ із рецепторним типом ER(–) PR(–) HER2/neu(–/+) — 2,2 ум.од. для ITSN2-S та 1,75 ум.од. — для ITSN2-L.
Дані щодо експресії ITSN2, отримані за допомогою вестерн-блот-аналізу, узгоджувалися з результатами кількісної ЗТ-ПЛР. Так, у зразках РГЗ із рецепторним типом ER(–) PR(–) HER2/neu(+) низьке співвідношення ITSN2-S і ITSN2-L виявлено обома методами (1,2 — за даними вестерн-блотингу та 0,77 — за даними ЗТ-ПЛР) і, навпаки, у клітинах РГЗ із рецепторним типом ER(+) PR(+) HER2/neu(–) співвідношення ITSN2-S і ITSN2-L становило 8 — за даними вестерн-блот-аналізу і 9,1 — за результатами ЗТ-ПЛР.
У проаналізованих зразках РГЗ із рецепторним типом HER2/neu(+) вміст мРНК ITSN2 виявився нижчим, ніж у РГЗ із рецепторними типами ER(–) PR(–) HER2/neu(–) та ER(+) PR(+) HER2/neu(–) (рис. 2).
L — довга ізоформа ITSN2; S — коротка ізоформа ITSN2; ER — рецептор до естрогенів; PR — рецептор до прогестерону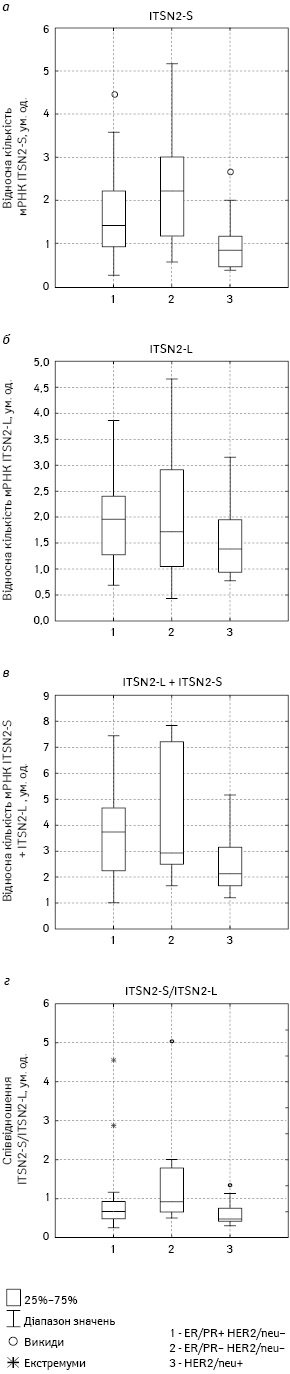
Достовірної відмінності в експресії довгої ізоформи ITSN2-L у досліджуваних зразках РГЗ не виявлено. Навпаки, різниця в експресії короткої ізоформи ITSN2-S в екстрактах із ЗПГЗ у пацієнтів зі сприятливим та несприятливим прогнозом виявилася вищою, ніж відмінності в сумарній експресії двох основних ізоформ гена ITSN2.
Таким чином, підвищений вміст довгої ізоформи ITSN2 у зразках РГЗ у пацієнтів із несприятливим прогнозом може бути додатковим прогностичним фактором перебігу захворювання. До складу довгої ізоформи ITSN2 входять відсутні в короткій формі домени DH, PH и С2, що беруть участь в активації полімеризації актину. Беручи до уваги важливість перебудов актинового цитоскелета для міграції клітин, а також взаємодію ITSN2 з компонентами інвадоподій, можна припустити наявність зв’язку між підвищенням вмісту ITSN2-L та зростанням інвазивності злоякісних клітин і утворенням метастазів, що потребує подальшого вивчення. Саме коротка форма ITSN2 може розглядатися як потенційний прогностичний маркер у хворих на РГЗ.
Подальші дослідження необхідні для підтверждення прогностичного потенціалу ITSN2 та можливості його використання як маркера прогнозу перебігу РГЗ.
ВИСНОВКИ
1. Рівень експресії гена ITSN2 у зразках РГЗ може бути незалежним прогностичним фактором відсутності рецидивів захворювання. Високий рівень експресії гена ITSN2 корелював з відсутністю у хворих із рецепторним типом ER(+) PR(+/–) HER2/neu(–) віддалених метастазів і довгостроковою ремісією у хворих, які отримали радикальне лікування. Найнижчий рівень експресії гена ITSN2 виявлено у хворих на РГЗ із рецепторним статусом ER(–) PR(–) HER2/neu(+), що має несприятливий прогноз.
2. Зразки РГЗ є гетерогенними як за кількістю довгої та короткої ізоформ мРНК ITSN2, так і за їх співвідношенням. Найнижчий вміст короткої ізоформи ITSN2 — у зразках РГЗ хворих із рецепторним типом ЕR(+) PR(+) HER2/neu(–) та метастазами в лімфовузлах. Найбільший вміст зафіксовано у пацієнтів із тричі негативним рецепторним типом ЕR(–) PR(–) HER2/neu(–). Ці пухлини мали найвищий вміст як короткої, так і довгої ізоформи мРНК ITSN2.
3. При порівнянні співвідношення вмісту мРНК довгої та короткої ізоформ ITSN2 у зразках РГЗ пацієнток без метастазів у лімфовузлах зі сприятливим прогнозом за цим показником значно переважає коротка ізоформа ITSN2, тоді як у хворих на РГЗ із несприятливим прогностичним статусом це співвідношення було значно меншим.
4. Підвищений вміст саме довгої ізоформи гена ITSN2 у зразках РГЗ хворих із рецепторним типом ER(–) PR(–) HER2/neu(–) та несприятливим прогнозом може бути додатковим прогностичним фактором перебігу захворювання, що потребує подальшого вивчення.
Список використаної літератури
1. Specht K., Harbeck N., Smida J. et al. (2008) Expression profiling identifies genes that predict recurrence of breast cancer after adjuvant CMF-based chemotherapy. Breast Cancer Res Treat, 118: 45–56.
2. Pucharcos C., Estivill X., de la Luna S. (2000) Intersectin 2, a new multimodular protein involved in clathrin-mediated endocytosis. FEBS Lett., 478: 43–51.
3. Sorkin A., Goh L.K. (2009) Endocytosis and intracellular trafficking of ErbBs. Exp. Cell Res., 315: 683–696.
4. Adams A., Thorn J.M., Yamabhai M. et al. (2000) Intersectin, an adaptor protein involved in clathrin-mediated endocytosis, activates mitogenic signaling pathways. J. Biol. Chem., 275: 27414–27420.
5. Laemlie U.K. (1970) Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 227 (5259): 680–685.
6. Martin N.P., Mohney R.P., Dunn S. et al. (2006) Intersectin regulates epidermal growth factor receptor endocytosis, ubiquitylation, and signaling. Mol. Pharmacol., 70: 1643–1653.
7. Sengar A.S., Wang W., Bishay J. et al. (1999) The EH and SH3 domain Ese proteins regulate endocytosis by linking to dynamin and Eps15. EMBO J., 18: 1159–1171.
8. Yamabhai M., Hoffman N.G., Hardison N.L. et al. (1998) Intersectin, a novel adaptor protein with two Eps15 homology and five Src homology 3 domains. J. Biol. Chem., 273: 31401–31407.
9. Hussain N., Jenna S., Glogauer M. et al. (2001) Endocytic protein intersectin-l regulates actin assembly via Cdc42 and N-WASP. Nat. Cell Biol., 3: 932–937.
10. Predescu S.A., Predescu D.N., Knezevic I. et al. (2007) Intersectin-1s regulates the mitochondrial apoptotic pathway in endothelial cells. J. Biol. Chem., 282: 17166–17178.
11. Das M., Scappini E., Martin N.P. et al. (2007) Regulation of neuron survival through an intersectin-phosphoinositide 30-kinase C2beta-AKT pathway. Mol. Cell Biol., 27: 7906–7917.
12. Radonic A., Thulke S., Mackay I.M. et al. (2004) Guideline to reference gene selection for quantitative real-time PCR. Biochem. Biophys. Res. Commun., 313: 856–862.
13. Drury S., Anderson H., Dowsett M. (2009) Selection of reference genes for normalization of qRT-PCR data derived from FFPE breast tumors. Diagn. Mol. Pathol., 18: 103–107.
Прогнозирование течения рака грудной железы путем определения гена интерсектина ITSN2
Национальный институт рака, Киев
Институт молекулярной биологии и генетики НАН Украины, Киев
Резюме. С учетом клинической и генетической гетерогенности рака грудной железы на сегодня одной из основных проблем является прогнозирование течения заболевания. Выявление сложных сетей белковых взаимодействий, изучение особенностей экспрессии гена в образцах опухоли и развитие технологий профилирования экспрессии генов ITSN2 могут быть независимым прогностическим фактором отсутствия рецидивов заболевания.
рак грудной железы, ген интерсектин ITSN2, химиотерапия.
Адреса:
Сивак Любов Андріївна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: lasyvak@gmail.com














Leave a comment