Онкофертильність при раку грудної залози. Алгоритм прийняття рішення перед початком лікування
Феськов А.М.1, Карташов С.М. 2, Сафонов Р.А.3, Благовещенский Е.В.3, Феськов В.А.1
- 1Центр репродукции человека «Клиника профессора А.М. Феськова», Харьков
- 2Харківська медична академія післядипломної освіти, Харків
- 3Харьковский национальный медицинский университет
Резюме. Ад’ювантна хіміотерапія, яку проводять у жінок репродуктивного віку з діагнозом раку грудної залози, призводить до значного зниження оваріального резерву, аж до повного вимкнення функції яєчників — синдрому передчасного виснаження яєчників. Для повноцінної реабілітації у певної категорії пацієнток виникає питання про відновлення репродуктивної функції. Вибір тактики ведення таких пацієнток ґрунтується на спільній роботі онколога та репродуктолога. Завданням онколога є визначення основного лікування (спочатку хірургічне лікування або хіміотерапія) і прогнозування наслідків захворювання. Завдання репродуктолога полягає у визначенні можливості реалізації репродуктивної функції, яка залежить від віку, оваріального резерву, репродуктивного анамнезу, ризику настання передчасного виснаження яєчників. У Центрі репродукції людини «Клініка професора О.М. Феськова» застосовують такі методи збереження фертильності: кріоконсервацію ембріонів, ооцитів, оваріальної тканини. У період між хірургічним лікуванням і початком променевої та хіміотерапії є припустимим проведення програми контрольованої стимуляції овуляції та кріоконсервації отриманих ембріонів/ооцитів. У разі необхідності старту хіміотерапії перед хірургічним лікуванням пацієнткам проводять кріоконсервацію оваріальної тканини з подальшою аутотрансплантацією та відновленням фолікулогенезу з метою вироблення власних ооцитів. Хіміотерапія при раку грудної залози включає застосування алкілуючих агентів, що призводить до найбільш вираженої загибелі фолікулів і незворотних ушкоджень генетичного матеріалу ооцитів ранніх стадій розвитку. Після зазначеного лікування методом допоміжних репродуктивних технологій може стати тільки донація ооцита. Тому консультація пацієнток цієї категорії з приводу збереження дітородної функції необхідна на етапі вироблення тактики лікування основного захворювання.
Резюме. Адъювантная химиотерапия, проводимая у женщин репродуктивного возраста с диагнозом рака грудной железы, приводит к выраженному снижению овариального резерва, вплоть до полного выключения функции яичников — синдрому преждевременного истощения яичников. Для полноценной реабилитации у определенной категории пациенток возникает вопрос о восстановлении репродуктивной функции. Выбор тактики ведения данных больных основывается на совместной работе онколога и репродуктолога. Задачей онколога является назначение основного лечения (сначала хирургическое лечение или химиотерапия) и прогнозирование исхода заболевания. Задача репродуктолога состоит в определении возможности реализации репродуктивной функции, которая зависит от возраста, овариального резерва, репродуктивного анамнеза, риска наступления преждевременного истощения яичников. В Центре репродукции человека «Клиника профессора А.М. Феськова» применяют следующие методы сохранения фертильности: криоконсервацию эмбрионов, ооцитов, овариальной ткани. В период между хирургическим лечением и началом лучевой и химиотерапии допустимо проведение программы контролируемой стимуляции овуляции и криоконсервации полученных эмбрионов/ооцитов. В случае необходимости старта химиотерапии перед хирургическим лечением пациенткам проводят криоконсервацию овариальной ткани с последующей аутотрансплантацией и восстановлением фолликулогенеза с целью выработки собственных ооцитов. Химиотерапия при раке грудной железы включает применение алкилирующих агентов, что приводит к наиболее выраженной гибели фолликулов и необратимым повреждениям генетического материала ооцитов ранних стадий развития. После указанного лечения методом вспомогательных репродуктивных технологий может стать только донация ооцита. Поэтому консультация пациенток данной категории по поводу сохранения детородной функции необходима на этапе выработки тактики лечения основного заболевания.
 Введение
Введение
Ежегодно в мире регистрируют повышение частоты заболеваемости раком грудной железы (РГЖ) среди женщин в возрасте младше 40 лет. В современном украинском обществе рождение первого ребенка в силу социальных условий все чаще приходится на возраст старше 30 лет. В это время овариальный резерв претерпевает значительные изменения, что выражается в его критическом снижении после 35 лет (рис. 1). Это проявляется в значительном снижении частоты наступления беременности, даже в условиях физиологического эндокринного фона, состояния либидо, психоэмоциональной сферы и т.п.
Адъювантная терапия, проводимая после оперативного лечения [1], включает протоколы химиотерапевтических препаратов, обладающих гонадотоксическими характеристиками.
Наступление синдрома преждевременного истощения яичников в результате лечения лишает женщин
возможности продолжения рода.
Ввиду гормонзависимой природы заболевания в большинстве случаев наступление аменореи является необходимым компонентом терапии с целью снижения частоты рецидивов и повышения частоты выживаемости пациенток [2]. Таким образом, женщине, проходящей антигормональную терапию в комбинации с химиотерапией, придется отложить рождение ребенка на 5 лет и более. У женщин после 30 лет такое лечение значительно уменьшает количество фолликулов в корковом слое яичника, что в связи с возрастом приводит к бесплодию.
Основными факторами химиотерапевтически индуцированной аменореи являются возраст, в котором проведена терапия, вид химиотерапевтических препаратов и количество курсов.
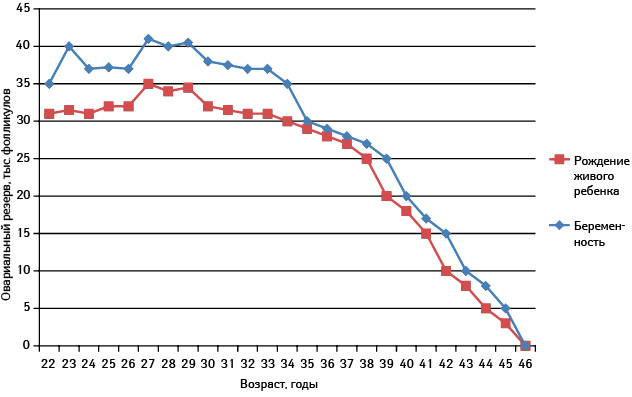
Рис. 1. Возраст и овариальный резерв
Алкилирующие агенты являются одними из давно применяемых и эффективных химиотерапевтических препаратов при РГЖ, при этом будучи самым разрушительным фактором для овариального резерва. Пациентки, которым проведено лечение циклофосфамидом в эквивалентной дозе 2,4–3 г/м2 в течение 12 нед, могут добавить минимум 10 лет к своему репродуктивному возрасту или 2–3 года на каждый цикл химиотерапии [3–5].
Восстановление менструальной функции возможно у пациенток после проведения полного курса лечения РГЖ. Такая картина вовсе не отражает восстановление овариального резерва и репродуктивного потенциала в целом. Из остаточных фолликулов, мобилизированных под воздействием гормонов гипоталамо-гипофизарной оси, созревает один, происходит выработка эстрадиола, что проявляется наступлением циклических изменений в эндометрии.
Классические программы сохранения фертильности с применением вспомогательных репродуктивных технологий (ВРТ) проводят в период 2–6 нед между хирургическим лечением и началом адъювантной химиотерапии [6]. Такой подход обусловлен безопасностью для женщины в аспекте частоты рецидива заболевания [7].
Опции сохранения детородной функции
Больным РГЖ доступны следующие опции ВРТ:
- криоконсервация эмбрионов;
- криоконсервация ооцитов;
- криоконсервация и аутотрансплантация аутологичной овариальной ткани.
В онкологической практике с целью уменьшения воздействия химиотерапевтических препаратов на яичники используют торможение функции органов препаратами агонистов гонадотропин-рилизинг гормона (ГнРГ) [8].
Недостатки применения агонистов ГнРГ — высокая стоимость лечения и повреждение генетического материала ооцитов, однако меньшее количество фолликулов подвергается механизму «выгорания» [9], что делает эту опцию применимой у пациенток, проходящих менее гонадотоксичную химиотерапию при других патологиях. Такие методы используют в своей практике врачи-онкологи преимущественно для сохранения эндокринной функции. Однако эффективность этих подходов (в аспекте сохранения яичника для последующего наступления беременности) значительно уступает опциям ВРТ.
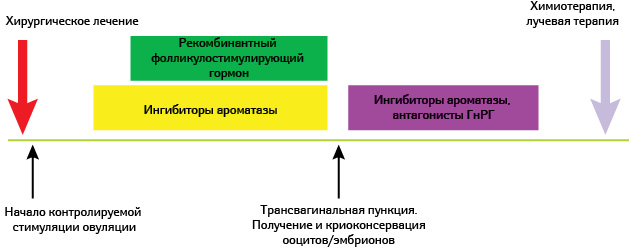
Рис. 2. Схема КОС при РМЖ
Для получения ооцитов как для криоконсервации, так и для оплодотворения с целью криоконсервации эмбрионов необходима стимуляция яичников для продуцирования больше одной яйцеклетки, как это происходит в естественном цикле.
Программа экстракорпорального оплодотворения с контролируемой стимуляцией овуляции для гормонзависимых опухолей представляет собой процедуру продолжительностью в среднем 8–11 дней, при которой антральные фолликулы запускаются в рост под воздействием рекомбинантного фолликулостимулирующего гормона. Повышение уровня эстрадиола в плазме крови, что является закономерным процессом в результате роста нескольких фолликулов, выступает фактором риска даже при ER-отрицательном варианте РГЖ. Поддержание уровня эстрадиола не выше физиологического (в период овуляции в естественном цикле) в циклах контролируемой овариальной стимуляции достигается введением препаратов ингибиторов ароматазы (летрозол, анастрозол) [10]. Данный подход позволяет проводить как «мягкие стимуляции», так и стимуляции с ростом 10–15 фолликулов, при котором к моменту получения ооцитов путем трансвагинальной пункции уровень эстрадиола составит <500 пг/мл [11] на протяжении 3–4 дней, после чего будет снижен антагонистами ГнРГ и прочими антиэстрогенными препаратами [12, 13] (рис. 2).
При противопоказаниях к проведению контролируемой стимуляции овуляции, которыми при РГЖ являются соматический статус и/или необходимость начала химиотерапии перед хирургическим лечением, для сохранения детородной функции проводится криоконсервация овариальной ткани [14, 15].
Данная опция ВРТ остается единственной возможностью для пациенток стать матерью генетически своего ребенка. Криоконсервация ткани яичника не требует стимуляции овуляции или какой-либо подготовки и может быть проведена в кратчайшие сроки после удаления коркового слоя яичника лапароскопическим доступом [16].
Алгоритм сохранения коркового слоя яичника при РГЖ представлен на рис. 3.
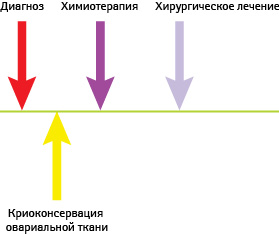
Рис. 3. Алгоритм сохранения коркового слоя яичника при РМЖ
Более подробный алгоритм сохранения коркового слоя яичника при РГЖ:
- установление диагноза;
- определение тактики лечения — необходимость проведения химиотерапии перед хирургическим лечением;
- лапароскопия, диссекция коркового слоя яичника;
- криоконсервация коркового слоя яичника (овариальной ткани);
- положительный исход;
- минимум через 5 лет — аутотрансплантация по согласованию с врачом-онкологом.
Корковый слой яичника женщины в своей верхней части (до 1 мм) содержит огромное количество преантральных фолликулов (примордиальные, первичные, вторичные), в которых находятся ооциты ранних стадий развития [17].
Относительно высокий индекс соотношения площадь поверхности/объем, низкий уровень метаболической активности, арест митотического деления ооцитов на стадии диплотены профазы 1-го деления мейоза делают корковый слой яичника приемлемым биологическим материалом для эффективной криоконсервации [18].
Аутотрансплантация возможна минимум через 5 лет, что еще раз подчеркивает важность отбора пациенток на этапе планирования их тактики ведения [19]. Оптимальной является ортотопическая трансплантация — в медуллярный слой яичника [20]. Все успехи криоконсервации овариальной ткани обязаны именно этому методу (за исключением двух беременностей после аутотрансплантации в широкую связку матки [21] и на брюшину передней брюшной стенки [22]).
Возможна также гетеротопическая аутотрансплантация — в области подкожных карманов предплечья, передней брюшной стенки, париетальной брюшины передней брюшной стенки. Однако при таком подходе возможно лишь восстановление эндокринной функции на непродолжительный период, так как реваскуляризация трансплантатов менее интенсивна, что из-за ишемии приводит к большей потере преантральных фолликулов [23]. Также создающееся давление негативно влияет на рост развившихся антральных фолликулов [24].
После аутотрансплантации и восстановления эндокринной функции, которое при ортотопической трансплантации длится 3–4 мес, женщинам проводят мониторинг фолликулогенеза [25]. При проходимости маточных труб, благоприятном состоянии имплантационных свойств эндометрия, фертильных параметрах спермы мужа возможно как естественное наступление беременности, так и инсеминация спермой мужа. Однако целью ВРТ сегодня является рождение здорового потомства. В большинстве случаев программу экстракорпорального оплодотворения используют для выбора генетически здорового эмбриона.
Существует теоретический риск реимплантации опухолевых клеток после аутотрансплантации коркового слоя ткани яичника. Однако этот риск остается лишь теоретическим, так как для этой процедуры проводят строгий отбор пациенток. В мире не зарегистрировано не единого случая реимплантации опухолевых клеток [35].
Криоконсервация овариальной ткани на протяжении более столетия зарекомендовала себя в качестве метода восстановления эндокринной функции у женщин с менопаузальными расстройствами. По данным 2013 г., около 40 детей в мире родились в результате применения данной методики [26], которую использовали как опцию ВРТ с целью сохранения фертильности. Однако статус ее применения, по мнению Американской ассоциации репродуктивной медицины (American Society for Reproductive Medicine), остается экспериментальным [27].
Криоконсервация эмбрионов и ооцитов являются наиболее эффективными методами, позволяющими сохранить детородную функцию у женщин, больных РГЖ.
Генетические риски развития РГЖ у потомства и пути их снижения
Известно, что злокачественное новообразование — это результат реализовавшейся генетической предрасположенности как под влиянием провоцирующих факторов (например РГЖ, ассоциированный с беременностью, бесконтрольное применение гормональных препаратов), так и без их участия [28].
Для примера приведем интересный факт, который демонстрирует, как онкология тесно переплетается с репродуктологией.
Скомпрометированный геном ооцита для репродукции — результат отсутствия оплодотворения или замирания эмбриона, а также иных аномалий развития репродуктивных клеток, которые эмбриолог четко прослеживает на этапе культивирования.
Скомпрометированный геном женщины в онкологии — это предрасположенность к развитию злокачественного новообразования у данной биологической особи [28].
Современная молекулярная генетика придает большое значение носительству BRCA1/2 мутаций. Например, в ряде стран со страховой медициной носителям указанных мутаций предусмотрено бесплатное углубленное обследование по поводу профилактики РГЖ [29].
С точки зрения молекулярной генетики BRCA1/2 мутации являются олигонуклеотидным полиморфизмом. BRCA 1 и 2, по данным на 2007 г., имеют суммарно 1037 функциональных олигонуклеотидных последовательностей, являющихся причиной РГЖ [30]. Исследуемое во всем мире носительство 4 и 5 патологических олигонуклеотидных последовательностей BRCA 1 и 2 соответственно представляет собой статистически доказанное повышение частоты заболеваемости РГЖ, раком яичника, отделов толстого кишечника, у мужчин — раком предстательной железы. Для каждой популяции выделены свои «патологические» последовательности [31].
ВРТ включают предимплантационную генетическую диагностику эмбриона, что дает возможность определить хромосомные аномалии и моногенные заболевания. После введения в широкую практику методик биопсии трофэктодермы эмбриона 5–6-суточного развития — бластоцисты — стало возможным определение BRCA1/2 мутаций. При выявленном у матери носительстве указанных генов такой подход позволяет значительно снизить риск передачи РГЖ потомству [32].
Случаи «семейного рака» при планировании проведения ВРТ с целью сохранения фертильности являются показанием к обсуждению с пациенткой вопроса о донации ооцита, так как частота развития РГЖ (или рака иных локализаций) у потомства будет значительно превышать общепопуляционную.
РГЖ и беременность
Несмотря на данные доказательной медицины о безопасности течения беременности после пролеченного РГЖ, вопрос остается дискутабельным [33]. Однако метаанализ 14 исследований, в которые были включены 1244 случая наступления беременности (у женщин после лечения РГЖ) и 18 145 случаев, составивших контрольную группу, доказал отсутствие существенных различий в выживаемости между контрольной и исследуемой группой [34].
Женщинам доступны 2 варианта вынашивания плода: в полости матки или гестационное (суррогатное) материнство. Выбор зависит прежде всего от возраста, в котором женщина решила реализовать свое право на материнство, оценки состояния полости матки и возможности вынашивания плода. С онкологической точки зрения при принятии решения основными являются мнение врача-онколога, стадия заболевания (определяющие факторы — состояние лимфатических узлов и наличие/отсутствие метастазов), молекулярная таксономия новообразования.
Выводы
Увеличение продолжительности жизни пациенток после лечения РГЖ стало результатом достижений современной онкологии. Такие параметры ставят новую задачу перед медициной — улучшение качества жизни. Для молодых женщин, получивших лечение по поводу РГЖ, вопросы планирования семьи становятся доминантными в планах самореализации. Принятие решения относительно детородной функции и реализации репродуктивного потенциала является залогом успеха реабилитации женщины.
Применение у молодых пациенток схем лечения с менее гонадотоксическим действием может быть рассмотрено при опухолях с благоприятным прогнозом. Однако при необходимости агрессивной терапии, способной вызвать преждевременное истощение яичников, то есть их «выключение», методы сохранения репродуктивной функции должны быть рассмотрены онкологом и репродуктологом с участием самой пациентки.
Криоконсервация эмбриона — наиболее эффективная методика сохранения фертильности для замужних женщин, так как для получения эмбриона необходим сперматозоид для оплодотворения ооцита. При желании женщины использовать сперму донора опция криоконсервации эмбриона также доступна. Эффективность такой методики составляет 43–67% в криопротоколе в рамках программы ВРТ.
Криоконсервация ооцитов является оптимальным методом сохранения генетического материала для молодых незамужних женщин. Однако для достижения частоты наступления беременности, равной таковой при использовании криоконсервированных эмбрионов, необходимо в среднем 6–9 зрелых ооцитов (стадия М2).
При противопоказаниях к проведению контролируемой стимуляции овуляции у пациенток в возрасте до 35 лет применяют криоконсервацию коркового слоя яичника, содержащего преантральные фолликулы. После снятия женщины с онкологического учета, что происходит минимум через 5 лет, производят аутотрансплантацию ткани яичника с целью восстановления эндокринной и овуляторной функции. Это позволяет продуцировать яичником собственные ооциты.
Онкофертильность при РГЖ является мультидисциплинарной проблемой. Определение онкологом лечения, прогноза выживаемости, а врачом репродуктивной медицины — возможности реализовать каждой пациенткой свой репродуктивный потенциал является залогом успеха в достижении цели стать матерью.
Список использованной литературы
- Goldhirsch A., Ingle J.N., Gelber R.D. et al. (2009) Thresholds for therapies: highlights of the St. Gallen International Expert Consensus on the primary therapy of early breast cancer 2009. Ann. Oncol., 20: 1319–1329.
- Gnant M., Greil R., Kubista E. et al. (2006) The impact of treatment-induced amenorrhea on survival of premenopausal patients with endocrine-responsive breast cancer: 10-year result of ABCSG-05 (CMF vs. goserelin þ tamoxifen). 2006 Breast Cancer Res. Treat., 100: S10–1.
- Petrek J.A., Naughton M.J., Case L.D. et al. (2006) Incidence, time course, and determinants of menstrual bleeding after breast cancer treatment: a prospective study. J. Clin. Oncol., 24: 1045–51.
- Walshe J.M., Denduluri N., Swain S.M. et al. (2006) Amenorrhea in premenopausal women after adjuvant chemotherapy for breast cancer. J. Clin. Oncol., 24: 5769–79.
- Gerber B., Dieterich M., Muller H., Reimer T. (2008) Controversies in preservation of ovary function and fertility in patients with breast cancer. Breast Cancer Res. Treat., 108: 1–7.
- Lee S.J., Schover L.R., Partridge A.H. et al. (2006) American Society of Clinical Oncology American Society of Clinical Oncology recommendations on fertility preservation in cancer patients. J. Clin. Oncol., 24: 2917–31.
- Oktay K. (2005) Further evidence on the safety and success of ovarian stimulation with letrozole and tamoxifen in breast cancer patients undergoing in vitro fertilization to cryopreserve their embryos for fertility preservation. J. Clin. Oncol., 23: 3858–3859.
- Clowse M.E.B., Behera M.A., Anders C.K. et al. (2005) Ovarian Preservation by GnRH Agonists during Chemotherapy: A Meta-Analysis. J. Womens Health (Larchmt), 18(3): 311–319.
- Kalich-Philosoph L., Roness H., Carmel A. et al. (2013) Cyclophosphamide Triggers Follicle Activation and «Burnout»; AS101 Prevents Follicle Loss and Preserves Fertility. Sci. Transl. Med., 5: 185ra62.
- Sonmezer M., Oktay K. (2006) Fertility preservation in young women undergoing breast cancer therapy. Oncologist, 11: 422–434.Cahill D.J., Wardle P.G., Harlow C.R. et al (2000) Expected contribution to serum oestradiol from individual ovarian follicles in unstimulated cycles. Hum. Reprod., 15: 1909–1912.
- Oktay K. (2005) Further evidence on the safety and success of ovarian stimulation with letrozole and tamoxifen in breast cancer patients undergoing in vitro fertilization to cryopreserve their embryos for fertility preservation. J. Clin. Oncol., 23: 3858–3859.
- Azim A., Costantini-Ferrando M., Oktay K. (2007) Relative potencies of anastrozole and letrozole to suppress estradiol in breast cancer patients undergoing ovarian stimulation before in vitro fertilization. J. Clin. Endocrinol. Metab., 92: 2197–2200.
- Quinn G.P., Vadaparampil S.T., Lee J.H. et al. (2009) Physician referral for fertility-preservation in oncology patients: a national study of practice behaviors. J. Clin. Oncol., 27: 5952–7.
- Donnez J., Jadoul P., Squifflet J. et al. (2010) Ovarian tissue cryopreservation and transplantation in cancer patients. Best Pract. Res. Clin. Obstet. Gynaecol., 24: 87–100.
- McLaren J.F., Bates G.W. (2012) Fertility preservation in women of reproductive age with cancer. Am. J. Obstet. Gynecol., 207: 455–62.
- Donnez J., Martinez-Madrid B., Jadoul P. (2006) Ovarian tissue cryopreservation and transplantation: a review. Hum. Reprod. Update,12: 519–35.
- Keros V., Xella S., Hultenby K. (2009) Vitrification versus controlled-rate freezing in cryopreservation of human ovarian tissue. Hum. Reprod., 24(7): 1670–83. doi: 10.1093/humrep/dep079.
- Wallace W.H., Anderson R.A., Irvine D.S. (2005) Fertility preservation for young patients with cancer: who is at risk and what can be offered? Lancet Oncol., 6: 209–18.
- Silber S.J., Lenahan K.M., Levine D.J. et al. (2005) Ovarian transplantation between monozygotic twins discordant for premature ovarian failure. N. Eng. J. Med., 353: 58–63.
- Donnez J., Jadoul P., Pirard C. et al. (2012) Live birth after transplantation of frozen-thawed ovarian tissue after bilateral oophorectomy for benign disease. Fertil Steril, 98: 720–5.
- Stern C.J., Gook D., Hale L.G. et al. (2013) First reported clinical pregnancy following heterotopic grafting of cryopreserved ovarian tissue in a woman after a bilateral oophorectomy. Hum. Reprod., 28(11): 1–4. doi:10.1093/humrep/det360.
- Van Eyck A.S., Bouzin C., Feron O. et al. (2010) Both host and graft vessels contribute to revascularization of xenografted human ovarian tissue in a murine model. Fertil Steril, 93: 1676–85.
- Oktay K., Buyuk E., Veeck L. et al. (2004) Embryo development after heterotopic transplantation of cryopreserved ovarian tissue. Lancet, 363: 837–40.
- Donnez J., Squifflet J., Van Eyck A.S. et al. (2008) Restoration of ovarian function in orthopically transplanted cryopreserved ovarian tissue: a pilot experience. RBM Online, 16: 694–704.
- Donnez J., Silber S., Andersen C.Y. et al. (2011) Children born after autotransplantation of cryopreserved ovarian tissue. Ann. Med., 43: 437–50.
- American College of Obstetricians and Gynecologists Committee on Practice Bulletins № 126 (2012) Management of gynecological issues in women with breast cancer. Obstet. Gynecol., 119: 666–82.
- American Society of Clinical Oncology (2003) American Society of Clinical Oncology policy statement update: genetic testing for cancer susceptibility. J. Clin. Oncol., 21(12): 2397–406.
- Welcsh P.L., King M.C. (2001) BRCA1 and BRCA2 and the genetics of breast and ovarian cancer. Hum. Mol. Genet., 10(7): 705–13.
- Johnson N., Fletcher O., Palles C. (2007) Counting potentially functional variants in BRCA1, BRCA2 and ATM predicts breast cancer susceptibility. Hum. Mol. Genet., 16 (9): 1051–1057. doi: 10.1093/hmg/ddm050.
- Agnese D.M. (2006) Battle of the BRCA1/BRCA2(offspring) sex ratios: truth or consequences. J. Med. Genet., 43(3): 201–202. doi: 10.1136/jmg.2004.028977.
- McArthur S.J., Leigh D., Marshall J.T., de Boer K.A. (2005) Pregnancies and live births after trophectoderm biopsy and preimplantation genetic testing of human blastocysts. Fertil. Steril., 84(6): 1628–36.
- Peccatori F.A., Azim H.A. Jr. (2009) Pregnancy in breast cancer survivors: a need for proper counseling. Breast, 18(6): 337–8.
- Azim H.A. Jr., Santoro L., Pavlidis N. et al. (2011) Safety of pregnancy following breast cancer diagnosis: A meta-analysis of 14 studies. Eur. J. Cancer 47: 74–83.
- Donnez J., Dolmans M.-M., Pellicer A. et al. (2013) Restoration of ovarian activity and pregnancy after transplantation of cryopreserved ovarian tissue: a review of 60 cases of reimplantation. Fertil. Steril., 99: 1503–13.














Leave a comment