Кишкова пластика в лікуванні ятрогенних пошкоджень сечоводів у хворих онкологічного профілю
Стаховський Е.О., Кононенко О.А., Вукалович П.С., Войленко О.А., Котов В.А., Вітрук Ю.В., Гаврилюк О.М.
Резюме. У статті досліджували ефективність використання кишкової пластики сечоводів у лікуванні протяжних ятрогенних пошкоджень сечоводів у пацієнтів онкологічного профілю. Показанням до заміщення сечоводу сегментом тонкої кишки у хворих на рак були протяжні пошкодження сечоводу з розвитком незворотних фіброзних змін у його стінці, відсутність ознак прогресування основного онкологічного захворювання, збережена функція нирки (рівень клубочкової фільтрації на боці ураження >12 мл/хв). У всіх 14 пацієнтів, обстежених у віддалений післяопераційний період, відмічено відновлення уродинаміки по сечовивідних шляхах. Кишкова пластика сечоводів дає можливість зберегти нирку та покращити її функцію, що сприяє комплексному підходу до лікування хворих онкологічного профілю.

Вступ
За останні десятиріччя частота пошкоджень верхніх сечовивідних шляхів (ВСШ) значно зросла. Це пов’язано з розширенням показань до оперативного лікування злоякісних новоутворень малого таза, широким впровадженням у практику ендоурологічних, лапароскопічних оперативних втручань і частим застосуванням великофракційної променевої терапії [1–5].
Нині променеву терапію як самостійний метод або в поєднанні з оперативним втручанням застосовують у більшості хворих онкологічного профілю. При лікуванні пацієнток із раком шийки матки променеву терапію використовують більш ніж у 90% випадків [6].
Незважаючи на широке впровадження сучасного обладнання для проведення променевої терапії, удосконалення методики опромінення, кількість хворих із променевими ускладненнями залишається великою [7]. Частота розвитку урологічних ускладнень у хворих, що одержали променеву терапію, досягає 50%. Найбільш тяжкими з них є сечові нориці та стриктури сечоводів [8].
Відновлення прохідності сечових шляхів може бути здійснено за допомогою великої кількості методик, ефективність яких не завжди задовольняє хірурга. Проте у випадках протяжних дефектів сечоводу, які виникли в результаті впливу променевої терапії, розвитку післяпроменевого фіброзу, коли заміщення пошкодженого сечоводу сечовими шляхами є малоефективним, а інколи й неможливим, доцільно проводити органозамісні операції [9].
Використання ілеоуретеропластики набуло популярності в реконструктивній урології після того, як у 1909 р. Shoemaker вперше описав кишкову пластику сечоводу, а пізніше Goodwin та співавтори популяризували її при лікуванні сечокам’яної хвороби, нейром’язової дисплазії сечоводів, обструкції сечоводів, зумовленої туберкульозом, та ін. [10–13]. Останнім часом втілення нових методів лікування (лапароскопічних, ендоскопічних), а також підвищення онкологічної захворюваності та розширення показань до оперативного і комбінованого лікування зумовили збільшення кількості ятрогенних пошкоджень ВСШ, що є однією з причин частішого проведення нефректомій в Україні. Визначення тактики лікування та пошук шляхів відновлення цілісності сечовивідного тракту при протяжних пошкодженнях сечоводу у хворих з онкологічною патологією є однією з актуальних проблем пластичної урології.
Залишаються не до кінця вивченими особливості уродинаміки та функція нирки у пацієнтів із кишковою пластикою сечоводів.
Мета: вивчити ефективність використання кишкової пластики сечоводів у лікуванні протяжних ятрогенних пошкоджень сечоводів у хворих онкологічного профілю.
Об’єкт і методи дослідження
Клінічному аналізу підлягали 18 хворих (29 сечоводів) з ятрогенними пошкодженнями сечоводів, яким у науково-дослідному відділенні пластичної та реконструктивної онкоурології Національного інституту раку проведено обстеження та оперативне лікування із заміщенням сечоводу ізольованим сегментом тонкої кишки.
Однобічний уретерогідронефроз (УГН) діагностовано у 7 (38,8%) пацієнтів, двобічний — у 11 (61,2%).
Хворим проведено комплексне обстеження з вивченням анатомо-функціональних змін сечовидільної системи та функції нирок як до, так і після операції, що включало: лабораторні аналізи, ультразвукове дослідження, екскреторну урографію, антеградну пієлоуретерографію, цистографію, комп’ютерну томографію, магнітно-резонансну томографію, кліренс-тести ендогенного креатиніну, динамічну реносцинтиграфію, урофлоуметрію.
Вік пацієнтів коливався в межах 33–67 років і в середньому становив 56,4±8,2 року. Чоловіків було 2 (11,1%), жінок — 16 (89,9%).
Однобічна кишкова пластика сечоводів виконана 7 (38,8%) пацієнтам, двобічна — 11 (61,2%).
Віддалені результати вивчено у 14 (77,7%) хворих в строки від 3 міс до 5 років. Оцінку ефективності оперативного лікування проводили за 4-бальною шкалою:
- відмінний результат: відсутність скарг пацієнта та проявів пієлонефриту, повне відновлення уродинаміки по ВСШ, відновлення нормальних розмірів сечоводу, чашечко-мискової системи нирки, кількісні показники клубочкової фільтрації (КФ) в межах норми, відсутній міхурово-ілеальний рефлюкс, працездатність збережена;
- добрий результат: можуть виникати періодичні незначні скарги на біль на боці пошкодження сечоводу, загострення пієлонефриту відсутні, порівняно з доопераційними показниками рентгенорадіологічних досліджень спостерігається позитивна динаміка анатомо-функціональних змін, що передбачає нормалізацію розмірів або зменшення ектазії порожнистої системи нирки, покращення уродинаміки та функції нирки, фармакостимуляція фуросемідом сприяє виведенню контрастної речовини з нирки, зберігається працездатність;
- задовільний результат: скарги пацієнта на періодичний біль ниючого характеру в поперековій ділянці, можливі періодичні загострення пієлонефриту, що піддаються антибактеріальній терапії, уродинаміка та функція нирки зберігаються на доопераційному рівні, можливий міхурово-ілеальний рефлюкс, за відсутності хронічної ниркової недостатності (ХНН) працездатність збережена;
- незадовільний результат: операція не призводить до суб’єктивного поліпшення стану хворого, а уродинаміка та функція нирки прогресивно знижуються, наявне прогресування ХНН при двобічній патології, діагностується рецидивна обструкція сечоводу.
Результати
Найбільш частим показанням до виконання ілеоуретеропластики з приводу ятрогенного пошкодження сечоводу був післяпроменевий заочеревинний фіброз — у 13 (72,2%) пацієнтів, у 3 (16,6%) випадках ятрогенне пошкодження сечоводу виникло під час пангістеректомії, в 1 (5,6%) — при передній резекції прямої кишки, ще в 1 (5,6%) — при екстирпації прямої кишки. У 2 хворих ятрогенна травма сечоводу ускладнена норицею сечоводу.
Аналіз клінічних даних показав, що у всіх пацієнтів причиною погіршення функції нирки був УГН. Його виникнення було зумовлено порушенням прохідності сечоводу на великій протяжності (більш ніж ⅓ довжини). В основі цих змін — ретроперитонеальний фіброз, який виник внаслідок променевої терапії (13 хворих), та сечовий заплив, спричинений пошкодженням сечоводу (5 пацієнтів).
Погіршення функції нирки проявлялося наявністю УГН, відсутністю або зниженням виділення рентген-контрастної речовини.
Першим етапом лікування виконано пункційну нефростомію під УЗД-контролем у 14 хворих (19 сечоводів).
Показанням до перкутанної нефростомії були: відсутність або різке зниження видільної функції нирки на екскреторній урографії при збереженій паренхімі (товщина паренхіми нирки >8 мм) — 10 хворих (у 6 виконано двобічну нефростомію); купірування проявів пієлонефриту — 4 пацієнти; по 1 випадку — ліквідація функціонуючої сечовідно-вагінальної та сечовідно-нашкірної нориці.
При дослідженні функції нирок до операції діагностовано ниркову недостатність у 14 (77,7%) пацієнтів. У 3 (21,4%) виявлено латентну стадію ХНН відповідно до класифікації М.А. Лопаткіна і І.М. Кучинського (1973 р.), у 4 (28,6%) — компенсовану, у 7 (50%) — інтермітуючу (табл. 1).
Таблиця 1. Стадії ХНН (М.А. Лопаткін, І.М. Кучинський, 1973 р.)
| Стадія ХНН | ЗКФ, мл/хв |
n=14 n (%) |
| І | 50,8±4,1 | 6 (42,9) |
| ІІ | 36,4±1,9 | 5 (35,7) |
| ІІІ | 30,3±2,4 | 3 (21,4) |
ЗКФ — тут і далі — загальна клубочкова фільтрація; n — кількість пацієнтів.
У 5 (17,2%) випадках обструкцію сечоводу діагностовано на рівні верхньої та середньої його третини, у 16 (55,2%) — на рівні нижньої половини, у 8 (27,6%) — на рівні нижньої третини.
Показанням
до заміщення сечоводу сегментом тонкої кишки у хворих онкологічного профілю були протяжні пошкодження сечоводу з розвитком незворотних фіброзних змін у його стінці, відсутність ознак прогресування основного онкологічного захворювання, збережена функція нирки (рівень КФ на боці ураження >12 мл/хв).
Протипоказаннями до кишкової пластики сечоводів були: спайкова хвороба шлунково-кишкового тракту, термінальна ниркова недостатність, декомпенсована супутня патологія, прогресування основного онкологічного захворювання та ін.
При застосуванні кишкової пластики сечоводів ми дотримувалися нижченаведених принципів виконання операції. Кишковий трансплантат має мати адекватну довжину. Середня довжина тонкої кишки, яку використовували для заміщення сечоводу, становила 21,4±3,6 см. Надто довгий трансплантат призводить до поганого пасажу сечі та може викликати ацидоз. Сегмент кишки слід відсікати на відстані 40 см від баугінієвої заслінки, тому що термінальна частина тонкої кишки має загальне кровопостачання та іннервацію зі сліпою кишкою, вітамін В12 всмоктується в основному у дистальному відділі здухвинної кишки. Відновлення прохідності тонкого кишечнику виконували шляхом накладання анастомозу «кінець в кінець». При розмірі кишкового трансплантата понад 15 см його розміщення має бути ізоперистальтичним. Анастомоз сечоводів у кишку накладали методом «кінець в бік». Слизова оболонка трансплантата в перші дні виділяє велику кількість слизу, тому його необхідно дренувати. Кишковий трансплантат розміщували в черевній порожнині, а анастомози — екстраперитонеально. При заміщенні обох сечоводів необхідно використовувати один трансплантат, який розташовують ізоперистальтично. У 14 пацієнтів із метою запобігання міхурово-кишковому рефлюксу дистальний відділ кишкового трансплантата моделювали за методикою професора Е.О. Стаховського, що передбачало формування в місці кишково-міхурового анастомозу двох окремих каналів.
У 18 випадках операцію проводили лапаротомним доступом під комбінованою епідуральною анестезією. Крововтрата становила 93±38 мл. Післяопераційний ліжко-день тривав 13,2±1,4 дня.
Ускладнення в післяопераційний період діагностовано у 7 (38,9%) пацієнтів: в 1 випадку зареєстровано гостру кишкову непрохідність, у 3 — нагноєння післяопераційної рани, в 1 — тривалий парез кишечнику і в 2 — загострення пієлонефриту.
Загострення ХНН у ранній післяопераційний період відмічали у 4 (22,2 %) пацієнтів із ХНН ІІІ ступеня, що потребувало медикаментозної корекції азотистого обміну, водно-електролітного балансу й антибактеріальної терапії.
У 14 (77,7%) хворих були проведені контрольні обстеження у віддалений післяопераційний період у строки від 3 міс до 5 років.
У всіх 14 пацієнтів, обстежених у віддалений післяопераційний період, відзначено відновлення уродинаміки по сечовивідних шляхах.
Порівняльна оцінка комплексного обстеження до та після оперативного лікування з використанням ізольованого сегмента тонкої кишки дозволило оцінити ефективність операції на основі аналізу анатомо-функціональних змін у нирках та ВСШ (табл. 2).
Таблиця 2. Анатомо-функціональна характеристика ВСШ до та після заміщення сечоводу сегментом тонкої кишки
| Показник | До операції,n (%) (n=18) | Після операції (3 міс),n (%) (n=14) | р |
| УГН (сечоводів) | 29 (80,5) | 7 (25) | χ2=19,7 р<0,05 |
| КФ на боці ураження (мл/хв) | 24,6±5,3 | 29,2±7,5 | р<0,05 |
| ЗКФ (мл/хв) | 42,5±13,6 | 62,4±7,4 | р<0,001 |
| ХНН (ЗКФ ≤60 мл/хв) | 14 (77,7) | 6 (42,8) | χ2 =4,09 р=0,12 |
Після контрольного обстеження у термін 3 міс після проведення реконструктивних оперативних втручань із використанням сегмента тонкої кишки кількість УГН достовірно зменшилася (7 (25%) випадків).
Проведено оцінку роздільної КФ на боці ураження та ЗКФ. Виявлено, що виконання кишкової пластики сечоводів дозволило збільшити КФ із 24,6 до 29,2 мл/хв на боці ураження, а ЗКФ — із 42,5 до 62,4 мл/хв (р<0,05).
Проведений статистичний аналіз не виявив достовірної різниці між кількістю пацієнтів із ХНН до та після операції, що було зумовлено невеликою кількістю учасників дослідження (χ2=4,09; р=0,12), хоча відмічено позитивну динаміку у хворих на ХНН (зменшення з 14 (77,7%) до 6 (42,8%) випадків) після проведення ілеоуретеропластики.
Серед 14 пацієнтів, обстежених у післяопераційний період, міхурово-кишковий рефлюкс діагностовано у 2 (14±10%).
Аналіз згідно з критеріями оцінки ефективності лікування показав, що у 4 (28,6%) пацієнтів результат був відмінний (рисунок), у 6 (42,8%) — добрий, у 4 (21,4%) — задовільний; незадовільних результатів не відзначено.
а
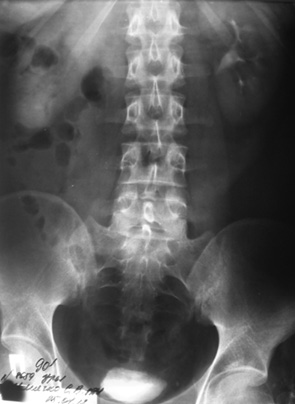
б
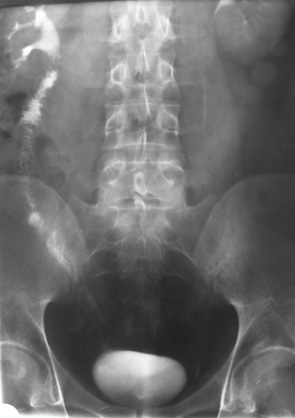
Рисунок. Дані обстеження хворого О. до та після кишкової пластики сечовода: а) екскреторна урографія до операції: різке зниження секреторно-видільної функції правої нирки, відсутнє контрастування порожнистої системи нирки та сечовода як результат травматичного пошкодження сечоводу і сечового запливу; б) екскреторна урографія після операції: хороша секреторно-видільна функція правої нирки після тотальної кишкової пластики правого сечоводу — порожниста система нирки не розширена, заповнюється контрастом на 10-й хвилині, контрактується кишковий трансплантат
Незважаючи на хороші функціональні результати, власне онкологічний у 5 пацієнтів був поганим. Так, у 2 осіб діагностовано прогресування первинного онкологічного захворювання у 1-й рік спостереження. У зв’язку з місцевим рецидивом, множинними метастазами у паренхіматозні органи пацієнти померли на 5-й та 7-й місяць після проведення реконструктивного оперативного втручання.
У інших 3 пацієнтів також діагностовано метастази протягом періоду спостереження. Хворі отримали ад’ювантний курс хіміотерапії. 2 пацієнтів з прогресуванням онкологічного захворювання наразі перебувають в ремісії.
Обговорення
Нині в Україні, незважаючи на збережену функцію нирки при протяжних пошкодженнях сечоводу, виконують нефректомію чи довічну нефростомію, які призводять до інвалідизації хворого. Часто пацієнти з онкологічним захворюванням потребують комплексного лікування, яке передбачає проведення ад’ювантної хіміотерапії, а її нефротоксичний ефект і супутня патологія (цукровий діабет, гіпертонічна хвороба та ін.) сприяють розвитку або поглибленню ХНН. Слід зазначити, що порушення функції нирок, зниження рівня КФ є одним із протипоказань до проведення хіміотерапії, тому покращення функції нирок шляхом відновлення уродинаміки дає можливість комплексного підходу до лікування хворих онкологічного профілю.
Відсутність видільної функції нирки на екскреторній урографії не має бути показанням до нефректомії. Результати нашого дослідження показують, що пункційна нефростомія як перший етап оперативного лікування дає можливість відновити екскреторну функцію нирки, провести необхідні функціональні (кліренс-тести ендогенного креатиніну) та інструментальні методи обстеження (антеградна пієлоуретерографія, визначення рівня обструкції сечоводу), тим самим вирішити питання доцільності та обсягу оперативного втручання. Крім того, пункційна нефростомія дозволяє знизити рівень креатиніну та сечовини крові при двобічній патології, купірувати пієлонефрит, больові прояви та ін.
Результати нашого дослідження продемонстрували, що основним показанням до кишкової пластики є протяжне пошкодження сечоводу з незворотними змінами в його стінці. Операція покращує функцію нирки шляхом відновлення уродинаміки, а також підвищує якість життя пацієнта.
Слід зазначити, що наша оперативна техніка виконання кишкової пластики сечоводів відрізнялася від описаної у вітчизняній та зарубіжній літературі. Ми, на відміну від деяких авторів (Д.П. Чухрієнко, А.В. Люлько, 1972; Ф. Хінман, 2007), розміщуємо кишковий трансплантат інтраабдомінально, що є профілактикою ішемії сегмента тонкої кишки та забезпечує адекватну перистальтику виключеного сегмента кишки; уретероілеоанастомоз накладаємо екстраперитонеально «кінець в бік» з метою попередження стриктури анастомозу, екстраперитонеальне розміщення попереджує формування сечового запливу. Наступною особливістю методики є те, що тонкокишковий трансплантат має бути адекватної довжини, оскільки надто довгий сегмент тонкої кишки спричиняє формування перегину трансплантата, що викликає застій слизу, сечі, підвищення ризику ацидозу. У свою чергу, короткий трансплантат зумовлює натяг та ішемію, що порушує перистальтику, призводить до формування стриктури анастомозів.
У дослідженні лише у 2 (14±10%) із 14 пацієнтів, обстежених у віддалений післяопераційний період, зареєстровано міхурово-кишковий рефлюкс, який не викликав особливих змін із боку уродинаміки та функції нирки. Зазначеним пацієнтам не проводили інтраілеальну пластику — з метою запобігання рефлюксу. В обох випадках міхурово-кишковий рефлюкс не супроводжувався клінічними проявами і не потребував додаткової медикаментозної терапії.
Ускладнення в ранній післяопераційний період констатували майже у 39% хворих. Така частота ускладнень пов’язана з тим, що 13 (72,2%) із 18 пацієнтів отримували променеву терапію, 16 (88,8 %) перенесли дві та більше операцій на органах малого таза та заочеревинному просторі. У пацієнтів, що отримали променеву терапію, відзначали вищий рівень післяопераційних ускладнень, таких як ранева інфекція, кишкова непрохідність, пов’язаних із розвитком післяпроменевого фіброзу, ішемії та спайкової хвороби.
Ілеоуретеропластика у віддалений післяопераційний період не потребує ні зовнішніх, ні внутрішніх дренажних систем нирки, тим самим забезпечуючи пацієнтам високу якість життя.
У віддалений післяопераційний період відзначено підвищення рівня КФ (з 24,6 до 29,2 мл/хв) на боці ураження після виконання реконструктивних оперативних втручань, що дало можливість зменшити кількість випадків ХНН практично на 35%.
Висновки
Основним показанням до виконання кишкової пластики сечоводів є протяжні незворотні зміни в сечоводі при збереженій функції нирки.
Кишкова пластика сечоводів дає можливість зберегти нирку та покращити її функцію, тим самим зменшити кількість випадків розвитку ХНН, що сприяє комплексному підходу до лікування пацієнтів онкологічного профілю. Тому збереження нирки при протяжних пошкодженнях ВСШ є дуже важливим завданням в онкології.
Список ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Кан Я.Д., Афанасьев М.Б. (1988) Обструкция мочеточников после лучевой терапии у онкологических больных. Урол. и нефрол, 2: 31–34.
2. Лоран О.Б., Годунов Б.Н., Зайцев А.В. и др. (2000). Повреждения органов мочевой системы при эндоскопических операциях в гинекологии. Акушерство и гинекология, 1: 19–23.
3. Пронин В.И., Кан Я.Д., Зверев М.П. (1987) Осложнения со стороны верхних мочевых путей после лучевой и комбинированной терапии больных раком мочевого пузыря. Урол. и нефрол., 3: 42–43.
4. Applegate G.B., Bass K.M., Kubick C.J. (1987) Ureteral obstruction as a complication of the Burch colposuspension procedure: case report. Am. J. Obstet. Gynecol., 156: 445.
5. Maier U., Hofbauer J. (1986). Urolodische Komplicationen nach kurativer Strahlentherapie dynakologischer Karzinome. Urologe (Ausg. A), 25 (1): 33–37.
6. Крикунова Л.И. (2002). Лучевая терапия рака шейки матки. Практическая онкология, 3(3): 194–199
7. Matsuura Y., Kawagoe T., Toki N. et al. (2006). Long-standing complication after treatment for cancer of the uterine cervix-clinical significance of medical examination at 5 years after treatment. Int. J. Gynecol. Cancer, 16 (1): 294–7.
8. Лоран О.Б., Липский В.С. (2001) Медицинская и социальная реабилитация женщин, страдающих пузырно-влагалищными свищами. Саратов: Приволж. Книжное изд-во. 110 с.
9. Hinev A. (2008) Ureteral substitution by an isolated ileal segment via novel antireflux technique: initial experience with 5 case. ACI, 4: 37–41.
10. Shoemaker: Cited by Hinman F. (1936) A critical study of the different principles of surgery whitch have been used in uretero-intestinal implantation. Ass. Genito-Urin. Surg., 29: 15.
11. Boxer R., Skinner D., Goodwin W. (1979) Replacement of ureter by small intestine: clinical application and results of the ileal yreter in 89 patients. J. Urol., 121: 728.
12. Карпенко В.С. (1998). Применение кишечной пластики в хирургии уретерогидронефроза. Клінічна хірургія, 12: 34–39.
13. Armatys S.A., Mellon M.J., Beck S.D. et al. (2009) Use of ileum as ureteral replacement in urological reconstruction. J. Urol., 181(1):
177–81.
Кишечная пластика в лечении ятрогенных повреждений мочеточников у больных онкологического профиля
Резюме. В статье исследовали эффективность использования кишечной пластики мочеточников в лечении протяженных ятрогенных повреждений мочеточников у больных онкологического профиля. Показанием к замещению мочеточника сегментом тонкой кишки у больных раком были протяженные повреждения мочеточника с развитием необратимых фиброзных изменений в его стенке, отсутствие признаков прогрессирования основного онкологического заболевания, сохраненная функция почки (уровень клубочковой фильтрации на стороне поражения >12 мл/мин). У всех 14 пациентов, обследованных в отдаленный послеоперационный период, отмечено восстановление уродинамики по мочевыводящим путям. Кишечная пластика мочеточников позволяет сохранить почку и улучшить ее функцию, что способствует комплексному подходу к лечению больных онкологического профиля.
ятрогенные повреждения мочеточника, уретерогидронефроз, кишечная пластика мочеточников.














Leave a comment