Рак піхви: сучасний стан проблеми
Воробьева Л.И., Неспрядько С.В., Гончарук И.В., Гаврилюк О.М., Бакай О.А. , Ганич О.В.
Резюме. У статті представлено огляд літератури, присвячений проблемі раку піхви. Розглянуто питання епідеміології, скринінгу, діагностики, описано прогностичні фактори, а також лікування раку піхви.
Резюме. В статье представлен обзор литературы, посвященный проблеме рака влагалища. Рассмотрены вопросы эпидемиологии, скрининга, диагностики, описаны прогностические факторы, а также лечение рака влагалища.
 Рак влагалища (РВ) — редкое новообразование, составляет 1–3% всех опухолей женских половых органов. Заболеваемость РВ составляет примерно 1 случай на 100 тыс. женщин; она остается относительно неизменной с 80-х годов. По данным Национального канцер-регистра, в течение последних лет количество случаев РВ остается стабильным (в 2006 г. зарегистрировано 146 случаев РВ, в 2009 г. — 145, а в 2011 г. — 142) [1]. В США ежегодно выявляют около 2420 новых случаев заболевания и констатируют около 820 смертей от этой патологии [2, 3]. Согласно правилам Международной федерации гинекологов и акушеров (International Federation of Gynecology and Obstetrics — FIGO), случай может быть классифицирован как РВ только после исключения первичного роста из шейки, уретры или вульвы [4].
Рак влагалища (РВ) — редкое новообразование, составляет 1–3% всех опухолей женских половых органов. Заболеваемость РВ составляет примерно 1 случай на 100 тыс. женщин; она остается относительно неизменной с 80-х годов. По данным Национального канцер-регистра, в течение последних лет количество случаев РВ остается стабильным (в 2006 г. зарегистрировано 146 случаев РВ, в 2009 г. — 145, а в 2011 г. — 142) [1]. В США ежегодно выявляют около 2420 новых случаев заболевания и констатируют около 820 смертей от этой патологии [2, 3]. Согласно правилам Международной федерации гинекологов и акушеров (International Federation of Gynecology and Obstetrics — FIGO), случай может быть классифицирован как РВ только после исключения первичного роста из шейки, уретры или вульвы [4].
Первичный РВ диагностируют редко, чаще выявляют его метастатические поражения или вторичное вовлечение в опухолевый процесс (распространение со смежных органов). Вторичное поражение влагалища обусловлено раком эндометрия и трофобластическими опухолями (24–55%), раком шейки матки (РШМ) (33%), мочевого пузыря и почки (5%), прямой кишки (2%), грудной железы (1%), яичника (1%) [4–6].
Эпидемиология и факторы риска
РВ — болезнь женщин старшего возраста с пиком заболеваемости на 6–7-ом десятке лет жизни. В возрасте до 50 лет эту опухоль выявляют у менее 15% больных, и менее 10% случаев приходятся на возраст до 40 лет [7–10]. Плоскоклеточный РВ — наиболее частый гистологический тип (78–90%), другие первичные опухоли представлены аденокарциномами (3–5%), меланомами (3%), саркомами (3%) [4, 6]. Плоскоклеточные карциномы влагалища в начальной стадии распространяются поверхностно, но, к сожалению, у некоторых женщин заболевание диагностируют с метастазами. Отдаленные метастазы чаще возникают в легких и печени [4, 11]. Аденокарциномы часто метастазируют в надключичные и тазовые узлы. Светлоклеточные карциномы являются редкими, их наиболее часто диагностируют у больных в возрасте младше 30 лет.
Эпидемиологические исследования показали, что для РВ, подобно РШМ, характерна строгая взаимосвязь с вирусом папилломы человека (ВПЧ). Наличие ВПЧ 16-го типа коррелирует с развитием РВ. Примерно у ⅓ женщин, заболевших РВ, имеются указания в анамнезе на эпителиальную дисплазию или РШМ более 5 лет до обращения по поводу РВ. Хроническое воспаление влагалища также способствует развитию рака, однако механизм канцерогенеза при этом не совсем понятен и не изучен широко [4, 11]. У больных с предшествующим РШМ отмечают существенный риск развития РВ, возможно, вследствие общей экспозиции этих локализаций и/или чувствительности к эндогенным или экзогенным карциногенным раздражителям [4, 6].
Скрининг
Стандартные скрининговые программы не разработаны [4, 6, 11]. Рекомендуется выполнять мазок Папаниколау каждые 3–5 лет у женщин, перенесших гистерэктомию по поводу доброкачественных опухолей [4]. Поскольку заболеваемость РВ низкая, рутинный скрининг экономически не оправдан. Женщины с дисплазией эпителия или РШМ в анамнезе относятся к группе высокого риска, и им показано регулярное исследование Пап-мазков.
Прогностические факторы
Стадия заболевания, локализация и размер опухоли определяют прогноз заболевания РВ. Заболеваемость, отдаленные метастазы и локальный контроль коррелируют со стадией опухоли [4–6]. По данным наблюдения 843 больных РВ, 5-летняя выживаемость при I стадии составила 64–90%, при II стадии — 31–80%, III — 0–79%, IV — 0–62%. Размер опухоли также считается прогностическим фактором выживаемости, а также отдаленного и локального контроля [4, 5]. В исследованиях Chyle и соавторов [4] при поражениях до 5 см в наибольшем диаметре 10-летний период локального рецидивирования составил 20%, а при опухолях больше 5 см — 40%. Локализация опухоли — также важный прогностический фактор состояния лимфоузлов. Установлено, что лимфоотток из верхней трети влагалища осуществляется в основном в межподвздошные, внутренние и наружные подвздошные лимфатические узлы. Лимфоотток из нижней части влагалища происходит прямо в пахово-бедренные лимфатические узлы. Возраст больной рассматривают как прогностический фактор в некоторых исследованиях [4, 13], однако в других обзорах он таковым не считается [9]. Что касается гистологического типа и градации, то в некоторых исследованиях [4, 6] было показано, что степень дифференцировки является независимым значимым прогностическим фактором выживаемости. Также Chyle и соавторы заметили большую частоту рецидивирования у больных аденокарциномой, по сравнению с пациентами с плоскоклеточной карциномой.
Диагностика, клиническая оценка и стадирование
Безболезненное вагинальное кровотечение и выделения — наиболее распространенные симптомы РВ [4–6, 11]. При больших размерах опухоли пациентки отмечают задержку мочи, боль, гематурию и частые мочеиспускания. Опухоли, развивающиеся на задней стенке влагалища, могут вызывать такие ректальные симптомы, как тенезмы, запор или кровь в испражнениях. Приблизительно у 5% больных возникает тазовая боль как результат распространения опухоли за пределы влагалища, и у около 5–10% пациенток отсутствуют симптомы, а болезнь выявляют при обычном тазовом осмотре и взятии мазка по Папаниколау. Диагностика включает подробный анамнез болезни и физикальное обследование. При ранних плоскоклеточных опухолях диагноз предполагают на основании патологического результата мазка по Папаниколау у больных с предшествующей гистерэктомией или ВПЧ-зависимым инвазивном заболевании шейки; однако такая схема не работает при светлоклеточных аденокарциномах, которые часто характеризуются подслизистым ростом. В этих случаях диагноз подтверждают прицельной биопсией под местной анестезией. Для уточнения диагноза у больных с патологическим мазком по Папаниколау, необъяснимым вагинальным кровотечением или изъязвленными эритрематозными очагами в верхней части влагалища выполняют кольпоскопию. Бимануальное исследование остается самым важным методом для оценки локального распространения РВ. Осмотр женщин зеркалами Куско — одна из причин того, что опухоли влагалища не визуализируются.
Диагностика РВ не представляет больших трудностей ввиду визуализации и доступности при гистологической верификации. При осмотре с помощью зеркала определяют локализацию, размеры первичного очага, степень распространенности процесса. Пальпаторно, бимануально определяют состояние регионарных лимфатических узлов. Для уточнения диагноза используют кольпоскопию, цитологические, гистологические исследования материала опухоли и пунктата лимфатических узлов. Всем женщинам проводят ультразвуковое исследование малого таза, брюшной полости и забрюшинного пространства, рентгенографию грудной клетки, цистоскопию, ректороманоскопию (рис. 1). При необходимости выполняют КТ, МРТ (рис. 2), ПЭТ/КТ и другие дополнительные исследования (экскреторная урография, сцинтиграфия, определение онкомаркеров (SCC)).
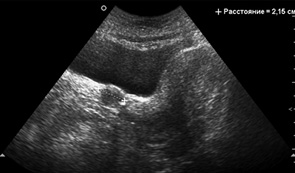
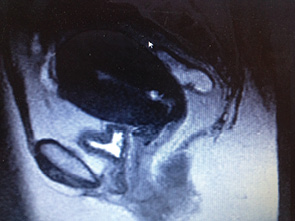

РВ следует дифференцировать с пролежнем, сифилитической, туберкулезной язвой, остроконечными кондиломами, папилломами, эндометриозом, меланобластомой, опухолями метастатического характера.
Система стадирования РВ основана на клинических критериях. При I стадии опухоль ограничена стенками влагалища, при II — вовлекает подвлагалищную ткань, но не переходит на стенку таза, при III опухоль распространяется на стенку таза, при IV — за пределы малого таза или вовлекает слизистую оболочку мочевого пузыря или прямой кишки.
Лечение инвазивного рака влагалища
FIGO рекомендует планировать лечение на основании стадии заболевания и места вовлечения влагалища. Из-за редкости опухоли данные, касающиеся истории развития, прогностических факторов и лечения РВ, исходят из малых ретроспективных исследований. Большая часть ныне доступной литературы о лучевой терапии (ЛТ) и технике хирургических вмешательств относится к первичной плоскоклеточной карциноме влагалища.
Стадия I
Опухоль I стадии по FIGO определяется как ограниченная слизистой оболочкой влагалища. Карциному влагалища I стадии по FIGO удовлетворительно излечивают с помощью ЛТ. Показатель вовлеченности лимфоузлов при I стадии по FIGO относительно низкий — 6–16% [4–6, 9]. Эти данные получены путем экстраполяции ретроспективных исследований, и потому их нужно рассматривать с осторожностью. Стандарт хирургического лечения все еще не разработан, описано несколько различных подходов. У некоторых больных с малыми опухолями было применено широкое локальное иссечение со свободными от опухоли краями [4, 7, 12]. Также выполняли частичную, полную простую и радикальную вагинэктомию [2, 4, 13]. Радикальная вагинэктомия состоит из удаления пораженного влагалища и околовлагалищной ткани до боковой стенки таза. Более агрессивная хирургия, такая как радикальная гистерэктомия [4, 11, 14] с тазовой лимфодиссекцией и тазовой экзентерацией, описана для больных с высоким риском рецидива (рис. 3).
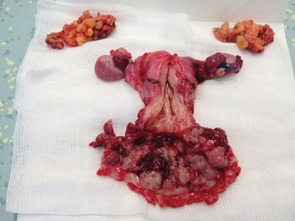
При поражениях нижней трети влагалища может потребоваться вульвовагинэктомия в дополнение к рассечению и экзентерации пахово-бедренных лимфоузлов до достижения негативных краев резекции. Если края оказались прилегающими к опухоли или позитивными после резекции, рекомендуется адъювантная ЛТ. В литературе описаны 8 исследований [4, 13, 15] с участием 174 больных, результаты которых продемонстрировали 56–90% 5-летнюю выживаемость у женщин с заболеванием в I стадии по FIGO, которых лечили только хирургическими методами (табл. 1). Некоторые авторы поддерживают использование адъювантной ЛТ у больных с высоким риском рецидивирования, описывая 79–100% 5-летней выживаемости [4, 12]. Методом выбора при лечении пациенток с раком влагалища в I стадии по FIGO является ЛТ: в 22 исследованиях, включающих 553 больных, описана кумулятивная 5-летняя выживаемость в пределах от 33 до 100% (см. табл. 1). Широкоприменяемой стратегией облучения была комбинация внутритканевой и внутриполостной терапии с использованием дистанционной лучевой терапии (ДЛТ) больных с прогностическим фактором высокого риска. Нет установленного критерия относительно применения ДЛТ у больных с заболеванием в I стадии; как правило, ДЛТ рекомендуется для больших, более инфильтрирующих или менее дифференцированных опухолей, при которых существует более высокий риск метастазирования в лимфоузлы. У женщин с заболеванием в I стадии по FIGO хирургическое лечение дает статистически и клинически лучшие результаты, чем ЛТ. У женщин с выявленным заболеванием в I стадии и леченных только хирургическими методами относительная 5-летняя выживаемость составляет 90% по сравнению с 63% у больных с I стадией, у которых применяли только облучение (p < 0,05) [4, 11, 12].
Таблица 1. Выживаемость больных РВ в I стадии в соответствии со способом лечения
| Автор | Больные, n | Выживаемость леченых больных, n (%) | ||
| Только ЛТ | Только хирургия | Хирургия + ЛТ | ||
| Murphy and Bozzini, 1963 | 90 | 90 (36) | – | – |
| Dunn and Napier, 1966 | 16 | Брахитерапия — 11 (73)Брахитерапия + ДЛТ — 1 (100)ДЛТ — 3 (33) | – | 1 (100) |
| Frick et al., 1968 | 20 | 15 (55) | 5 (80) | – |
| Pride et al., 1979 | 9 | Брахитерапия — 9 (66) | – | – |
| Pempree et al., 1977 | 6 | 6 (83) | – | – |
| Mohlen et al., 1980 | 19 | 19 (68) | – | – |
| Ball and Berman, 1982 | 27 | 8 (55) | 19 (84) | – |
| Chu and Beechinor, 1984 | 8 | 4 (88) | 4 | – |
| Rubin et al., 1984 | 14 | 7 (71) | 5 (80) | 2 (100) |
| Perez et al., 1988 | 50 | 49 (75) | – | 1 |
| Davis et al., 1991 | 44 | 14 (65) | 25 (85) | 5 (100) |
| Kucera and Varva, 1991 | 16 | Брахитерапия — 13 (84,6) ДЛТ — 3 (66,7) |
– | – |
| Reddy et al., 1991 | 15 | 15 (78) | – | – |
| Stock et al., 1992 | 6 | Брахитерапия — 6 (44) | – | – |
| Dixit et al., 1993 | 8 | 6 (100) | – | 2 (100) |
| Lee et al., 1994 | 17 | 17 (94) | – | – |
| Stock et al., 1994 | 23 | 6 (80) | 15 (56) | 2 (100) |
| Urbanski et al., 1996 | 33 | 33 (72,7) | – | |
| Creasman et al., 1998 | 245 | 122 (63) | 76 (90) | 47 (79) |
| Perez et al., 1999 | 59 | 57 (80) | – | – |
| Tjakma et al., 2001 | 27 | 1 (68) | 22 (77) | – |
| Tewari et al., 2001 | 10 | Брахитерапия — 10 (100) | – | – |
Выводы
В настоящее время возможными вариантами первичного лечения карциномы влагалища, ограниченной слизистой оболочкой, являются хирургический метод или ЛТ. При малых опухолях, не вовлекающих мышечную слизистую оболочку, расположенных в верхней трети влагалища, может быть использовано широкое иссечение.
Стадия II
При РВ во II стадии по FIGO новообразование вовлекает ткани, окружающие влагалище, но не распространяется на тазовую стенку. Perez и соавторы используют подклассификацию стадирования по FIGO, в которой различаются опухоли, инфильтрирующие параметрий (Stage IIB) и распрострененные только на околовлагалищную подслизистую оболочку(Stage IIА) [4, 14]. ЛТ является стандартом лечения. Наиболее широкопринятой стратегией лечения является брахитерапия и ДЛТ на первичную опухоль. Комбинация брахитерапии и ДЛТ увеличивает 5-летнюю выживаемость по сравнению только с ДЛТ или только брахитерапией [4, 6]. Некоторые авторы выделяют потенциальное преимущество для безрецидивной выживаемости и локального контроля использования внутритканевой ЛТ по сравнению с использованием внутриполостной терапии. При II стадии дозы облучения в пределах 70–75 Гр на первичную опухоль или срединную часть вентрального, латерального или дорсального параметрия необходимы для достижения соответствующего контроля над опухолью. Удлинение времени лечения не показало важного воздействия на контроль тазовой опухоли. Для повышения дозы облучения опухоли первичной локализации могут быть использованы различные подходы. Выбор подхода зависит от локализации и размера опухоли. Апикальные опухоли можно лечить внутриполостным облучением шейки матки, если она еще есть. В последнем случае используется внутриполостная терапия, только если остаточная опухоль находится на расстоянии не более 3–5 мм от поверхности влагалища. Больных с более глубокими поражениями лечат внутритканевым имплантом. Наконец, если больной не подходит эта процедура, проводят добавочное дистанционное облучение. При поверхностных опухолях, охватывающих среднюю треть влагалища, применяют внутриполостную и внутритканевую брахитерапию, при поражении передней и боковой стенок — внутритканевую брахитерапию, при малых поражениях по задней поверхности — ДЛТ с добавочной внутриполостной терапией, при больших поражениях по задней стенке — ДЛТ. Пациенток с опухолями, включающими дистальную треть, лечат добавочными курсами внутритканевой ЛТ. Как описано ниже, при поражениях нижней трети, вовлекающих паховые лимфоузлы, необходимо применять облучение тазовых и/или паховых лимфоузлов. В литературе описаны 18 исследований [6, 4, 11, 14, 15] с участием 643 больных, из которых у пациенток со II стадией по FIGO, пролеченных только ЛТ, достигнута 13–80% кумулятивная 5-летняя выживаемость (табл. 2). Несмотря на обнадеживающие результаты, высокая частота появления отдаленных метастазов (30–46% у больных со II стадией по FIGO) привела авторов к заключению, что необходимо применять системные цитотоксические препараты для улучшения выживаемости. В одном исследовании применение ЛТ и сопутствующей химиотерапии флуороурацилом и митомицином С в лечении РВ показало хорошие результаты в отношении локального контроля. Dalrymple и соавторы недавно опубликовали малое исследование, включающее 14 больных РВ в основном в I и II стадии, леченых сниженными дозами ЛТ (в среднем 63 Гр) одновременно с применением различных химиотерапевтических схем, основанных на флуороурациле, и достигших 93% 5-летней выживаемости. Необходимы дальнейшие исследования для определения терапевтической эффективности одновременного химиолучевого и оптимального химиотерапевтического лечения. Имеется несколько отчетов об отдельных больных РВ во II стадии, у которых применяли радикальную хирургию (радикальная вагинэктомия или тазовая экзентерация). В литературе в 7 исследованиях описали 98 больных с кумулятивной 5-летней выживаемостью 0–70% (см. табл. 2). Одно непрямое наблюдение и проспективное исследование опубликовали результаты воздействия неоадъювантной химиотерапии (НАХТ) с последующей радикальной операцией на выживаемость больных с опухолями влагалища во II стадии FIGO. Возможное объяснение этих многообещающих результатов — то, что влагалище пронизано множеством сосудов и потому доставка лекарственных препаратов может происходить оптимальным образом. У более 90% больных получена частичная или полная реакция на неоадъювантное лечение, они были прооперированы после завершения химиотерапии. Проводили радикальную гистерэктомию типа III, радикальную вагинэктомию и двухстороннюю экстраперитонеальную лимфодиссекцию. Если нижняя треть влагалища была вовлечена до НАХТ, то также удаляли паховые лимфоузлы. До настоящего времени не было проведено сравнения НАХТ с последующим радикальным хирургическим вмешательством и ЛТ.
Таблица 2. Выживаемость больных РВ во II стадии в соответствии с методами лечения
| Автор | Больные, n | Выживаемость леченых больных, n (%) | ||
| Только ЛТ | Только хирургия | Хирургия + ЛТ | ||
| Frick et al., 1968 | 13 | 11 (36) | 2 (-) | – |
| Pempree et al., 1977 | IIa 20 IIb 11 |
IIa 20 (65) IIb 11 (63,5) |
– | – |
| Mohlen et al., 1980 | 29 | 29 (40) | – | – |
| Ball and Berman, 1982 | 17 | 9 (13) | 8 (-) | – |
| Chu and Beechinor, 1984 | 19 | 18 (44) | 1 | – |
| Rubin et al., 1984 | 29 | 21 (52) | 3 (67) | 5 (40) |
| Perez et al., 1988 | IIa 49 IIb 26 |
IIa 49 (55) IIb 26 (43) |
– | – |
| Davis et al., 1991 | 45 | 9 (50) | 27 (49) | 9 (69) |
| Kucera and Varva, 1991 | 23 | Брахитерапия — 4 (50) ДЛТ — 19 (42,1) |
– | – |
| Reddy et al., 1991 | 22 | 22 (71) | – | – |
| Stock et al., 1992 | 27 | 27 (48) | – | – |
| Dixit et al., 1993 | 10 | 8 (50) | – | 2 (50) |
| Lee et al., 1994 | IIa 16 IIb 10 |
IIa 16 (80) IIb 10 (39) |
– | – |
| Stock et al. 1994 | 58 | 25 (31) | 23 (68) | 10 (69) |
| Urbanski et al., 1996 | 37 | 37 (54,1) | – | – |
| Creasman et al., 1998 | 209 | 136 (57) | 34 (70) | 39 (58) |
| Perez et al., 1999 | IIa 63 IIb 34 |
IIa 63 (55) IIb 34 (35) |
– | – |
| Tewari et al., 2001 | IIa 14 IIb 25 |
Брахитерапия — IIa 14 (60) IIb 25 (61) |
– | – |
| Benedetti Panici et al., 2008 | 11 | НАХТ 11 (91) 75 мес | ||
Выводы
Наиболее частой стратегией лечения РВ во II стадии является комбинация брахитерапии и ДЛТ на первичную опухоль. У части паценток может быть выполнено хирургическое лечение (радикальная вагинэктомия или тазовая экзентерация). НАХТ с последующей радикальной операцией является допустимой альтернативой стандартному лечению по результатам выживаемости.
Стадия III
Стадия III по FIGO определяется как опухоль, распространенная на тазовую стенку. FIGO не указывает, как классифицировать опухоль, когда паховые лимфоузлы являются клинически позитивными. AJCC предложила систему стадирования TNM, которая классифицирует больных с односторонними паховыми метастазами как N1 (стадия III) и с двухсторонними узлами как N2 (стадия IVA), но эта система редко используется. Всем этим больным требуется лечение ДЛТ. Большинство авторов высказываются за использование брахитерапии во всех возможных случаях, поскольку это, несомненно, дает эффект при лечении этих больных [4, 6, 15]. В литературе описано 17 исследований, в которых 390 больных РВ с III стадией по FIGO, леченых только ЛТ, достигли 0–80% кумулятивной 5-летней выживаемости (табл. 3). Комбинация ДЛТ и брахитерапии — наиболее широкоприменяемый способ лечения этой категории больных. Брахитерапия внутритканевая или внутриполостная является важной для локального контроля. Для отдельных больных в качестве выбора тактики лечения может рассматриваться тазовая экзентерация или комбинация облучения и экзентерации [4, 14]; только 2 исследования этого лечения 38 больных в целом сообщили 5-летнюю выживаемость 50–60%.
Таблица 3. Выживаемость больных РВ в III стадии в соответствии со способом лечения
| Автор | Больные, n | Выживаемость леченых больных, n (%) | ||
| Только ЛТ | Только хирургия | Хирургия + ЛТ | ||
| Frick et al., 1968 | 6 | 6 (-) | – | – |
| Pempree et al., 1977 | 20 | 20 (80) | – | – |
| Mohlen et al., 1980 | 25 | 25 (8) | – | – |
| Ball and Berman, 1982 | 6 | 4 (-) | 2 (-) | – |
| Chu and Beechinor, 1984 | 7 | 7 (35) | – | – |
| Rubin et al., 1984 | 13 | 10 (50) | 1 (100) | 2 (50) |
| Perez et al., 1988 | 16 | 16 (32) | – | – |
| Kucera and Varva, 1991 | 46 | Брахитерапия — 4 (-)ДЛТ — 42 (38,1) | – | – |
| Reddy et al., 1991 | 6 | 6 (-) | – | – |
| Stock et al., 1992 | 10 | 10 (40) | – | – |
| Dixit et al., 1993 | 42 | 42 (64) | – | – |
| Lee et al., 1994 | 10 | 10 (79) | – | – |
| Stock et al., 1994 | 9 | 9 (-) | – | – |
| Urbanski et al., 1996 | 40 | 40 (22,5) | – | – |
| Creasman et al., 1998 | III–IV 201 | 144 (35) | 21 (47) | 36 (60) |
| Perez et al., 1999 | 20 | 20 (38) | – | – |
| Tewari et al., 2001 | 15 | 15 (30) | – | – |
Выводы
Комбинация ДЛТ и брахитерапии — наиболее широкоприменяемая практика лечения больных РВ в III стадии. Для отдельных больных в качестве выбора тактики лечения может рассматриваться тазовая экзентерация или комбинация облучения и экзентерации.
Стадия IV
Опухоли стадии IV встречаются крайне редко. Стадия IV по FIGO определена как опухоль, прорастающая малый таз или включающая слизистую оболочку мочевого пузыря или прямой кишки. Опухоль в стадии IVA — заболевание, распространенное на прилегающие органы, стадии IVB — распространенное на удаленные органы. Комбинация внутритканевой, внутриполостной и ДЛТ — выбор лечения для больных IVA [4, 6] с 5-летней выживаемостью 0–62% (табл. 4). Для отдельных больных, здоровых в других отношениях и не имеющих отдаленного распространения, выбором лечения может служить тазовая экзентерация и реконструкция влагалища с использованием нежного мышечно-кожного (gracilis myocutaneous) лоскута или мышечно-кожного лоскута абдоминального отдела прямой кишки (rectus abdominis myocutaneous) [2, 4, 6, 7, 12] (5-летняя выживаемость 0–50%). Для паллиативного устранения симптомов у больных стадии IVB выбором лечения является ЛТ [4]. Предлагались одновременная химиотерапия и ЛТ [4, 6, 11, 15]. Уровень контроля опухоли в тазу при III–IV стадии относительно низкий; 70–80% больных имеют стойкую или рецидивирующую опухоль, несмотря на высокие дозы ДЛТ и брахитерапии. Метастазы в отдаленных локализациях возникают у 25–30% больных с локально запущенными опухолями. Следовательно, существует необходимость в лучших подходах к лечению запущенного заболевания, таких как применение параллельной химиолучевой терапии. Такие препараты как флуороурацил, митомицин С и цисплатин показали ожидаемые результаты при сочетании с ЛТ с таким высоким уровнем полной реакции, как 85% [4], но отдаленные результаты таких схем лечения были изменчивыми.
Таблица 4. Выживаемость больных РВ в IV стадии в соответствии со способом лечения
| Автор | Больные, n | Выживаемость леченых больных, n (%) | ||
| Только ЛТ | Только хирургия | Хирургия + ЛТ | ||
| Frick et al., 1968 | 3 | 2 (-) | 1 (-) | – |
| Pempree et al., 1977 | 7 | 7 (-) | – | – |
| Mohlen et al., 1980 | 9 | 9 (-) | – | – |
| Ball and Berman, 1982 | 4 | 3 (-) | 1 (-) | – |
| Chu and Beechinor, 1984 | 3 | 3 (-) | – | – |
| Rubin et al., 1984 | 8 | 8 (-) | 1 (-) | – |
| Perez et al., 1988 | 8 | 8 (-) | – | – |
| Kucera and Varva, 1991 | IVa 19 IVb 6 |
IVa 19 (33,3) IVb 6 (-) |
– | – |
| Reddy et al., 1991 | 1 | 1 (-) | – | – |
| Stock et al., 1992 | 10 | 10 (40) | – | – |
| Lee et al., 1994 | 6 | 6 (-) | – | – |
| Stock et al., 1994 | 10 | 7 (-) | 2 (50) | 1 (-) |
| Urbanski et al., 1996 | 15 | 15 (-) | – | – |
| Creasman et al., 1998 | III–IV 201 | 144 (35) | 21 (47) | 36 (60) |
| Perez et al., 1999 | 15 | 15 (-) | – | – |
| Tewari et al., 2001 | 7 | 7 (-) | – | – |
Выводы
Комбинация внутритканевой, внутриполостной и ДЛТ является выбором лечения для больных с РВ в IVA стадии. Была предложена одновременная химиотерапия и ЛТ.
Обсуждение
РВ остается сложной проблемой онкогинекологии. Его редкость препятствует проведению испытаний III фазы, поэтому данные необходимо собирать из ретроспективных исследований. Такой низкий уровень доказательности делает невозможной выработку универсально принятых рекомендаций. К сожалению, диагноз часто устанавливают поздно, поэтому заболевание уже вовлекает подслизистую ткань и иногда тазовую стенку. Сейчас подавляющее большинство пациенток с этим новообразованием лечат ЛТ. Первичная опухоль может подвергаться брахитерапии, лимфоузлы — ДЛТ. Роль хирургического лечения ограничена начальными стадиями. С усовершенствованием анестезии, которое расширило возможности подвергать хирургии большее количество больных, в том числе пожилых, страдающих ожирением и сопутствующими заболеваниями, а также открытие химиочувствительности опухолей нижних половых путей, что показали несколько испытаний НАХТ, вероятно, в ближайшем будущем хирургия будет играть более заметную роль. Исследования, проведенные на ретроспективных сериях, всегда показывали эквивалентность или превосходство хирургического метода над применением только ЛТ при I стадии. Другая стратегия лечения, заслуживающая дальнейших исследований, — это сочетанная химиолучевая терапия, ставшая стандартным методом лечения при раке шейки матки. Как и при заболеваниях некоторых других органов, лечение РВ будет экстраполировано на основании более частых новообразований, которые, по всей видимости, имеют похожее поведение. Следовательно, обязательным является подбор схемы лечения онкогинекологом на основании характеристик каждой пациентки. С введением программ широкой вакцинации против ВПЧ можно надеяться, что в дальнейшем сократится частота этого заболевания. Далее, учитывая то, что большинство женщин имеют локальное заболевание, есть надежда, что улучшенные стратегии, применяемые при раке шейки матки, такие как НАХТ, ЛТ и химиолучевая терапия, будут использованы и у этой категории больных со сходным уровнем выживаемости и без угрозы для качества жизни.
Список использованной литературы
1. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2013) Рак в Україні, 2011–2012. Бюл. Нац. канцер-реєстру України, 14. Національний інститут раку, Київ, 120 с.
2. Creasman W., DeGeest K., DiSaia P., Zaino R.J. (1999) Significance of true surgical pathologic staging: a Gynecologic Oncology Group Study. Am. J. Obstet. Gynecol., 181: 31–34.
3. Levine D.A., De Los Santos J. (2011) Principles and Practice of Gynecologic oncology. Wolters Kluwer health, New York, 277 p.
4. Дисаи Ф.Дж., Крисман У.Т. (2011) Клиническая онкогинекология (пер с англ. под ред. Новиковой Е.Г.), 1: 188.
5. Бохман Я.В. (2002) Руководство по онкогинекологии. Фолиант, СПб: 542 с.
6. Давыдов М.И., Кузнецов В.В. (2009) Лекции по онкогинекологии : учеб. для студентов. МЕДпресс-информ: 432 с.
7. Кулаков В.И., Селезнева Н.Д., Краснопольский В.И. (2006) Оперативная гинекология. Н. Новгород: 640 с.
8. Мерабишвили В.М. (2006) Выживаемость онкологических больных. ООО Фирма КОСТА, СПб., 438 с.
9. Моисеенко В.М. (2008) Справочник по онкологии. Изд-во центр ТОММ, СПб.: 258 с.
10. Щепотин И.Б., Ганул В.Л., Клименко И.А. и др. Онкология. Книга плюс, Киев, 568 с.
11. Давыдов М.И., Летягин В.П., Кузнецов В.В. (2007) Опухоли женской репродуктивной системы. Медицинское информационное агенство, Москва, 376 с.
12. Воробьева Л.И., Проскурня Л.А., Цип Н.П. (2004) Хирургический метод в лечении злокачественных опухолей влагалища: за или против? Здоровье женщины, 2(18): 30–33.
13. Andersen E.S. (1989) Primary carcinoma of the vagina: A study of 29 cases. Gynecol., 33: 317.
14. Ayhan A., Reed N., Gultekin M. (2011) Textbook of gynecologic oncology. Gunes Publishing, Ankara, 1138 p.
15. Stock R.G., Chen A.S., Seski J. (1995) A 30-year experience in the management of primary carcinoma of the vagina: alysis of prognosis factors and treatment modalities. Gynecol. Oncol., 56: 45.
16. Hee Seung Kim, Yong Sang Song (2009) FIGO committee on Gynecologic Oncology. Int. J. Gynecol. Obstet., 104: 179.














Leave a comment