Морфологічна характеристика первинної пухлини та мікрометастазів у сторожових лімфатичних вузлах як прогностичний фактор прогресування меланоми шкіри
Кукушкина М.Н., Коровин С.И., Солодянникова О.И., Сукач Г.Г., Паливец А.Ю., Потороча А.Н. , Остафийчук В.В., Ковальчук П.А.
Резюме. Наявність або відсутність мікрометастазів у сторожових лімфатичних вузлах (СЛВ) є достовірним прогностичним фактором. Залучення СЛВ у пухлинний процес може бути різним: від наявності однієї меланомної клітини до повного заміщення лімфатичного вузла пухлиною. У зв’язку з цим для більш точного прогнозування перебігу захворювання і визначення критеріїв вибору тактики лікування запропоновано декілька класифікаційних систем. У дослідженні за участю 195 хворих на меланому шкіри, що перебували на лікуванні в Національному інституті раку, вивчено морфологічні характеристики первинної пухлини і мікрометастазів, що впливають на перебіг захворювання, які можуть служити критерієм вибору подальшої тактики лікування. Найбільш значущими несприятливими факторами для подальшого прогресування захворювання є товщина первинної пухлини за Breslow >2,0 мм, її поверхневе виразкування, велике (діаметром >5 мм) ураження СЛВ та екстракапсулярне поширення пухлини.
Резюме. Наличие или отсутствие микрометастазов в сторожевых лимфатических узлах (СЛУ) является достоверным прогностическим фактором. Вовлечение СЛУ в опухолевый процесс может быть разным: от наличия одной меланомной клетки до полного замещения лимфатического узла опухолью. В связи с этим для более точного прогнозирования течения заболевания и определения критериев выбора тактики лечения предложено несколько классификационных систем. В исследовании с участием 195 больных меланомой кожи, находившихся на лечении в Национальном институте рака, изучены морфологические характеристики первичной опухоли и микрометастазов, влияющие на течение заболевания, которые могут служить критерием выбора дальнейшей тактики лечения. Наиболее значимыми неблагоприятными факторами для дальнейшего прогрессирования заболевания являются толщина первичной опухоли по Breslow >2,0 мм, ее поверхностное изъязвление, обширное (диаметром >5 мм) поражение СЛУ и экстракапсулярное распространение опухоли.

Введение
Наличие метастазов в сторожевых лимфатических узлах (СЛУ) является важным прогностическим фактором, что подтверждено в результате исследования MSLT-I (Multicenter Selective Lymphadenectomy Trial): 5-летняя выживаемость больных с метастазами в СЛУ составила 72,3±4,6%, а без поражения СЛУ — 90,2±1,3% (р<0,001) [1].
В связи с этим, начиная с 2002 г., в классификацию меланомы кожи American Joint Committee on Cancer (AJCC) введено понятие регионарных микрометастазов (обозначаются буквой а) и макрометастазов (b). Согласно определению AJCC, макрометастазы — это клинически и/или радиологически определяемые метастазы в регионарных лимфатических узлах, подтвержденные гистологически после выполнения терапевтической лимфодиссекции, а микрометастазы — это метастазы в клинически и радиологически неизмененных лимфатических узлах, подтвержденные гистологически после выполнения биопсии СЛУ либо профилактической регионарной лимфодиссекции. Наличие микрометастазов в одном СЛУ определяется как N1a, в 2 или 3 узлах — как N2а [2]. В последующей версии классификации AJCC 2009 г. отмечено, что наличие микрометастазов в лимфатических узлах может быть подтверждено не только гистологическим, но также иммуногистохимическим методом [3].
Несмотря на то что в результате исследования MSLT-I доказана важность выполнения биопсии СЛУ для прогноза и стадирования меланомы кожи, остается открытым вопрос о ее самостоятельном лечебном значении и необходимости выполнения регионарной лимфодиссекции после обнаружения микрометастазов в СЛУ. В связи с этим в 2004 г. стартовало исследование MSLT-ІI, в ходе которого происходит набор пациентов с микрометастазами меланомы кожи, выявленными гистологическим, иммуногистохимическим методом или с помощью полимеразной цепной реакции, которых рандомизируют в 2 группы. В первой группе пациенты подвергаются срочной лимфодиссекции. Во второй находятся под наблюдением с использованием ультразвукового исследования регионарных лимфоколлекторов и выполнением отсроченной регионарной лимфодиссекции в случае появления макрометастазов. В данное исследование, которое будет длиться до декабря 2017 г., планируется включить 4200 пациентов [4].
На сегодня в большинстве стран действующим стандартом лечения является полное удаление лимфоузлов регионарного коллектора, в котором были выявлены микрометастазы опухоли, несмотря на то что только у 10–15% больных с положительными СЛУ после выполнения полной регионарной лимфодиссекции обнаруживают метастатическое поражение. Однако вовлечение СЛУ в опухолевый процесс может быть разным: от наличия одной меланомной клетки до полного замещения лимфатического узла опухолью. В связи с этим для более точного прогнозирования течения заболевания и определения критериев выбора тактики лечения предложено несколько классификационных систем.
В 2004 г. D. Dewar опубликовал результаты исследования с участием 146 пациентов с микрометастазами меланомы в СЛУ. Было выполнено гистологическое исследование как самих СЛУ, так и «несторожевых» лимфатических узлов, полученных после проведения последующей регионарной лимфодиссекции. Метастазы меланомы в каждом СЛУ оценивали в соответствии с их микроанатомической локализацией в пределах узла: субкапсулярные, комбинированные (субкапсулярные и паренхимальные), паренхимальные, мультифокальные множественные, обширное вовлечение лимфоузла диаметром >5 мм либо экстракапсулярное распространение опухоли. Автором установлена корреляция между микроанатомической локализацией метастазов в СЛУ и частотой поражения «несторожевых» лимфатических узлов. В частности, у 38 (26%) больных констатирована субкапсулярная локализация микрометастазов в СЛУ, при этом ни в одном случае не выявлено метастазов в «несторожевых» лимфатических узлах. При других микроанатомических локализациях поражение «несторожевых» лимфатических узлов отмечено в среднем в 22,2% случаев: при комбинированной локализации — у 6 (11,1%) больных, паренхимальной — у 3 (18,8%), при мультифокальной множественной — у 7 (36,8%), обширном вовлечении лимфоузла либо экстракапсулярном распространении опухоли — у 8 (42,1%). По мнению автора, полученные данные свидетельствуют в пользу того, что у больных с субкапсулярно расположенными микрометастазами меланомы в СЛУ можно воздержаться от выполнения регионарной лимфодиссекции [5].
H. Starz предложена так называемая микроморфометрическая S-классификация, в основе которой лежит глубина инвазии опухолевых клеток в СЛУ, измеряемая с помощью окулярного микрометра и определяемая как расстояние между внутренним слоем капсулы лимфатического узла и клетками меланомы в его паренхиме. Автор выделил 4 стадии: S0 — в случае отсутствия гистологически определяемых метастазов в СЛУ; SІ — при глубине инвазии1,0 мм. При стадиях SІ и SІІ поражение «несторожевых» лимфатических узлов выявлено у 15% больных. 5-летняя выживаемость при этих стадиях практически не отличается от выживаемости пациентов с отрицательными СЛУ. При стадии SІІІ метастазы в «несторожевых» лимфатических узлах возникают у 50% пациентов и почти все прогрессируют в течение 5 лет наблюдения [6].
A. van Akkoi, изучив морфологические данные 388 пациентов с микрометастазами меланомы в СЛУ, предложил использовать в качестве прогностического фактора максимальный размер самого крупного микрометастаза в СЛУ (Роттердамская классификация). Разделив больных в зависимости от размера микрометастаза на 3 группы (1,0 мм), он изучил их общую 5-летнюю выживаемость, которая составила 91; 61 и 51% соответственно (р<0,001). Автором предложено расценивать микрометастазы в СЛУ размером <0,1 мм как субмикрометастазы либо «биологически ложноположительные» метастазы; больные с субмикрометастазами могут приравниваться к таковым без поражения СЛУ и не нуждаются в выполнении регионарной лимфодиссекции [7].
A. Meier в так называемой Ганноверской балльной системе использовал 1 основной параметр — максимальный размер самого крупного микрометастаза (<0,1 мм; >0,1 мм) и 2 дополнительных — глубину инвазии опухолевых клеток в паренхиме лимфатического узла (<2 мм; >2 мм) и вовлечение капсулы лимфоузла (наличие или отсутствие). При максимальном размере микрометастаза <0,1 мм и отсутствии дополнительных параметров прогноз оценивается как благоприятный, аналогичный для отрицательных СЛУ. При максимальном размере микрометастаза >0,1 мм и наличии 2 дополнительных параметров прогноз оценивается как неблагоприятный [8].
В 2009 г. I. van der Ploeg опубликовал данные сравнительной оценки трех гистологических субклассификаций СЛУ. После изучения гистопрепаратов 116 больных с метастазами в СЛУ доказано, что наиболее часто с поражением «несторожевых» лимфатических узлов коррелируют глубина инвазии опухолевых клеток в СЛУ и максимальный размер микрометастазов до 0,4 мм. Общая 5-летняя выживаемость напрямую зависит от глубины инвазии опухолевых клеток в СЛУ: при SІ она составляет 92%, при SІІ — 83%, при SІІІ — 68%. По мнению авторов, при глубине инвазии опухолевых клеток <0,4 мм следует воздерживаться от выполнения регионарной лимфодиссекции [9].
Объект и методы исследования
В научно-исследовательском отделении опухолей кожи и мягких тканей Национального института рака биопсию СЛУ применяют с 2009 г., с того времени ее выполнили у 195 больных с меланомой кожи.
Для детекции СЛУ используют радионуклидный метод. До начала лечения выполняют биопсию опухоли кожи в объеме иссечения с отступом от края новообразования до 2–3 мм. После верификации диагноза проводится обследование больного, включающее рентгенографию органов грудной полости, ультразвуковое исследование органов брюшной полости и регионарных лимфатических узлов. Накануне операции выполняют лимфосцинтиграфию для идентификации регионарного лимфоколлектора и приблизительного местонахождения в нем СЛУ. В качестве лимфотропных радиофармпрепаратов используют коллоиды «Nanocis» или «Nanoalbumon», меченные радиоактивнымТс активностью 75–100 МБк, которые вводят вокруг послебиопсийного рубца в 3–4 точки интрадермально. Лимфосцинтиграфию проводят непосредственно после введения изотопа и через 2 ч на гамма-камере или на однофотонном эмиссионном компьютерном томографе. На сцинтиграммах определяется депо радиофармпрепарата в месте его введения и очаги накопления, соответствующие СЛУ. Месторасположение СЛУ отмечают на коже пациента маркером. На следующий день во время операции сначала выполняется широкое иссечение послебиопсийного рубца, а затем — удаление СЛУ.
Удаленные СЛУ исследуют после фиксации в парафиновом блоке, так как использование свежезамороженных срезов сопровождается большим количеством ложноотрицательных результатов, к тому же часть материала может быть потеряна в процессе процедуры замораживания. Срезы удаленных СЛУ, выполненные с шагом в 2 мм, исследуют после окрашивания гематоксилином и эозином.
В случае наличия метастазов в СЛУ их оценивают согласно микроанатомической локализации по D. Dewar, то есть выделяют субкапсулярную, комбинированную (субкапсулярная и паренхимальная), паренхимальную, мультифокальную множественную локализацию метастазов, а также обширное вовлечение лимфоузла диаметром >5 мм либо экстракапсулярное распространение опухоли.
Кроме того, изучается степень поражения СЛУ по собственной методике, согласно которой выделяют метастазы в виде отдельных опухолевых клеток, скопления опухолевых клеток, обширного вовлечения лимфоузла диаметром >5 мм и экстракапсулярного распространения опухоли.
При статистической обработке данных использованы методы описательной статистики для количественных (среднее, медиана, стандартное отклонение) и качественных (n, %) показателей. Для сравнительного анализа распределений исследуемых характеристик применен критерий χ и χ с поправкой Йейтса при количестве наблюдений в группах <5. Различия оценивали как статистически значимые при значении р<0,05.
Результаты и их обсуждение
Биопсия СЛУ выполнена 195 больным меланомой кожи (средний возраст 50,2±13,7 года, 115 женщин, 80 мужчин, средняя толщина первичной опухоли 2,6±1,2 мм, 67 (34,3%) первичных опухолей имеют поверхностное изъязвление). У 34 пациентов (17,4%) установлена ІА стадия заболевания.
Метастазы в СЛУ выявлены у 35 больных, что составило 17,9% (средний возраст 50,0±13,4 года, 20 женщин, 15 мужчин, средняя толщина первичной опухоли 3,8±1,7 мм, 14 (40,0%) первичных опухолей имеют поверхностное изъязвление).
Среди больных с положительными СЛУ субкапсулярная локализация метастазов зарегистрирована у 3 (8,6%), паренхимальная — у 6 (17,1%), комбинированная (субкапсулярная и паренхимальная) — у 3 (8,6%), мультифокальная множественная — у 14 (40,0%), обширное вовлечение лимфоузла диаметром >5 мм или экстракапсулярное распространение опухоли — у 9 (25,7%) пациентов.
Метастазы в виде отдельных опухолевых клеток выявлены у 9 (25,7%) больных, в виде скопления опухолевых клеток — у 17 (48,6%), обширное вовлечение лимфоузла диаметром >5 мм — у 5 (14,3%) и экстракапсулярное распространение опухоли — у 4 (11,4%) пациентов.
В течение последующего периода наблюдения (медиана — 38 мес) у 10 (28,6%) пациентов с метастазами в СЛУ выявлено дальнейшее прогрессирование заболевания: у 2 (5,7%) больных обнаружены метастазы в лимфатических узлах скомпрометированного регионарного лимфоколлектора, у 2 (5,7%) — в нерегионарных лимфатических узлах, у 6 (17,2%) — во внутренних органах.
При толщине опухоли <2,0 мм не зарегистрировано ни одного случая прогрессирования заболевания. У одинакового количества пациентов толщина опухоли составляла 2,01–4,0 мм и >4,0 мм.
Среди 10 больных, у которых выявлено прогрессирование заболевания, поверхностное изъязвление первичной опухоли констатировано в 7 случаях (70%); среди 25 пациентов без признаков пролонгации — также у 7, что, однако, составляет 28% (χ=5,25; р=0,022; отношение рисков (ОР) — 2,5; 95% доверительный интервал (ДИ) 1,2–5,3).
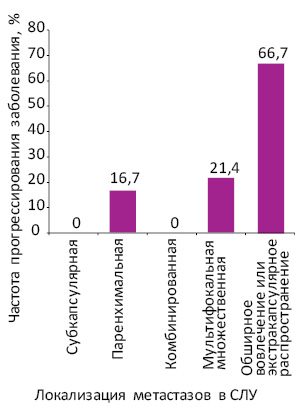
Среди больных с субкапсулярной и комбинированной локализацией метастазов не отмечено ни одного случая прогрессирования заболевания. При паренхимальной локализации метастазы во время последующего периода наблюдения диагностированы у 1 из 6 больных (16,7%), при мультифокальной множественной — у 3 из 14 (21,4%), при обширном вовлечении лимфоузла диаметром >5 мм либо экстракапсулярном распространении опухоли — у 6 из 9 (66,7%) пациентов (рис. 1). Максимальная частота прогрессирования меланомы кожи в зависимости от локализации микрометастазов в СЛУ зафиксирована при обширном вовлечении лимфоузла либо экстракапсулярном распространении опухоли (6/9 (66,7%)), что существенно превышает частоту прогрессирования при всех прочих локализациях метастазов (4/16 (15,4%)) (χ=8,62; р=0,0033; ОР — 4,3; 95% ДИ 1,6–11,9).
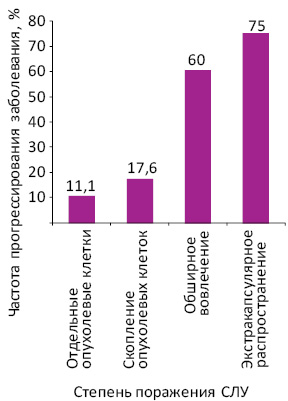
При метастазах в виде отдельных опухолевых клеток прогрессирование заболевания отмечено у 1 (11,1%) из 9 больных, при метастазах в виде скопления опухолевых клеток — у 3 (17,6%) из 17, при обширном вовлечении лимфоузла диаметром >5 мм — у 3 (60,0%) из 5 и при экстракапсулярном распространении опухоли — у 3 (75,0%) из 4 пациентов (рис. 2). Чаще прогрессирование меланомы выявлено при обширном вовлечении лимфатического узла (χ=2,6%; р=0,10). Повышение частоты пролонгации статистически значимо при экстракапсулярном распространении опухоли (χ=3,96; р=0,043).
Таблица 1. Прогрессирование заболевания в зависимости от толщины первичной опухоли по Breslow и локализации метастазов в СЛУ
| Толщина первичной опухоли по Breslow | Локализация метастазов в СЛУ | Всего | ||||
| Субкапсулярная | Паренхимальная | Комбинированная(субкапсулярная и паренхимальная) | Мультифокальная множественная | Обширное вовлечение СЛУ или экстракапсулярное распространение | ||
| –––––– | ||||||
| 1,01–2,0 мм | – | – | – | – | – | – |
| 2,01–4,0 мм | – | 1/10 | – | 1/10 | 3/10 | 5/10(50,0%) |
| >4,01 мм | – | – | – | 2/10 | 3/10 | 5/10(50,0%) |
| Всего | – | 1/10(10,0%) | – | 3/10(30,0%) | 6/10(60%) | 10/10(100,0%) |
Таблица 2. Прогрессирование заболевания в зависимости от толщины первичной опухоли по Breslow и степени поражения СЛУ
| Толщина первичной опухоли по Breslow | Степень поражения СЛУ | Всего | |||
| Отдельные опухолевые клетки | Скопление опухолевых клеток | Обширное вовлечение | Экстракапсулярное распространение | ||
| ––––– | |||||
| 1,01–2,0 мм | – | – | – | – | – |
| 2,01–4,0 мм | 1/10 | 1/10 | 1/10 | 2/10 | 5/10(50,0%) |
| >4,01 мм | – | 2/10 | 2/10 | 1/10 | 5/10(50,0%) |
| Всего | 1/10(10,0%) | 3/10(30,0%) | 3/10(30,0%) | 3/10(30,0%) | 10/10(100,0%) |
Нами изучена частота прогрессирования заболевания в зависимости от толщины меланомы кожи по Breslow, микроанатомической локализации метастаза и степени поражения лимфатического узла (табл. 1, 2).
Наиболее часто (в 60% случаев) метастазы в период наблюдения выявляли при обширном вовлечении СЛУ либо при экстракапсулярном распространении опухоли и толщине первичной меланомы >2,0 мм. Несколько реже (30%) заболевание манифестировало при мультифокальной множественной локализации метастазов в СЛУ и аналогичной толщине опухоли кожи. Не выявлено повышения уровня прогрессирования заболевания с увеличением толщины первичной опухоли в зависимости от степени поражения лимфатического узла.
Выводы
Таким образом, наиболее значимыми неблагоприятными факторами для дальнейшего прогрессирования заболевания являются толщина первичной опухоли по Breslow >2,0 мм, ее поверхностное изъязвление, обширное (диаметром >5 мм) поражение СЛУ и экстракапсулярное распространение опухоли. Морфологическая и количественная характеристики субклинического поражения СЛУ у больных меланомой кожи могут определять течение заболевания и служить критерием выбора дальнейшей тактики лечения.
Список использованной литературы
1. Morton D.L., Thompson J.F., Alistair J. (2006) Sentinel Node Biopsy or Nodal Observation in Melanoma. N. Engl. J. Med., 13(355): 1307–1317.
2. Balch C.M., Buzaid A.C., Soong S.J. (2001) Final Version of the American Joint Committee on Cancer Staging System for Cutaneous Melanoma. J. Clin. Oncol., 16(19): 3635–3648.
3. Balch C.M., Gershenwald J.E., Soong S.J. (2009) Final version of 2009 AJCC melanoma staging and classification. J. Clin. Oncol., 27(36): 6199–6206.
4. Morton D.L. (2012) Overview and Update of Phase III Multicenter Selective Lymphadenectomy Trials (MSLT-I and MSLT-II) in melanoma. Clin. Exp. Metastasis, 29: 699–706.
5. Dewar D.J., Newell.B., Green M.A. et al. (2004) The Microanatomic Location of Metastatic Melanoma in Sentinel Lymph Nodes Predicts Nonsentinel Lymph Node Involvement. J. Clin. Oncol., 22: 3345–3349.
6. Starz H., Siedlecki K., Balda B.R. et al. (2004) Sentinel lymphadenectomy and S-classification: a successful strategy for better prediction and improvement of outcome of melanoma. Ann. Surg. Oncol., 11(3): 162–168.
7. van Akkooi A.C., Nowecki Z.I., Voit C. et al. (2008) Sentinel node tumor burden according to the Rotterdam criteria is the most important prognostic factor for survival in melanoma patients: a multicenter study in 388 patients with positive sentinel nodes. Ann. Surg., 248(6): 949–955.
8. Meier A., Satzger I., Völker B. et al. (2010) Comparison of classification systems in melanoma sentinel lymph nodes — an analysis of 697 patients from a single center. Cancer, 116(13): 3178–88.
9. van der Ploeg I., Kroon B., Antonini N. (2009) Comparison of three micromorphometric pathology classifications of melanoma metastases in the sentinel node. Ann.Surg., 250(2): 301–304.














Leave a comment