Кардіотоксичність при проведенні хіміотерапевтичного лікування у пацієнтів похилого віку із неходжкінськими лімфомами
Резюме. При вивченні структури захворюваності на неходжкінські лімфоми встановлено, що один із піків підвищення цього показника припадає на віковий діапазон 60–80 років. Зважаючи на те, що стандартні режими при лікуванні хворих на лімфоми включають антрациклінові антибіотики, які є препаратами кардіотоксичної групи, подібна терапія у пацієнтів похилого віку може призвести до ускладнень з боку серцево-судинної системи. Проведено аналіз лікування 83 хворих похилого віку із неходжкінськими лімфомами за схемами СНОР та СNОР. Встановлено, що вказані схеми мають зіставну ефективність, проте лікування пацієнтів похилого віку за схемою СНОР супроводжується більш високою кардіальною токсичністю. Проаналізовано фактори, що впливають на розвиток кардіальної токсичності при проведенні хіміотерапевтичного лікування у хворих похилого віку, створено алгоритм прогнозування розвитку ранніх і пізніх ускладнень з боку серцево-судинної системи у пацієнтів цієї категорії із неходжкінськими лімфомами.
 Проблема лікування хворих на неходжкінські лімфоми (НХЛ) в останні роки набуває все більшої актуальності. Протягом останніх двох десятиліть захворюваність на цей вид раку у світі зросла більш ніж у 1,5 раза [1]. За даними Національного канцер-реєстру України, у 2011 р. захворюваність на НХЛ становила 5,2 на 100 тис. населення. При вивченні її структури встановлено, що один із піків підвищення цього показника припадає на віковий діапазон 60–80 років. Максимальний рівень захворюваності на НХЛ в Україні у 2011 р. відзначено у хворих віком 70–74 років і становить 13,3 на 100 тис. населення.
Проблема лікування хворих на неходжкінські лімфоми (НХЛ) в останні роки набуває все більшої актуальності. Протягом останніх двох десятиліть захворюваність на цей вид раку у світі зросла більш ніж у 1,5 раза [1]. За даними Національного канцер-реєстру України, у 2011 р. захворюваність на НХЛ становила 5,2 на 100 тис. населення. При вивченні її структури встановлено, що один із піків підвищення цього показника припадає на віковий діапазон 60–80 років. Максимальний рівень захворюваності на НХЛ в Україні у 2011 р. відзначено у хворих віком 70–74 років і становить 13,3 на 100 тис. населення.
Нині, незважаючи на вдосконалення методів лікування пацієнтів зі злоякісними новоутвореннями, проблема виживаності після рецидивів хвороби чи ускладнень поліхіміотерапії (ПХТ), як і раніше, залишається актуальною. З огляду на те, що cтандартом для лікування пацієнтів молодого та похилого віку з НХЛ є схема СНОР (циклофосфамід, доксорубіцин, вінкристин, преднізолон) — режим, який включає антрациклінові антибіотики,— таке лікування у хворих похилого віку може призвести до ускладнень з боку серцево-судинної системи. У 2009 р. 67% від загальної кількості первинних хворих на НХЛ, які не отримали спеціального лікування, становили хворі у віці понад 60 років.
Це зумовлює пошук засобів, спрямованих на зниження токсичності та зменшення вираженості побічної дії стандартних схем лікування.
Кардіотоксичність хіміотерапевтичних препаратів є одним із найсерйозніших побічних ефектів при лікуванні хворих онкологічного профілю, тому необхідна пильна увага до пацієнтів, які отримують терапію антрациклінами та деякими іншими препаратами. Антрацикліни є лікарськими засобами, які пригнічують активність міокарда, призводячи до розвитку кардіоміопатії [2, 3].
Факторами ризику антрациклінової кардіотоксичності є вік пацієнта понад 65 років, наявність в анамнезі ішемічної хвороби, гіпертонії, попереднє опромінення ділянки середостіння чи лівої половини грудної порожнини (ліва грудна залоза, ліва легеня тощо), прийом антрациклінів у попередніх схемах ПХТ [4]. Залежно від термінів розвитку та механізму дії, кардіотоксичність може бути гострою чи хронічною (кумулятивна). Клінічні прояви і патофізіологія пошкодження серцевого м’яза антрацикліновими антибіотиками не відрізняються від сердцевої недостатності, викликаної іншими причинами. Зазвичай, це швидкопрогресуючий синдром декомпенсації з розширенням серця, випотом у порожнинах тіла і венозним застоєм. Але якщо декомпенсація серця при ревматичних клапанних пороках, гіпертонічній хворобі, постінфарктному кардіосклерозі тією чи іншою мірою піддається медикаментозному лікуванню, терапевтичні засоби при антрацикліновій кардіоміопатії малоефективні [5].
Тяжкість антрациклінової кардіотоксичності різна і може проявитися транзиторними змінами електрокардіограми (ЕКГ) у вигляді аритмій і міокардитів, у тяжчих випадках гостро розвивається застійна серцева недостатність. Серйозну небезпеку становить хронічна кардіотоксичність, яка розвивається поволі після успішного завершення лікування злоякісної пухлини і клінічно проявляється серцевою недостатністю, некоронарними некрозами міокарда, а морфологічно — фіброзом м’язів серця.
Діагностувати субклінічні пошкодження серця можна за допомогою стандартної ЕКГ, холтерівського моніторування ЕКГ, оцінки варіабельності ритму серця, ехокардіографії, радіонуклідної вентрикулографії, сцинтиграфії міокарда, магнітно-резонансної томографії, аналізу концентрації серцевих ферментів та інших біохімічних маркерів пошкодження міокарда. При стандартній ЕКГ та її добовому моніторуванні виявляють різні порушення ритму і провідності серця, неспецифічні зміни зубця Т, подовження інтервалу Q–T і збільшення його дисперсії. Тяжке ураження міокарда проявляється систолічною дисфункцією лівого шлуночка, характерними ознаками якої є зменшення фракції викиду, ступеня передньозаднього скорочення, збільшення кінцево-діастолічного і кінцево-систолічного об’єму (КДО і КСО)серця, які визначають за допомогою ехокардіографії [4, 6].
Антрациклінові ушкодження міокарда можуть супроводжуватися підвищенням концентрації в плазмі крові серцевих ферментів — креатинфосфокінази, лактатдегідрогенази, інших маркерів пошкодження міокарда, зокрема тропоніну. Слід зазначити, що рівні тропоніну в плазмі крові при цьому підвищуються незначно (істотно менше, ніж при інфаркті міокарда), однак можуть зберігатися навіть упродовж декількох місяців після лікування [7].
Отже, своєчасна діагностика вихідного статусу серцево-судинної системи, динамічний контроль на етапах лікування, що проводиться з можливістю аргументованої корекції, та подальша реабілітація є актуальною проблемою.
Мета дослідження —зменшення кардіальної токсичності при проведенні хіміотерапевтичного лікування у пацієнтів похилого віку з НХЛ.
Об’єкт і методи дослідження
Проведено аналіз результатів лікування 83 хворих на НХЛ похилого віку, які отримували хіміотерапевтичне чи комбіноване хіміопроменеве лікування на базі науково-дослідного відділення хіміотерапії гемобластозів Національного інституту раку (НІР) в період 2004–2011 рр. У першу (I) групу були включені 48 пацієнтів похилого віку, які отримували курси ПХТ за схемою СНОР; другу (II) групу склали 35 хворих похилого віку, які отримували курси ПХТ за схемою СNOP. Усіх хворих обстежували з метою виявлення супутньої патології. Вивчення стану серцево-судинної системи здійснювали шляхом електрокардіографії в стандартних відведеннях та ехокардіографії до початку та після лікування. Кожному хворому призначали 4–8 курсів ПХТ за схемами СНОР (I дослідна група) або СNОР (ІІ дослідна група).
Після завершення ПХТ хворим проводили променеву терапію на зону біопсії, операційне поле та/або на нерезорбовані (залишкові) лімфатичні вузли в сумарній вогнищевій дозі 30–40 Гр на базі відділення радіології НІР. Після 3; 4; 6; 8 курсів і після закінчення лікування оцінювали ефективність терапії за критеріями Сheson (1999). З метою оцінки медикаментозної токсичності та побічних ефектів ПХТ аналізували частоту ускладнень після проведеного лікування. Токсичність оцінювали згідно з критеріями токсичності Національного інституту раку США. Розподіл хворих за віком проводили відповідно до Міжнародної класифікації ВООЗ (1964 р.): осіб у віці 60–74 років відносили до похилого віку, 75–89 — старечого.
Середній вік хворих становив 69,02±2,85 року (від 60 до 81 року); чоловіків було 41, жінок — 42 (відношення чоловіків до жінок 0,97). Найбільшу кількість пацієнтів відзначено у віковій категорії 60–69 років — 52 (62,65%); 25 (30,12%) хворих — у віковій групі від 70 до 79 років; 6 (7,23%) були у віці понад 80 років. Найбільше було пацієнтів із IVА та IVВ стадією захворювання: 36,14 та 16,87% відповідно. Наявність симптомів інтоксикації відзначали у 26,51% хворих основної групи. Розподіл пацієнтів за віком, статтю та стадією захворювання наведено у табл. 1, 2.
Таблиця 1. Розподіл хворих на НХЛ похилого та старечого віку І і ІІ основних груп за віковою групою та статтю
| Вікова група | |||||
| Група хворих | Похилого віку (60–74 років), n | Старечого віку (75–81 років), n | Усього, n | ||
| чоловіки | жінки | чоловіки | жінки | ||
| І основна група | 18 | 23 | 5 | 2 | 48 |
| ІІ основна група | 15 | 16 | 3 | 1 | 35 |
| р | >0,05 | >0,05 | >0,05 | >0,05 | |
Таблиця 2. Розподіл хворих на НХЛ І та ІІ груп за стадією захворювання
| Група хворих | Стадія захворювання | |||||||||||||
| ІА | ІІА | ІІВ | ІІІА | ІІІВ | ІVА | IVВ | ||||||||
| n | % | n | % | n | % | n | % | n | % | n | % | n | % | |
| І основна(n=48) | 4 | 8,33 | 6 | 12,50 | 2 | 4,16 | 6 | 12,50 | 3 | 6,25 | 19 | 39,58 | 8 | 16,66 |
| ІІ основна(n=35) | 3 | 8,57 | 7 | 20,00 | 1 | 2,85 | 5 | 14,28 | 2 | 5,71 | 11 | 31,42 | 6 | 17,14 |
| р | >0,05 | >0,05 | >0,05 | >0,05 | >0,05 | >0,05 | >0,05 | |||||||
Кількість прогностичних факторів ризику у І та ІІ основних групах була практично однакова, розбіжність показників статистично недостовірна (р>0,05). Розподіл хворих І та ІІ основних груп за групою ризику представлено в табл. 3.
Таблиця 3. Розподіл хворих на НХЛ похилого віку І та ІІ груп за групою ризику
| Група ризику | І група | ІІ група | р | ||
| n | % | n | % | ||
| Низький ризик | 11 | 23,4 | 9 | 25,71 | >0,05 |
| Проміжний ризик | 27 | 57,44 | 19 | 54,28 | >0,05 |
| Високий ризик | 10 | 20,83 | 7 | 20 | >0,05 |
Отримані результати
Після завершення лікування загальна ефективність становила 85,71% в І групі та 84,77% — у ІІ (р>0,05). 71,73% хворих похилого віку І групи (одержували лікування за схемою СНОР) досягли повної ремісії, у ІІ групі (лікування за схемою СNOP) — 77,14% пацієнтів (р>0,05); часткової ремісії досягли відповідно 13,04 та 8,57% (р>0,05), стабілізацію захворювання в І групі констатували у 2,17% хворих, у ІІ групі — у 2,85% (р>0,05). Прогресування пухлинного процесу під час лікування зафіксовано у 13,04% пацієнтів І групи та у 11,42% — ІІ (р>0,05) (рисунок).
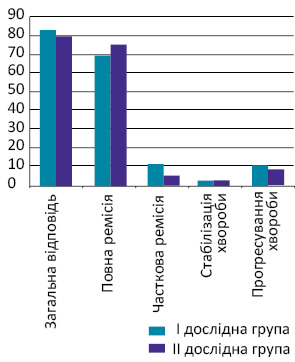
Отже, при оцінці безпосередніх результатів лікування за схемою СНОР і СNОР хворих похилого та старечого віку І та ІІ груп не виявлено статистично значущих розбіжностей (р>0,05).
Аналіз побічних ефектів й ускладнень після проведеної терапії у хворих на НХЛ похилого віку показав, що домінуючими були гематологічна токсичність і токсичність з боку серцево-судинної системи.
Терапія за схемою СНОР викликає більш виражену гематологічну токсичність порівняно зі схемою СNOP — у 34 (70,83%) хворих І групи і у 20 (57,14%) ІІ групи (р0,05), тромбоцитопенію ІІІ–IV ступеня — у 5,71 і 14,58% пацієнтів відповідно (р>0,05).
У всіх пацієнтів І групи до початку лікування фракція викиду була задовільна (середня — 57,33±6,57%). Після проведеної терапії у 2 хворих І групи зареєстровано фракцію викиду, нижчу від нижньої межі норми (49%). Середня фракція викиду після лікування становила 51,89±7,12%, тобто зафіксовано зниження в середньому на 11,04%. Зниження більше ніж на 10%, що свідчить про токсичне ураження міокарда, спостерігали у 5 хворих. КДО до лікування становив 157±49,95 см3, після — 188±32,56 см3, різниця з вихідними значеннями — 16,48%. КСО до лікування становив 71,53±44,5 см3, після — 77,85±25,35 см3, зареєстровано підвищення на 8,11%.
За даними ЕКГ у динаміці до та після лікування у 6 (12,5%) хворих І групи реєстрували дифузні зміни міокарда, у 5 (10,41%) — гіпоксію міокарда, у 4 (8,33%) — подовження комплексу QRS, у 2 (4,16%) — тахікардію (>100 уд./хв), у 2 (4,16%) — екстрасистолії, ще у 2 (4,16%) — блокаду лівої ніжки пучка Гіса. У 12 хворих після лікування зафіксовано підвищення частоти серцевих скорочень: до лікування середня частота становила 76±6,89 уд./хв, після — 88±9,12 уд./хв. У 8 (16,66%) пацієнтів після лікування діагностовано токсичну кардіоміопатію, у 2 (4,16%) — дистрофічні зміни міокарда; тенденцію до підвищення артеріального тиску відзначали у 7 (14,58%) хворих. У 2 (4,16%) осіб після лікування розвинулася серцево-судинна недостатність І та ІІ ступеня.
У всіх пацієнтів ІІ групи до початку лікування фракція викиду була задовільною, у 4 (11,43%) становила 50–51%, що є нижньою межею норми. Середня фракція викиду до лікування — 58,69±5,94%. Після лікування у жодного хворого ІІ групи не зафіксовано значення фракції викиду, нижче нижньої межі норми(56,38±4,72%, тобто відбулося зниження в середньому на 5,6%). У всіх хворих цей показник був у межах норми, зниження більше ніж на 10% не спостерігали. КДО до лікування становив 147±42,91 см3, після — 171±28,44 см3, що дорівнювало 16,28% від вихідних даних. КСО до лікування — 65,55±34,2 см3, після — 69,91±23,34 см3, підвищення на 6,23%.
За даними ЕКГ у 91,42% хворих ІІ групи не виявлено змін у динаміці після лікування. У 1 (2,85%) пацієнта після терапії діагностовано гіпоксію міокарда, у 1 (2,85%) — синусову брадикардію, ще у 1 (2,85%) — дистрофічні зміни міокарда.
При аналізі токсичності ПХТ хворих похилого віку у 17 (35,41%) із них І групи, що отримували лікування за схемою СНОР, і у 5 (14,28%) пацієнтів ІІ групи виявлено кардіальну токсичність різного ступеня.
Встановлено статистично значущу розбіжність показників у групах (р<0,05) (табл. 4).
Таблиця 4. Порівняльна оцінка кардіальної токсичності після ПХТ у хворих похилого віку
| Токсичність | Ступінь | Група хворих | р | |||
| І група(n=48) | ІІ група(n=35) | |||||
| n | % | n | % | |||
| Синусова брадикардія | 1 | 2,08±2,86 | 1 | 2,85±2,81 | >0,05 | |
| Екстрасистолічна аритмія | 3 | 6,25±3,49 | 0 | 0,00 | >0,05 | |
| Тенденція до підвищення артеріального тиску | 7 | 14,58±5,09 | 4 | 11,42±5,37 | >0,05 | |
| Токсична кардіоміопатія | 10 | 20,83±5,86 | 1 | 2,85±2,81 | ||
| Дистрофічні зміни міокарда | 3 | 6,25±3,49 | 1 | 2,85±2,81 | >0,05 | |
| Неповна блокада ніжки пучка Гіса | 2 | 4,16±2,87 | 0 | 0,00 | >0,05 | |
| Гіпертрофія лівого шлуночка | 2 | 4,16±2,87 | 0 | 0,00 | >0,05 | |
| Серцева недостатність | I | 1 | 2,08±2,86 | 0 | 0,00 | >0,05 |
| II | 1 | 2,08±2,86 | 0 | 0,00 | >0,05 | |
| Усього хворих | 19 | 39,58±7,05 | 5 | 14,28±5,91 | ||
Максимальну токсичність з боку серцево-судинної системи відзначали у групі хворих, які отримували лікування за схемою СНОР та мали кардіальну патологію (60,86%).
Під час контрольного обстеження через 6 міс після завершення лікування у 5 хворих І групи діагностовано захворювання серцево-судинної системи, а саме: ішемічну хворобу серця — у 1; кардіосклероз — у 1; токсичну кардіоміопатію — у 1; ішемічну хворобу серця, синусову аритмію, дифузні зміни міокарда — у 1 пацієнта; у 2 осіб — гострий інфаркт міокарда. Один хворий І групи помер через 8 міс після лікування від інфаркту міокарда.
Таким чином, при проведенні лікування у хворих похилого віку за схемою СНОР частіше розвивалася кардіальна токсичність різного ступеня тяжкості, на відміну від пацієнтів, які отримували лікування за схемою СNОР.
З метою визначення факторів, які впливають на розвиток ускладнень з боку серцево-судинної системи, проведено кореляційний аналіз виникнення серцево-судинних ускладнень у хворих похилого віку та встановлено достовірний зв’язок із кількістю курсів ПХТ (χ2=17,5; р<0,05), наявністю у хворого атеросклеротичних змін коронарних судин (χ2=22,9; р<0,001), ішемічної хвороби серця (χ2=20,75, р<0,001), діабету (χ2=5,65; р<0,05), станом хворого до початку лікування (χ2=4,49; р<0,05), симптомами інтоксикації (χ2=5,62; р<0,05). Таким чином, за наявності у хворого ішемічної хвороби серця, атеросклерозу коронарних судин, діабету, стану за ЕСОG <1 до початку лікування та зі збільшенням кількості курсів ПХТ підвищується частота розвитку ускладнень з боку серцево-судинної системи.
У пацієнтів похилого віку із НХЛ виявлено зворотній кореляційний зв’язок ускладнень з боку серцево-судинної системи з рівнем гемоглобіну та еритроцитів периферичної крові (χ2=10,04; р<0,05), рівнем фракції викиду (χ2=5,58; р<0,05), тахікардією до початку лікування (χ2=5,62; р<0,05).
За допомогою дискримінантного аналізу на основі комплексу клініко-гематологічних та функціональних показників отримано класифікаційні функції для виявлення хворих похилого віку з високою вірогідністю розвитку ускладнень з боку серцево-судинної системи після проведення хіміотерапії. Встановлено, що на розвиток цих ускладнень достовірно впливають такі фактори: вік хворого, стадія захворювання, рівні гемоглобіну та кількість еритроцитів до початку лікування, показник фракції викиду.
Для прогнозу наявності (відсутності) ускладнень з боку серцево-судинної системи у хворих похилого віку розроблено класифікаційні функції:
1) для виявлення хворих з ускладненнями:
γ1 = -140,27 + 2,64 вік + 0,80 фракція викиду + 10,94 еритроцити + 0,09 гемоглобін;
2) для виявлення хворих без ускладнень:
γ2 = -124,65 + 2,55 вік + 0,72 фракція викиду + 10,08 еритроцити + 0,065 гемоглобін.
Якщо γ1 > γ2, то прогнозовано розвиток ускладнень з боку серцево-судинної системи після проведення ПХТ у хворих на НХЛ похилого віку.
Встановлено, що чутливість прогнозу розвитку ускладнень з боку серцево-судинної системи з використанням класифікаційних функцій становить 90,16%, чутливість прогнозу без подібних ускладнень — 73,16%. Результати дискримінантного аналізу дозволяють виявляти пацієнтів похилого віку з НХЛ із високою вірогідністю ускладнень з боку серцево-судинної системи ще до початку лікування, що необхідно для планування терапії хворих цієї категорії, раннього виявлення та своєчасного усунення ускладнень.
На підставі вивчення діагностичної інформативності комплексу клініко-гематологічних та функціональних показників у хворих на НХЛ похилого та старечого віку з ускладненнями з боку серцево-судинної системи розроблено алгоритм прогнозування вірогідності розвитку таких ускладнень. Обчислення інформативної цінності ознак проводили за критерієм Стьюдента. Порівнювали частоту виявлення досліджуваної ознаки у хворих на НХЛ похилого віку з ранніми та пізніми ускладненнями з боку серцево-судинної системи та без них. Для ознак, які найбільше відрізнялися в групах, обчислювали значення інформативності. Таким чином, було виділено найінформативніші, з погляду диференційної діагностики, ознаки. Алгоритм представлено за ступенем інформативності показника (табл. 5, 6).
Таблиця 5. Алгоритм прогнозування розвитку ранніх серцево-судинних ускладнень у хворих на НХЛ похилого та старечого віку
| Критерій | Коефіцієнт інформативності | |
| 1. Супутні захворювання | Атеросклероз коронарних судин | 5,20 |
| Цукровий діабет | 2,91 | |
| Ішемічна хвороба серця | 4,36 | |
| Гіпертонічна хвороба | 2,30 | |
| Аритмія | 4,09 | |
| Серцево-судинна недостатність | 4,80 | |
| Стать (жіноча) | 2,11 | |
| 2. Клінічне обстеження на початку лікування | ІV стадія захворювання | 2,59 |
| Наявність симптомів інтоксикації | 2,47 | |
| Стан хворого (ЕСОG >1) | 4,15 | |
| 3. Лабораторні показники на початку лікування | Еритроцити (≤2,99 • 109/л) | 2,30 |
| Гемоглобін (≤96 г/л) | 3,15 | |
| 4. Функціональні показники на початку лікування | Фракція викиду (≤54,4%) | 7,13 |
| Тахікардія (≥96 уд./хв) | 2,10 |
Таблиця 6. Алгоритм прогнозування розвитку пізніх серцево-судинних ускладнень у хворих на НХЛ похилого віку
| Критерій | Коефіцієнт інформативності | |
| 1. Супутні захворювання | Атеросклероз коронарних судин | 4,60 |
| Цукровий діабет | 2,51 | |
| Гіпертонічна хвороба | 2,30 | |
| Серцево-судинна недостатність | 3,62 | |
| 2. Клінічне обстеження на початку лікування | ІV стадія захворювання | 3,15 |
| Стан хворого (ЕСОG >1) | 2,50 | |
| 3. Лабораторні та функціональні показники на початку лікування | Гемоглобін (≤99 г/л) | 2,84 |
| Фракція викиду (≤56%) | 4,40 | |
| Тахікардія (≥96 уд./хв) | 2,10 |
Встановлено пряму залежність між кількістю балів і вірогідністю розвитку ускладнень з боку серцево-судинної системи. Поєднання коефіцієнтів інформативності свідчить про більший їх внесок у прогноз розвитку ускладнень. Сума коефіцієнтів інформативності ≥10 свідчить про 99,9% вірогідність розвитку ускладнень з боку серцево-судинної системи у пацієнтів похилого віку при проведенні лікування у зв’язку з НХЛ.
Отриманий алгоритм дозволяє обчислити вірогідність виникнення ускладнень з боку серцево-судинної системи у хворих на НХЛ похилого віку на ініціальних етапах хвороби до проведення ПХТ. Встановлено можливість визначення за аналізом результатів клінічного обстеження, показників периферичної крові та функціональних досліджень у кожному конкретному випадку коефіцієнтів інформативності, що відповідають значенням наведених показників, та за їх загальною сумою припустити вірогідність розвитку ранніх та пізніх ускладнень з боку серцево-судинної системи у хворих похилого віку.
Обговорення
При вивченні структури захворюваності на НХЛ встановлено, що один із піків підвищення цього показника припадає на вікову групу 60–80 років. Зважаючи на те, що стандартні режими при лікуванні пацієнтів із лімфомами включають антрациклінові антибіотики, які є препаратами кардіотоксичної групи, така терапія у хворих похилого віку може призвести до ускладнень з боку серцево-судинної системи.
Проведено аналіз лікування 83 хворих на НХЛ похилого віку за схемами СНОР та СNОР. Встановлено, що обидві схеми характеризуються зіставною ефективністю (загальна відповідь — 84,77 та 85,71% відповідно; р>0,05), проте СНОР супроводжується більш високою кардіальною токсичностю (у 70,83 та 57,14% відповідно (р<0,05); у 39,58 та 14,28% відповідно (р<0,05)).
Розроблений алгоритм прогнозування розвитку серцево-судинних ускладнень дозволяє розрахувати вірогідність їх виникнення у хворих на НХЛ похилого віку на ініціальних етапах захворювання до проведення ПХТ та дає можливість своєчасно спланувати комплекс лікувально-профілактичних заходів, що сприяє підвищенню ефективності лікування та поліпшенню якості життя пацієнтів цієї категорії.
Особливу увагу потрібно приділяти профілактиці кардіоміопатії. Перш за все, до початку цитостатичної терапії у кожного пацієнта постає питання про необхідність виявлення факторів ризику пошкодження серця, що дозволить у разі їх наявності модифікувати схему хіміотерапії шляхом зміни швидкості й режиму введення препарату, зниження максимальної кумулятивної дози або заміни на менш токсичний препарат, врахування доцільності проведення променевої терапії. Для своєчасного запобігання ускладненням з боку серця слід ретельно моніторувати стан серцево-судинної системи у пацієнтів протягом лікування та після його завершення. Це можливо тільки при взаємодії між онкологами і кардіологами, що дозволить підвищити ефективність профілактики, своєчасної діагностики та терапії кардіальної токсичності.
Список використаної літератури
1. Федоренко З.П., Гулак Л.О., Горох Є.Л. та ін. (2010) Рак в Україні, 2008–2009. Захворюваність, смертність, виживаність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 11: 111 с.
2. Дворецкий Л.И. (2001) Пожилой больной. Москва: 42–44.
3. Gianni L., Herman E.H. , Lipshultz S.E. et al. (2008) Anthracycline cardiotoxicity: from bench to bedside. J. Clin. Oncol., 2: 3777–3784.
4. Орел Н.Ф. (2004) Кардиотоксичность антрациклинов: возможности преодоления. Актуальные вопросы клинической онкологии, 6(3): 121–124.
5. Jurcut R., Wildiers H., Ganame J. et al. (2008) Detection and monitoring of cardiotoxicity — what does modern cardiology offer? Support Care Cancer, 16: 437–445.
6. Sereno M., Brunello A., Chiappori A. et al. (2008) Cardiac toxicity: old and new issues in anti-cancer drugs. Clin. Transl. Oncol., 10(1): 35–46.
7. Dodos F., Halbsquth T., Erdmann E., Hoppe U.C. (2008) Usefulness of myocardial performance index and biochemical markers for early detection of anthracyclineinduced cardiotoxicity in adults. Clin. Res. Cardiol., 97: 318–326.
Кардиотоксичность при проведении химиотерапевтического лечения у пациентов пожилого возраста с неходжкинскими лимфомами
Резюме. При изучении структуры заболеваемости неходжкинскими лимфомами определено, что один из пиков заболеваемости приходится на возрастной диапазон 60–80 лет. Учитывая то, что стандартные режимы лечения лимфом включают антрациклиновые антибиотики, которые являются препаратами кардиотоксической группы, такое лечение у больных пожилого возраста может привести к осложнениям со стороны сердечно-сосудистой системы. Проведен анализ лечения 83 больных пожилого возраста с неходжкинскими лимфомами по схемам СНОР и СNОР. Установлено, что указанные схемы имеют сопоставимую эффективность, однако лечение больных пожилого возраста по схеме СНОР сопровождается более высокой кардиальной токсичностью. Проанализированы факторы, влияющие на развитие кардиальной токсичности при проведении химиотерапевтического лечения у больных пожилого возраста, создан алгоритм прогнозирования развития ранних и поздних осложнений со стороны сердечно-сосудистой системы у пациентов этой категории с неходжкинскими лимфомами.
лимфома, пожилой возраст, токсичность, сердечно-сосудистая система.














Leave a comment